A: Happovakion määrittäminen
Olet epäilemättä tietoinen siitä, että jotkin hapot ovat vahvempia kuin toiset. Eri yhdisteiden tai funktionaalisten ryhmien suhteellista happamuutta – toisin sanoen niiden suhteellista kykyä luovuttaa protoni yhteiselle emäkselle samanlaisissa olosuhteissa – kvantifioidaan luvulla, jota kutsutaan happamuusvakioksi, lyhenteellä Ka. Vertailuun valittu yhteinen emäs on vesi.
Tarkastelemme etikkahappoa ensimmäisenä esimerkkinä. Jos valmistamme etikkahapon laimean liuoksen veteen, hapon (protonin luovuttaja) ja veden (protonin vastaanottaja) välillä tapahtuu happo-emäsreaktio.
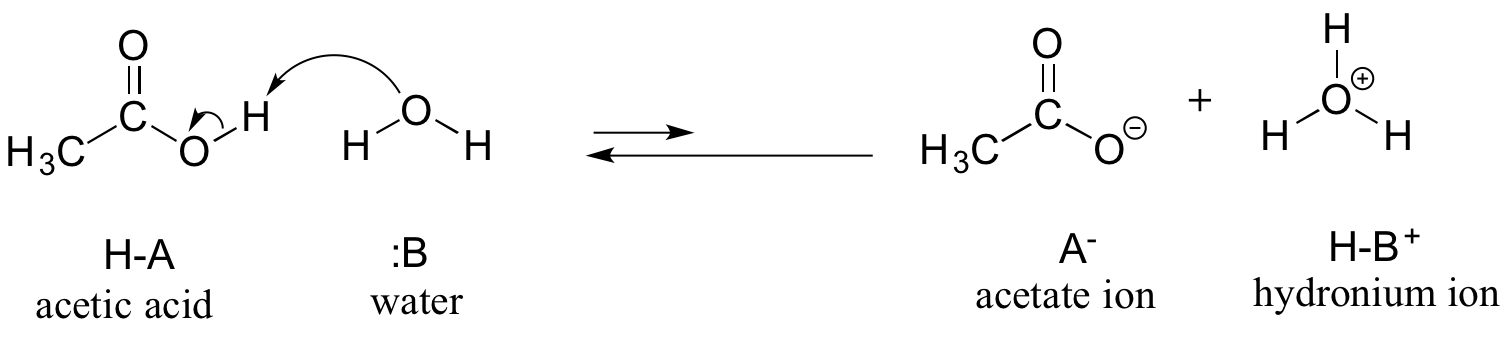
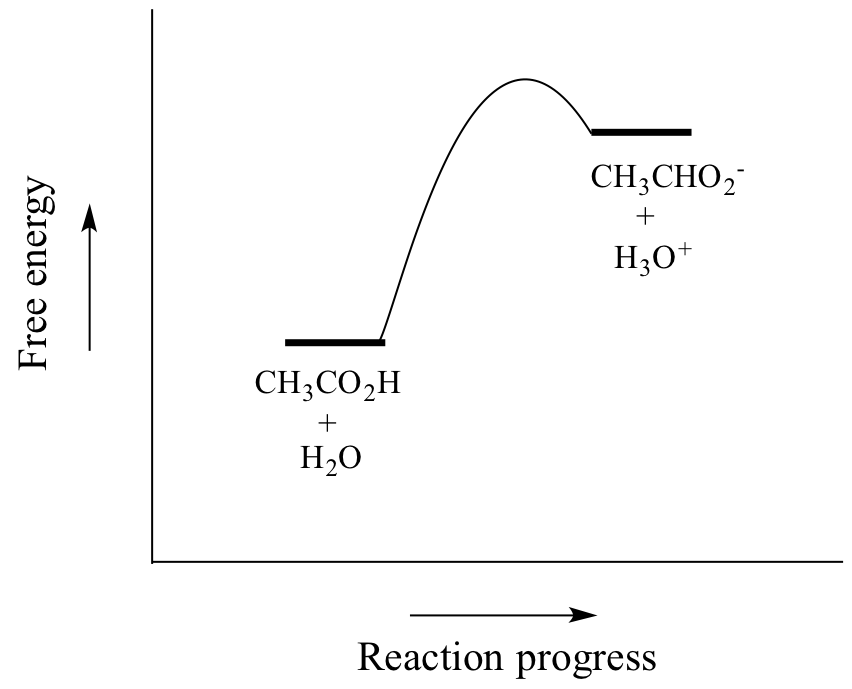
Etikkahappo on heikko happo, joten tasapaino suosii reaktantteja tuotteiden kustannuksella – se on termodynaamisesti ”ylämäkeä”, kuten yllä olevassa kuvassa näkyy reaktion eteen- ja taaksepäin suuntautuvien reaktionuolien suhteellisesta pituudesta ja alla olevassa reaktiokoordinaatistokaaviossa, jossa tuotteet ovat korkeamman energian omaavia kuin reaktantit.
Kuten tiedätte, tasapainovakio Keq määritellään seuraavasti:
![]()
Jokainen tasapainovakion lauseke on itse asiassa kaikkien reaktioon osallistuvien lajien aktiivisuuksien suhde. Aktiivisuuksien käytön välttämiseksi ja kokeellisten mittausten yksinkertaistamiseksi konsentraatioiden tasapainovakio approksimoi liuenneiden aineiden ja kaasujen aktiivisuuksia laimeissa liuoksissa niiden molaarisuuksilla. Kiinteiden aineiden, puhtaiden nesteiden ja liuottimien aktiivisuuksia ei kuitenkaan approksimoida niiden molaarisuuksilla. Sen sijaan näillä aktiivisuuksilla määritellään olevan arvo, joka on yhtä suuri kuin 1 (yksi).
Jos siis tunnustamme, että veden aktiivisuus laimeassa liuoksessa approksimoidaan arvolla yksikkö (1), voimme jakaa 1:llä saadaksemme etikkahapon happovakion Ka:n lausekkeen tavanomaisen muodon:
\}(1)} = \dfrac{}{}{}{ } \]
Tosiasiassa laimealle vesiliuokselle veden aktiivisuus approksimoidaan arvolla 1, joten tietyn hapon HA tai HB+ yleinen dissosiaatiovakio ilmaistaan:
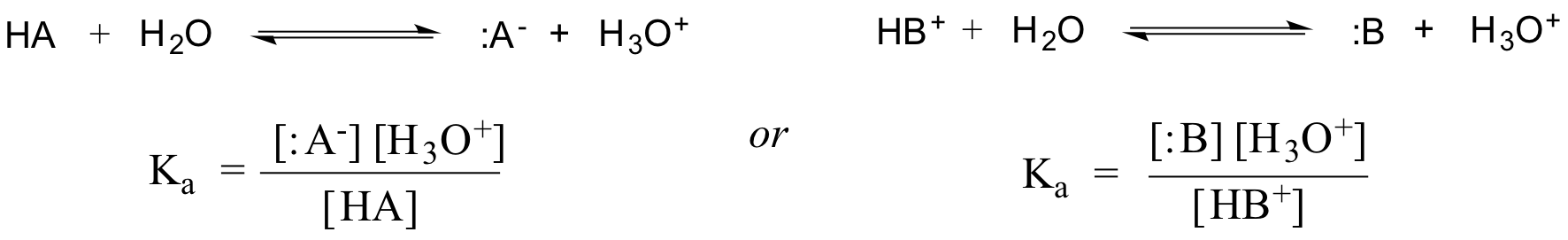
Eetikkahapon Ka:n arvo on 1.75 x 10-5 – paljon pienempi kuin 1, mikä osoittaa, että tasapainotilassa liuoksessa on paljon enemmän etikkahappoa kuin asetaattia ja hydroniumioneja.
Kääntäen rikkihappo, jonka Ka-arvo on noin 109, tai suolahappo, jonka Ka-arvo on noin 107, dissosioituvat molemmat olennaisesti täydellisesti vedessä: ne ovat hyvin vahvoja happoja.
Lukua kuten 1,75 x 10- 5 ei ole kovin helppo sanoa, muistaa tai visualisoida, joten kemistit käyttävät tavallisesti helpompaa termiä ilmaisemaan suhteellista happamuutta. Hapon pKa-arvo on yksinkertaisesti sen Ka-arvon log (emäksellä 10).
pKa = -log Ka Ka = 10-pKa
Tehdessämme laskutoimituksia saamme selville, että etikkahapon pKa on 4,8. Rikkihapon pKa on -10 ja suolahapon pKa on -7. Käyttämällä pKa-arvoja voimme ilmaista tavallisten yhdisteiden ja funktionaalisten ryhmien suhteellista happamuutta numeerisella asteikolla, joka ulottuu noin -10:stä (erittäin voimakas happo) 50:een (yhdiste, joka ei ole lainkaan hapan). Mitä pienempi pKa-arvo on, sitä vahvempi happo on.
Biologisen orgaanisen kemian kannalta merkityksellisten ionisoituvien (protonin luovuttavien tai hyväksyvien) funktionaalisten ryhmien pKa-arvot vaihtelevat yleensä noin 5:stä noin 20:een. Seuraavassa on esitetty yhteenveto tärkeimmistä näistä, ja konjugaattihappomuotojen pKa-arvot ovat hyvin karkeat. Myös happamat ryhmät, joiden pKa-arvot ovat lähellä nollaa, on mainittu viitteellisesti.
Tietoon tulevat likimääräiset pKa-arvot
hydroniumioni (H3O+) : 0
protonoitu alkoholi: 0
protonoitu karbonyyli: 0
karboksyylihapot: 5
protonoituja imiinejä: 7
protonoidut amiinit: 10
fenolit: 10
tiolit: 10
vesi: 14
alkoholit: 15-18
alfahiilihapot*: 20
*alfa-hiilihapot käsitellään myöhemmin tässä luvussa
Suositellaan vahvasti, että painat nämä karkeat arvot mieleesi jo nyt – sitten jos tarvitset tarkempaa arvoa, voit aina katsoa sen pKa-taulukosta.
Varoitus! pKa ei ole sama kuin pH!
On tärkeää ymmärtää, että pKa ei ole sama asia kuin pH: edellinen on yhdisteen tai funktionaalisen ryhmän luontainen ominaisuus, kun taas jälkimmäinen on hydroniumionien konsentraation mitta tietyssä vesiliuoksessa:
pH = -log
Tuntemalla pKa-arvot voimme vertailla happojen voimakkuutta, mutta myös emästen voimakkuutta. Keskeinen muistettava ajatus on tämä: mitä vahvempi on konjugoitu happo, sitä heikompi on konjugoitu emäs. Voimme todeta, että hydroksidi-ioni on vahvempi emäs kuin ammoniakki (NH3), koska ammoniumioni (NH4+, pKa = 9,2) on vahvempi happo kuin vesi (pKa = 14,0).
Harjoitus 7.2.1
Kumpi on vahvempi emäs, CH3O- vai CH3S-? Asetaatti-ioni vai ammoniakki? Hydroksidi- vai asetaatti-ioni?
Liuos
Käytetään pKa-käsitteen ymmärtämistä monimutkaisemman molekyylin yhteydessä. Mikä on esimerkiksi alla olevan yhdisteen pKa?
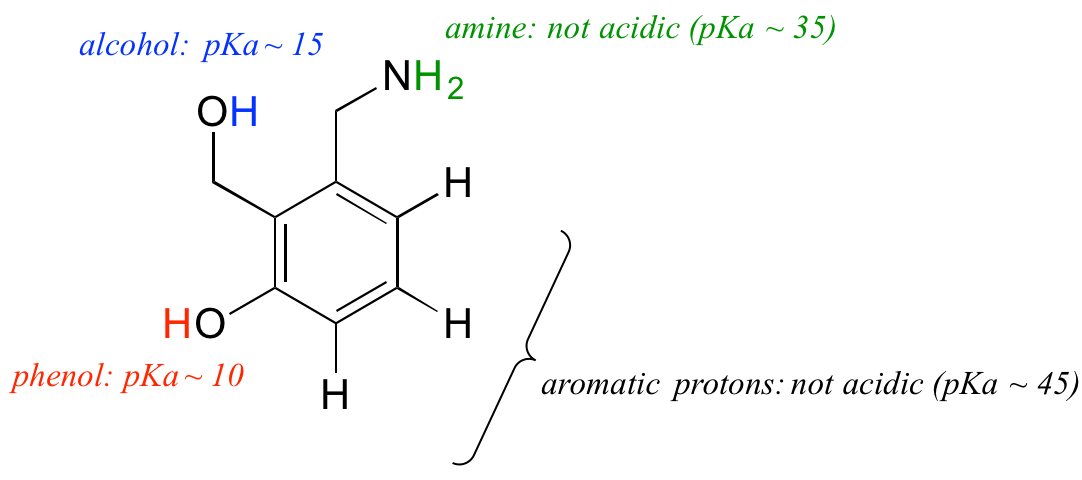
Meidän on arvioitava molekyylin neljän erityyppisen protonin potentiaalinen happamuus ja löydettävä niistä happamimmat. Kaikki aromaattiset protonit eivät ole happamia – niiden pKa on noin 45. Myöskään amiiniryhmä ei ole hapan, sen pKa on noin 35. (Muista, että varauksettomat amiinit ovat emäksisiä: vain positiivisesti varautuneet protonoidut amiinit, joiden pKa-arvot ovat noin 10, ovat heikosti happamia). Alkoholin protonin pKa on noin 15, ja fenolin protonin pKa on noin 10. (Varmista, että tunnistat fenolin ja alkoholin välisen eron – muista, että fenolissa OH-ryhmä on sitoutunut suoraan aromaattiseen renkaaseen). Jos tämä molekyyli reagoisi yhden mooliekvivalentin vahvan emäksen, kuten natriumhydroksidin, kanssa, juuri fenolin protoni luovuttaisi fenolaattianionin muodostamiseksi.
Harjoitus 7.2.2
Tunnista kunkin alla olevan molekyylin hapan funktionaalinen ryhmä ja anna sen likimääräinen pKa.

Liuos