Happovakion määrittely
Olet epäilemättä tietoinen siitä, että jotkut hapot ovat vahvempia kuin toiset. Eri yhdisteiden tai funktionaalisten ryhmien suhteellista happamuutta – toisin sanoen niiden suhteellista kykyä luovuttaa protoni yhteiselle emäkselle samanlaisissa olosuhteissa – kvantifioidaan luvulla, jota kutsutaan happamuusvakioksi, lyhenteellä \(K_a\). Vertailuun valittu yhteinen emäs on vesi.
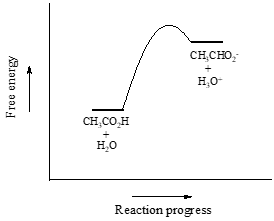
Tarkastelemme etikkahappoa ensimmäisenä esimerkkinä. Jos teemme laimean liuoksen etikkahappoa veteen, hapon (protonin luovuttaja) ja veden (protonin vastaanottaja) välillä tapahtuu happo-emäsreaktio.

Etikkahappo on heikko happo, joten tasapaino suosii reagoivia aineita suhteessa tuotteisiin – se on termodynaamisesti ”ylämäkeä”. Tämä näkyy yllä olevassa kuvassa etenevien ja kääntyvien reaktionuolien suhteellisesta pituudesta.
Tasapainovakio \(K_{eq}\) määritellään seuraavasti:
\}{} = \frac{}{}{}\]
Muistakaa, että kyseessä on laimea vesiliuos: lisäsimme pienen määrän etikkahappoa suureen määrään vettä. Siksi veden konsentraatio (noin 55,6 mol/l) muuttuu reaktion aikana hyvin vähän, ja sitä voidaan käsitellä vakiona.
Jos siirretään veden konsentraation vakiotermi tasapainovakion lausekkeen vasemmalle puolelle, saadaan lauseke \(K_a\), etikkahapon happovakio:
\ = \frac{}{}\]
Yleisemmällä tasolla tietyn hapon HA tai HB+ dissosiaatiovakio ilmaistaan seuraavasti:
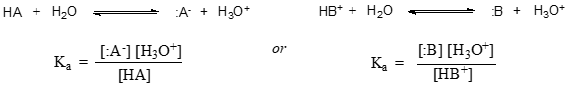
Eetikkahapon \(K_a\) arvo on \(1.75 \ kertaa 10^{-5}\) – paljon pienempi kuin \(1\), mikä osoittaa, että liuoksessa on tasapainotilanteessa paljon enemmän etikkahappoa kuin asetaattia ja hydroniumioneja.
Sitä vastoin rikkihappo, jonka \(K_a\) on noin \(10^9\), tai suolahappo, jonka \(K_a\) on noin \(10^7\), dissosioituvat molemmat olennaisesti täydellisesti vedessä: ne ovat hyvin vahvoja happoja.
Lukua \(1,75 \ kertaa 10^{- 5}\) ei ole kovin helppo sanoa, muistaa tai havainnollistaa, joten kemistit käyttävät yleensä sopivampaa termiä ilmaisemaan suhteellista happamuutta. Hapon \(pK_a\)-arvo on yksinkertaisesti sen \(K_a\)-arvon log (emäksellä 10).
\
Laskemalla saadaan selville, että etikkahapon \(pK_a\)-arvo on \(4.8\). Rikkihapon \(pK_a\) on -10 ja suolahapon \(pK_a\) on -7. \(pK_a\)-arvojen avulla voidaan ilmaista tavallisten yhdisteiden ja funktionaalisten ryhmien suhteellinen happamuus numeerisella asteikolla, joka ulottuu noin -10:stä (erittäin voimakas happo) 50:een (yhdiste, joka ei ole lainkaan hapan). Mitä pienempi \(pK_a\)-arvo on, sitä vahvempi happo on.
Biologisen orgaanisen kemian kannalta merkityksellisten ionisoituvien (protonin luovuttavien tai hyväksyvien) funktionaalisten ryhmien \(pK_a\)-arvot vaihtelevat yleensä noin 5:stä noin 20:een. Seuraavassa esitetään yhteenveto tärkeimmistä näistä, ja konjugaattihappomuotojen \(pK_a\)-arvot ovat hyvin karkeat. Viitteeksi on myös muita happamia ryhmiä, joiden \(pK_a\)-arvot ovat lähellä nollaa.
Tyypilliset \(pK_a\)-arvot
| ryhmä | likimääräiset \(pK_a\) |
|---|---|
| hydroniumioni | 0 |
| protonoitu alkoholi | 0 |
| protonoitu karbonyyli | 0 |
| karboksyylihapot | 5 |
| protonoidut imiinit | 7 |
| protonoidut amiinit. | 10 |
| fenolit | 10 |
| tiolit | 10 |
| alkoholit, vesi | 15 |
| \(\alfa\)-hiilihapot * | 20 |
*\(\alfa\)-hiilihapot selvitetään kohdassa 7.6A
On erittäin suositeltavaa tallentaa nämä karkeat arvot muistiin nyt – jos tarvitset tarkempaa arvoa, voit aina katsoa sen täydellisemmästä \(pK_a\)-taulukosta. Tämän kirjan liitteessä on yksityiskohtaisempi taulukko tyypillisistä \(pK_a\)-arvoista, ja paljon täydellisempiä taulukoita on saatavilla esimerkiksi Handbook of Chemistry and Physics -teoksessa.
\(pK_a\) vs. \(pK_a\). \(pH\)
On tärkeää ymmärtää, että \(pK_a\) ei ole sama asia kuin \(pH\): edellinen on yhdisteen tai funktionaalisen ryhmän luontainen ominaisuus, kun taas jälkimmäinen on hydroniumionien konsentraation mitta tietyssä vesiliuoksessa:
\\\]
Tietämällä \(pK_a\)-arvot voimme vertailla paitsi happojen myös emästen vahvuutta. Keskeinen muistettava ajatus on tämä: mitä vahvempi on konjugoitu happo, sitä heikompi on konjugoitu emäs. Voimme todeta, että hydroksidi-ioni on vahvempi emäs kuin ammoniakki (\(NH_3\)), koska ammoniumioni (\(NH4^+\), \(pK_a = 9.2\)) on vahvempi happo kuin vesi (\(pK_a = 15.7\)).
Harjoitus \(\PageIndex{1}\)
Kumpi on vahvempi emäs, \(\(CH_3O^-\) vai \(\(CH_3S^-\))? Asetaatti-ioni vai ammoniakki? Hydroksidi- vai asetaatti-ioni?
Käytetään \(pK_a\)-käsitteen ymmärtämistä monimutkaisemman molekyylin yhteydessä. Mikä on esimerkiksi alla olevan yhdisteen \(pK_a\)?

Meidän on arvioitava molekyylin neljän erityyppisen protonin potentiaalista happamuutta ja löydettävä niistä happamimmat. Kaikki aromaattiset protonit eivät ole happamia – niiden \(pK_a\) on noin 45. Myöskään amiiniryhmä ei ole hapan, sen \(pK_a\) on noin 35. (Muistakaa, että varauksettomat amiinit ovat emäksisiä: vain positiivisesti varautuneet protonoidut amiinit, joiden \(pK_a\)-arvot ovat noin 10, ovat heikosti happamia). Alkoholin protonin \(pK_a\)-arvo on noin 15 ja fenolin protonin \(pK_a\)-arvo on noin 10. (Varmista, että tunnistat eron fenolin ja alkoholin välillä – muista, että fenolissa \(OH\)-ryhmä on sitoutunut suoraan aromaattiseen renkaaseen). Jos tämä molekyyli reagoi yhden mooliekvivalentin vahvan emäksen, kuten natriumhydroksidin, kanssa, fenoliprotonin luovuttaisi fenolaattianioni.
Harjoitus \(\PageIndex{2}\)
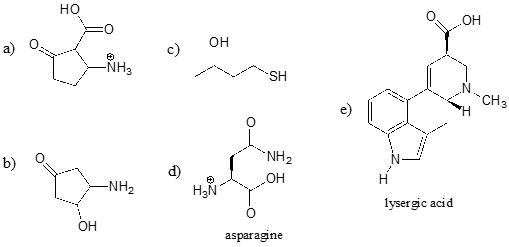
Tunnista kunkin alla olevan molekyylin hapan funktionaalinen ryhmä ja anna sen likimääräinen \(pK_a\).