| Ed Davis, Dr. |
Esittely
Lentivirukset ja adeno-assosioituneet virukset (AAV) ovat osoittautuneet korvaamattomiksi keinoiksi geneettisen materiaalin tuomiseksi nisäkässoluihin joko viljelyssä tai kokonaisina eläiminä. Molemmat järjestelmät soveltuvat hyvin moniin perustutkimussovelluksiin, kuten proteiinien yliekspressioon, vasta-ainetuotantoon ja geenien tyrmäykseen, ja molemmat ovat lupaavia geeniterapian kannalta. Kummallakin virusjärjestelmällä on kuitenkin omat ainutlaatuiset etunsa ja haittansa sovelluksesta riippuen. GeneCopoeia tarjoaa laajat tuotevalikoimat sekä lentiviruksille että AAV:lle, mikä tarjoaa tehokkaita ja joustavia vaihtoehtoja DNA:n siirtämiseen soluihin. Tässä teknisessä huomautuksessa kuvaamme GeneCopoeian Lentifect™ -lentivirus- ja AAVPrime™ AAV-tuotelinjojen taustalla olevat teknologiat ja keskustelemme kunkin teknologian eduista eri sovelluksissa auttaaksemme sinua valitsemaan, mikä järjestelmä sopii parhaiten tarpeisiisi.
Miksi käyttää viruksia DNA:n toimittamiseen?
Yksi yleisimmistä tavoista toimittaa DNA:ta soluihin on plasmidipohjainen transfektio, jossa soluja käsitellään kemiallisilla yhdisteillä, kuten kalsiumfosfaatilla, tai lipidipohjaisilla reagensseilla. Plasmiditransfektio ei kuitenkaan ole aina toivottavaa tai käytännöllistä. Esimerkiksi joidenkin solujen transfektointi on hyvin vaikeaa tai mahdotonta, kun taas useimmat viljellyt solut tukevat infektiota (eli transduktiota) joko lentiviruksen tai AAV:n avulla. Toiseksi plasmiditransfektiota ei voida käyttää DNA:n in vivo -siirtoon, mutta virustransduktiota voidaan käyttää. Sekä lentivirusta että AAV:tä voidaan käyttää moniin erilaisiin sovelluksiin, kuten proteiinien ilmentämiseen avoimista lukukehyksistä (ORF), geenien tyrmäykseen RNA-interferenssillä (RNAi) lyhyen hiusneula-RNA:n (shRNA) avulla, luciferaasi- ja muihin reportterigeenitesteihin sekä geenien tyrmäykseen CRISPR-Cas9-järjestelmän (CRISPR-Cas9, Clustered, Rulesely Interspaced, Short Palindromic Repeats) avulla. Monet näistä virusvektoreiden sovelluksista on toteutettu menestyksekkäästi viljellyissä kuolemattomissa nisäkässolulinjoissa, primaarisessa soluviljelyssä, eläinmalleissa ja geeniterapiassa ihmispotilailla.
Lentiviraaliset järjestelmät
Käsitteellä ”lentiivirukset” viitataan retrovirusten luokkaan, johon kuuluu myös ihmisen immuunipuutosvirus (HIV), ja suurin osa tällä hetkellä käytössä olevista lentiviraalisista järjestelmistä onkin johdettu HIV:stä (katsauksessa kirjassaan: Mátrai ym., s ), 2010; Sakuma ym., 2012). Siirtogeeniä kantavat lentivirukset integroituvat genomiin infektion yhteydessä, joten ne mahdollistavat vakaan ilmentymisen sekä jakautuvissa että jakautumattomissa soluissa.
Lentivirusjärjestelmiä on muokattu voimakkaasti HIV:stä useiden sukupolvien ajan, jotta ne olisivat turvallisia käsitellä ja hyödyllisiä sovelluksissa. GeneCopoeia käyttää kolmannen sukupolven lentiviraalijärjestelmää (Dull, et al. 1998), joka vaatii neljä erillistä plasmidia infektiivisten viruspartikkelien (virionien) tuottamiseen. GeneCopoeian lentiviraaliplasmidi sisältää ainoastaan ilmentyvän kiinnostavan geenin, antibioottivalintageenin ja pakkaussignaalisekvenssit. Joskus klooni sisältää myös fluoresoivan reportterigeenin. GOI:n sisältävään plasmidiin, jossa on valikoiva merkkiaine ja reportterigeeni, mahtuu enintään noin 5-6 kb:n inserttejä. (Kuva 1), vaikka virustitterit laskevat dramaattisesti, kun insertin koko ylittää noin 4 kb.
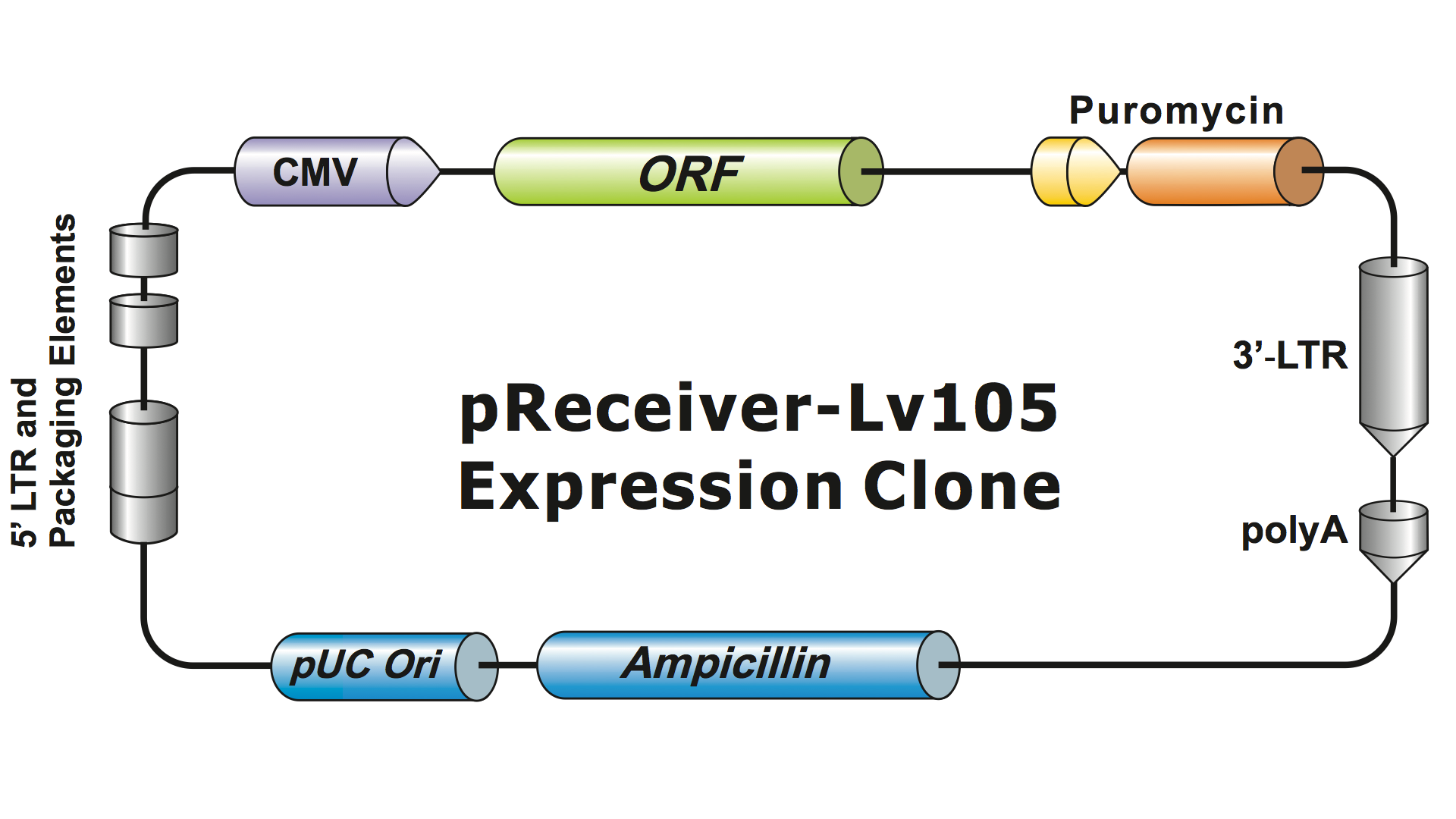 |
Kuva 1. Plasmadiagnoosi. Esimerkki GeneCopoeia-lentiviraali-ekspressiokloonista |
Lisäplasmidit ilmentävät pakkaamiseen ja integrointiin tarvittavia retroviruselementtejä (gag, pol, env, Rev). Kun kaikki neljä plasmidia ilmentyvät pakkaussoluissa, GOI RNA integroituu partikkeleihin. Koska retrovirusproteiinit ilmentyvät vain pakkaamisen aikana, infektoituneet solut eivät voi tuottaa tarttuvaa virusta. Lisäksi GeneCopoeian Lentifect™ -lentivirushiukkaset sisältävät deletion LTR:n U3-alueella, mikä tekee niistä itseinaktivoituvia (SIN). SIN-deleetio estää lentiviruksen replikaation siinä harvinaisessa tapauksessa, että kaikki neljä plasmidia yhdistyvät luodakseen yhden aktiivisen virusplasmidin. Näin ollen lentivirushiukkaset ovat turvallisia käsitellä, eikä patogeenisen viruksen syntyminen ole käytännössä mahdollista.
Parannettujen turvallisuusmuutosten lisäksi GeneCopoeian Lentifect™ -lentivirushiukkaset kantavat vesikulaarisen stomatiittiviruksen G-glykoproteiinia (VSV-G) villin tyypin HIV env-geenin sijasta, mikä muuttaa viruksen kudostrooppisuutta CD4+ T-soluista käytännössä mihin tahansa nisäkässolutyyppiin. Näin ollen lentivirukset ovat laajalti käytetty järjestelmä nisäkässolujen viljelyssä, eläinmalleissa ja geeniterapiasovelluksissa.
Koska lentivirusvektoreita on muutettu näillä tavoin, GeneCopoeian Lentifect™ -lentivirusjärjestelmillä on parannettu turvallisuus, ja niillä on seuraavat ominaisuudet, jotka tekevät niistä erittäin käyttökelpoisia DNA:n siirtoon:
- Ne infektoivat lähes kaikki nisäkässolutyypit
- Neillä voidaan toimittaa suhteellisen suuria DNA-sekvenssejä – jopa noin 5-6 kb:n pituisia
- Neillä voidaan tuottaa stabiileja solulinjoja tai ohjata stabiilia geeniekspressiota elimissä ja kudoksissa in vivo, koska siirtogeeni integroituu satunnaisiin kohtiin genomissa
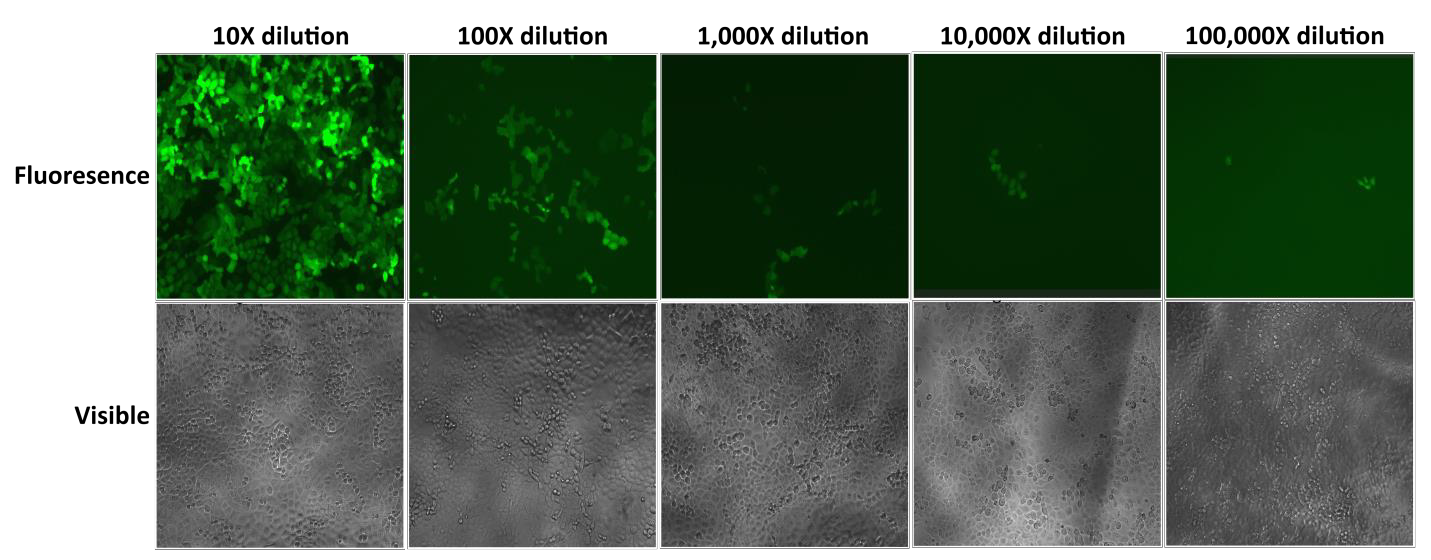
GeneCopoeian Lentifect™ -lentiviraalipartikkelit tuottavat korkeita tittereitä, joiden avulla tutkijat voivat tehokkaasti ilmentää kiinnostuksen kohteena olevia geenejä (kuva 2).
|
Kuva 2. Lentifect™-tensiiviraalipartikkelien sarjalaimennosten testaus. eGFP:n fluoresenssi kuvattiin fluoresenssimikroskoopilla 72 tuntia transduktion jälkeen. |
|
GeneCopoeia tarjoaa yhden alan kattavimmista linssiviraalivalikoimista (taulukko 1).
| Tuote/palvelu | Kuvaus |
| Lentiviraaliset kloonit ja kloonausvektorit | Esivalmistetut ja räätälöidyt kloonit, jotka kantavat ORF:iä, promoottoreita, shRNA:ita, miRNA:iden 3′ UTR:iä, esiarvoja ja estäjiä, sgRNA:ita jne. Saatavana useilla promoottoreilla, tunnisteilla ja reporttereilla. Vektorit kiinnostavien sekvenssien tee-se-itse-kloonaukseen. |
| Lentifect™ -lentiviraalipartikkelit | Valmiiksi valmistettuja ja räätälöityjä, käyttövalmiita lentiviraalipartikkeleita. Valmistetaan GeneCopoeian laajoista, koko genomin kattavista kloonikokoelmista tai asiakkaan lähettämistä klooneista. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Kokonaisvaltainen reagenssijärjestelmä tee-se-itse-lintsiviiripartikkelien valmistukseen. Sisältää pakkausplasmidit, pakkaussolulinjan, partikkelien konsentrointiliuoksen ja titraussarjan. |
Taulukko 1. GeneCopoeian lentivirustuotteiden ja -palveluiden valikoima.
AAV-pohjaiset järjestelmät
Lentivirusten RNA-genomista poiketen AAV:llä on yksisäikeinen DNA-genomi (Samulski ja Muzyczka, 2014). AAV ei myöskään ole peräisin patogeenistä, vaan se on pikemminkin adenoviruksen kontaminantti, jolle ei ole liitetty patogeenisiä olosuhteita. Luonnossa esiintyvä AAV integroituu genomiin lentiviruksen tavoin, mutta vain AAVS1-lokukseen kromosomissa 19. Tämä paikka tunnetaan myös nimellä ”Safe Harbor”, koska sitä käytetään yleisesti siirtogeenin insertiontiin vahingoittamatta soluja (DeKelver, et al., 2010).
Lentiviruksen tavoin AAV:tä on muokattu turvallisuuden ja käytettävyyden vuoksi. AAV edellyttää samanaikaista tartuntaa apuviruksen kanssa. AAV-genomi on 4,7 kb pitkä ja sisältää kaksi geeniä, Rep ja Cap, joita tarvitaan viruksen replikaatioon ja integroitumiseen. AAVPrime™:ssä Rep ja Cap on poistettu, jolloin jäljelle jäävät vain 145 bp:n 5′ ja 3′ inverted terminal repeats (ITR). Repin ja Capin poistamisella on kolme tarkoitusta: 1) Se poistaa auttajaviruksen kyvyn sallia AAV-infektoitujen solujen tuottaa uusia AAV-virioneja; 2) Se sallii enintään noin 4 kb:n pituisten geenien insertioinnin (vaikkakin virustitteri vähenee, kun transgeenit ovat yli 3 kb:n pituisia); ja 3) Se käytännössä poistaa AAV:n kyvyn integroitua. AAV:n pieni koko aiheuttaa haasteita joissakin sovelluksissa. Esimerkiksi CRISPR-genomieditointiin tutkijat käyttävät S. aureus -bakteerista peräisin olevaa Cas9-nukleaasia, koska se on noin 30 prosenttia lyhyempi kuin yleisemmin käytetty S. pyogenes -bakteerin Cas9 (Ran, et al., 2015).
Pakkaamista varten Rep- ja Cap-geenit on siirretty eri plasmidiin ja adenoviruksen apugeenit on sijoitettu kolmanteen plasmidiin, jolloin koko pakkausjärjestelmä on turvallinen ja apuviruksista vapaa (kuva 3).
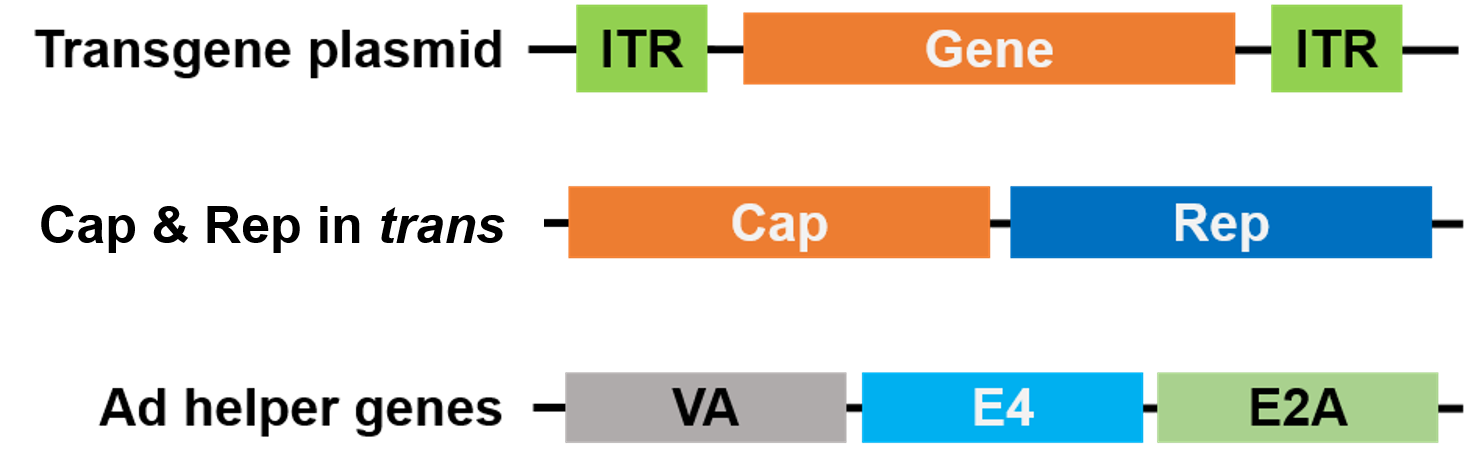 |
Kuva 3. Pakkausjärjestelmä, joka on turvallinen ja jossa ei ole apuviruksia. Apuviruksesta vapaa AAV. Pakkaamiseen käytetään 3 plasmidia. Kiinnostavan geenin plasmidi (ylhäällä) sisältää inverted terminal repeats (ITR). Toinen plasmidi (keskellä) kantaa AAV:n Cap- ja Rep-geenejä, ja kolmas plasmidi (alhaalla) kantaa Adenoviruksen (Ad) |
Lisäksi AAV:tä on olemassa eri serotyyppejä, jotka vaikuttavat AAV-infektion kudospesifisyyteen. Useiden serotyyppien avulla tutkijat voivat joko a) infektoida laajan valikoiman isäntäsoluja tai b) rajoittaa infektion yhteen tai muutamaan kudokseen. GeneCopoeian AAVPrime™ AAV-partikkeleita on saatavilla useina serotyyppeinä (taulukko 2).
| Serotyyppi | Primäärinen kohdekudos | Kuvaus |
| AAV-1 | Lihakset | Valmis sydänlihaksille, luurankolihaksille, hermosolu- ja gliakudoksille. |
| AAV-2 | Lihas, maksa, verkkokalvo | Yleisimmin käytetty serotyyppi. Paras neuroneille, lihakselle, maksalle ja aivoille. |
| AAV-3 | Megakaryosyytit | Paras megakaryosyyteille, lihakselle, maksalle, keuhkoille ja verkkokalvolle. |
| AAV-4 | Retina | Paras neuroneille, lihaksille, aivoille ja verkkokalvolle. |
| AAV-5 | Keuhkot | Paras keuhkoille, neuroneille, nivelnivelille, verkkokalvolle ja haimalle. |
| AAV-6 | Lihaksille, keuhkoille | Paras keuhkoille, maksalle ja sydämelle. |
| AAV-7 | Lihas, verkkokalvo, hermosolut | Paras lihaksille, hermosoluille ja maksalle. |
| AAV-8 | Maksa | Paras lihaksille, aivoille, maksalle ja verkkokalvolle. |
| AAV-9 | Vaihteleva | Paras lihakseen, sydämeen, maksaan, keuhkoihin ja aivoihin. |
| AAV-10 | Pleura, CNS | Kloonattu Cynomolguksesta, lähes identtinen AAVrh10:n kanssa paitsi 12 aminohappoa VP1:ssä. Paras keuhkoille, lihaksille, sydämelle, NCS:lle ja maksalle. |
| AAV-DJ | Vaihteleva | Sekoitus 8 luonnossa esiintyvää serotyyppiä. Transdusoi tehokkaasti monenlaisia solutyyppejä in vitro. |
| AAV-DJ/8 | Various | AAV-DJ:n muunnos, jossa on hepariinia sitova domeeni (HBD) -mutaatio, joka mahdollistaa maksan sekä muiden kudosten infektoinnin in vivo. |
TAULUKKO 2. Luettelo laajalti käytetyistä AAV-serotyypeistä
AAVPrime™ AAV-partikkeleilla on seuraavat ominaisuudet, jotka tekevät niistä erittäin käyttökelpoisia DNA:n levittämiseen:
- Korkeat titterit. Puhdistettujen partikkelien titteri voi olla jopa 10^14 GC/ml (genomikopioita/ml)
- Monipuolinen. Useat serotyypit mahdollistavat käytön joko laajalla tai rajoitetulla valikoimalla isäntäsoluja
- Alhainen toksisuus. Ei integroidu isännän genomiin.
- Vähäinen immunogeenisuus. Minimaalinen isännän immuunivaste.
- Turvallinen. Ei liity mihinkään ihmisen sairauteen
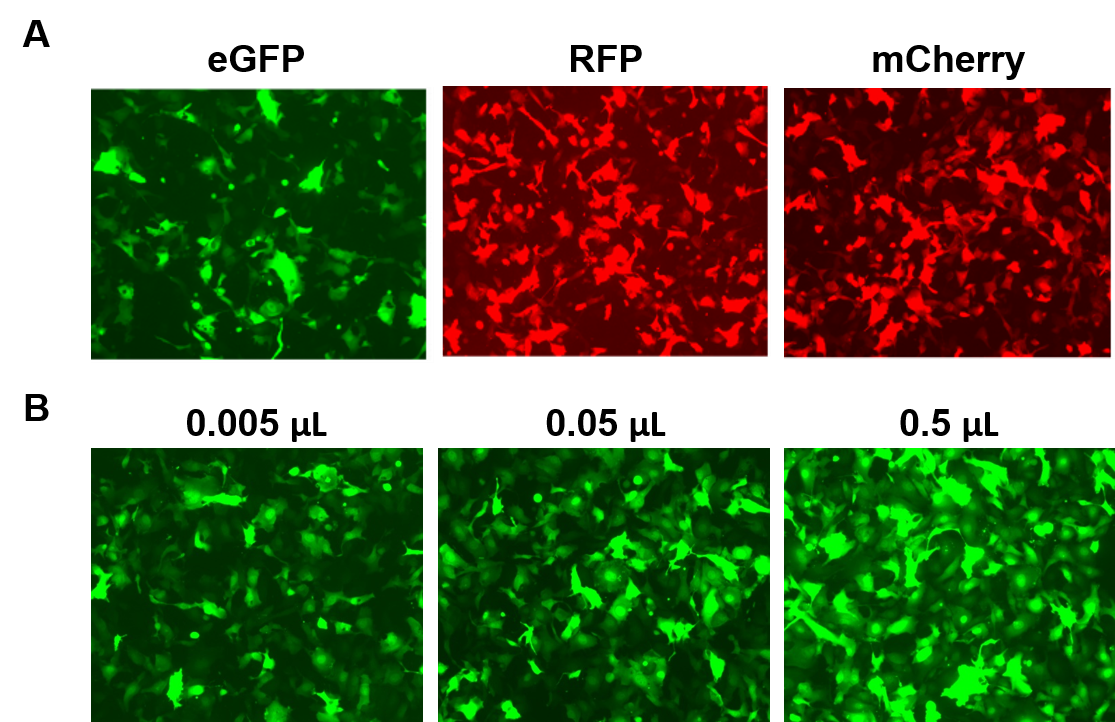
AAVPrime™-partikkeleita on saatavana ihmisen ja hiiren ORF:eille 3 kb:iin asti, useina serotyyppeinä ja promoottorivaihtoehtoina, joko standardipuhtaina (vain in vitro -käyttöön) tai puhdistettuina (in vivo -käyttöön). Asiakkaat voivat tilata plasmidiklooneja, räätälöityjä partikkeleita kiinnostaville geeneille tai valita valmiista vaihtoehdoista, jotka ilmentävät geenejä, kuten fluoresoivia reporttereita (kuva 4).
|
Kuva 4. GeneCopoeian AAVPrime™-partikkelien suorituskyky. A. HT1080-solut 24-kuoppalevyissä, jotka transdusoitiin 0,5 µl:lla tehostettua GFP:tä (eGFP), punaista fluoresoivaa proteiinia (RFP) ja monomeerista Cherryä (mCherry) ilmentävällä standardipuhtaalla AAV:llä. B. HT1080-solut 24-kuoppalevyissä transdusoitiin vaihtelevilla määrillä puhdasta eGFP:tä ilmentävää AAV:tä. Solut visualisoitiin fluoresenssimikroskoopilla (valotusaika: 400 ms). |
|
Minkä valitsisin: Lentivirus vai AAV?
Lentiviruksen ja AAV:n välinen valinta riippuu monista tekijöistä. Esimerkiksi se, että lentivirukset integroituvat genomiin, voi olla sekä etu että haitta, riippuen tarpeistasi. Katso alla olevaa taulukkoa päätöksenteon helpottamiseksi:
| Suuremmat insertit | Vakaa integroituminen | Ei ole. integroituminen | Solu/kudospesifisyys | in vivo turvallisuus | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Jos haluat lisätietoja GeneCopoeian virusjärjestelmistä ja tilata, käy verkkosivuillamme (https://www.genecopoeia.com/product/lentiviral-system/)
Johtopäätökset
Me GeneCopoeialla pyrimme tarjoamaan sinulle korkealaatuisia, huipputeknologiaa hyödyntäviä tuotteita funktionaaliseen genomiikkaan ja solubiologiaan. Tarjoamme laajan tuotevalikoiman genomin laajuisista plasmidi-DNA-kloonien sarjoista ORF:eille, geenipromoottoreille, miRNA:ille, shRNA:ille ja CRISPR:lle, tehokkaista sarjoista ja reagensseista tuotteisiin fluoresoivia solurakenne-koettimia, nukleiinihappojen kvantifiointia ja leimattuja vasta-aineita varten. Jos haluat lisätietoja, käy verkkosivuillamme www.genecopoeia.com tai ota yhteyttä osoitteeseen [email protected].
DeKelver, et al. (2010). Toiminnallinen genomiikka, proteomiikka ja säätely-DNA-analyysi isogeenisissä ympäristöissä käyttäen sinkkisormi-nukleaasi-ohjattua siirtogeenisyyttä ihmisen genomissa olevaan safe harbor -lokukseen. Genome Res 20, 1133.
Dull, et al. (1998). Kolmannen sukupolven lentovirusvektori, jossa on ehdollinen pakkausjärjestelmä. J. Virol. 72, 8463.
Ran, et al. (2015). In vivo genomin muokkaus Staphylococcus aureus Cas9:n avulla. Nature 526, 186.
Sakuma, et al. (2012). Lentiviraaliset vektorit: perustutkimuksesta translaatiotutkimukseen. Biokemia. J. 443, 603.
Samulski ja Muzyczka (2014). AAV-välitteinen geeniterapia tutkimus- ja terapeuttisiin tarkoituksiin. Annu. Rev. Virol. 1, 427.