A: Definice konstanty kyselosti
Jistě víte, že některé kyseliny jsou silnější než jiné. Relativní kyselost různých sloučenin nebo funkčních skupin – jinými slovy jejich relativní schopnost darovat proton společné zásadě za stejných podmínek – se kvantifikuje číslem zvaným konstanta kyselosti, zkráceně Ka. Společnou bází zvolenou pro srovnání je voda.
Naším prvním příkladem bude kyselina octová. Pokud vytvoříme zředěný roztok kyseliny octové ve vodě, dojde k acidobazické reakci mezi kyselinou (donorem protonů) a vodou (akceptorem protonů).
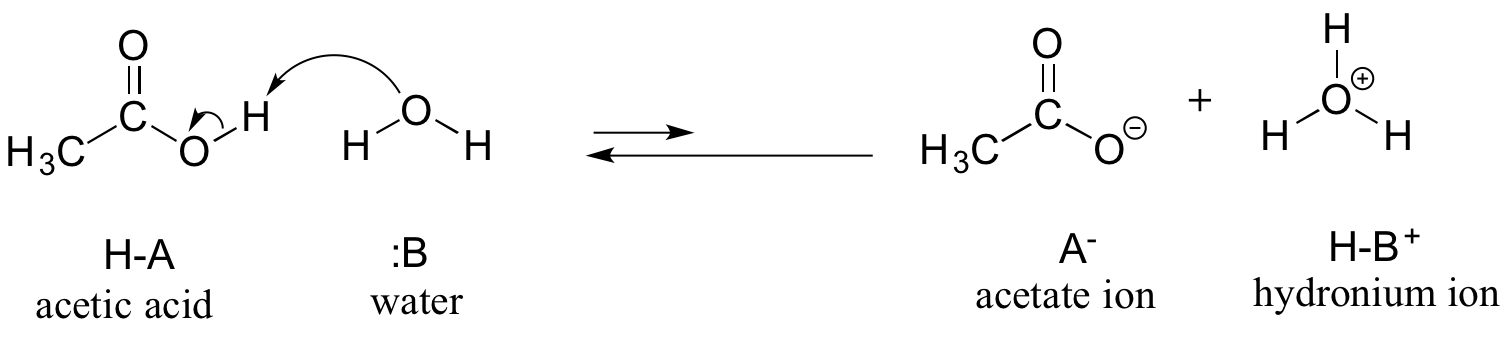
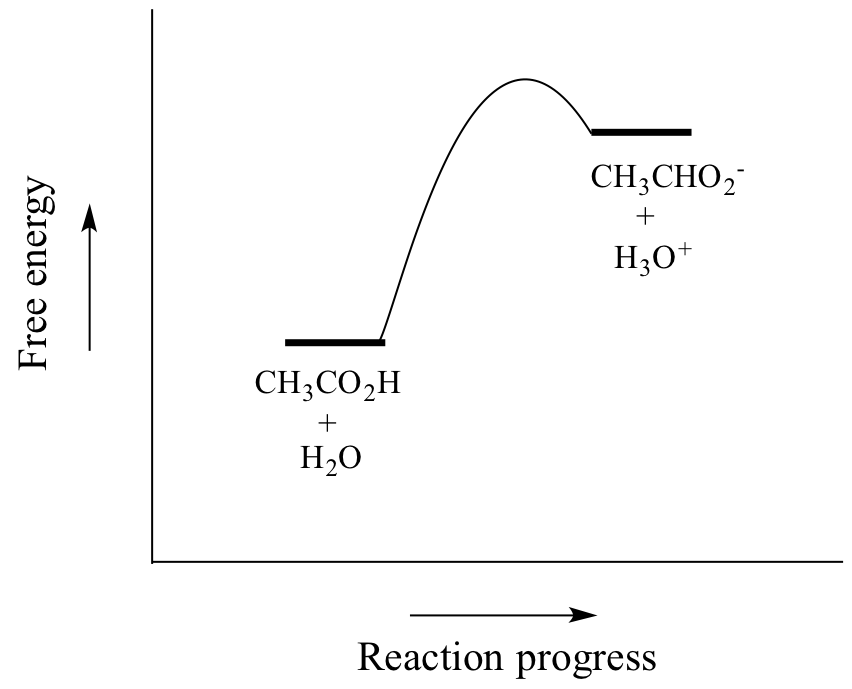
Kyselina octová je slabá kyselina, takže rovnováha upřednostňuje reaktanty před produkty – je termodynamicky „do kopce“, jak je naznačeno na obrázku výše relativní délkou šipek dopředné a zpětné reakce a v reakčním souřadnicovém diagramu níže, v němž mají produkty vyšší energii než reaktanty.
Jak víte, rovnovážná konstanta Keq je definována jako:
![]()
Každé vyjádření rovnovážné konstanty je vlastně poměrem aktivit všech druhů zúčastněných v reakci. Aby se zabránilo používání aktivit a zjednodušilo se experimentální měření, aproximuje se rovnovážná konstanta koncentrací aktivitami rozpuštěných látek a plynů ve zředěných roztocích s jejich příslušnými molárními hodnotami. Aktivity pevných látek, čistých kapalin a rozpouštědel však nejsou aproximovány jejich molárními hodnotami. Místo toho jsou tyto aktivity definovány tak, že mají hodnotu rovnou 1 (jedna).
Pokud tedy připustíme, že aktivita vody ve zředěném roztoku je aproximována hodnotou jednoty (1), můžeme ji vydělit 1 a získat běžný tvar výrazu pro Ka, kyselou konstantu pro kyselinu octovou:
\}{(1)} = \dfrac{}{} \]
Ve skutečnosti se pro zředěný vodný roztok aktivita vody aproximuje hodnotou 1, takže obecná disociační konstanta pro danou kyselinu HA nebo HB+ se vyjadřuje takto:
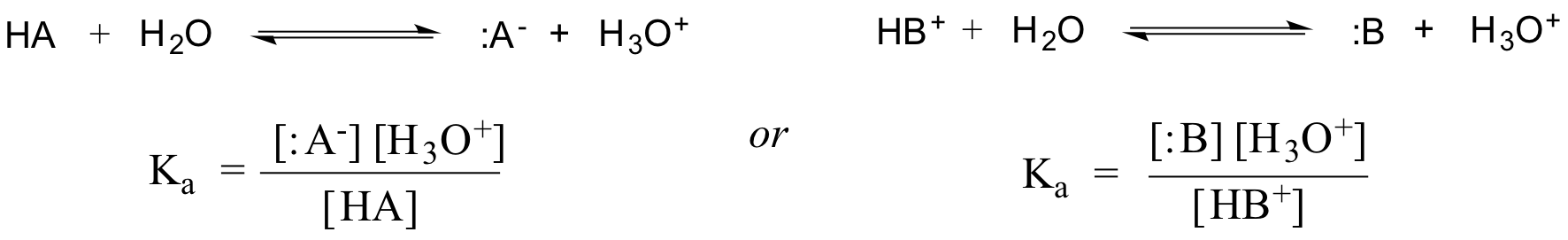
Hodnota Ka pro kyselinu octovou je 1.75 x 10-5 – mnohem méně než 1, což znamená, že v rovnovážném stavu je v roztoku mnohem více kyseliny octové než octanu a hydroniových iontů.
Naproti tomu kyselina sírová s Ka přibližně 109 nebo kyselina chlorovodíková s Ka přibližně 107 podléhají ve vodě v podstatě úplné disociaci: jsou to velmi silné kyseliny.
Číslo jako 1,75 x 10- 5 není příliš snadné ani vyslovit, ani si zapamatovat, ani si ho představit, proto chemici obvykle používají pro vyjádření relativní kyselosti vhodnější termín. Hodnota pKa kyseliny je jednoduše logaritmus (základ 10) její hodnoty Ka.
pKa = -log Ka Ka = 10-pKa
Počítáme-li, zjistíme, že pKa kyseliny octové je 4,8. V tomto případě je pKa kyseliny octové 4,8. PKa kyseliny sírové je -10 a kyseliny chlorovodíkové je -7. Použití hodnot pKa nám umožňuje vyjádřit relativní kyselost běžných sloučenin a funkčních skupin na číselné stupnici přibližně od -10 (pro velmi silnou kyselinu) do 50 (pro sloučeninu, která není kyselá vůbec). Čím nižší je hodnota pKa, tím silnější je kyselina.
Ionizovatelné (proton darující nebo akceptující) funkční skupiny důležité pro biologickou organickou chemii mají obecně hodnoty pKa v rozmezí přibližně od 5 do 20. Nejdůležitější z nich jsou shrnuty níže, s velmi hrubými hodnotami pKa pro konjugované formy kyselin. Pro informaci jsou uvedeny i další kyselé skupiny s hodnotami pKa blízkými nule.
Přibližné hodnoty pKa, které je třeba znát
hydroniový ion (H3O+) : 0
protonovaný alkohol: 0
protonovaný karbonyl: 0
karboxylové kyseliny: 5
protonované iminy: 7
protonované aminy: 10
fenoly: 10
thioly: 10
voda: 14
alkoholy: 15-18
alfa-uhlíkové kyseliny*:
*alfa-uhlíkové kyseliny budou probrány později v této kapitole
Důrazně doporučujeme, abyste si tyto hrubé hodnoty nyní uložili do paměti – pokud pak budete potřebovat přesnější hodnotu, můžete ji vždy vyhledat v tabulce pKa.
Pozor! pKa není totéž co pH!
Důležité je uvědomit si, že pKa není totéž co pH: první hodnota je inherentní vlastností sloučeniny nebo funkční skupiny, zatímco druhá je mírou koncentrace hydroniového iontu v daném vodném roztoku:
pH = -log
Znalost hodnot pKa nám umožňuje nejen porovnávat sílu kyselin, ale také sílu zásad. Klíčová myšlenka, kterou je třeba si zapamatovat, zní: čím silnější je konjugovaná kyselina, tím slabší je konjugovaná zásada. Můžeme určit, že hydroxidový ion je silnější báze než amoniak (NH3), protože amonný ion (NH4+, pKa = 9,2) je silnější kyselina než voda (pKa = 14,0).
Cvičení 7.2.1
Která báze je silnější, CH3O- nebo CH3S-? Octanový iont nebo amoniak? Hydroxidový nebo acetátový ion?“
Roztok
Použijeme naše znalosti pojmu pKa v kontextu složitější molekuly. Jaká je například pKa níže uvedené sloučeniny?
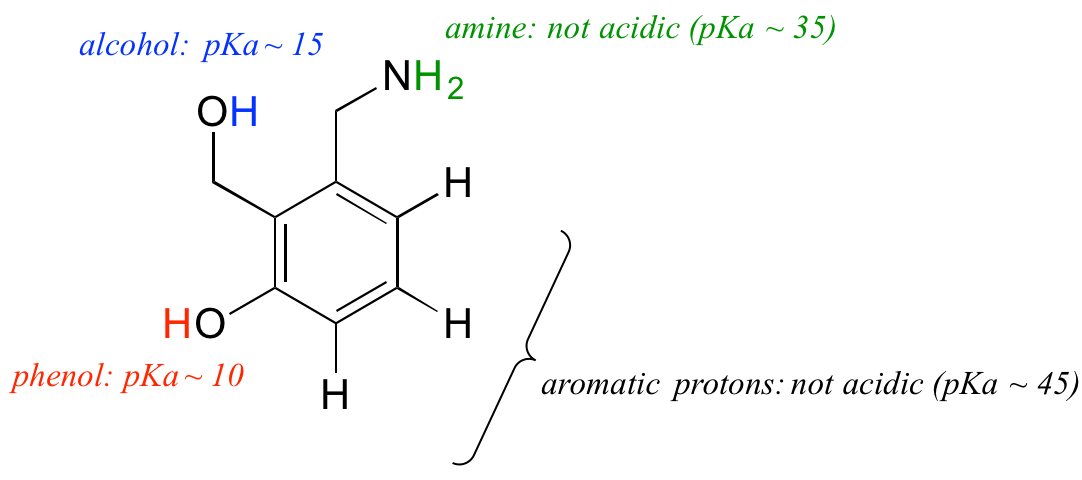
Potřebujeme vyhodnotit potenciální kyselost čtyř různých typů protonů na molekule a najít ten nejkyselejší. Aromatické protony nejsou všechny kyselé – jejich pKa se pohybuje kolem hodnoty 45. Aminová skupina také není kyselá, její pKa je asi 35. (Nezapomeňte, že nenabité aminy jsou zásadité: slabě kyselé jsou právě kladně nabité protonované aminy s hodnotami pKa kolem 10.) Proton alkoholu má pKa asi 15 a proton fenolu má pKa asi 10: nejkyselejší skupinou na výše uvedené molekule je tedy fenol. (Ujistěte se, že dokážete rozpoznat rozdíl mezi fenolem a alkoholem – nezapomeňte, že ve fenolu je OH skupina vázána přímo na aromatický kruh). Pokud by tato molekula reagovala s jedním molárním ekvivalentem silné zásady, jako je hydroxid sodný, byl by to právě fenolový proton, který by byl darován za vzniku fenolátového aniontu.
Cvičení 7: Zjistěte, co je to fenolová skupina.2.2
Určete nejkyselejší funkční skupinu na každé z níže uvedených molekul a uveďte její přibližné pKa.

Roztok
.