Brønsted-Lowryho definice kyselosti a zásaditosti
Naší diskusi o acidobazické chemii začneme několika základními definicemi. První z nich navrhli v roce 1923 dánský chemik Johannes Brønsted a anglický chemik Thomas Lowry a stala se známou jako Brønstedova-Lowryho definice kyselosti a zásaditosti. Podle Brønstedovy a Lowryho definice je kyselina druh, který působí jako donor protonů, zatímco zásada je akceptor protonů. V předchozí kapitole jsme již probírali jeden z nejznámějších příkladů Brønstedovy-Lowryho acidobazické reakce mezi kyselinou chlorovodíkovou a hydroxidovým iontem:
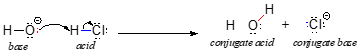
V této reakci dochází k přenosu protonu z HCl (kyselina, neboli donor protonu) na hydroxidový iont (báze, neboli akceptor protonu). Jak jsme se dozvěděli v předchozí kapitole, zakřivené šipky znázorňují pohyb elektronů při tomto procesu rozbíjení a vytváření vazby.
Po tom, co Brønstedova-Lowryho kyselina daruje proton, se to, co zůstane, nazývá konjugovaná báze. Chloridový ion je tedy konjugovanou zásadou kyseliny chlorovodíkové. A naopak, když Brønstedova-Lowryho zásada přijme proton, přemění se na konjugovanou kyselou formu: voda je tedy konjugovanou kyselinou hydroxidového iontu.
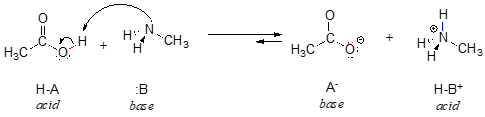
Tady je organická acidobazická reakce, mezi kyselinou octovou a methylaminem:
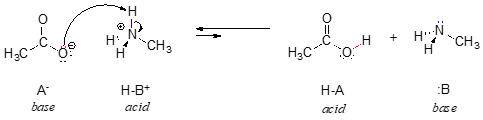
V opačném směru této reakce je acetátový iont bází a methylamoniový iont (protonovaný methylamin) kyselinou.
Co činí sloučeninu kyselou (pravděpodobně daruje proton) nebo zásaditou (pravděpodobně přijímá proton)? Zodpovězení této otázky je jedním z našich hlavních úkolů v této kapitole a bude vyžadovat, abychom využili mnohé z toho, co jsme se naučili o organické struktuře v prvních dvou kapitolách, a také myšlenky o termodynamice, které jsme si prošli v kapitole 6.
Prozatím se zabývejme pouze jednou společnou vlastností zásad: aby molekula mohla působit jako zásada, musí mít reaktivní pár elektronů. Ve všech acidobazických reakcích, které uvidíme v této kapitole, má základní druh atom s osamělým párem elektronů. Když například methylamin působí jako zásada, osamělý pár elektronů na atomu dusíku je využit k vytvoření nové vazby s protonem.
Je jasné, že methylamonný ion nemůže působit jako zásada – nemá reaktivní pár elektronů, kterým by mohl přijmout proton.
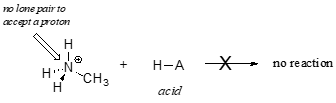
Později, ve 14. kapitole, budeme studovat reakce, při nichž dvojice elektronů ve vazbě alkenového nebo aromatického kruhu působí bazicky – prozatím se však zaměříme na bazicitu nevazebných (osamělých párových) elektronů.
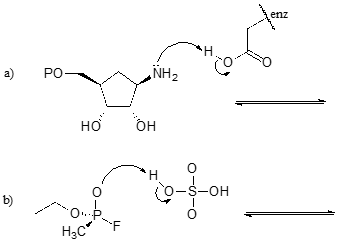
Cvičení \(\PageIndex{1}\)
Dokončete níže uvedené reakce – jinými slovy, nakreslete struktury chybějících konjugovaných kyselin a konjugovaných zásad, které vyplývají z uvedených zakřivených šipek.