Definice konstanty kyselosti
Jistě víte, že některé kyseliny jsou silnější než jiné. Relativní kyselost různých sloučenin nebo funkčních skupin – jinými slovy jejich relativní schopnost darovat proton společné zásadě za stejných podmínek – se kvantifikuje číslem zvaným konstanta kyselosti, zkráceně \(K_a\). Jako společnou zásadu pro srovnání jsme zvolili vodu.
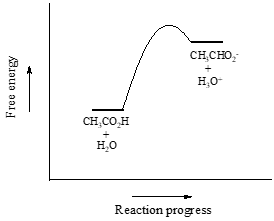
Naším prvním příkladem bude kyselina octová. Pokud vytvoříme zředěný roztok kyseliny octové ve vodě, dojde k acidobazické reakci mezi kyselinou (donorem protonů) a vodou (akceptorem protonů).

Kyselina octová je slabá kyselina, takže rovnováha upřednostňuje reaktanty před produkty – je termodynamicky „do kopce“. To je na obrázku výše naznačeno relativní délkou šipek dopředné a zpětné reakce.
Rovnovážná konstanta \(K_{eq}\) je definována takto:
\}{} = \frac{}{}\]
Pamatujte, že se jedná o zředěný vodný roztok: do velkého množství vody jsme přidali malé množství kyseliny octové. Proto se v průběhu reakce koncentrace vody (přibližně 55,6 mol/l) mění jen velmi málo a lze ji považovat za konstantní.
Přesuneme-li konstantní člen pro koncentraci vody na levou stranu výrazu pro rovnovážnou konstantu, dostaneme výraz pro \(K_a\), kyselou konstantu pro kyselinu octovou:
\ = \frac{}{}\]
Obecněji se disociační konstanta pro danou kyselinu HA nebo HB+ vyjadřuje takto:
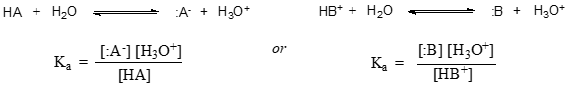
Hodnota \(K_a\) pro kyselinu octovou je \(1.75 \krát 10^{-5}\) – mnohem méně než \(1\), což znamená, že v rovnovážném stavu je v roztoku mnohem více kyseliny octové než octanu a hydroniových iontů.
Naproti tomu kyselina sírová s \(K_a\) přibližně \(10^9\) nebo kyselina chlorovodíková s \(K_a\) přibližně \(10^7\) podléhají ve vodě v podstatě úplné disociaci: jsou to velmi silné kyseliny.
Číslo jako \(1,75 \krát 10^{- 5}\) není příliš snadné vyslovit, zapamatovat si nebo si ho představit, proto chemici obvykle používají pro vyjádření relativní kyselosti vhodnější termín. Hodnota \(pK_a\) kyseliny je jednoduše logaritmus (základ 10) její hodnoty \(K_a\).
\
Počítáním zjistíme, že \(pK_a\) kyseliny octové je \(4,8\). Hodnota \(pK_a\) kyseliny sírové je -10 a kyseliny chlorovodíkové je -7. Použití hodnot \(pK_a\) nám umožňuje vyjádřit relativní kyselost běžných sloučenin a funkčních skupin na číselné stupnici přibližně od -10 (pro velmi silnou kyselinu) do 50 (pro sloučeninu, která není kyselá vůbec). Čím nižší je hodnota \(pK_a\), tím silnější je kyselina.
Ionizovatelné (proton darující nebo přijímající) funkční skupiny důležité pro biologickou organickou chemii mají obecně hodnoty \(pK_a\) v rozmezí přibližně 5 až 20. Nejdůležitější z nich jsou shrnuty níže, s velmi přibližnými hodnotami \(pK_a\) pro konjugované formy kyselin. Pro informaci jsou uvedeny i další kyselé skupiny s hodnotami \(pK_a\) blízkými nule.
Typické hodnoty \(pK_a\)
| skupina | přibližné \(pK_a\) |
|---|---|
| hydroniový ion | 0 |
| protonovaný alkohol | 0 |
| protonovaný karbonyl | 0 |
| karboxylové kyseliny | 5 |
| protonované iminy | 7 |
| protonované aminy | 10 |
| fenoly | 10 |
| tioly | 10 |
| alkoholy, voda | 15 |
| \(\alfa\)-uhlíkaté kyseliny * | 20 |
*\(\alfa\)-uhlíkaté kyseliny budou vysvětleny v oddíle 7.6A
Doporučujeme, abyste si tyto hrubé hodnoty nyní uložili do paměti – pokud pak budete potřebovat přesnější hodnotu, můžete ji vždy vyhledat v úplnější tabulce \(pK_a\). Příloha této knihy obsahuje podrobnější tabulku typických hodnot \(pK_a\) a mnohem úplnější tabulky jsou k dispozici ve zdrojích, jako je Handbook of Chemistry and Physics.
\(pK_a\) vs. \(pK_a\). \(pH\)
Je důležité si uvědomit, že \(pK_a\) není totéž co \(pH\): \(pK_a\) je inherentní vlastností sloučeniny nebo funkční skupiny, zatímco \(pK_a\) je mírou koncentrace hydroniových iontů v daném vodném roztoku:
\\]
Znalost hodnot \(pK_a\) nám umožňuje nejen porovnávat sílu kyselin, ale také sílu zásad. Klíčová myšlenka, kterou je třeba si zapamatovat, je tato: čím silnější je konjugovaná kyselina, tím slabší je konjugovaná zásada. Můžeme určit, že hydroxidový ion je silnější báze než amoniak (\(NH_3\)), protože amonný ion (\(NH4^+\), \(pK_a = 9.2\)) je silnější kyselina než voda (\(pK_a = 15,7\)).
Cvičení \(\PageIndex{1}\)
Která báze je silnější, \(CH_3O^-\) nebo \(CH_3S^-\)? Acetátový iont nebo amoniak? Hydroxidový nebo acetátový iont?
Použijme naše znalosti konceptu \(pK_a\) v kontextu složitější molekuly. Například jaká je \(pK_a\) níže uvedené sloučeniny?

Potřebujeme vyhodnotit potenciální kyselost čtyř různých typů protonů na molekule a najít ten nejkyselejší. Aromatické protony nejsou všechny kyselé – jejich \(pK_a\) je přibližně 45. Aromatické protony nejsou všechny kyselé. Aminová skupina také není kyselá, její \(pK_a\) je přibližně 35. (Nezapomeňte, že nenabité aminy jsou zásadité: slabě kyselé jsou kladně nabité protonované aminy s hodnotami \(pK_a\) kolem 10.) Proton alkoholu má hodnotu \(pK_a\) asi 15 a proton fenolu má hodnotu \(pK_a\) asi 10: nejkyselejší skupinou na výše uvedené molekule je tedy fenol. (Ujistěte se, že dokážete rozpoznat rozdíl mezi fenolem a alkoholem – nezapomeňte, že ve fenolu je skupina \(OH\) vázána přímo na aromatický kruh). Pokud by tato molekula reagovala s jedním molárním ekvivalentem silné zásady, jako je hydroxid sodný, byl by to fenolový proton, který by byl darován za vzniku fenolátového aniontu.
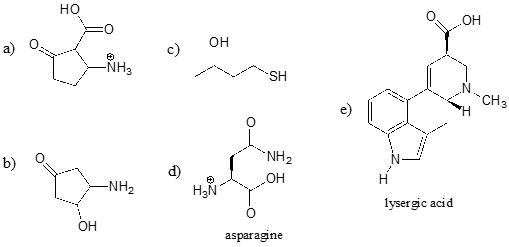
Cvičení \(\PageIndex{2}\)
Určete nejkyselejší funkční skupinu na každé z níže uvedených molekul a uveďte její přibližné \(pK_a\).
.