Úvod
Rheumatoidní artritida (RA) je autoimunitní onemocnění polygenní povahy, charakterizované polyartritidou se systémovými projevy a zvýšenou a závažnou morbiditou.1,2 RA postihuje 0,5-1 % populace a způsobuje snížení kvality života, významné fyzické postižení a značné ekonomické náklady.3-6 Klinický projev onemocnění je různorodý, od mírných sebeomezujících forem až po velmi agresivní, rychlý vývoj, který vrcholí destrukcí postiženého kloubu a následnou invaliditou.7
Genetické studie potvrdily existenci genetického substrátu, který částečně souvisí s některými geny kódujícími proteiny zapojené do reakcí T buněk.1 Tato zjištění posilují význam role přisuzované T buňkám v iniciaci a udržování abnormální imunitní odpovědi u tohoto onemocnění.8
Patogeneze RA je komplexní a zahrnuje různé buněčné populace související s vrozenou a adaptivní imunitní odpovědí. Na patogenezi se podílejí rezidentní buňky v synovii, jako jsou fibroblastické synoviocyty B nebo makrofágy intimy, a zánětlivé buňky z krve jako T lymfocyty, B lymfocyty a monocyty9. Všechny přispívají k agresivní transformaci fenotypu synoviocytů B a rozvoji intenzivního zánětlivého infiltrátu s konečným výsledkem destrukce chrupavky a subchondrální kosti10,11 (obr. 1).
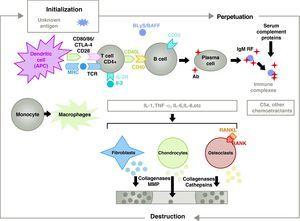
Patofyziologie revmatoidní artritidy. Obecné patofyziologické uspořádání revmatoidní artritidy. AC, protilátka; BAFF, faktor aktivující B buňky; BLyS, stimulátor B lymfocytů; CD, diferenciační klastr; CPA, buňka prezentující antigen; CPH, MHC; CTLA4, lymfocyty asociovaný antigen 4 T cytotoxická frakce komplementu C5a 5a, FR, revmatoidní faktor; Ig, imunoglobulin; IL, interleukin; MMP, matrixové metaloproteinázy; RANK, aktivátor receptoru jaderného faktoru B kappa; RANKL, ligand aktivátoru receptoru pro jaderný faktor B kappa; RCT, T buněčný receptor; TNF, tumor nekrotizující faktor.
Současná léčba RA je založena na podávání chorobu modifikujících antirevmatik (DMARDs) používaných samostatně nebo v kombinaci.12 Tyto léky zpomalují destrukci kloubů, tj. jsou schopny modifikovat přirozený průběh onemocnění.4,13 Procento pacientů s uspokojivou klinickou odpovědí je však nízké a u vysokého procenta pacientů často vyžaduje přidání biologického léku.9,13-15
V posledních letech byly identifikovány nové molekuly a terapeutické cíle, jejichž blokáda by mohla snížit nebo eliminovat chronickou zánětlivou odpověď. Jednou z těchto nových molekul je abatacept. Abatacept je plně humanizovaný proteinový konstrukt sestávající z extracelulární domény lidského cytotoxického T lymfocytárního antigenu 4 (CTL4) a geneticky upraveného fragmentu Fc oblasti lidského imunoglobulinu G1 (IgG1), který inhibuje kostimulaci T buněk působících na pravé jádro imunitní odpovědi, a tedy na počátku onemocnění.
Aktivace T buněk
Efektivní imunitní aktivace T buněk vyžaduje účast dvou skupin membránových receptorů na antigen prezentujících buňkách (APC)14 (obr. 1 a 2). První z nich je vehikulum, které APC používají k poskytnutí předem zpracovaného specifického antigenu T buňce. I přes obrovské úsilí věnované tomuto výzkumu se stále nedaří identifikovat artritogenní antigeny spouštějící RA8. Prezentace antigenu, proti němuž se rozvíjí specifická imunitní odpověď, ze strany APC je organizována prostřednictvím trimolekulárního komplexu, který tvoří: molekuly hlavního histokompatibilního komplexu (MHC) přítomné v APC, antigen, proti němuž se rozvíjí imunitní odpověď, a membránový receptor na T-buňce (TCR) specifický pro tento antigen15 (signální nebo signální dráha imunitní odpovědi 1).
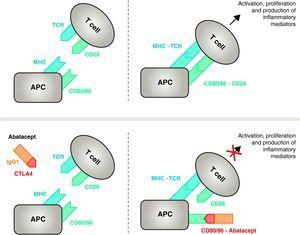
Mechanismus účinku abataceptu. Fragment abataceptu obsahující extracelulární doménu CTLA4 se váže na receptory CD80/CD86, čímž zabraňuje interakci s receptorem CD28 nebo jej vytěsňuje. Tímto způsobem selektivně blokuje specifickou vazbu CD80/CD86 na receptor CD28, což z patofyziologického hlediska znamená zablokování druhého signálu pro aktivaci imunitního systému, a tedy aktivaci T buněk CPA, antigen-prezentující buňka; MHC, hlavní histokompatibilní komplex; TCR, T buněčný receptor.
Pro zablokování plné aktivace T buněk je zapotřebí druhá sada mezibuněčné komunikace receptorů mezi APC a T buňkami, která probíhá prostřednictvím kostimulačních drah a představuje tzv. 2 signál imunitní odpovědi.14 Ačkoli existuje několik kostimulačních drah, jedna z nich je zásadní, a to vazba receptorů CD80 (B7-1)/CD86 (B7-2) na membráně CPA s receptorem CD28 na T buňkách.10,16 Současná aktivace obou spouští intenzivní vnitrobuněčnou signalizaci v T buňkách, která je nezbytná pro plnou aktivaci, proliferaci, přežití a produkci cytokinů.8 Po 24-48 hodinách aktivace T lymfocytů zahajuje stejná intracelulární signalizace regulační mechanismus, jehož cílem je deaktivace samotné odpovědi. To indukuje expresi CTLA411 na buněčné membráně lymfocytů s úkolem konkurovat CD28 kvůli jeho větší afinitě k CD80/CD86.17,18
Aktivace obou subsetů T buněk, CD4+ a CD8+, závisí na kostimulačním receptoru CD28. CD4+ T buňky jsou pomocné T buňky. Rozpoznávají peptidy prezentované molekulami MHC II. třídy přítomnými na APC. Tyto antigeny pocházejí z exogenní cesty, která zpracovává patogeny, například bakterie. Mnoho autoimunitních onemocnění je spojeno s patologickou odpovědí CD4+ T buněk. CD8+ T-lymfocyty jsou zase cytotoxické lymfocyty (CTL). Buňky CD8+ T rozpoznávají antigeny, především virové a nádorové, prezentované molekulami třídy I MHC. Po aktivaci zprostředkovávají CD8+ buňky destrukci cílových buněk prostřednictvím produkce perforinu, granzymů a interferonu (IFN)-g. Oba podtypy T buněk jsou aktivovány kostimulací pomocí CD2815, ačkoli aktivace CD8+ T buněk je na této kostimulační cestě méně závislá. Zatímco všechny CD4+ buňky ve skutečnosti exprimují CD28 na své membráně, u CD8+ k tomu dochází jen asi v 50 %.19 Kromě toho bylo prokázáno, že CD4+ buňky vykazují větší odpověď na vazbu CD2820. Promotor CD28 navíc není absolutní podmínkou pro aktivaci CTL.21 To vše by v klinické praxi poskytlo dvojí terapeutický přínos. Na jedné straně abatacept působí přednostně na cílovou buňku v patogenezi onemocnění. Dále by snížené působení na aktivitu CD8+ lymfocytů zajistilo lepší bezpečnostní profil z hlediska virových a nádorových komplikací.
Aktivace CD4+ T lymfocytů je výchozím bodem pro prozánětlivou kaskádu s produkcí velkého množství cytokinů a buněčnou proliferací, která, pokud přetrvává a udržuje se, jako je tomu u RA, vede k velmi aktivnímu chronickému zánětu, schopnému ničit tkáně, v nichž je vyvolán, v případě RA8 většinou klouby (obr. 1). Synovie začíná proliferovat díky infiltrujícím buňkám z krve, včetně samotných T lymfocytů a jejich podtypů a také B lymfocytů Monocyty se diferencují v makrofágy a osteoklasty a také aktivují kloubní chondrocyty. V tomto prostředí se vyskytuje velké množství prozánětlivých cytokinů, jako jsou interleukin (IL)-1, IL-6 a tumor nekrotizující faktor (TNF) a mnoho dalších. B buňky také produkují autoprotilátky, jako je revmatoidní faktor nebo protilátky proti citrulinovaným peptidům. To vše vede k destrukci nejen synoviální membrány, ale také pod ní ležící kosti a chrupavky.22
Biotechnologie v léčbě revmatoidní artritidy
Vzhledem k výše uvedenému výzkumu byla vyvinuta a komercializována biotechnologická výroba různých molekul zaměřených na blokování specifických cílů. První generace se vyznačovala výskytem léků neutralizujících TNF: etanercept, infliximab a adalimumab a anakinra, které inhibují působení IL-1. Následně se objevily nové molekuly, jako je abatacept, který moduluje kostimulaci imunitní odpovědi, certolizumab a golimumab, které blokují TNF, rituximab proti receptoru CD20 B lymfocytů a tocilizumab, který blokuje IL-6.7,23-26
I přes obrovský skok z hlediska terapeutické účinnosti v důsledku zavedení těchto léků značné procento pacientů, odhadem 25 až 40 %, nereaguje na v současné době uváděné léky nebo biologické přípravky na trh nebo je postiženo výskytem nežádoucích účinků.27-32 Potřeba zlepšit tuto situaci zůstává podnětem k hledání a vývoji nových molekul zaměřených na regulaci různých terapeutických cílů, které by mohly zlepšit terapeutickou účinnost, jako je tomu v případě abataceptu, který selektivně moduluje aktivaci T buněk.33
Abatacept je proteinový konstrukt, který se vyrábí pomocí technologie rekombinantní DNA v ovariálních buňkách křečka.34,35 Tato molekula byla navržena tak, aby zasahovala do regulace kostimulačních drah v T buňkách, které hrají důležitou roli v patogenezi různých autoimunitních onemocnění, infekcí, rejekce transplantovaných orgánů a nádorové imunity.36
Abatacept se používá v kombinaci s methotrexátem u pacientů s RA, kteří nedostatečně reagovali nebo nesnášeli jiné DMARDs, včetně methotrexátu (MTX) nebo inhibitoru TNF-alfa. U polyartikulární juvenilní idiopatické artritidy je indikován u pacientů ve věku 6 let a starších, kteří měli nedostatečnou odpověď na jiné DMARDs včetně alespoň jednoho léku neutralizujícího TNF.35
Mechanismus účinku přípravku Abatacept
Abatacept je selektivním modulátorem kostimulačního signálu CD80/86-CD28, a jak již bylo uvedeno výše, ten je nezbytný pro aktivaci T buněk Abatacept inhibuje aktivaci T buněk tím, že selektivně blokuje specifickou vazbu receptoru CD80/CD86 v APC na CD28 na T buňce (obr. 2).22,37 Farmakologická strategie se snaží inhibovat zrychlenou imunitní/zánětlivou odpověď, charakteristickou pro toto onemocnění, a obnovit normální homeostázu imunitního systému. Ve skutečnosti je soupeření mezi endogenním CD28 a CTLA4 o vazbu na CD80/86 fyziologickým mechanismem, který slouží k regulaci a případnému ukončení normální imunitní odpovědi. Abatacept blokováním vazby CD80/86 na CD28 inhibuje přenos druhého signálu imunitní odpovědi, který nepřímo vytváří negativní signál na aktivaci T buněk. Kromě toho má abatacept pravděpodobně větší účinek v tom, že zabraňuje tvorbě kostimulačního signálu v T buňkách a inaktivuje ty již aktivní, které nejsou vázány na CTLA4 T buněk
Podpůrný prostředek pro použití
1. Proč je abatacept zařazen do skupiny imunomodulačních léčiv? V podstatě proto, že způsobuje depleci buněk, zejména T buněk, díky farmakologickému účinku, který se uplatňuje tím, že neblokuje selektivně určitý cytokin, čímž zabraňuje radikálnímu potlačení základních drah pro správné fungování imunitní odpovědi.8
2. Jak zabraňuje vazbě Fc oblasti molekuly na její receptor? Fc oblast abataceptu je geneticky modifikována tak, že se neváže na receptory CD16 a CD32 a velmi slabě se váže na receptor CD64. Tato konstrukce obchází buněčné reakce zprostředkované Fc receptorem, jako je buněčná cytotoxicita závislá na protilátkách (ADCC) a cytotoxicita závislá na komplementu (CDC).18 Obě jsou spojeny s lýzou buněk s možnými nežádoucími účinky, které se mohou projevit u prolongované38 léčby. Proto se zdá, že modifikovaný fragment IgG1 je aktivní, čímž zabraňuje nežádoucím účinkům vyplývajícím z ADCC.39
3. Protizánětlivý účinek abataceptu. Abatacept významně snižuje mnoho zánětlivých mediátorů u pacientů s RA a vrací je do normálu, což prokázalo několik klinických studií použitých při výzkumu tohoto léku.
V jednoleté placebem kontrolované studii fáze II-b u pacientů s RA a nedostatečnou odpovědí na MTX byly odebrány vzorky a měřeny sérové hladiny vybraných markerů ve dnech před infuzí za účelem studia účinku abataceptu na mediátory a prozánětlivé cytokiny. Skupina pacientů dostávala MTX a abatacept 10 mg/kg podle pravidelného schématu. Kontrolní skupina byla mezitím léčena MTX a placebem. Jeden rok po léčbě se markery ve skupině s abataceptem 10mg/kg normalizovaly, zatímco ve skupině s placebem zůstaly zvýšené (TNF: 7,4 vs 10,3pg/ml; FR: 159 vs 225U/l, sIL-2R: vs 1228,3 . 1697,1pg/ml IL-6: 7,3 vs 19,9pg/ml).40
4. Imunogenicita. Podle údajů o přípravku se u pouhých 187 z 3877 (4,8 %) pacientů s RA léčených abataceptem po dobu až 8 let vyvinuly během léčby protilátky proti přípravku.41 Protilátky proti abataceptu byly hodnoceny u pacientů po ukončení léčby (>42 dní po poslední dávce) a u 103 z 1888 (5,5 %) byly séropozitivní. Naproti tomu v jiné studii u 2000 pacientů s abataceptem byly měřeny protilátky a byl učiněn závěr, že abatacept má nízkou imunogenicitu.42,43
5. Ukázalo se, že abatacept má nízkou imunogenicitu. Abatacept a tuberkulóza. TNF se podílí na zánětlivé odpovědi a imunopatologii tuberkulózy (TBC). Studie in vitro ukazují, že TNF zvyšuje fagocytární aktivitu a mykobaktericidní makrofágy, zatímco in vivo se podílí na počáteční tvorbě a následném udržování granulomů, což kontroluje růst mykobakterií a omezuje jejich šíření. V chronickém modelu reaktivace latentní tuberkulózy u myší jsme studovali vývoj infekce u myší léčených abataceptem ve srovnání s jinou skupinou léčenou myším monoklonálním anti-TNF.42 4 měsíce po infikování myší C57BL/6 Mycobacterium tuberculosis a po potvrzení, že mají latentní tuberkulózní infekci, byly myši 16 týdnů léčeny jedním ze dvou experimentálních zásahů. Po této době všechny myši léčené anti-TNF uhynuly na diseminovanou TBC s průměrnou dobou přežití 44 dní. Naopak žádná z myší léčených abataceptem neuhynula.
Zatímco ve skupině s abataceptem se koncentrace IFN-g v séru nezměnila, u myší s anti-TNF byla zvýšená. Toto zvýšení bylo přičítáno zvýšené infiltraci CD4+ a CD8+ způsobené rozsáhlým rozptýlením bakteriálních kolonií.
Takže zatímco myši léčené anti-TNF terapií vykazovaly 100% mortalitu, abatacept nezměnil schopnost myší organizovat zánětlivou odpověď schopnou kontrolovat šíření tuberkulózy. Stále však není k dispozici dostatek klinických údajů, které by tyto výsledky potvrdily u lidí.
6. Antiresorpční účinek abataceptu na remodelaci kostí. Aktivita osteoklastů je u RA zvýšená, a to jak v kloubu, kde způsobuje kostní eroze, tak i systémově, kde dosahuje hodnot spojených s generalizovanou osteoporózou.44,45
V synoviální membráně bylo totiž prokázáno zvýšení ligandu receptoru aktivátoru jaderného faktoru NF-kB (RANKL).45,46 Abatacept v závislosti na dávce inhibuje tvorbu myších osteoklastů a osteoklastogenní aktivitu hodnocenou in vitro. Ta byla studována u myších osteoklastů kultivovaných na dentinových destičkách, u kterých se měřil počet resorpčních jamek po 6 dnech přidávání různých dávek abataceptu.47
Léčivo významně snížilo plochu kostní resorpce. Tyto údaje naznačují, že abatacept je molekula, která se váže přímo na prekurzorové buňky osteoklastů a inhibuje jejich diferenciaci. Tento mechanismus by mohl vysvětlovat antiserozivní účinek léku u pacientů s RA. Pacienti léčení abataceptem totiž vykazovali klesající tendenci hladin RANK a jeho ligandu RANKL v synovii, což vše souviselo se zvýšením osteoprotegerinu.48 Ačkoli přesný mechanismus, který je základem tohoto pozorování, není jasný, tato zjištění dobře korelují s radiologickým zlepšením pozorovaným u pacientů léčených abataceptem.
7. Účinky abataceptu na jiné imunitní buňky. Ačkoli APC je cílovou buňkou, která váže abatacept, a makrofágy na svém povrchu rovněž exprimují receptory CD80/86, existuje jen málo studií zkoumajících působení léku na aktivitu těchto buněk. Nedávná studie in vitro skutečně ukázala, že makrofágy vykazovaly výraznou expresi receptorů CD80/86 a léčba abataceptem podstatně snížila produkci cytokinů49. Tyto výsledky naznačují, že mechanismus účinku léku by mohl být rozšířen na regulaci makrofágové linie, klíčových buněk v patogenezi onemocnění.
Abatacept také potlačuje folikulární migraci antigen-specifických T buněk a následně spolupráci mezi T buňkami a folikulárními B buňkami v lymfatické uzlině. Tento nález byl pozorován in situ v lymfatických uzlinách myší BALB/c50. Po transfuzi těchto myší antigenně specifickými předimulovanými T buňkami se při následné imunizaci myší projevila proliferace T buněk a jejich migrace do oblasti B lymfocytů. U myší léčených abataceptem byla proliferace a migrace T buněk blokována, což ve většině případů omezilo jejich přítomnost v parakortexu lymfatických uzlin. Dlouhodobá léčba abataceptem tedy snižuje proliferaci, mobilitu a distribuci intraganglionárních autoantigenních paměťových lymfocytů, což by mohlo vést k poklesu autoprotilátek.
Závěry o mechanismu účinku abataceptu
Abatacept je plně humanizovaný proteinový konstrukt sestávající z extracelulární domény lidského cytotoxického T lymfocytárního antigenu 4 (CTL4) a geneticky modifikovaného fragmentu Fc oblasti IgG1, navržený tak, aby zasahoval do regulace kostimulace T lymfocytů Léčivo inhibuje aktivaci T buněk selektivním blokováním specifické vazby CD80/CD86 na receptor CD28, a proto inhibuje proliferaci T buněk a imunitní reakce B lymfocytů Tento farmakologický účinek vede ke snížení hladiny zánětlivých mediátorů u pacientů s RA a k bezpečné a účinné klinické odpovědi.
Konflikt zájmů
Dr. Gabriel Herrero-Beaumont obdržel výzkumné granty od společnosti Bristol-Myers-Squibb. Dr. Santos Castañeda obdržel vzdělávací a výzkumné granty od společností Abbott, MSD a Pfizer.
.