Vzhledem k relativní strukturní jednoduchosti a opakovatelnosti DNA by z toho vyplývalo, že proteiny, které se na ni specificky vážou, mohou mít společné motivy DNA vazebných domén, ale se specifickými postranními řetězci aminokyselin umožňujícími specifické vazebné interakce.
- helix-turn-helix: vyskytuje se u prokaryotických DNA vazebných proteinů.
Obrázek: helix-turn-helix
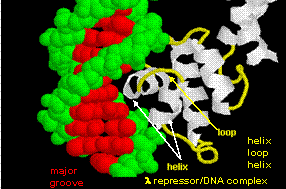
Obrázek ukazuje dva takové proteiny, cro represor z bakteriofága 434 a lambda represor z bakteriofága lambda. (Bakteriofágy jsou viry, které infikují bakterie.) Všimněte si, jak je specifičnosti dosaženo částečně tvorbou specifických H-vazby mezi proteinem a hlavním žlábkem operátorové DNA.
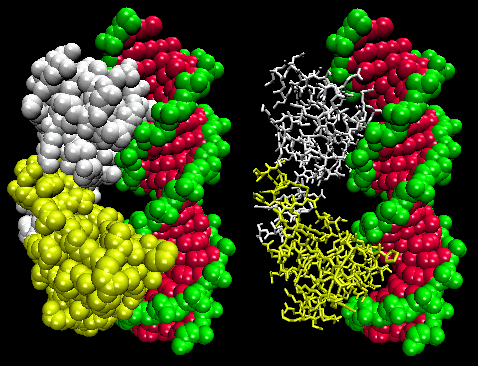
Obrázek: Represorový komplex Lambda/DNA
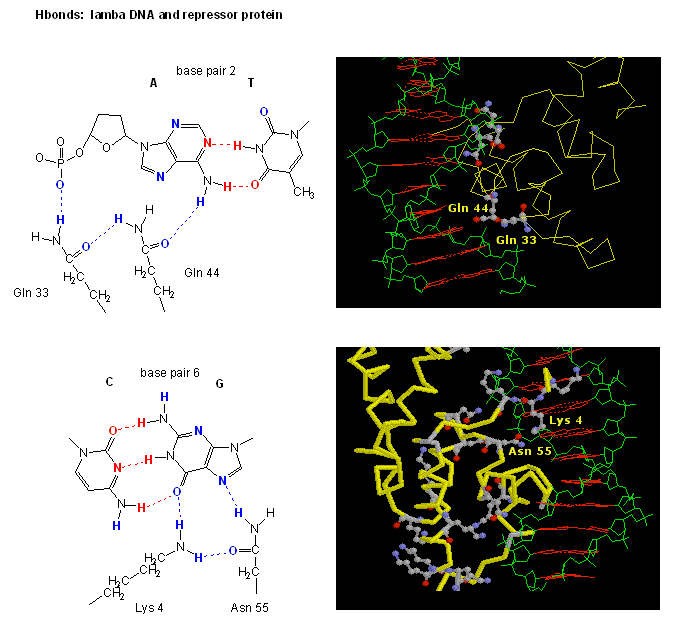
Obrázek: H vazebné interakce meziλ represorem a DNA
![]() Jmol: Jmol14 (Java) | JSMol (HTML5)
Jmol: Jmol14 (Java) | JSMol (HTML5)
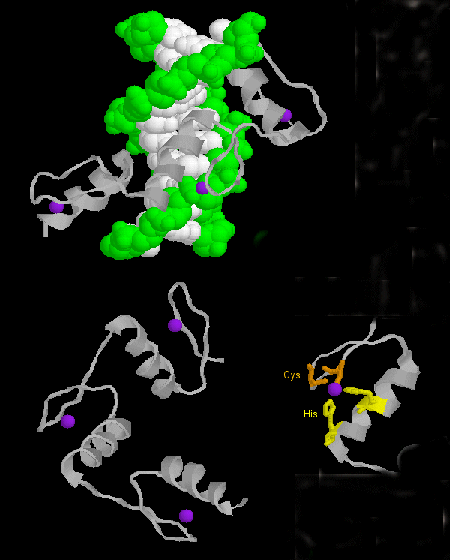
- zinkový prst: (eukaryota) Tyto proteiny mají společný sekvenční motiv X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4-, v němž X je libovolná aminokyselina. Zn2+ je tetraedricky koordinován s postranními řetězci Cys a His, které jsou na jednom ze dvou antiparalelních beta řetězců, respektive alfa šroubovici. Zinkový prst stabilizovaný zinkem se váže na hlavní drážku DNA. ]
Obrázek: zinkový prst
![]() Jmol: Jmol14 (Java) | JSMol (HTML5)
Jmol: Jmol14 (Java) | JSMol (HTML5)
Bílkoviny Zn finger, kterých je v lidském genomu kódováno 900 (včetně výše popsaného proteinu CTCF vázajícího eukaryotické izolátory), mohou být mobilizovány ke skutečným opravám specifických mutací v buňkách, které by v případě, že by byly provedeny u dostatečně vysokého procenta mutovaných buněk, mohly vyléčit specifická genetická onemocnění, jako jsou některé formy těžké kombinované imunodeficience. V této nové technice (Urnov et al, 2005) je několik propojených vazebných domén Zn prstů (jedna z přirozeně se vyskytujících nebo mutantních forem vyrobených v laboratoři), z nichž každá je specifická pro určitou sekvenci nukleotidů, spojeno s nespecifickou endonukleázou odvozenou od enzymu FokI. Nukleáza je aktivní v dimerní formě, takže aktivní komplex vyžaduje k sestavení v cílovém místě dvě endonukleázové domény, z nichž každá je navázána na čtyři různé Zn finger domény. Specifičnosti vazby je dosaženo selekcí pomocí Zn finger domén. Nukleáza pak vytvoří na DNA zářez a následují opravné mechanismy hostitelské buňky. Tento proces zahrnuje oddělení řetězce, homologní rekombinaci oblasti se zářezem s komplementární DNA v buňce a opravu zářezu. Pokud se do buněk přidá přebytek divokého typu (nemutované) DNA a použije se jako templát, normální oprava DNA mutaci opraví. Urnov a spol. prokázali, že až 20 % kultivovaných buněk obsahujících mutaci lze opravit v laboratoři. Pokud by tyto buňky získaly selektivní růstovou výhodu, mutované buňky by byly nakonec nahrazeny buňkami divokého typu.
- receptory pro hormony steroidů: (eukaryota) Na rozdíl od většiny hormonů, které se vážou na povrchové receptory buněk, steroidní hormony (deriváty cholesterolu) procházejí buněčnou membránou a vážou se na cytoplazmatické receptory prostřednictvím hormonální vazebné domény. Tím se změní tvar receptoru, který se pak přes DNA vazebnou doménu váže na specifické místo na DNA (hormonální reakční element). Ve struktuře analogické zinkovému prstu je Zn 2+ tetraedricky koordinován se 4 Cys v globulární struktuře, která se váže jako dimer na dvě identické, ale obrácené sekvence DNA (palindrom) v hlavním háji. (Příklady palindromů: Able was I ere I saw Elba; Dennis and Edna dine, said I, as Enid and Edna sinned.
Podívejme se na glukokortikoidní receptor (GR) jako na konkrétní příklad. Váže se na DNA jako dimer. Dvě DNA vazebné domény dimeru se spojují se dvěma sousedními hlavními drážkami DNA v GR vazebné sekvenci (GBS), krátké sekvenci DNA v promotoru. Meijsing a spol. zjistili, že GBS funguje nejen jako vazebné místo pro GR, které umožňuje transkripci genů, ale také ovlivňuje konformaci receptoru, což způsobuje, že transkripce genů je regulována jiným způsobem. Skupina zkonstruovala luciferázové „reportérové geny“, které mají GBS spojený s genem pro protein luciferázu, které by exprimovaly protein luciferázu (který fluoreskuje), pokud by byly přepisovány, s GBS. Zjistili, že relativní transkripční aktivita nekoreluje s relativní afinitou vazby GR na GBS. GBS, které byly mnohem aktivnější než ostatní, se vázaly srovnatelně s těmi s nižší aktivitou, zatímco GBS s podobnou transkripční aktivitou se vázaly s různou afinitou. To ukazuje, že GBS propůjčuje GR, který je s ním spojen, jedinečnou funkci (tj. transkripce není jednoduše ovlivněna tím, zda je GR navázán na GBS, či nikoli). Bylo zjištěno, že �pákové rameno� receptoru prochází při vazbě na DNA konformačními změnami, přičemž změny jsou specifické pro sekvenci, na kterou je navázáno. Bylo zjištěno, že mutantní protein GR-γ je identický s proteinem divokého typu GR-α, s výjimkou pákového ramene, má odlišnou transkripční aktivitu, přestože se vážou na stejné místo na DNA, což ukazuje, že pákové rameno a jeho konformace ovlivňuje transkripci.
- leucinové zipy (nebo nůžky): (eukaryota) Tyto bílkoviny obsahují úseky 35 aminokyselin, v nichž se Leu vyskytuje opakovaně v intervalu 7 aminokyselin. Tyto oblasti proteinu tvoří amfifilní šroubovice, s Leu na jedné straně, s jedním Leu po dvou závitech šroubovice. Dva z těchto proteinů mohou vytvořit dimer, stabilizovaný vzájemnou vazbou těchto nepolárních amfifilních šroubovic bohatých na leucin, a vytvořit tak spirálu, podobně jako u svalového proteinu myosinu. Leucinový zip představuje vazebnou doménu proteinu. DNA vazebná doména se nachází v prvních 30 N-koncových aminokyselinách, které jsou bazické a při vazbě proteinu na DNA tvoří alfa šroubovici. Leucinový zip pak funguje tak, že spojuje dva DNA vazebné proteiny a umožňuje N-koncovým bazickým šroubovicím interagovat s hlavním žlábkem DNA způsobem specifickým pro bázi. Valin a izoleucin se spolu s leucinem často nacházejí v úsecích aminokyselin, které mohou interagovat a vytvářet další typy stočených závitů.
Obrázek: leucinové zipy (vytvořeno pomocí VMD)
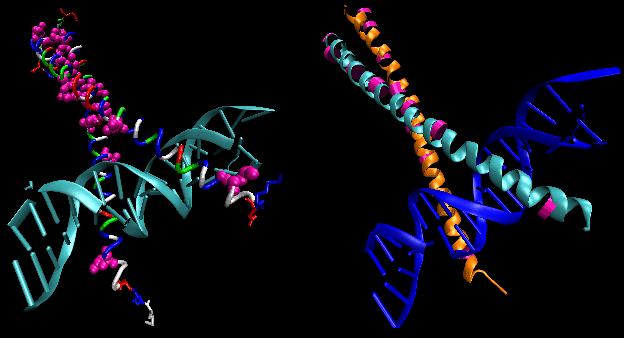
![]() Jmol: Jmol14 (Java) | JSMol (HTML5)
Jmol: Jmol14 (Java) | JSMol (HTML5)
Stejně jako nukleázy se zinkovými prsty byly použity k vyvolání opravy mutací, jiná studie genomu potkana použila speciálně navržené ZFN k vyvolání zlomů v ds-DNA, které obsahovaly mutace z nepřesného mechanismu opravy DNA (pomocí NHEJ), a tudíž obsahovaly specifické mutace (Geurts, et al. 2009). Tento proces, �knockout genu�, zabraňuje produkci proteinu normálně přepisovaného cílovým genem. Pěti- a šestiprsté ZFN byly použity k dosažení vysoké míry specifity cílené vazby na gen pro tři různé proteiny: zelený fluorescenční protein (GFP), imunoglobulin M (IgM) a Rab38. Knockout byl úspěšný u 12 % testovaných potkanů; tato zvířata neměla žádný protein divokého typu a neměla žádnou expresi. ZFN byly dostatečně specifické, takže nebyly pozorovány žádné mutace na žádném z 20 předpokládaných necílových míst. Tato studie podporuje životaschopnost kontroly transkripce a exprese pro léčbu onemocnění a význam specifické vazby.
Viděli jsme, že ke specifickému rozpoznávání DNA proteiny přispívají dva hlavní faktory; tvorba vodíkových vazeb na specifické donory a akceptory nukleotidů v hlavní drážce a sekvenčně závislé deformace šroubovice DNA do změněných tvarů se zvýšenou afinitou proteinových ligandů. Například Tata Binding Protein (TBP) může interagovat s rozšířenou vedlejší drážkou v TATA boxu. Nové poznatky potvrzují, že kromě toho jsou proteiny schopny využívat informace v menších drážkách, které se „zúžily“ v závislosti na sekvenci nukleotidů.
Dráhy DNA obohacené o A mohou vést ke zkroucení konformací, které způsobují vodíkové vazby mezi páry bází v hlavních drážkách, což vede ke zúžení menších drážek. Vysoké množství párů bází AT se soustřeďuje v úzkých vedlejších drážkách (šířka <5,0 �) a páry bází CG se častěji vyskytují v širokých vedlejších drážkách.
Jak zúžení vedlejších drážek ovlivňuje rozpoznávání DNA? Úzké vedlejší drážky zvyšují negativní elektrostatický potenciál DNA, čímž se stávají specifičtějším a rozpoznatelnějším místem. Páteřní fosfáty DNA jsou blíže středu drážky, když je úzká, což koreluje úzké vedlejší drážky s negativnějším elektrostatickým potenciálem.
Minoritní drážky-interakční části proteinů obsahují arginin, jehož postranní řetězec může být umístěn do užší a negativnější minoritní drážky. Argininy se mohou vázat a v některých případech se vkládají jako krátké sekvenční motivy, které zvyšují specifičnost rozpoznávání tvaru DNA. Arg je upřednostňován před Lys, protože efektivní poloměr nosiče náboje v Arg je větší než nosiče náboje v Lys. To by vedlo ke snížení desolvační energie pro Arg, což by podpořilo jeho vazbu na zúžený hlavní žlábek. Tento objev ukazuje, že „při anotaci celého genomu a předpovídání vazebných míst transkripčních faktorů je třeba brát v úvahu roli tvaru DNA“.
Obrázek: Tvar DNA: Arg ve vazbě transpozázy T3c v zúženém menším háji transpozonu T3c
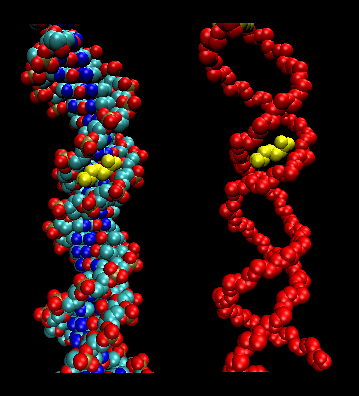
- Posuvný model pro interakce protein/DNA
Přispěvatelé a atribuce
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)