- Úvod
- Materiál a metody
- Výsledky a diskuse
- Termodynamický argument
- Které reakce acetogeneze jsou termodynamicky výhodné?
- Které reakce acetogeneze jsou za zkoumaných podmínek nejpravděpodobnější?
- Které reakce acetogeneze pravděpodobně probíhají in situ?
- In situ energetické výtěžky reakcí acetogeneze na základě naměřených koncentrací
- Energetické výtěžky reakcí acetogeneze za účasti H2 ve srovnání s konkurenčními reakcemi redukce síranů a metanogeneze
- Metabolické strategie acetogenů
- Niková diferenciace na základě využívání substrátů
- Spory specialista vs. generalista
- Energetické náklady biosyntézy u acetogenů
- Závěr
- Prohlášení o střetu zájmů
- Poděkování
Úvod
Předchozí studie anoxických sedimentů prokázaly redoxní zónování mezi mikroby remineralizujícími terminální organickou hmotu v závislosti na dostupnosti akceptorů elektronů (např. Froelich et al., 1979; Canfield et al., 1993). Organismy využívající akceptor elektronů s nejvyšším výtěžkem Gibbsovy volné energie dominují nad skupinami využívajícími energeticky méně výhodné akceptory elektronů (např. Cappenberg, 1974; Lovley a Goodwin, 1988; Hoehler et al., 1998). Vyšší energetické výtěžky podporují rychlejší růst a vedou ke konkurenčnímu vyloučení skupin využívajících méně výhodné akceptory elektronů (Cord-Ruwisch et al., 1988). Energetické substráty s vysokou rychlostí obratu, např. vodík (H2) a acetát, mohou být dokonce staženy až na termodynamické prahové koncentrace, při nichž pouze přítomný energeticky nejvýhodnější akceptor elektronů poskytuje dostatek energie pro translokaci protonů přes buněčnou membránu, tvorbu ATP a růst (Hoehler et al., 2001; Hoehler, 2004). Důkazy podporující představu biologické redoxní zonace pocházejí ze sladkovodních a pobřežních mořských sedimentů a z laboratorních chemostatových a kokultivačních experimentů.
V souladu s představou redoxní zonace by procesy denitrifikace, redukce manganu a železa a redukce síranů měly vyloučit energeticky méně výhodné reakce zahrnující redukci nebo disproporcionaci CO2 všude tam, kde dostupné pooly dusičnanů, manganu (IV), železa (III) a síranů nejsou limitující pro rychlost (např, Froelich et al., 1979; Canfield et al., 1993). Ve sladkovodních a pobřežních mořských sedimentech často dochází k vyčerpání nejpříznivějších oxidantů mělce v důsledku přebytku donorů elektronů vznikajících při fermentačních a hydrolýzních reakcích (Capone a Kiene, 1988). To vytváří niku pro Archaea produkující metan (metanogeny) a mikroby syntetizující acetát (acetogeny), skupiny, které jsou schopny získávat energii z redukce CO2 v podložních vrstvách (např. Phelps a Zeikus, 1984; Avery a kol., 2002; Ferry a Lessner, 2008; Liu a Conrad, 2011). Naproti tomu v oligotrofnějších pobřežních mořských sedimentech, které pokrývají většinu zemského povrchu, jsou organické látky, a tedy i dostupnost donorů elektronů, obvykle limitující. K vyčerpání dusičnanů, oxidovaných kovů, síranů a/nebo dokonce kyslíku (O2) dochází až desítky metrů pod mořským dnem – pokud vůbec (např. D’Hondt a kol., 2004; D’Hondt a kol., 2009). V souladu s tím by metanogeny a acetogeny neměly existovat nebo přinejlepším vést okrajové existence – neaktivní nebo přežívající v malém počtu na nekonkurenceschopných energetických substrátech, které ostatní skupiny nevyužívají, jako jsou metylované sloučeniny C1 nebo metoxylované aromatické sloučeniny (Franklin et al., 1988; Lever et al., 2010). Proto se nedávné důkazy z hluboko pohřbených mořských sedimentů naznačující významnou akumulaci biogenního metanu v přítomnosti sulfátů a kovů redukujících populací zdají být překvapivé (Wang et al., 2008). Navíc, i když sulfátreduktory a metanogeny získávají ze společných energetických substrátů více energie než acetogeny, přibývá důkazů, že acetogeny hrají kvantitativně významnou roli v koloběhu organického uhlíku v mořské a suchozemské hlubinné biosféře (Heuer et al., 2006, 2009; Griebler a Lueders, 2008; Pedersen et al., 2008; Lever et al., 2010).
V následujících částech se budu zabývat možnými důvody koexistence acetogeneze s jinými cestami, které jsou v hlubokém podpovrchovém prostředí považovány za energeticky výhodnější. Ve svých analýzách budu (1) konzervativně počítat energetické výtěžky reakcí rozšířené acetogeneze v podpovrchové vrstvě, (2) zkoumat potenciál substrátového generalismu jako úspěšné strategie při extrémním energetickém omezení a (3) zkoumat náklady biosyntézy a potenciální způsoby, kterými mohou acetogeny snížit energii vynaloženou na biosyntézu.
Materiál a metody
Potenciální energetické výtěžky byly vypočteny pro celkem 14 acetogenních substrátů a 20 reakcí acetogeneze (tabulka 1). Kritériem pro výběr těchto substrátů bylo (1) široké využití acetogeny, (2) dříve prokázaný kvantitativní význam těchto nebo příbuzných substrátů jako metabolických meziproduktů v anaerobních sedimentech, (3) zastoupení širokého spektra typů substrátů využívaných acetogeny a (4) dříve publikované termodynamické vlastnosti (tabulka 2). Reakce zahrnovaly anorganické substráty (H2-CO2, CO), monokarboxylové kyseliny (mravenčan, laktát), dikarboxylové kyseliny (glykolát, oxalát), alkoholy (methanol, ethanol), ketony (pyruvát), sacharidy (glukóza, celobióza), methylhalogenidy (methylchlorid, CH3Cl; známý také jako chlormethan) a methoxylované aromatické sloučeniny (syringát, vanilát).

Tabulka 1. Přehled reakcí acetogeneze zkoumaných v této studii (podle Drake et al., 2006).
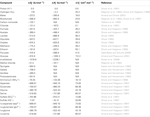
Tabulka 2. Termodynamické údaje vodných výluhů a produktů za standardních podmínek (N/A = nejsou k dispozici publikované hodnoty).
Vzhledem k nedostatku/absenci údajů o koncentraci většiny těchto sloučenin z hlubinného podloží jsem použil konzervativní odhady koncentrací. To znamená, že koncentrace edukátů použité ve výpočtech se nacházely v dolní části spektra dříve stanovených koncentrací pro tyto nebo podobné substráty v sedimentárním nebo mořském prostředí, zatímco koncentrace produktů se blížily horní části dříve naměřeného koncentračního spektra (Meyer-Reil, 1978; Ansbaek a Blackburn, 1979; Sørensen a kol…, 1981; Kaiser a Hanselmann, 1982; King et al., 1982, 1983; Smith a Oremland, 1983; Smith et al., 1985; Edenborn a Litchfield, 1987; King, 1988, 2007; Lovley a Goodwin, 1988; Martens, 1990; Liu a Suflita, 1993; Hoehler et al., 1998; Chidhaisong et al., 1999; Ballschmiter, 2003; Dhillon et al., 2005; Finke et al., 2006; Chapelle a Bradley, 2007; Heuer et al., 2009; Lever et al., 2010). V souladu s tím byla pro rozpuštěné plynné energetické substráty (CO, CH3Cl; H2 viz následující věta) použita koncentrace 0,1 nM, zatímco pro všechny ostatní energetické substráty bylo předpokládáno 100 nM. Pro kompenzaci vysoké nejistoty ohledně přesnosti existujících údajů o koncentraci H2 z podmořského dna byly vzhledem k významu vodíku jako (ko)substrátu v několika reakcích acetogeneze (tabulka 1) a vzhledem k dříve publikovaným důkazům naznačujícím acetogenezi prostřednictvím redukce CO2 s H2 v hlubokém podpovrchovém prostředí (Heuer et al., 2009) použity dvě koncentrace vodíku, 0,1 nM a 1 μM. Tyto koncentrace zahrnují rozmezí naměřené v širokém spektru podpovrchových lokalit bohatých na organické látky až po ultraoligotrofní lokality během etap 201 a 204 oceánského vrtného programu (ODP), expedice 329 IODP a expedice M76 Meteor do režimu benguelského vzedmutí (Shipboard Scientific Party, 2003; Lorenson et al., 2006; Expedition 329 Scientists, 2011; Lin et al., 2011). Pro reakce acetogeneze zahrnující H2 jako ko-substrát by 1 μM H2 neměl být limitující. Pro metabolické produkty jsem předpokládal koncentraci acetátu 1 M, galátu a protokatechátu 100 nM a typické koncentrace protonů (10-8 M) a chloridů (0,56 M; Pilson, 1998) v mořské vodě. Koncentrace hydrogenuhličitanů 2 mM (typická koncentrace mořské vody) byla použita, pokud byl hydrogenuhličitan eduktem, a 200 mM, pokud byl hydrogenuhličitan produktem. Pro redukční reakce síranů jsem použil koncentrace síranů 10 mM a koncentrace sulfidů 1 mM. Pro reakce metanogeneze jsem předpokládal koncentraci metanu 1 mM. Ve všech výpočtech bylo použito pH 8,0.
Pro výpočty energetických výtěžků in situ reakcí acetogeneze z H2-CO2, mravenčanu-H2 a mravenčanu jsem použil publikované údaje získané během výpravy ODP Leg 201 do rovníkového Pacifiku a na okraj Peru (Shipboard Scientific Party, 2003). Kromě pH byly použity naměřené koncentrace H2, rozpuštěného anorganického uhlíku (DIC), mravenčanu a octanu. Teplota in situ byla vypočtena z naměřeného teplotního gradientu v každé lokalitě. Tlak in situ byl vypočten z hloubky vody a sedimentu za předpokladu průměrné hustoty vody 1,029 g cm-3 a za použití průměrných hodnot objemové hustoty sedimentu pro jednotlivé sedimentární podjednotky (Shipboard Scientific Party, 2003). Naměřené koncentrace aminokyselin (glutamát, aspartát, serin, glycin) v sedimentárních jádrech ODP Leg 201 byly získány od Mitterera (2006).
Gibbsovy volné energie na reakci byly vypočteny pro standardní podmínky (25 °C, 1 atm), jakož i pro teplotní a tlakové extrémy zahrnující většinu podpovrchových sedimentů na Zemi (Stumm a Morgan, 1981). -1,9 °C, což je teplota mrznutí většiny mořské vody, představuje spodní teplotní hranici, se kterou se pravděpodobně setkáme v hluboké biosféře, zatímco 122 °C představuje horní teplotní hranici, kterou toleruje známý život (Takai a kol., 2008). Rozmezí tlaku 1-1000 atm platí od mělkých pobřežních sedimentů až po naprostou většinu podpovrchových sedimentů v otevřeném oceánu. Aktivity byly aproximovány z koncentrací pomocí naměřeného koeficientu aktivity γ hydrogenuhličitanu (0,532) pro aniontové substráty/produkty acetogeneze (mravenčan, octan, mléčnan, šťavelan, glykolát, syringát, vanilan) a naměřeného koeficientu aktivity methanu (1,24) pro plyny (H2, CO) a alkoholy (methanol, ethanol; obojí podle Millera a Schreibera, 1982). Koeficienty aktivity vody, sacharidů (glukózy, celobiózy) a aminokyselin (aspartátu, glutamátu, glycinu, serinu) byly stanoveny na 1,0. Publikované koeficienty aktivity byly použity pro sulfát (0,104) a sulfid (0,410; Millero a Schreiber, 1982).
Gibbsovy energie na substrát byly vypočteny z Gibbsových energií na reakci vydělením těchto energií počtem substrátů na reakci. Termodynamické prahové koncentrace každého substrátu byly vypočteny nastavením  na odhadované biologické energetické kvantum (BEQ) -10 kJ mol-1 a vyřešením rovnice pro koncentraci substrátu, přičemž všechny ostatní edukáty a koncentrace produktů zůstaly stejné a jak je uvedeno výše.
na odhadované biologické energetické kvantum (BEQ) -10 kJ mol-1 a vyřešením rovnice pro koncentraci substrátu, přičemž všechny ostatní edukáty a koncentrace produktů zůstaly stejné a jak je uvedeno výše.
Výsledky a diskuse
Termodynamický argument
Pro posouzení energetické proveditelnosti mikrobiálních metabolických reakcí (tabulka 1) v hlubokých podpovrchových sedimentech je užitečné konzervativně vypočítat jejich energetické výtěžky za podmínek, které se podobají podmínkám zjištěným in situ. V této části zkoumám energetický potenciál různých reakcí acetogeneze probíhajících v hlubokých podpovrchových sedimentech zkoumáním (1) výtěžků Gibbsovy volné energie na reakci  (2) výtěžků Gibbsovy volné energie na substrát
(2) výtěžků Gibbsovy volné energie na substrát  (3) termodynamických prahových koncentrací substrátů, aby reakce acetogeneze byly termodynamicky výhodné, (4) energetické výtěžky in situ reakcí, pro které byly kvantifikovány koncentrace eduktů a produktů v podpovrchových sedimentech, a (5) energetické výtěžky na molekulu vodíku (H2) různých reakcí lito- a organotrofní acetogeneze zahrnujících H2 ve srovnání s konkurenčními reakcemi hydrogenotrofní redukce síranů a metanogeneze.
(3) termodynamických prahových koncentrací substrátů, aby reakce acetogeneze byly termodynamicky výhodné, (4) energetické výtěžky in situ reakcí, pro které byly kvantifikovány koncentrace eduktů a produktů v podpovrchových sedimentech, a (5) energetické výtěžky na molekulu vodíku (H2) různých reakcí lito- a organotrofní acetogeneze zahrnujících H2 ve srovnání s konkurenčními reakcemi hydrogenotrofní redukce síranů a metanogeneze.
Které reakce acetogeneze jsou termodynamicky výhodné?
Vypočtené Gibbsovy volné energie ukazují, že většina reakcí acetogeneze je v hlubokých podpovrchových sedimentech termodynamicky výhodná – s energetickými výtěžky převyšujícími BEQ  v širokém rozsahu teplot, tlaků a koncentrací vodíku (tabulka 3). Nejvyšší energetické hodnoty s
v širokém rozsahu teplot, tlaků a koncentrací vodíku (tabulka 3). Nejvyšší energetické hodnoty s  mají sacharidy, pyruvát, methylchlorid, methoxylované aromatické sloučeniny a laktát. U ostatních substrátů, jako je glykolát, oxalát, methanol a ethanol, jsou energetické výtěžky rovněž vyšší než BEQ. Naproti tomu klasická autotrofní („homoacetogenní“) reakce z H2-CO2 a reakce z mravenčanu jsou endergonické při koncentraci 0,1 nM H2 (tab. 3) a poskytují energii pouze při koncentraci 1 μM H2 a nízkých až středních teplotách (tab. 3). U energeticky výnosných substrátů, které lze použít s H2 nebo bez něj, tj. u oxidu uhelnatého, laktátu, methanolu a syringátu, poskytují reakce bez účasti H2 více energie při = 0,1 nM než reakce s H2; v případě oxidu uhelnatého a laktátu je tento rozdíl zásadní, protože reakce bez vodíku poskytují vysoce energetické výtěžky, zatímco reakce s H2 jsou endergonické (tab. 3). Při = 1 μM se to mění, tj. energetické výtěžky některých reakcí s vodíkem jsou exergonické a poskytují více energie než BEQ (tabulka 3); v jednom případě (laktát, -1,9 °C) výtěžky volné energie dokonce převyšují výtěžky acetogeneze ze samotného laktátu při nízkých až středních teplotách (viz také výsledky a diskuse k tabulce 4 v další části).
mají sacharidy, pyruvát, methylchlorid, methoxylované aromatické sloučeniny a laktát. U ostatních substrátů, jako je glykolát, oxalát, methanol a ethanol, jsou energetické výtěžky rovněž vyšší než BEQ. Naproti tomu klasická autotrofní („homoacetogenní“) reakce z H2-CO2 a reakce z mravenčanu jsou endergonické při koncentraci 0,1 nM H2 (tab. 3) a poskytují energii pouze při koncentraci 1 μM H2 a nízkých až středních teplotách (tab. 3). U energeticky výnosných substrátů, které lze použít s H2 nebo bez něj, tj. u oxidu uhelnatého, laktátu, methanolu a syringátu, poskytují reakce bez účasti H2 více energie při = 0,1 nM než reakce s H2; v případě oxidu uhelnatého a laktátu je tento rozdíl zásadní, protože reakce bez vodíku poskytují vysoce energetické výtěžky, zatímco reakce s H2 jsou endergonické (tab. 3). Při = 1 μM se to mění, tj. energetické výtěžky některých reakcí s vodíkem jsou exergonické a poskytují více energie než BEQ (tabulka 3); v jednom případě (laktát, -1,9 °C) výtěžky volné energie dokonce převyšují výtěžky acetogeneze ze samotného laktátu při nízkých až středních teplotách (viz také výsledky a diskuse k tabulce 4 v další části).
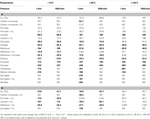
Tabulka 3. Výtěžky Gibbsovy volné energie různých reakcí acetogeneze v širokém rozsahu teplot, tlaků a koncentrací H2.
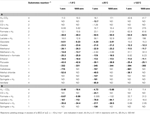
Tabulka 4. Výtěžky Gibbsovy volné energie na substrát pro různé reakce acetogeneze v širokém rozsahu teplot (°C), tlaků (atm) a koncentrací H2.
V rámci vypočtených rozsahů má teplota mnohem větší vliv na výtěžky volné energie reakcí acetogeneze než tlak. Pro změny tlaku od 1 do 1000 atm mají největší vliv reakce, které zahrnují H2, přičemž laktát + H2 mají největší změnu (5,2 kJ mol-1); pro všechny reakce bez H2 je rozdíl v  mezi tlakem 1 a 1000 atm ≤2 kJ mol-1. Pro srovnání, rozdíl v
mezi tlakem 1 a 1000 atm ≤2 kJ mol-1. Pro srovnání, rozdíl v  způsobený změnou teploty z -1,9 na +122 °C je vždy větší než rozdíl v
způsobený změnou teploty z -1,9 na +122 °C je vždy větší než rozdíl v  způsobený změnou tlaku z 1 na 1000 atm. U reakcí z H2-CO2, formátu-H2, laktátu-H2 a celobiózy změna hodnot
způsobený změnou tlaku z 1 na 1000 atm. U reakcí z H2-CO2, formátu-H2, laktátu-H2 a celobiózy změna hodnot  přecházející z -1,9 na +122 °C dokonce přesahuje 100 kJ mol-1 reakce.
přecházející z -1,9 na +122 °C dokonce přesahuje 100 kJ mol-1 reakce.
Velikost vlivu teploty zřejmě sleduje trendy. Za prvé, ze šesti reakcí zahrnujících H2 nebo mravenčan, pro které bylo možné vypočítat teplotní efekty, není žádná z nich při teplotě 122 °C termodynamicky příznivá. To a obrovský celkový pokles výtěžků volné energie pro reakce acetogeneze zahrnující H2 nebo mravenčan v závislosti na teplotě naznačuje silnou selekci proti těmto reakcím při teplotách blížících se známé horní hranici života – ledaže by koncentrace H2 nebo mravenčanu při vysokých teplotách byly mnohem vyšší, než se zde předpokládá. Za druhé se zdá, že existuje systematický rozdíl v tom, jak teplota ovlivňuje energetické výtěžky. U všech substrátů C1-C3 s výjimkou reakcí ze samotného laktátu se výtěžky volné energie s teplotou snižují; u reakcí ze samotného laktátu dochází s teplotou k mírnému nárůstu. Naproti tomu výtěžky volné energie reakcí acetogeneze ze sacharidů glukózy (C6) a celobiózy (C12) vykazují silný nárůst v závislosti na teplotě. Na základě malého počtu substrátů zahrnutých do těchto výpočtů a toho, že jediné dva zahrnuté velké substráty jsou sacharidy, je předčasné tvrdit, že větší uhlíkové substráty by měly být spotřebovávány přednostně při vysokých teplotách. Přesto skutečnost, že u některých substrátů nebo reakcí acetogeneze se energetický výtěžek v závislosti na teplotě zvyšuje, zatímco u jiných klesá, naznačuje, že teplota významně ovlivňuje, které substráty jsou spotřebovávány a které reakce s energetickým výtěžkem acetogeny v hluboké biosféře provádějí.
Které reakce acetogeneze jsou za zkoumaných podmínek nejpravděpodobnější?
Výtěžek Gibbsovy volné energie metabolické reakce udává, zda lze tuto reakci v daném prostředí využít jako zdroj energie. Za podmínek omezujících substráty, které jsou pravděpodobné v hluboké biosféře, však lze očekávat, že volba mikrobiálních konzumentů – za předpokladu, že se řídí optimálním potravním chováním – se bude řídit energetickým výtěžkem na mol substrátu – pokud celková reakce produkuje více energie než BEQ. U substrátů, které mohou být metabolizovány více reakcemi, z nichž každá poskytuje více energie než BEQ, např. methanol při -1,9 °C (tabulka 3), lze očekávat, že konzumenti budou dávat přednost reakcím s nejvyšším energetickým výtěžkem na substrát. Kromě toho je možné, že organismy, přestože jim chybí energie, dávají přednost určitým substrátům před jinými na základě obsahu energie na molekulu substrátu. Abychom prozkoumali možné důsledky optimálního potravního chování, které se řídí energetickými výtěžky na substrát, byly tyto výtěžky vypočteny (tabulka 4).
Při porovnání různých substrátů na úrovni jednotlivých substrátů zůstávají výtěžky Gibbsovy volné energie vysoké  pro celobiózu, glukózu (všechny T a P), laktát + H2 (pouze při = 1 μM, -1,9 a 25 °C; vše beze změny oproti tabulce 3), stejně jako syringát (tabulka 4). Za předpokladu jejich dostupnosti v hluboké biosféře a toho, že acetogeny se rozhodují na základě energie na molekulu substrátu, by tyto substráty měly být spotřebovávány přednostně před ostatními zkoumanými. Dalšími vhodnými substráty mohou být – v pořadí podle klesajícího energetického výtěžku – vanilát, methylchlorid, laktát, pyruvát, methanol a oxalát. Klasická litoautotrofní reakce z H2-CO2 a reakce z mravenčanu a glykolátu mají nejmenší energetický výtěžek na úrovni substrátu, a proto je nejméně pravděpodobné, že budou spotřebovány, pokud by energetický obsah na úrovni substrátu určoval výběr acetogenního substrátu.
pro celobiózu, glukózu (všechny T a P), laktát + H2 (pouze při = 1 μM, -1,9 a 25 °C; vše beze změny oproti tabulce 3), stejně jako syringát (tabulka 4). Za předpokladu jejich dostupnosti v hluboké biosféře a toho, že acetogeny se rozhodují na základě energie na molekulu substrátu, by tyto substráty měly být spotřebovávány přednostně před ostatními zkoumanými. Dalšími vhodnými substráty mohou být – v pořadí podle klesajícího energetického výtěžku – vanilát, methylchlorid, laktát, pyruvát, methanol a oxalát. Klasická litoautotrofní reakce z H2-CO2 a reakce z mravenčanu a glykolátu mají nejmenší energetický výtěžek na úrovni substrátu, a proto je nejméně pravděpodobné, že budou spotřebovány, pokud by energetický obsah na úrovni substrátu určoval výběr acetogenního substrátu.
Při porovnávání energetických výtěžků substrátů acetogeneze, pro které je známo více reakčních cest, tj, CO, mravenčan, laktát, methanol a syringát, platí pro mravenčan a syringát stále stejné celkové trendy pozorované na úrovni jednotlivých reakcí – nezávisle na koncentraci H2 (tabulky 3 a 4). U oxidu uhelnatého, laktátu a methanolu se stejné trendy objevují při = 1 nM, ale ne při = 1 μM. Přestože celková reakce z oxidu uhelnatého poskytuje více energie než reakce z oxidu uhelnatého + H2 při vysokých (tab. 4), acetogeneze z oxidu uhelnatého + H2 poskytuje více energie na úrovni jednotlivých substrátů (tab. 4). V případě laktátu poskytují reakce z laktátu + H2 při vysoké H2 více energie na jeden laktát než reakce ze samotného laktátu – nejen jako dříve při -1,9 °C (tab. 3), ale také při +25 °C (tab. 4). A v případě methanolu – na rozdíl od dřívějška (tabulka 3) – reakce s H2 poskytují více energie na methanol při vysoké H2 a nízké teplotě (-1,9 až 25 °C) než reakce se samotným methanolem (tabulka 4). Tyto výsledky potvrzují důležitost výpočtu energetických výtěžků na úrovni jednotlivých substrátů. Navíc podtrhují pravděpodobný význam teploty při regulaci toho, které reakce acetogeneze probíhají in situ – a to i v případě, že tyto reakce zahrnují stejný uhlíkový substrát.
Míra, do jaké mohou mikrobi detekovat a reagovat na (malé) rozdíly v energetických výtěžcích různých reakcí zahrnujících stejné substráty, a tím optimalizovat své potravní chování s ohledem na energetické výtěžky na substrát, je málo známá. Potenciální výhody pro přežití v prostředí s nedostatkem energie jsou zřejmé. Přesto není známo, zda mikrobi v hluboké biosféře s nedostatkem energie projevují nějakou formu substrátové selektivity, nebo spíše bez rozdílu spotřebovávají jakýkoli metabolizovatelný substrát, který se dostane do jejich dosahu. Strategie uplatňovaná jednotlivými buňkami nemusí záviset pouze na energetickém výtěžku na substrát. Na to, které substráty budou spotřebovávány, budou mít pravděpodobně vliv i další faktory, jako je rychlost obratu substrátu, energetické náklady na transport substrátu/metabolitu přes buněčnou membránu a energetická návratnost každého enzymu, který je třeba syntetizovat pro katabolizaci dalšího energetického substrátu.
Které reakce acetogeneze pravděpodobně probíhají in situ?
Dosud uvedené vypočtené výtěžky volné energie vycházejí z omezených publikovaných informací o koncentracích acetogenních substrátů. Pro hlubokou podpovrchovou biosféru byly publikovány pouze údaje o koncentraci H2, mravenčanu a acetátu (Shipboard Scientific Party, 2003; Lorenson et al., 2006; Heuer et al., 2009; Lever et al., 2010; Expedition 329 Scientists, 2011); koncentrace ostatních substrátů musely být aproximovány pomocí údajů z povrchových mořských sedimentů (Meyer-Reil, 1978; Sørensen et al., 1981; King et al., 1983; Smith a Oremland, 1983; Parkes et al., 1989; Martens, 1990; Hoehler et al., 2001; Dhillon et al., 2005; Finke et al., 2006; King, 2007), sladkovodních sedimentů (King et al., 1982; Lovley a Goodwin, 1988; Chidhaisong et al., 1999; Keppler et al., 2000), mořských vodních sloupců (Edenborn a Litchfield, 1987; Ballschmiter, 2003) a suchozemské hlubinné biosféry (Chapelle a Bradley, 2007). Jelikož se koncentrace H2, mravenčanu a octanu v hlubinné biosféře překrývají s koncentracemi těchto druhů v jiných sedimentárních prostředích, zdá se realistické konzervativně aproximovat podpovrchové koncentrace jiných substrátů, jako je glukóza nebo šťavelan, nejnižšími hodnotami naměřenými v jiných sedimentárních prostředích. To však nemůže zakrýt skutečnost, že skutečné koncentrace nebyly změřeny. Alternativou k výpočtu energetických výtěžků při předpokládaných koncentracích substrátů je proto výpočet prahových koncentrací potřebných k tomu, aby acetogeny splnily BEQ ze substrátu. To lze provést konzervativně, protože koncentrace většiny ostatních reakčních eduktů a produktů, tj. H+, H2O, HCO3-, acetátu, H2, Cl-, jsou pro hlubokou biosféru dobře omezeny a/nebo nastaveny na konzervativní hodnoty (viz Materiály a metody). Termodynamické prahové koncentrace byly stejně jako dříve vypočteny pro = 0,1 nM a 1 μM (tabulka 5).
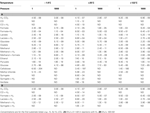
Tabulka 5. Termodynamické prahové koncentrace rozšířených reakcí acetogeneze v širokém rozsahu teplot a tlaků za předpokladu biologického energetického kvanta 
Na první pohled je zřejmé, že koncept prahových koncentrací je relevantní pouze pro skupinu acetogenních substrátů. Pro glukózu, celobiózu, syringát, jakož i syringát + H2 při 1 μM , jsou prahové koncentrace nižší než jedna molekula substrátu na litr. Ve skutečnosti jsou termodynamické prahové koncentrace pro glukózu a celobiózu dokonce řádově nižší než jedna molekula na celý objem pozemského oceánu (tabulka 5)! Pro oxid uhelnatý, laktát, pyruvát, metylchlorid, syringát + H2 při nízkých , nebo laktát + H2 při vysokých se také zdá nepravděpodobné, že by splnění BEQ bylo reálnou překážkou. U těchto reakcí se prahové koncentrace pohybují nanejvýš v nízkém pikomolárním rozmezí – a s tím ~2-3 řády níže, než je známo, že mikrobi stahují limitní koncentrace metabolitů (např. Fuhrman a Ferguson, 1986; Hoehler et al., 2001; Stolper et al., 2010). Pokud jsou dříve naměřené koncentrace organických substrátů v hlubokých podpovrchových sedimentech, které byly většinou (0,1 μM (např. Shipboard Scientific Party, 2003; Mitterer, 2006; Heuer et al., 2009; Lever et al., 2010), dobrou referencí, pak nám zbývají stejné závěry jako dříve (tab. 4), tj, že většina reakcí acetogeneze produkuje energetické výtěžky přesahující BEQ, a to i při koncentracích substrátů, které jsou pro hlubokou biosféru nízké.
Možná ještě zajímavější je, že zkoumání těch substrátů, které byly dříve považovány za méně pravděpodobné pro využití acetogeny (na základě tabulek 3 a 4), naznačuje, že i mravenčan a H2-CO2 jsou potenciálními substráty acetogenů v některých podpovrchových prostředích. Koncentrace mravenčanu od nízkých mikromolárů až po desítky mikromolárů (tab. 5) byly zdokumentovány pro lokality od organicky bohatých (lokalita ODP 1230) až po vysoce oligotrofní (lokalita ODP 1231; Shipboard Scientific Party, 2003). Termodynamické výpočty založené na naměřených koncentracích mravenčanu naznačují, že mravenčan by mohl být v určitých hloubkách v podpovrchových sedimentech na křídle hřebene Juan de Fuca substrátem acetogeneze (Lever et al., 2010). Přesné kvantifikace koncentrací vodíku v hlubinné biosféře jsou zatíženy nejistotou, přičemž dvě různé metody poskytují výsledky lišící se až o dva řády (Lin et al., 2011). Přesto nezávisle na použité metodě nejsou naměřené koncentrace přesahující 10 nM neobvyklé (Shipboard Scientific Party, 2003; Lorenson et al., 2006; Expedition 329 Scientists, 2011; Lin et al., 2011) a naznačují, že i acetogeneze z H2-CO2 je na některých místech možná, ne-li rozšířená.
In situ energetické výtěžky reakcí acetogeneze na základě naměřených koncentrací
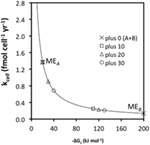
Pokud je mi známo, jediné vzorky podpovrchových sedimentů, u nichž byly kvantifikovány všechny koncentrace eduktů a produktů reakcí acetogeneze, pocházejí z etapy ODP 201 (Shipboard Scientific Party, 2003). Sedm lokalit odebraných během této expedice se liší od organicky bohatých po oligotrofní a pokrývají rozsah energetických podmínek, který pravděpodobně zahrnuje většinu anoxických podpovrchových sedimentů na Zemi. U těchto vzorků byly koncentrace mravenčanu a vodíku (a žádných jiných acetogenních substrátů) měřeny souběžně s koncentracemi acetátu, DIC (proxy pro hydrogenuhličitan) a pH, což umožnilo výpočet energetických výtěžků in situ reakcí acetogeneze z H2-CO2, mravenčanu a mravenčanu + H2 (obr. 1).

Obr. 1. Hloubkové profily energetických výtěžků spojených s reakcemi acetogeneze z (A) H2-CO2, (B) mravenčanu a (C) mravenčanu-H2 pro lokality ODP 1225-31. Všechny výpočty jsou založeny na měřeních ze sedimentárních jader odebraných během etapy ODP 201 (Shipboard Scientific Party, 2003).
Vypočtené výtěžky volné energie pro tři reakce ukazují jasné trendy: reakce z H2-CO2 jsou většinou endergonické a poskytují energii přesahující hodnotu BEQ pouze v několika malých hloubkách na lokalitě ODP 1231 (obr. 1A). Reakce z mravenčanu jsou exergonické s energetickými výtěžky kolem nebo nad hodnotou BEQ ve všech sledovaných lokalitách a hloubkách (obr. 1B). Reakce z mravenčanu + H2 jsou z větší části mírně exergonické, ale BEQ překračují pouze v několika málo hloubkách v lokalitách ODP 1225, 1230 a 1231 (obr. 1C).
Na základě těchto výsledků lze předpokládat, že acetogeneze z mravenčanu je možná v širokém rozsahu podpovrchových stanovišť, zatímco reakce acetogeneze zahrnující H2-CO2 nebo mravenčan + H2 jsou nepravděpodobné. Přesto je třeba vzít v úvahu vysokou nejistotu spojenou s kvantifikací koncentrací H2 v pórové vodě. Koncentrace H2 naměřené během etapy ODP 201 byly získány inkubační metodou, která předpokládá, že vodík v headspace je po inkubační době v rovnováze s rozpuštěným vodíkem v pórových tekutinách (Lovley a Goodwin, 1988; Hoehler et al., 1998). Ve srovnání s novou metodou založenou na extrakci stejných vzorků poskytuje inkubační metoda měření koncentrací, které jsou trvale o jeden až dva řády nižší (Lin et al., 2011). Pokud jsou koncentrace H2 in situ v sedimentech odebraných během Leg 201 o jeden řád vyšší než dříve naměřené, snížilo by to Gt′ pro acetogenezi z H2-CO2 o ~22 kJ mol-1. V takovém případě by téměř polovina vzorků měla hodnoty energie vyšší než BEQ (obr. 1A). Pokud jsou koncentrace in situ o dva řády vyšší, sníží to Δ Gt′ pro acetogenezi z H2-CO2 o dalších ~22 kJ mol-1 – celkem o ~44 kJ mol-1 reakce ve srovnání s naměřenými údaji o H2. V tomto případě by energetické výtěžky acetogeneze z H2-CO2 překročily BEQ v drtivé většině vzorků odebraných během etapy 201.
Energetické výtěžky reakcí acetogeneze za účasti H2 ve srovnání s konkurenčními reakcemi redukce síranů a metanogeneze
Hlavní empirická podpora konceptu redoxní zonace pochází z izotopových stopovacích studií a měření koncentrací vodíku v sulfát-redukujících a metanogenních sladkovodních a pobřežních povrchových sedimentech (např, Cappenberg, 1974; Capone a Kiene, 1988; Lovley a Goodwin, 1988; Hoehler a kol., 1998; Heimann a kol., 2010). Acetogenezi byla v sedimentech věnována menší pozornost kvůli obtížnosti detekce tohoto procesu; koneckonců konečný produkt acetát je také klíčovým substrátem pro reduktory síranů a metanogeny a rychlý obrat vede k tomu, že se acetát obvykle nehromadí ve vysokých koncentracích – na rozdíl od konečných produktů redukce síranů a metanogeneze, sulfidů a metanu. Acetogeneze je navíc často ztotožňována s „homoacetogenní“ reakcí z H2-CO2, která je při termodynamické kontrole koncentrací H2 v sulfátredukujících nebo metanogenních sedimentech termodynamicky nevýhodná. Jen výjimečně byly zohledněny energetické výtěžky organotrofních reakcí acetogeneze, které zahrnují H2 (Liu a Suflita, 1993; Lever et al., 2010). Zde porovnávám energetické výtěžky různých reakcí acetogeneze zahrnujících H2 s výtěžky široce rozšířených hydrogenotrofních reakcí redukce síranů a metanogeneze v širokém rozsahu koncentrací H2 (obr. 2).
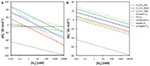
Obrázek 2. Vztah mezi koncentrací H2 a energetickými výtěžky pro redukci síranů, methanogenezi a acetogenezi z H2-CO2, jakož i acetogenezi z formátu-H2, CO-H2, methanolu-H2, laktátu-H2 a syringátu-H2. (A) energetické výtěžky na reakci  černá čára označuje BEQ, (B) energetické výtěžky na substrát
černá čára označuje BEQ, (B) energetické výtěžky na substrát  Všechny výpočty byly provedeny za předpokladu standardní teploty a tlaku a za použití koncentrací eduktů a produktů, jak je uvedeno v Materiálech a metodách, s výjimkou .
Všechny výpočty byly provedeny za předpokladu standardní teploty a tlaku a za použití koncentrací eduktů a produktů, jak je uvedeno v Materiálech a metodách, s výjimkou .
Na první pohled je zřejmé, že reakce acetogeneze z H2-CO2 je termodynamicky méně výhodná než reakce sulfátové nebo metanogeneze z H2-CO2, a to nezávisle na koncentraci H2 (obr. 2A). Za podmínek použitých ve výpočtech mohou reduktory sulfátů splnit BEQ až do koncentrací H2 ~0,6 nM, metanogeny až do 11 nM, zatímco acetogeny vyžadují koncentrace H2 410 nM. Acetogeneze z mravenčanu + H2 je rovněž nepravděpodobná, protože její energetické výtěžky jsou nižší než BEQ, pokud koncentrace H2 nejsou v mikromolárním rozmezí. Energeticky výhodnější než redukce síranů nebo methanogeneze je však acetogenní reakce ze syringátu + H2, která i při koncentracích H2 pouhých 0,01 nM poskytuje vysoké energetické výtěžky (~-90 kJ mol-1) – koncentrace, při nichž jsou redukce síranů i methanogeneze endergonní. Navíc, zatímco redukce síranů z H2-CO2 je celkově druhou energeticky nejvýnosnější reakcí, reakce acetogeneze z CO, methanolu a laktátu produkují více energie než hydrogenotrofní methanogeneze při koncentracích H2 v typickém rozmezí naměřeném v hlubokých podpovrchových sedimentech.
Pokud se energetické výtěžky posuzují na úrovni jednotlivých molekul vodíku, jsou výsledky ještě zarážející. Reakce acetogeneze ze syringátu + H2, metanolu + H2 a CO + H2 poskytují více energie na molekulu H2 než redukce sulfátu z H2-CO2 (obr. 2B). Reakce z laktátu + H2 poskytuje méně energie než hydrogenotrofní redukce síranů, ale o něco více než hydrogenotrofní methanogeneze, zatímco reakce acetogeneze z mravenčanu + H2 a H2-CO2 poskytují nejmenší množství energie na molekulu H2 a jsou endergonické s výjimkou mikromolárních koncentrací H2 (obr. 2B).
Dalo by se namítnout, že reakce karboxydo- a organotrofní acetogeneze za účasti H2 jsou v mořských sedimentech nepravděpodobné. Koneckonců reakce zahrnující stejný uhlíkový substrát bez H2 poskytují více energie s výjimkou případů, kdy se vysoké koncentrace H2 shodují s nízkou teplotou (tabulky 3 a 4) – což je stav, který byl tradičně pozorován pouze během sezónně vyvolaných dočasných nerovnováh v mělkých sedimentech (Hoehler et al., 1999) a v sezónně stabilních podpovrchových sedimentech je možná nepravděpodobný. Přesto rozdíly v naměřených koncentracích H2 v hlubokých podpovrchových sedimentech závislé na metodě (Lin et al., 2011) ponechávají prostor pro velkou nejistotu; pokud se ukáže, že vyšší naměřené hodnoty získané novou metodou založenou na extrakci (Lin et al., 2011) jsou přesné, pak karboxydo- a organotrofní reakce acetogeneze s H2 mohou být v převážně chladné hluboké biosféře konkurenceschopné, ne-li energeticky výhodné, oproti karboxydo- a organotrofním reakcím bez H2. Důkazy podporující význam organotrofních reakcí s H2 pocházejí z podpovrchových sedimentů Atlantické pobřežní nížiny (Liu a Suflita, 1993). Acetogenní izolát z těchto sedimentů vykazoval růst pouze O-demethoxylací syringátu v atmosféře H2-CO2, zatímco v atmosféře N2-CO2 nebo N2 nebyl růst na syringátu pozorován. A tím, že metabolizoval syringát s H2, byl tento organismus schopen konkurovat hydrogenotrofním metanogenům o H2 v počátečním obohacení sedimentu.
Schopnost získávat energii z demethoxylace syringátu nebo jiných monomerů ligninu je rozšířená mezi acetogeny, ale ne mezi reduktory sulfátu nebo metanogeny, což naznačuje, že methoxyskupiny na aromatických kruzích mohou představovat nekonkurenční substráty (Lever et al., 2010). Totéž neplatí pro ostatní substráty, laktát, CO a methanol (obr. 2). Laktát slouží jako růstový substrát nejen mnoha acetogenům (Lever et al., 2010), ale také mnoha sulfátreduktorům (Rabus et al., 2006), u kterých lze očekávat vyšší energetické výtěžky z konkurenčních sulfátredukčních reakcí. Podobně, přestože jsou jako růstové substráty využívány méně než mezi acetogeny (Lever et al., 2010), CO, a methanol mohou sloužit jako energetické substráty také některým reduktorům sulfátů (přehled v Mörsdorf et al., 1992), stejně jako několika methanogenům (přehled ve Whitman et al., 2006, a ve Ferry, 2010). Lze očekávat, že jak sulfátreduktory, tak metanogeny získají více energie z reakcí zahrnujících CO nebo metanol než acetogeny. Proto mohou být důkazy naznačující důležitou roli acetogeneze v koloběhu CO a metanolu v mořských a sladkovodních sedimentech překvapivé (King, 2007; Jiang et al., 2010). V následující části budu argumentovat, že schopnost acetogenů využívat širokou škálu substrátů je životaschopnou strategií přežití v podmínkách energetického omezení – navzdory nižším energetickým výtěžkům na substrát.
Metabolické strategie acetogenů
Nápadným rysem acetogenů jako metabolického cechu je rozšířená schopnost využívat jako energetické substráty velký počet a širokou diverzitu sloučenin uhlíku. Více než polovina všech kultivovaných kmenů pozitivně testuje růst na H2/CO2, oxid uhelnatý, mravenčan, metanol, etanol, další alifatické sloučeniny, jako je laktát, a metoxylované aromatické sloučeniny (Lever et al., 2010). Mezi další široce používané růstové substráty patří sacharidy, jiné mastné kyseliny a alkoholy s krátkým řetězcem, methoxylované alifatické sloučeniny, betainy, aminokyseliny a aldehydy (Drake et al., 2006). Některé kmeny využívají dokonce i složité organické polymery, jako je celulóza nebo karboxymethylcelulóza (Wolin a Miller, 1994; Karita et al., 2003; Wolin et al., 2003). Vzhledem k omezenému počtu energetických substrátů, na kterých se obvykle testuje růst, může rozsah substrátů acetogenů výrazně přesahovat v současnosti známé spektrum. Jakékoli methylové nebo methoxylové skupiny sloučenin nalezených v prostředí představují potenciální energetické substráty, které by se za termodynamicky příznivých podmínek mohly spojit s CO2 za vzniku acetátu.
Vzhledem k nápadné metabolické všestrannosti acetogenů se zdá pravděpodobné, že výsledná plasticita s ohledem na využití substrátů je součástí strategie, která umožňuje acetogenům koexistovat se sulfátreducenty a metanogeny. V následujících částech se budu zabývat dvěma hypotézami, které se snaží vysvětlit výhody širokého metabolického spektra. První hypotéza říká, že acetogeny mohou koexistovat se sulfátovými reduktory a metanogeny díky diferenciaci niky s ohledem na využití substrátů. Jinými slovy, acetogeny se mohou vyhnout konkurenci tím, že spotřebovávají substráty, které nevyužívají reduktory sulfátů nebo metanogeny. Druhou hypotézou je, že schopnost sdružovat energii ze široké škály metabolických reakcí umožňuje koexistenci navzdory nižší energii ze sdílených substrátů. Tyto dvě hypotézy nejsou neslučitelné, ale spíše by měly být považovány za dvě vzájemně se doplňující výhody generalistické metabolické strategie.
Niková diferenciace na základě využívání substrátů
Při společném pohledu mohou reduktory sulfátů, i když ne ve stejné míře jako acetogeny, také využívat velké množství substrátů. Při podrobnějším zkoumání se však ukazuje, že pouze schopnost využívat H2, mastné kyseliny s krátkým řetězcem a ethanol je u různých rodů skutečně rozšířená (Rabus et al., 2006). Běžné acetogenní substráty jako methanol, glukóza, fruktóza, oxid uhelnatý a metoxylované monomery ligninu nejsou substráty pro naprostou většinu sulfátových reduktorů (Mörsdorf et al., 1992; Rabus et al., 2006). Termodynamická výhoda vyšších energetických výtěžků redukce sulfátů ve srovnání s acetogenezí se tedy projevuje pouze u podskupiny acetogenních substrátů, které jsou rovněž využívány reduktory sulfátů. Tento závěr podporují stopovací experimenty, které ukazují na H2 a mastné kyseliny s krátkým řetězcem jako hlavní donory elektronů využívané reduktory síranů v ústí řek a mořských sedimentech (Sørensen et al., 1981; Parkes et al., 1989). Podobně experimentální důkazy naznačující acetogeny jako klíčové spotřebitele CO a methoxylových skupin v sulfátredukujících mořských sedimentech (Küsel et al., 1999; King, 2007) naznačují, že navzdory překrývání substrátů acetogeny a reduktory sulfátů praktikují určitou formu diferenciace nik, kdy každá skupina upřednostňuje jiné energetické substráty tam, kde koexistují.
Daleko méně metabolicky univerzální než acetogeny nebo reduktory sulfátů je substrátový rozsah metanogenů omezen na (1) redukci CO2 (H2/CO2, mravenčan, několik jich využívá oxid uhelnatý nebo alkoholy), (2) disproporcionaci acetátu a (3) demetylaci C1 sloučenin (methanol, methylsulfidy a methylaminy). S výjimkou jednoho rodu (Methanosarcina) je většina methanogenů substrátovými specialisty a je schopna růstu pouze na jedné z těchto tří skupin substrátů (Whitman et al., 2006). Potenciální konkurence mezi acetogeny a metanogeny o substráty je tedy omezena na malou podmnožinu acetogenních substrátů.
Niková diferenciace, která vede k využívání různých energetických substrátů tam, kde tyto skupiny koexistují, tak může vysvětlovat, proč reduktory sulfátů a metanogeny kompetitivně nevylučují acetogeny v anoxických sedimentech. Proč se sulfátreduktory nepřizpůsobily k využívání celého spektra substrátů používaných acetogeny? A vzhledem k tomu, že jak acetogeny, tak metanogeny využívají reduktivní dráhu acetyl CoA pro produkci energie a/nebo fixaci C a překrývají se ve využívání substrátů (Drake et al., 2006; Whitman et al., 2006), proč se tyto dvě skupiny mohou tak drasticky lišit, pokud jde o jejich metabolickou všestrannost? Konečné evoluční vysvětlení zůstává předmětem spekulací. Na bližší úrovni mohly hrát roli při určování rozdílů v metabolických strategiích rozdíly ve výtěžnosti energie a rychlosti obratu energetických substrátů.
Nejčastější substráty používané reduktory sulfátů a metanogeny, tj. H2 a acetát, tzv. centrální meziprodukty degradace organického uhlíku (např. Valentine, 2001; Dolfing et al., 2008), jsou pravděpodobně donory elektronů s nejvyšší rychlostí obratu v anoxických sedimentech. Vysokou rychlost obratu mají i další mastné kyseliny s krátkým řetězcem, které představují důležité energetické substráty pro reduktory sulfátů (Sørensen et al., 1981; Parkes et al., 1989); dokonce i metylované sloučeniny využívané metanogeny, tj, methanol, methylaminy a methylsulfidy, mají v určitých prostředích vysokou rychlost obratu (např. Zhilina a Zavarzin, 1990; Mitterer a kol., 2001; Jiang a kol., 2010; Lin a kol., 2010). Substráty s vysokou rychlostí obratu jsou obvykle malé, protože pocházejí z různých individuálně méně hojných větších zdrojových molekul; často v sobě také ukrývají méně energie než větší organické molekuly s nižší rychlostí obratu (tab. 3 a 4). Proč mohou některé skupiny využívat substráty s vysokou rychlostí obratu, ale nízkou energetickou výtěžností, zatímco jiné používají substráty s nízkou rychlostí obratu, ale vysokou energetickou výtěžností? Část odpovědi může spočívat v univerzálním požadavku buněk na splnění požadavků na udržovací energii.
Splnění požadavků na udržovací energii je obzvláště náročné v hlubokých podpovrchových sedimentech, protože ty jsou obvykle po tisíce až miliony let odříznuty od zdrojů čerstvé organické hmoty. Zde se převážná většina buněk pravděpodobně nachází ve stavu trvalého hladovění (D’Hondt et al., 2004; Jørgensen et al., 2006) a hladovění může dokonce představovat primární zdroj úmrtnosti. Na základě chemostatových experimentů byl stanoven následující vztah mezi udržovací energií a teplotou (Tijhuis et al., 1993; Harder, 1997):

kde ME je udržovací energie (kJ (g suché hmoty)-1 d-1), A konstanta , Ea aktivační energie (69,4 kJ mol-1 K-1), R univerzální plynová konstanta (0,008314 kJ mol-1 K-1) a T teplota (K). Hodnota konstanty A byla vypočtena z rychlosti dodávky energie, při níž se zastaví růst a replikace mikrobiálních buněk v chemostatových experimentech (Tijhuis et al., 1993). Od té doby se odhaduje, že skutečná prahová energie potřebná pro udržení buněk je o tři řády nižší než prahová energie pro růst/replikaci (Price a Sowers, 2004; Biddle a kol., 2006). Proto budu ve všech výpočtech ME používat pro A hodnotu 4,99 × 109 kJ (g suché hmoty)-1 d-1 . Na základě této hodnoty A lze vypočítat udržovací energii 1,26 kJ (g sušiny)-1 rok-1 při standardní teplotě. Tijhuis et al. (1993) navrhují, aby 26 g suché hmoty buňky obsahovalo v průměru 12 g uhlíku. V kombinaci s publikovaným odhadem 10 fg C na buňku u mikrobů žijících v sedimentech (Whitman et al., 1998), lze pak vypočítat specifickou udržovací energii buňky, MEcell, 2,74 × 10-14 kJ cell-1 rok-1 při standardní teplotě.
Vztah mezi MEcell, výtěžkem Gibbsovy volné energie na substrát,  (kJ mol-1), a rychlostí obratu substrátu specifickou pro buňku, kcell (mol cell-1 rok-1), která je potřebná k tomu, aby buňka splnila požadavky na udržovací energii, lze vyjádřit takto:
(kJ mol-1), a rychlostí obratu substrátu specifickou pro buňku, kcell (mol cell-1 rok-1), která je potřebná k tomu, aby buňka splnila požadavky na udržovací energii, lze vyjádřit takto:
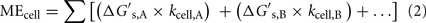
kde A a B označují substráty A, resp. Pokud buňky spotřebovávají pouze jeden substrát, tento výraz se zjednodušuje, takže rovnici lze řešit pro kcell, pokud jsou známy MEcell a  :
:

Vztah mezi kcell a  je hyperbolický (obrázek 3A). To má důsledky pro metabolické strategie mikrobů: mikrobi mohou například uspokojovat požadavky na udržovací energii spotřebou substrátů s nízkými energetickými výtěžky, pokud je rychlost obratu vysoká a je splněna BEQ (MEA); naopak mikrobi mohou uspokojovat požadavky na ME při nízké rychlosti obratu, pokud jsou energetické výtěžky na substrát vysoké (MEB).
je hyperbolický (obrázek 3A). To má důsledky pro metabolické strategie mikrobů: mikrobi mohou například uspokojovat požadavky na udržovací energii spotřebou substrátů s nízkými energetickými výtěžky, pokud je rychlost obratu vysoká a je splněna BEQ (MEA); naopak mikrobi mohou uspokojovat požadavky na ME při nízké rychlosti obratu, pokud jsou energetické výtěžky na substrát vysoké (MEB).
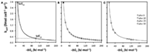
Obrázek 3. Vztahy mezi energetickými výtěžky na substrát  a rychlostí obratu (kcell). (A) Hyperbolický vztah mezi
a rychlostí obratu (kcell). (A) Hyperbolický vztah mezi  a kcell za předpokladu, že MEcell = 2,74 × 10- 14 kJ cell -1 rok -1. MEA a MEB označují dvě různé strategie pro splnění MEcell, MEA pro substrát s nízkou energetickou výtěžností
a kcell za předpokladu, že MEcell = 2,74 × 10- 14 kJ cell -1 rok -1. MEA a MEB označují dvě různé strategie pro splnění MEcell, MEA pro substrát s nízkou energetickou výtěžností  a vysokou kcell a MEB pro substrát s vysokou energetickou výtěžností
a vysokou kcell a MEB pro substrát s vysokou energetickou výtěžností  a nízkou kcell. (B) Ilustrace vlivu přírůstků energetických výtěžků substrátu o 10 kJ mol -1 na rychlost obratu potřebnou k dosažení MEcell. (C) Rychlost obratu pro MEA a MEB („plus 0“) ve srovnání s konkurenčními reakcemi „plus 10“, „plus 20“ a „plus 30“ s o 10, 20 a 30 kJ mol -1 vyššími energetickými výtěžky na substrát.
a nízkou kcell. (B) Ilustrace vlivu přírůstků energetických výtěžků substrátu o 10 kJ mol -1 na rychlost obratu potřebnou k dosažení MEcell. (C) Rychlost obratu pro MEA a MEB („plus 0“) ve srovnání s konkurenčními reakcemi „plus 10“, „plus 20“ a „plus 30“ s o 10, 20 a 30 kJ mol -1 vyššími energetickými výtěžky na substrát.
Dalším důsledkem je, že malé změny  výrazně ovlivňují rychlost obratu potřebnou ke splnění MEcell, pokud jsou energetické výtěžky na substrát malé (zde <50 kJ mol-1), ale ne, pokud jsou vysoké (zde ≥100 kJ mol-1; obrázek 3B). Pokud se
výrazně ovlivňují rychlost obratu potřebnou ke splnění MEcell, pokud jsou energetické výtěžky na substrát malé (zde <50 kJ mol-1), ale ne, pokud jsou vysoké (zde ≥100 kJ mol-1; obrázek 3B). Pokud se  změní z -10 na -20 kJ mol-1, rychlost obratu potřebná ke splnění požadavků na udržovací energii klesne o 50 %. Pro srovnání, pokud se
změní z -10 na -20 kJ mol-1, rychlost obratu potřebná ke splnění požadavků na udržovací energii klesne o 50 %. Pro srovnání, pokud se  změní z -100 na -110 kJ mol-1, pokles požadované rychlosti obratu je pouze ~9 %.
změní z -100 na -110 kJ mol-1, pokles požadované rychlosti obratu je pouze ~9 %.
Co to znamená, pokud jde o substráty používané reduktory sulfátu a metanogeny ve srovnání se substráty používanými acetogeny? Na obrázku 3C jsou znázorněny rychlosti udržovacího obratu pro stejné metabolické reakce, A a B, jako na obrázku 3A (plus 0), a také pro tři hypotetické dráhy, které produkují vyšší energetické výtěžky na substrát (plus 10, plus 20, plus 30); „plus 0“ je příkladem reakcí acetogeneze z vysoce obratového, nízkoenergetického substrátu (MEA), resp. nízko obratového, vysokoenergetického substrátu (MEB); cesty za „plus 10“, „plus 20“ a „plus 30“ jsou energeticky výhodnější reakce metanogeneze a redukce sulfátů zahrnující stejné dva substráty. Rozdíly v  -10, -20 a -30 kJ mol-1 oproti acetogenním reakcím vycházejí z typických rozdílů v
-10, -20 a -30 kJ mol-1 oproti acetogenním reakcím vycházejí z typických rozdílů v  vypočtených pro reakce metanogeneze/sulfátredukce vs. acetogeneze zahrnující substráty mravenčan, metanol a laktát v širokém rozsahu teplot (275-337 K) a koncentrací síranů (0-28 mM) v podpovrchových sedimentech (Lever et al., 2010). Srovnání ukazuje, že reakce acetogeneze pracující v blízkosti termodynamického prahu (MEA, ΔGs′ = -10 kj mol-1 Obr. 3C) mají obrovskou nevýhodu při splnění MEcel ve srovnání s konkurenčními metanogenními nebo sulfátredukčními reakcemi, které mohou pracovat při polovičním, třetinovém nebo čtvrtinovém obratu substrátu (Tabulka 6). Výhoda výrazně nižších rychlostí obratu potřebných k dosažení MEcell se snižuje se zvyšujícími se energetickými výtěžky na substrát (MEB, obrázek 3C). Z toho vyplývá, že minimální rychlosti obratu tří konkurenčních reakcí methanogeneze a redukce sulfátů jsou nižší pouze o 9, 17 a 23 %, když je energetický výtěžek na substrát -100 kJ mol-1 pro reakci acetogeneze (tabulka 6).
vypočtených pro reakce metanogeneze/sulfátredukce vs. acetogeneze zahrnující substráty mravenčan, metanol a laktát v širokém rozsahu teplot (275-337 K) a koncentrací síranů (0-28 mM) v podpovrchových sedimentech (Lever et al., 2010). Srovnání ukazuje, že reakce acetogeneze pracující v blízkosti termodynamického prahu (MEA, ΔGs′ = -10 kj mol-1 Obr. 3C) mají obrovskou nevýhodu při splnění MEcel ve srovnání s konkurenčními metanogenními nebo sulfátredukčními reakcemi, které mohou pracovat při polovičním, třetinovém nebo čtvrtinovém obratu substrátu (Tabulka 6). Výhoda výrazně nižších rychlostí obratu potřebných k dosažení MEcell se snižuje se zvyšujícími se energetickými výtěžky na substrát (MEB, obrázek 3C). Z toho vyplývá, že minimální rychlosti obratu tří konkurenčních reakcí methanogeneze a redukce sulfátů jsou nižší pouze o 9, 17 a 23 %, když je energetický výtěžek na substrát -100 kJ mol-1 pro reakci acetogeneze (tabulka 6).
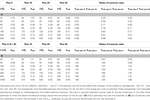
Tabulka 6. Přehled rychlostí obratu substrátu specifických pro buňku (kcell; fmol buňky-1 rok-1) potřebných ke splnění teoretické potřeby udržovací energie 2,74 × 10-1 4 kJ buňky-1 rok-1 při různých výtěžcích volné energie na substrát ( kJ mol-1).
kJ mol-1).
Vracíme se k otázce položené dříve v této části, tj, zda metanogeny/sulfátreduktory a acetogeny mohou praktikovat určitou formu diferenciace niky, kdy každá skupina využívá jiné substráty tam, kde se společně vyskytují, zde předložený model poskytuje jasnou odpověď. Živení se vysokoenergetickými substráty s nízkým obratem je pro mikroby životaschopnou strategií přežití, stejně jako živení se nízkoenergetickými substráty s vysokým obratem. Tyto dvě strategie mohou alespoň částečně vysvětlit koexistenci acetogenních a sulfátredukujících a/nebo metanogenních mikrobiálních populací. Důvodem, proč sulfátreduktory/metanogeny mohou využívat především nízkoenergetické substráty s vysokým obratem, je jejich obrovská energetická výhoda oproti acetogenům při metabolismu těchto substrátů. Při vysokém  se energetická výhoda sulfátových reduktorů/metanogenů oproti acetogenům snižuje a mohou vzrůst význam dalších cechovně specifických znaků. O jedné z nich bude pojednáno v následujícím oddíle.
se energetická výhoda sulfátových reduktorů/metanogenů oproti acetogenům snižuje a mohou vzrůst význam dalších cechovně specifických znaků. O jedné z nich bude pojednáno v následujícím oddíle.
Spory specialista vs. generalista
Potenciální výhody životního stylu specialista vs. generalista jsou předmětem diskusí mezi ekology již více než pět desetiletí. Tradiční názor je, že selektivita (specializace) se vyplatí za neomezujících energetických podmínek, zatímco menší diskriminace vůči zdrojům potravy (generalismus) je efektivnější strategií přežití při omezení energie (např. Emlen, 1966; Dykhuizen a Davies, 1980; recenze viz Pianka, 1994; Egli, 1995). S ohledem na mikrobiální ekologii byla tato argumentace zpochybněna některými mikrobiálními růstovými experimenty, v nichž se ukázalo, že dlouhá období hladovění zvýhodňují specialisty (např. Kuenen, 1983).
Zásadní rozdíl mezi mikroby a makrobiotiky při energetickém omezení spočívá v tom, že mikrobi se snaží nejen splnit požadavky na udržovací energii, ale také získat minimální volnou energii (BEQ) z metabolické reakce, aby vůbec byli schopni produkovat ATP. Proto jsou substrátoví specialisté často vybaveni vysokými substrátovými afinitami až do velmi nízkých koncentrací, které jim umožňují konkurovat nejen jiným metabolickým cechům, ale i ostatním členům vlastního metabolického cechu. Klasickým příkladem mezi metanogeny je obligátně octový rod Methanosaeta, který může růst na koncentracích acetátu pod 10 μM (Jetten et al., 1992). Pro srovnání, (podle standardů metanogenů) „generalistický“ rod Methanosarcina, jehož příslušníci mohou růst prostřednictvím redukce CO2, disproporcionace acetátu a demetylace C1 sloučenin, vyžaduje pro růst koncentraci acetátu nejméně 200 μM (Jetten et al., 1992). Zdá se, že vysoká afinita k substrátům je u specialistů strategií, díky níž mohou účinněji přijímat substráty a snižovat jejich koncentrace pod prahové koncentrace vyžadované generalisty. Tato forma energetického (tj. termodynamického) vyloučení, která se vyskytuje pouze u mikrobů, poskytuje vstupní bránu pro substrátové specialisty za předpokladu, že mohou splnit požadavky na udržovací energii. Cenou substrátové specializace je menší dostupná zásoba energie v důsledku využití menšího počtu energetických substrátů a nižší výtěžnost energie na substrát.
V energeticky chudých prostředích, jako jsou hluboké podpovrchové sedimenty, může metabolická strategie specialistů účinně fungovat u substrátů s vysokou rychlostí obratu. Vysoká rychlost obratu a relativně vysoká hustota buněk jsou nezbytné k udržení nízkých koncentrací substrátu, které specialistům umožňují termodynamicky vyloučit méně efektivní konzumenty téhož substrátu. Jak však bylo ukázáno dříve (tabulky 1- 3), termodynamické vyloučení acetogenů je pravděpodobné pouze pro nízkoenergetické substráty H2 a mravenčan. Ostatní, méně časté, ale energeticky bohatší substráty se vyskytují v koncentracích přesahujících termodynamický práh a poskytují jen malý podnět ke specializaci vzhledem k nemožnosti termodynamicky vyloučit jiné skupiny, jako jsou acetogeny, z jejich konzumace. Proto může být mezi konzumenty těchto vzácnějších, energeticky bohatších substrátů účinnější generalistická metabolická strategie.
Jak bylo uvedeno v předchozí části, generalismus substrátů je mezi acetogeny rozšířenou vlastností. S ohledem na splnění požadavků na udržovací energii má použití více než jednoho substrátu jasné výhody (obrázek 4); například při vysokých rychlostech obratu a nízkých ΔG (-10 kJ mol-1 substrátu) může kombinace energetických výtěžků dvou substrátů, A a B, se stejným  a kcel umožnit acetogenům snížit potřebný obrat substrátu o 50 % a úspěšně konkurovat metanogenům/sulfátreduktorům, kteří získávají o 10 kJ více energie na mol substrátu A (MEA; obrázek 4; tabulka 6). I když se jedná o zlepšení konkurenceschopnosti, sdružování energie ze dvou substrátů stále nestačí k tomu, aby konkurovaly methanogenům/sulfátovým reduktorům, které získávají o 20 nebo 30 kJ více na mol substrátu a které stále mohou splnit MEcell při rychlostech obratu, které jsou o 33, resp. 50 % nižší (tabulka 6). Aby se vyrovnaly jejich energetickým výtěžkům, musela by se spojit energie ze tří nebo čtyř substrátů s vlastnostmi substrátu A, což je z hlediska energetické účinnosti značně nevýhodné, jak by se dalo namítnout. To se mění u substrátů s vysokými energetickými výtěžky (např. -100 kJ mol-1 substrátu) a z toho vyplývajícími nízkými požadovanými rychlostmi obratu (MEB; obrázek 4). U nich by spojení energie ze dvou substrátů umožnilo acetogenu růst s výrazně nižší rychlostí obratu než kterýkoli z konkurenčních methanogenů/sulfátreduktorů využívajících pouze jeden substrát – což je významná výhoda (obr. 4; tab. 6). Z toho vyplývá, že sdružování energie z více substrátů by zvýšilo konkurenceschopnost acetogenů se sulfátovými reduktory a methanogeny celkově – a zejména u energeticky bohatých substrátů.
a kcel umožnit acetogenům snížit potřebný obrat substrátu o 50 % a úspěšně konkurovat metanogenům/sulfátreduktorům, kteří získávají o 10 kJ více energie na mol substrátu A (MEA; obrázek 4; tabulka 6). I když se jedná o zlepšení konkurenceschopnosti, sdružování energie ze dvou substrátů stále nestačí k tomu, aby konkurovaly methanogenům/sulfátovým reduktorům, které získávají o 20 nebo 30 kJ více na mol substrátu a které stále mohou splnit MEcell při rychlostech obratu, které jsou o 33, resp. 50 % nižší (tabulka 6). Aby se vyrovnaly jejich energetickým výtěžkům, musela by se spojit energie ze tří nebo čtyř substrátů s vlastnostmi substrátu A, což je z hlediska energetické účinnosti značně nevýhodné, jak by se dalo namítnout. To se mění u substrátů s vysokými energetickými výtěžky (např. -100 kJ mol-1 substrátu) a z toho vyplývajícími nízkými požadovanými rychlostmi obratu (MEB; obrázek 4). U nich by spojení energie ze dvou substrátů umožnilo acetogenu růst s výrazně nižší rychlostí obratu než kterýkoli z konkurenčních methanogenů/sulfátreduktorů využívajících pouze jeden substrát – což je významná výhoda (obr. 4; tab. 6). Z toho vyplývá, že sdružování energie z více substrátů by zvýšilo konkurenceschopnost acetogenů se sulfátovými reduktory a methanogeny celkově – a zejména u energeticky bohatých substrátů.
Obrázek 4. Stejný vztah jako na obrázku 3C s tím rozdílem, že rychlosti obratu potřebné pro MEA a MEB („plus 0“) se nyní počítají pro součet dvou substrátů, A a B . Všechny ostatní hodnoty jsou stejné jako dříve.
Stejný princip jako při porovnávání výhod použití dvou vs. jednoho substrátu platí i při porovnávání výhod použití více, např. 3 vs. 2, 5 vs. 4, 10 vs. 5 atd. substrátů. Jde především o to, že acetogeny mají obvykle širší substrátové spektrum než sulfátreduktory nebo metanogeny a že sdružování energie z většího počtu substrátů může acetogenům v některých případech umožnit přežít při nižších rychlostech obratu substrátů než ostatní skupiny, a to i přes nižší energetické výtěžky na substrát. Experimentální důkazy, které by potvrdily sdružování zdrojů energie jako vysvětlení koexistence acetogenních a sulfátredukujících a/nebo methanogenních populací v hluboké biosféře, dosud chybí. Stejný princip však byl prokázán v kontinuálních kulturách zahrnujících jiné skupiny mikroorganismů, které byly pěstovány za podmínek omezujících obsah uhlíku: zde několik studií prokázalo, že substrátoví generalisté rostou při nižších koncentracích substrátu než substrátoví specialisté, pokud inkubace zahrnovala více substrátů (Gottschal et al., 1979; Dykhuizen a Davies, 1980; přehled v Egli et al., 1993; Egli, 1995).
Na základě předložených výpočtů (obrázek 4; tabulka 6) lze dojít k závěru, že sdružování energie je pro podpovrchové acetogeny účinnou strategií pro splnění MEcel pouze tehdy, pokud zahrnuje vysokoenergetické substráty. U nízkoenergetických substrátů by měly mít značnou výhodu specializovanější organismy s vyššími energetickými výtěžky na substrát, tj. reduktory sulfátů a metanogeny (obr. 4), za předpokladu, že energetické výtěžky reakcí acetogeneze dokonce překračují BEQ. I ten nejefektivnější specialista však dosáhne limitu, když rychlost obratu substrátů klesne pod hranici potřebnou k dosažení MEcell; v tomto okamžiku je specialista nucen buď spotřebovávat další substráty, nebo umožnit koncentraci substrátů nad termodynamickou hranici. Důkazy potenciálně podporující druhou možnost pocházejí z oligotrofních sedimentů jihopacifického gyru a rovníkového Pacifiku, kde byly zaznamenány vrcholy koncentrace H2 v řádu desítek nanomolarů pro podpovrchové horizonty s mimořádně nízkou mikrobiální aktivitou (Shipboard Scientific Party, 2003; Expedition 329 Scientists, 2011). Pokud jsou substrátoví specialisté nuceni připustit koncentrace substrátu nad termodynamickým prahem, stávají se zranitelnými vůči méně efektivním, generalističtějším organismům, které soutěží o jejich preferovaný substrát. V konečném důsledku lze proto očekávat, že kvůli většímu dostupnému substrátu, a tedy i zásobě energie, budou za energeticky nejchudších podmínek dominovat substrátoví generalisté.
Z dosud uvedených výsledků vyplývá, že je velmi obtížné předpovědět výsledek složité konkurence mezi acetogeny a dalšími skupinami o substráty v hlubinné biosféře. Kromě fyzikálních proměnných, jako je teplota a tlak, může být nutné měřit koncentrace všech relevantních eduktů a produktů – což je u acetogenů vzhledem k jejich širokému substrátovému spektru velmi náročný úkol – a také měřit rychlost obratu specifického pro jednotlivé substráty, což je vzhledem k velmi nízké rychlosti obratu v hlubinné biosféře zdánlivě nemožné. I kdybychom měli úplné znalosti o koncentracích a rychlostech obratu, předpovídání konkurenčních výsledků na úrovni substrátů by bylo ohroženo našimi stále omezenými znalostmi o metabolických schopnostech mikrobů obývajících anoxické (podpovrchové) sedimenty, jakož i o dalších důležitých životních vlastnostech. Jednou z nich jsou energetické náklady na biosyntézu – proměnná, která se u jednotlivých mikrobů a mikrobiálních metabolických gild pravděpodobně značně liší.
Energetické náklady biosyntézy u acetogenů
Z dnes známých šesti cest autotrofní fixace uhlíku je reduktivní cesta acetyl CoA nejjednodušší a energeticky nejvýhodnější díky absenci složitých biochemických meziproduktů (Russell a Martin, 2004; Berg et al., 2010). Tato striktně anaerobní dráha se skládá pouze z karbonylové větve, v níž se CO2 redukuje na karbonylovou skupinu vázanou na enzym, a methylové větve, v níž se CO2 redukuje na methylovou skupinu vázanou na kofaktor. Bifunkční enzym CO dehydrogenáza/acetyl CoA syntáza (CODH/ACS) provádí jak redukci CO2 na CO, tak syntézu konečného produktu, acetyl CoA, spojením karbonylové a methylové skupiny (např. Hügler a Sievert, 2011). Redukční cesta acetyl CoA je mezi cestami fixace C jedinečná tím, že je lineární; za geochemicky příznivých podmínek, např. v alkalickém prostředí hydrotermálních průduchů, je každý krok exergonický, což znamená, že fixace CO2 může probíhat spontánně (Martin a Russell, 2007). Proto se předpokládá, že tato cesta začala jako geochemická cesta (Russell a Martin, 2004). Navíc vzhledem k tomu, že se jedná o jedinou známou dráhu fixace C, která se vyskytuje jak u bakterií, tak u archeí, existuje domněnka, že reduktivní dráha acetyl CoA je nejstarší dráhou fixace C (Fuchs a Stupperich, 1985), nebo dokonce úplně první biochemickou dráhou, která se na Zemi vyvinula (Peretó a kol., 2004). Velká jednoduchost a nízké energetické náklady naznačují, že anaerobní organismy využívající tuto dráhu mají energetickou výhodu oproti organismům využívajícím jiné dráhy fixace C, jako je například reverzní cyklus kyseliny trikarboxylové.
Reduktivní dráha acetyl CoA se vyskytuje u všech známých acetogenů a metanogenů, stejně jako u několika autotrofních reduktorů sulfátu a anammox bakterií (Schauder et al..), 1989; Drake et al., 2006; Strous et al., 2006; Whitman et al., 2006). Některé metanogeny a autotrofní reduktory síranu využívají tuto dráhu výhradně k biosyntéze, zatímco jiné, včetně acetát-oxidujících reduktorů síranu, acetoklastických metanogenů a syntrofních oxidátorů acetátu, mohou vyrábět energii obrácením dráhy tak, aby se stala oxidační (např. Spormann a Thauer, 1988; Hattori et al., 2005; Liu a Whitman, 2008). Acetogeny, a mezi ně řadím fakultativní acetogeny, jako jsou některé reduktory sulfátu, metanogeny a anaerobní oxidátory acetátu (např., Jansen et al., 1984; Rother a Metcalf, 2004; Hattori et al., 2005; Lessner et al., 2006; Henstra et al., 2007), jsou jedinou známou skupinou, která tuto cestu realizuje jak pro biosyntézu, tak pro produkci energie. Možnou výhodou využití stejné dráhy pro produkci energie a asimilaci biomasy je, že je třeba vytvářet a udržovat menší genomy a méně enzymů. Vzhledem k tomu, že režim hladovění je mezi mikroby v energeticky chudých podpovrchových sedimentech pravděpodobně spíše pravidlem než výjimkou (Jørgensen et al., 2006), může snížení energetických nákladů na udržování genomu a syntézu enzymů poskytnout významnou výhodu mikrobům, kteří jsou schopni provádět produkci energie a biosyntézu stejnou cestou.
Bylo totiž postulováno, že syntéza a udržování enzymů pro opravy DNA z depurinačních reakcí a proteinů z racemizačních reakcí jsou hlavními energetickými výdaji mezi mikroorganismy v režimu přežívání (Price a Sowers, 2004). Zatímco o koncentracích a rychlosti obratu enzymů specifických pro jednotlivé buňky v hlubokém podpovrchovém dně je známo příliš málo na to, aby bylo možné vypočítat energetické náklady na syntézu a udržování těchto enzymů, v podpovrchových sedimentech peruánského okraje a rovníkového Pacifiku byly měřeny koncentrace stavebních kamenů bílkovin, tj. některých aminokyselin (aspartát, glutamát, serin, glycin) (Mitterer, 2006). Ty zde používám k výpočtu energetických nákladů na jejich litoautotrofní syntézu. Bez ohledu na lokalitu lze očekávat vysoké energetické náklady na syntézu všech čtyř aminokyselin (obr. 5). Za předpokladu, že se jedná o obecný trend pro všechny aminokyseliny, lze očekávat, že lithoautotrofní syntéza proteinů, a tedy i enzymů, je v podpovrchových sedimentech energeticky nákladný proces. Klíčovým meziproduktem při syntéze aminokyselin v anaerobních podmínkách je energeticky bohatá molekula acetyl CoA, která je rovněž klíčovým meziproduktem při acetogenezi. Za předpokladu, že acetogeneze z H2-CO2 je spojena s energetickými náklady (obr. 1A), pak obligátní litoautotrofové, včetně mnoha methanogenů a reduktorů sulfátu, kteří syntetizují aminokyseliny z H2 a CO2, budou vynakládat značné množství energie pouze na redukční syntézu acetyl CoA. Naproti tomu většina reakcí organotrofní acetogeneze je exergonická (tabulka 3). Většina acetogenů tedy může být schopna snížit energetické výdaje při syntéze enzymů ve srovnání s obligátně autotrofními organismy tím, že k syntéze prekurzoru aminokyselin acetyl CoA použije organické substráty.
Obrázek 5. Hloubkové profily energetických nákladů litoautotrofní syntézy aminokyselin (A) kyseliny asparagové , (B) kyseliny glutamové , (C) serinu a (D) glycinu (2 HCO3- + NH4+ + 3 H2 + H+ → NH3+CH2COO- + 4 H2O) v místech ODP 1225-31. Všechny výpočty jsou založeny na měřeních získaných ze sedimentárních jader odebraných během etapy ODP 201 (Shipboard Scientific Party, 2003; Mitterer, 2006).
Závěr
Pokud jsou energetické výtěžky na substrát jedinou důležitou proměnnou řídící mikrobiální metabolismus v energeticky chudých podpovrchových sedimentech, pak by acetogenní mikroby měly být vytlačovány jinými anaerobními mikroby, které provádějí energeticky výhodnější cesty, jako je redukce síranů a metanogeneze. I když tomu tak na některých místech může být, nedávné izotopové analýzy δ13C, které naznačují významný podíl acetogenních mikroorganismů na celkovém obratu acetátu, naznačují opak (Heuer et al., 2009; Lever et al., 2010). V této studii se zabývám několika potenciálně výhodnými vlastnostmi acetogenních mikrobů, které jim mohou umožnit koexistenci se sulfátreducenty a metanogeny navzdory nižším energetickým výtěžkům na substrát.
Na základě konzervativních výpočtů ukazuji, že většina acetogenních substrátů se pravděpodobně vyskytuje v koncentracích, které značně převyšují termodynamickou prahovou koncentraci pro acetogenezi, a jsou tedy potenciálními energetickými substráty pro acetogeny v hluboké biosféře. Díky své schopnosti metabolizovat určité substráty prostřednictvím více různých reakcí, např. samotný methanol, methanol + H2 nebo methanol + mravenčan, mají acetogeny ve srovnání se sulfátreduktory a methanogeny pozoruhodnou metabolickou flexibilitu, která jim v některých případech může umožnit získat vyšší energetické výtěžky na substrát než tyto dvě skupiny. Acetogeny mají také větší metabolickou všestrannost, pokud jde o počet a rozsah využívaných substrátů, než sulfátreduktory a metanogeny. V důsledku toho se mohou vyhnout konkurenci prostřednictvím diferenciace niky, tj. tím, že se živí substráty, které většina sulfátových reduktorů nebo metanogenů nevyužívá. Větší šíře substrátů dále znamená, že acetogeny mají přístup k energii z většího celkového počtu substrátů. Spíše než aby se vyvíjely jako vysoce efektivní a specializovaní konzumenti hojných jednotlivých substrátů, jsou tedy acetogeny pravděpodobně substrátovými generalisty se schopností čerpat z velkého fondu méně hojných (vzácných) substrátů.
Další výhoda acetogenního způsobu života může spočívat ve schopnosti acetogenů omezit energii vynakládanou na biosyntézu. Acetogeny využívají reduktivní dráhu acetyl CoA, která je energeticky nejméně nákladná ze všech drah fixace C. Tím, že tuto dráhu využívají jak k produkci energie, tak k biosyntéze, mohou omezit energii, kterou jiné skupiny vynakládají na udržování dalších genů a enzymů. Využití organických sloučenin spíše než H2/CO2 jako výchozích bloků syntézy biomasy může navíc acetogenům umožnit obejít energeticky nákladnou litoautotrofní fixaci C. Vzhledem k vysokým energetickým nákladům na syntézu aminokyselin v hlubokých podpovrchových sedimentech a ke skutečnosti, že syntéza a udržování enzymů pro opravu DNA a proteinů jsou pravděpodobně hlavními energetickými výdaji mikrobů v režimu hladovění, mohou být acetogeny schopny ušetřit rozhodující energii pro přežití díky jednoduchosti a univerzálnosti své biochemické dráhy.
Vzhledem k tomu, že naprostá většina buněk v hlubokých podpovrchových sedimentech je pravděpodobně v režimu hladovění s generační dobou stovek až tisíců let (Biddle et al., 2006; Jørgensen et al., 2006), zůstávají základní otázky týkající se ekologie těchto organismů nezodpovězeny. Jsou nalezené buňky vysoce rekalcitrantní přeživší z povrchového prostředí, nebo se přizpůsobily podmínkám extrémní energetické limitace? Kolonizovali mikrobi aktivně sedimenty dlouho po jejich akumulaci, nebo byli přítomni již od jejich prvotního uložení? Bez ohledu na odpovědi na tyto otázky je pravděpodobné, že schopnost acetogenů využívat široké spektrum substrátů a provádět biosyntézu s nízkými energetickými náklady představují cenné vlastnosti pro přežití v hlubinné biosféře – i když se původně nevyvinuly jako adaptace na toto prostředí.
Prohlášení o střetu zájmů
Autor prohlašuje, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Rád bych poděkoval Bo Barker Jørgensenovi a dalším členům Centra pro geomikrobiologii za konstruktivní diskusi o potenciálním významu acetogeneze v podpovrchových vrstvách a Bente Aa. Lomsteinové za užitečné připomínky týkající se chemie aminokyselin. Tato studie byla podpořena Dánskou národní výzkumnou nadací a Společností Maxe Plancka (granty pro Bo Barker Jørgensen), jakož i vnitroevropským stipendiem Marie Curie uděleným autorovi (# 255135).
Amend, J. P., and Helgeson, H. C. (1997). Výpočet standardních molárních termodynamických vlastností vodných biomolekul při zvýšených teplotách a tlacích. Část 1 L-α-aminokyseliny. J. Chem. Soc. Faraday Trans. 93, 1927-1941.
CrossRef Full Text
Amend, J. P., and Plyasunov, A. V. (2001). Sacharidy v termofilním metabolismu: výpočet standardních molárních termodynamických vlastností vodných pentóz a hexóz při zvýšených teplotách a tlacích. Geochim. Cosmochim. Acta 65, 3901-3917.
CrossRef Full Text
Amend, J. P., and Shock, E. L. (2001). Energetika celkových metabolických reakcí termofilních a hypertermofilních archeí a bakterií. FEMS Microbiol. Rev. 25, 175-243.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ansbaek, J., and Blackburn, T. H. (1979). Metoda analýzy obratu acetátů v pobřežním mořském sedimentu. Microb. Ecol. 5, 253-264.
CrossRef Full Text
Avery, G. B., Shannon, R. D., White, J. R., Martens, C. S., and Alperin, M. J. (2002). Controls on methane production in a tidal freshwater estuary and a peatland: methane production via acetate fermentation and CO2 reduction (Řízení produkce metanu v přílivovém sladkovodním ústí a rašeliništi: produkce metanu prostřednictvím acetátové fermentace a redukce CO2). Biogeochemistry 62, 19-37.
CrossRef Full Text
Ballschmiter, K. (2003). Vzor a zdroje přirozeně vznikajících organohalogenů v mořském prostředí: biogenní tvorba organohalogenů. Chemosphere 52, 313-324.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Berg, I., Kockelkorn, D., Ramos-Vera, H. G., Say, R. F., Zarzycki, J., Hügler, M., Alber, B. E., and Fuchs, G. (2010). Autotrofní fixace uhlíku u archeí. Nat. Rev. Microbiol. 10, 1-14.
CrossRef Full Text
Biddle, J. F., Lipp, J. S., Lever, M. A., Lloyd, K. G., Sørensen, K. B., Anderson, R., Fredricks, H. F., Elvert, M., Kelly, T. J., Schrag, D. P., Sogin, M. L., Brenchley, J. E., Teske, A., House, C. H. a Hinrichs, K.-U. (2006). Heterotrofní archea dominují v sedimentárních podpovrchových ekosystémech u Peru. Proc. Natl. Acad. Sci. U.S.A. 103, 3846-3851.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Canfield, D. E., Jørgensen, B. B., Fossing, H., Glud, R., Gundersen, J., Ramsing, N. B., Thamdrup, B., Hansen, J. W., Nielsen, L. P., and Hall, P. O. J. (1993). Pathways of organic carbon oxidation in three continental margin sediments (Cesty oxidace organického uhlíku ve třech sedimentech kontinentálního okraje). Mar. Geol. 113, 27-40.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Capone, D. G., and Kiene, R. P. (1988). Srovnání mikrobiální dynamiky v mořských a sladkovodních sedimentech: kontrasty v anaerobním katabolismu uhlíku. Limnol. Oceanogr. 33, 725-749.
CrossRef Full Text
Cappenberg, T. E. (1974). Vzájemné vztahy mezi bakteriemi redukujícími sírany a bakteriemi produkujícími metan v usazeninách na dně sladkovodního jezera. 2. Inhibiční experimenty. Antonie Van Leeuwenhoek 56, 1247-1258.
Chapelle, F. H., and Bradley, P. M. (2007). Hydrologický význam koncentrací oxidu uhelnatého v podzemní vodě. Ground Water 45, 272-280.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chidhaisong, A., Rosenstock, B., and Conrad, R. (1999). Měření monosacharidů a konverze glukózy na acetát v anoxické půdě rýžového pole. Appl. Environ. Microbiol. 65, 2350-2355.
Pubmed Abstract | Pubmed Full Text
Cord-Ruwisch, R., Seitz, H.-J., and Conrad, R. (1988). Schopnost hydrogenotrofních anaerobních bakterií soutěžit o stopy vodíku závisí na redoxním potenciálu koncového akceptoru elektronů. Arch. Microbiol. 149, 350-357.
CrossRef Full Text
Dalla-Betta, P., and Schulte, M. (2009). Výpočet vodných termodynamických vlastností meziproduktů a prekurzorů cyklu kyseliny citronové a odhad parametrů stavové rovnice při vysoké teplotě a tlaku. Int. J. Mol. Sci. 10, 2809-2837.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dhillon, A., Lever, M., Lloyd, K. G., Albert, D. B., Sogin, M. L., and Teske, A. (2005). Methanogen diversity evidenced by molecular characterization of methyl coenzyme M reductase (mcrA) genes in hydrothermal sediments of the Guaymas Basin. Appl. Environ. Microbiol. 71, 4592-4601.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
D’Hondt, S., Jørgensen, B. B., Miller, D. J., Batzke, A., Blake, R., Cragg, B. A., Cypionka, H., Dickens, G. R., Ferdelman, T., Hinrichs, K.-U., Holm, N. G., Mitterer, R., Spivack, A., Wang, G., Bekins, B., Engelen, B., Ford, K., Gettemy, G., Rutherford, S. D., Sass, H., Skilbeck, C. G., Aiello, I. W., Guèrin, G., House, C. H., Inagaki, F., Meister, P., Naehr, T., Niitsuma, S., Parkes, R. J., Schippers, A., Smith, D. C., Teske, A., Wiegel, J., Padilla, C. N., and Acosta, J. L. S. (2004). Distribuce mikrobiálních aktivit v hlubokých podpovrchových sedimentech. Science 306, 2216-2221.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
D’Hondt, S., Spivack, A. J., Pockalny, R., Ferdelman, T. G., Fischer, J. P., Kallmeyer, J., Abrams, L. J., Smith, D. C., Graham, D., Hasiuk, F., Schrum, H. a Stancin, A. M. (2009). Podpovrchový sedimentární život v jihopacifickém gyru. Proc. Nat. Acad. Sci. U.S.A. 106, 11651-11656.
Dolfing, J., Larter, S. R., and Head, I. M. (2008). Thermodynamic constraints on methanogenic crude oil biodegradation (Termodynamická omezení metanogenní biodegradace ropy). ISME J. 2, 442-452.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Drake, H. L., Küsel, K., and Matthies, C. (2006). „Acetogenic prokaryotes,“ in The Prokaryotes: An Evolving Electronic Resource for the Microbiological Community, eds M. Dworkin, S. Falkow, E. Rosenberg, K.-H. Schleifer, and E. Stackebrandt (New York: Springer), 354-420.
Dykhuizen, D., and Davies, M. (1980). Experimentální model: bakteriální specialisté a generalisté soupeřící v chemostatech. Ecology 61, 1213-1227.
CrossRef Full Text
Edenborn, H. M., and Litchfield, C. D. (1987). Obrat glykolátů ve vodním sloupci vrcholové části New York Bight. Mar. Biol. 95, 459-467.
CrossRef Full Text
Egli, T. (1995). Ekologický a fyziologický význam růstu heterotrofních mikroorganismů se směsí substrátů. Adv. microb. Ecol. 14, 305-386.
Egli, T., Lendenmann, U., and Snozzi, M. (1993). Kinetika mikrobiálního růstu se směsmi zdrojů uhlíku. Antonie Van Leeuwenhoek 63, 289-298.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Emlen, J. M. (1966). The role of time and energy in food preference (Úloha času a energie v preferenci potravy). Am. Nat. 100, 611-617.
CrossRef Full Text
Expedice 329 vědců. (2011). „South Pacific Gyre subseafloor life,“ in Proceedings of Integrated Ocean Drilling Program, (College Station, TX: IODP), 1-108.
Ferry, J. G. (2010). CO v metanogenezi. Ann. Microbiol. 60, 1-12.
CrossRef Full Text
Ferry, J. G., and Lessner, D. J. (2008). Methanogeneze v mořských sedimentech. Ann. N. Y. Acad. Sci. 1125, 147-157.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Finke, N., Vandieken, V., and Jørgensen, B. B. (2006). Acetát, laktát, propionát a isobutyrát jako donory elektronů pro redukci železa a síranů v arktických mořských sedimentech, Svalbard. FEMS Microbiol. Ecol. 59, 10-22.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franklin, M. J., Wiebe, W. J., and Whitman, W. B. (1988). Populace metanogenních bakterií ve slaném močálu v Georgii. Appl. environ. Microbiol. 54, 1151-1157.
Pubmed Abstract | Pubmed Full Text
Froelich, P. N., Klinkhammer, G. P., Bender, M. L., Luedtke, N. A., Heath, G. R., Cullen, D., Dauphin, P., Hammond, D., Hartman, B., and Maynard, V. (1979). Early oxidation of organic matter in pelagic sediments of the eastern equatorial Atlantic: suboxic diagenesis (Raná oxidace organické hmoty v pelagických sedimentech východního rovníkového Atlantiku: suboxická diageneze). Geochim. Cosmochim. Acta 43, 1075-1090.
CrossRef Full Text
Fuchs, G., and Stupperich, E. (1985). „Evolution of autotrophic CO2 fixation,“ in Evolution of Prokaryotes, eds K. H. Schleifer, and E. Stackebrandt (London: Academic Press), 235-251. .
Fuhrman, J. A., and Ferguson, R. L. (1986). Nanomolární koncentrace a rychlý obrat rozpuštěných volných aminokyselin v mořské vodě: shoda mezi chemickými a mikrobiologickými měřeními. Mar. Ecol. Prog. Ser. 33, 237-242.
CrossRef Full Text
Gottschal, J. S., de Vries, S., and Kuenen, J. G. (1979). Konkurence mezi fakultativně chemolitotrofním Thiobacillus A2 a obligátně chemolitotrofním Thiobacillus a heterotrofním Spirillum o anorganické a organické substráty. Arch. Microbiol. 121, 241-249.
CrossRef Full Text
Griebler, C., and Lueders, T. (2008). Mikrobiální diverzita v ekosystémech podzemních vod. Freshw. Biol. 54, 649-677.
CrossRef Full Text
Harder, J. (1997). Druhově nezávislá udržovací energie a přirozená velikost populací. FEMS Microbiol. Ecol. 23, 39-44.
CrossRef Full Text
Hattori, S., Galushko, A. S., Kamagata, Y., and Schink, B. (2005). Fungování dráhy CO dehydrogenáza/acetylkoenzym A při oxidaci acetátu i tvorbě acetátu syntroficky acetát oxidující bakterií Thermoacetogenium phaeum. J. Bacteriol. 187, 3471-3476.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Heimann, A., Jakobsen, R., and Blodau, C. (2010). Energetická omezení H2-dependentních terminálních procesů přijímání elektronů v anoxických prostředích: přehled pozorování a modelových přístupů. Environ. Sci. Technol. 44, 24-33.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Henstra, A. M., Dijkema, C., and Stams, A. J. M. (2007). Archaeoglobus fulgidus spojuje oxidaci CO s redukcí sulfátu a acetogenezí s přechodnou akumulací mravenčanu. Environ. Microbiol. 9, 1836-1841.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Heuer, V., Elvert, M., Tille, S., Krummen, M., Prieto Mollar, X., Hmelo, L. R., and Hinrichs, K.-U. (2006). Online analýza δ13C těkavých mastných kyselin v systémech sediment/voda pomocí kapalinové chromatografie s poměrem izotopů a hmotnostní spektrometrie. Limnol. Oceanogr. Methods 4, 346-357.
CrossRef Full Text
Heuer, V. B., Pohlman, J. W., Torres, M. E., Elvert, M., and Hinrichs, K.-U. (2009). Stabilní izotopová biogeochemie acetátu a dalších druhů rozpuštěného uhlíku v hlubokých podpovrchových sedimentech na severním okraji Kaskádie. Geochim. Cosmochim. Acta 73, 3323-3336.
CrossRef Full Text
Hoehler, T. M. (2004). Biologické energetické požadavky jako kvantitativní okrajové podmínky pro život v podzemí. Geobiology 2, 205-215.
CrossRef Full Text
Hoehler, T. M., Albert, D. B., Alperin, M. J., and Martens, C. S. (1999). Acetogeneze z CO2 v anoxickém mořském sedimentu. Limnol. Oceanogr. 44, 662-667.
CrossRef Full Text
Hoehler, T. M., Alperin, M. J., Albert, D. B., and Martens, C. S. (1998). Termodynamická kontrola koncentrací vodíku v anoxických sedimentech. Geochim. Cosmochim. Acta 62, 1745-1756.
CrossRef Full Text
Hoehler, T. M., Alperin, M. J., Albert, D. B., and Martens, C. S. (2001). Zdánlivé minimální požadavky na volnou energii metanogenních archeí a sulfát redukujících bakterií v anoxickém mořském sedimentu. FEMS Microbiol. Ecol. 38, 33-41.
CrossRef Full Text
Hügler, M., and Sievert, S. M. (2011). Za hranice Calvinova cyklu: autotrofní fixace uhlíku v oceánu. Ann. Rev. Mar. Sci. 3, 261-289.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jansen, K., Thauer, R. K., Widdel, F., and Fuchs, G. (1984). Dráhy asimilace uhlíku u sulfát redukujících bakterií. Asimilace mravenčanu, oxidu uhličitého, oxidu uhelnatého a acetátu bakterií Desulfovibrio baarsii. Arch. Microbiol. 138, 257-262.
CrossRef Full Text
Jetten, M. S. M., Stams, A. J. M., and Zehnder, A. J. B. (1992). Methanogenesis from acetate: a comparison of the acetate metabolism in Methanothrix soehngenii and Methanosarcina spp. FEMS Microbiol. Rev. 88, 181-198.
CrossRef Full Text
Jiang, N., Wang, Y., and Dong, X. (2010). Metanol jako primární metanogenní a acetogenní prekurzor v chladném mokřadu Zoige na Tibetské náhorní plošině. Microb. Ecol. 60, 206-213.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jørgensen, B. B., D’Hondt, S. L., and Miller, D. J. (2006). „Leg 201 synthesis: controls on microbial communities in deeply buried sediments,“ in Proceedings Ocean Drilling Program Science Results, eds B. B. Jørgensen, S. L. D’Hondt, and D. J. Miller (College Station, TX: ODP), 201, 1-45.
Kaiser, J.-P., and Hanselmann, K. W. (1982). Fermentativní metabolismus substituovaných monoaromatických sloučenin bakteriálním společenstvím z anaerobních sedimentů. Arch. Microbiol. 133, 185-194.
CrossRef Full Text
Karita, S., Nakayama, K., Goto, M., Sakka, K., Kim, W.-J., and Ogawa, S. (2003). Nová celulolytická, anaerobní a termofilní bakterie Moorella sp. kmen F21. Biosci. Biotechnol. Biochem. 67, 183-185.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Keppler, F., Eiden, R., Niedan, V., Pracht, J., and Schöler, H. F. (2000). Polouhlovodíky vznikající přirozenými oxidačními procesy během rozkladu organických látek. Nature 203, 298-301.
CrossRef Full Text
King, G. M. (1988). Dehalogenace v mořských sedimentech obsahujících přírodní zdroje halogenolů. Appl. Environ. Microbiol. 54, 3079-3085.
Pubmed Abstract | Pubmed Full Text
King, G. M. (2007). Spotřeba oxidu uhelnatého v sedimentech slaných bažin. FEMS Microbiol. Ecol. 59, 2-9.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
King, G. M., Klug, M. J., and Lovley, D. R. (1982). Metabolismus glukózy v sedimentech eutrofního jezera: stopová analýza příjmu a tvorby produktů. Appl. Environ. Microbiol. 44, 1308-1317.
Pubmed Abstract | Pubmed Full Text
King, G. M., Klug, M. J., and Lovley, D. R. (1983). Metabolismus acetátu, metanolu a metylovaných aminů v mezipřílivových sedimentech zátoky Lowes Cove v Maine. Appl. Environ. Microbiol. 45, 1848-1853.
Pubmed Abstract | Pubmed Full Text
Kuenen, J. G. (1983). „The role of specialists and generalists in microbial population interactions,“ chapter 10 in Foundations of Biochemical Engineering, eds H. W. Blanch, E. T. Papoutsakis, and G. Stephanopoulos (Washington, DC: ACS Publications), 229-251.
Küsel, K., Pinkart, H. C., Drake, H., and Devereux, R. (1999). Acetogenní a sulfát redukující bakterie osídlující rhizoplane a hluboké buňky kůry mořské trávy Halodule wrightii. Appl. Environ. Microbiol. 65, 5117-5123.
Pubmed Abstract | Pubmed Full Text
Lessner, D. J., Li, L., Li, Q., Rejtar, T., Andreev, V. P., Reichlen, M., Hill, K., Moran, J. J., Karger, B. L., and Ferry, J. G. (2006). Netradiční cesta redukce CO2 na metan u Methanosarcina acetivorans pěstovaného na CO odhalená pomocí proteomiky. Proc. Natl. Acad. Sci. U.S.A. 103, 17921-17926.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lever, M. A., Heuer, V. B., Morono, Y., Masui, N., Schmidt, F., Alperin, M. J., Inagaki, F., Hinrichs, K.-U., and Teske, A. (2010). Acetogeneze v hlubokých podpovrchových sedimentech křídla hřbetu Juan de Fuca: syntéza geochemických, termodynamických a genových důkazů. Geomicrobiol. J. 27, 183-211.
CrossRef Full Text
Lin, Y. S., Heuer, V. B., Ferdelman, T. G., and Hinrichs, K.-U. (2010). Mikrobiální přeměna anorganického uhlíku na dimethylsulfid v anoxickém jezerním sedimentu (Plußsee, Německo). Biogeosciences 7, 2433-2444.
CrossRef Full Text
Lin, Y. S., Heuer, V. B., Goldhammer, T., Kellermann, M. Y., Zabel, M., and Hinrichs, K.-U. (2011). Towards constraining H2 concentration in subseafloor sediment: a proposal for combined analysis by two distinct approaches. Geochim. Cosmochim. Acta 77, 186-201.
CrossRef Full Text
Liu, F., and Conrad, R. (2011). Chemolitotrofní acetogenní využití H2/CO2 v půdě italských rýžových polí. ISME J. 5, 1526-1539.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Liu, S., and Suflita, J. M. (1993). H2-CO2-dependentní anaerobní O-demetylační aktivita v podpovrchových sedimentech a izolovanou bakterií. Appl. Environ. Microbiol. 59, 1325-1331.
Pubmed Abstract | Pubmed Full Text
Liu, Y., and Whitman, W. B. (2008). Metabolická, fylogenetická a ekologická rozmanitost metanogenních archeí. Ann. N. Y. Acad. Sci. 1125, 171-189.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lorenson, T. D., Colwell, F. S., Delwiche, M., and Dougherty, J. A. (2006). „17. Data report: acetate and hydrogen concentrations in pore fluids associated with a large gas hydrate reservoir, southern hydrate ridge, offshore Oregon, USA,“ in Proceedings of Ocean Drilling Program Scientific Results 204, eds A. M. Tréhu, G. Bohrmann, M. E. Torres, and F. S. Colwell (College Station, TX: IODP), 1-20.
Lovley, D. R., a Goodwin, S. (1988). Koncentrace vodíku jako indikátor terminálních reakcí přijímajících elektrony ve vodních sedimentech. Geochim. Cosmochim. Acta 52, 2993-3003.
CrossRef Full Text
Martens, C. S. (1990). Generace aniontů organických kyselin s krátkým řetězcem v hydrotermálně pozměněných sedimentech pánve Guaymas, Kalifornský záliv. Appl. Geochem. 5, 71-76.
CrossRef Full Text
Martin, W., and Russell, M. J. (2007). O původu biochemie v alkalickém hydrotermálním průduchu. Philos. Trans. R. Soc. Lond. B Biol. Sci. 362, 1887-1925.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Meyer-Reil, L.-A. (1978). Příjem glukózy bakteriemi v sedimentu. Mar. Biol. 44, 293-298.
CrossRef Full Text
Millero, F. J., and Schreiber, D. R. (1982). Použití modelu párování iontů k odhadu koeficientů aktivity iontových složek přírodních vod. Am. J. Sci. 282, 1508-1540.
CrossRef Full Text
Mitterer, R. M. (2006). „12. Datová zpráva: D/L ratios and concentrations of selected amino acids in interstitial waters, Equatorial Pacific and Peru Margin, ODP Leg 201,“ in Controls on Microbial Communities in Deeply Buried Sediments, Eastern Equatorial Pacific and Peru Margin Sites, eds B. B. Jørgensen, S. L. D’Hondt, and D. J. Miller (College Station, TX: ODP), 1-7.
Mitterer, R. M., Malone, M. J., Goodfriend, G. A., Swart, P. K., Wortmann, U. G., Logan, G. A., Feary, D. A., and Hine, A. C. (2001). Společná tvorba sirovodíku a metanu v mořských karbonátových sedimentech. Geophys. Res. Lett. 28, 3931-3934.
CrossRef Full Text
Mörsdorf, G., Frunzke, K., Gadkari, D., and Meyer, O. (1992). Mikrobiální růst na oxidu uhelnatém. Biodegradation 3, 61-82.
Oelkers, E. H., Helgeson, H. C., Shock, E. L., Sverjensky, D. A., Johnson, J. W., and Pokrovskii, V. A. (1995). Summary of the apparent standard molal Gibbs free energies of formation of aqeous species, minerals, and gases at pressures 1 to 5000 bar and temperatures 5 to 1000°C (Souhrn zdánlivých standardních molálních Gibbsových volných energií tvorby vodných druhů, minerálů a plynů při tlaku 1 až 5000 barů a teplotě 5 až 1000 °C). J. Phys. Chem. Ref. Data 24, 1401-1560.
CrossRef Full Text
Parkes, R. J., Gibson, G. R., Mueller-Harvey, I., Buckingham, W. J., and Herbert, R. A. (1989). Stanovení substrátů pro bakterie redukující sírany v mořských a ústních sedimentech s různou rychlostí redukce síranů. J. Gen. Microbiol. 135, 175-187.
Pedersen, K., Arlinger, J., Eriksson, S., Hallbeck, A., Hallbeck, L., and Johansson, J. (2008). Počty, biomasa a kultivační diverzita mikrobiálních populací v závislosti na hloubce a specifických podmínkách vrtu v podzemní vodě z hloubek 4-450 m v Olkiluoto ve Finsku. ISME J. 2, 760-775.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Peretó, J., Lopez-Garcia, P., and Moreira, D. (2004). Ancestrální biosyntéza lipidů a raná evoluce membrán. Trends Biochem. Sci. 29, 469-477.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Phelps, T. J., and Zeikus, J. G. (1984). Vliv pH na terminální metabolismus uhlíku v anoxických sedimentech mírně kyselého jezera. Appl. Environ. Microbiol. 48, 1088-1095.
Pubmed Abstract | Pubmed Full Text
Pianka, E. R. (1994). Evolutionary Ecology, 5th Edn. New York: HarperCollins College Publishers, 486.
Pilson, M. E. Q. (1998). Úvod do chemie moře. Upper Saddle River, NJ: Prentice-Hall, Inc.
Price, P. B., and Sowers, T. (2004). Temperature dependence of metabolic rates for microbial growth, maintenance, and survival [Závislost rychlosti metabolismu mikrobů na teplotě, udržování a přežití]. Proc. Natl. Acad. Sci. U.S.A. 101, 4631-4636.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Rabus, R., Hansen, T. A., and Widdel, F. (2006). „Dissimilatory sulfate- and sulfur- reducing prokaryotes“, in The Prokaryotes: An Evolving Electronic Resource for the Microbiological Community, eds M. Dworkin, S. Falkow, E. Rosenberg, K.-H. Schleifer, and E. Stackebrandt (New York: Springer), 659-768.
Rother, M., and Metcalf, W. W. (2004). Anaerobní růst Methanosarcina acetivorans C2A na oxidu uhelnatém: neobvyklý způsob života methanogenního archeonu. Proc. Natl. Acad. Sci. U.S.A. 101, 16929-16934.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Russell, M. J., and Martin, W. (2004). Skalní kořeny dráhy acetyl-CoA. Trends Biochem. Sci. 29, 358-363.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schauder, R., Preuß, A., Jetten, M., and Fuchs, G. (1989). Oxidační a redukční dráha acetyl CoA/dehydrogenázy oxidu uhelnatého u Desulfobacterium autotrophicum. Arch. Microbiol. 151, 84-89.
CrossRef Full Text
Shipboard Scientific Party. (2003). „Controls on microbial communities in deeply buried sediments, Eastern Equatorial Pacific and Peru Margin sites 1225-1231,“ in Proceedings Of Ocean Drilling Program Initial Reports. 201, eds S. L. D’Hondt, B. B. Jørgensen, D. J. Miller, . (College Station, TX: ODP). Dostupné na adrese: http://www-odp.tamu.edu/publications/201_IR/201ir.htm
Shock, E. L. (1995). Organické kyseliny v hydrotermálních roztocích: standardní molární termodynamické vlastnosti karboxylových kyselin a odhady disociačních konstant při vysokých teplotách a tlacích. Am. J. Sci. 295, 496-580.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Shock, E. L., and Helgeson, H. C. (1988). Calculation of the thermodynamic and transport-properties of aqueous species at high-pressures and temperatures-correlation algorithms for ionic species and equation of state predictions to 5-kb and 1000°C. Geochim. Cosmochim. Acta 52, 2009-2036.
CrossRef Full Text
Shock, E. L., and Helgeson, H. C. (1990). Výpočet termodynamických a transportních vlastností vodných druhů při vysokých tlacích a teplotách: standardní parciální molární vlastnosti organických druhů. Geochim. Cosmochim. Acta 54, 915-945.
CrossRef Full Text
Shock, E. L., Sassani, D. C., Willis, M., and Sverjensky, D. A. (1997). Anorganické druhy v geologických tekutinách: korelace mezi standardními molárními termodynamickými vlastnostmi vodných iontů a hydroxidových komplexů. Geochim. Cosmochim. Acta 61, 907-950.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Smith, R. L., and Oremland, R. S. (1983). Anaerobní rozklad šťavelanů: rozšířený přirozený výskyt ve vodních sedimentech. Appl. environ. Microbiol. 46, 106-113.
Pubmed Abstract | Pubmed Full Text
Smith, R. L., Strohmaier, F. E., and Oremland, R. S. (1985). Isolation of anaerobic oxalate-degrading bacteria from freshwater lake sediments [Izolace anaerobních bakterií rozkládajících oxalát ze sladkovodních jezerních sedimentů]. Arch. Microbiol. 141, 8-13.
CrossRef Full Text
Sørensen, J., Christensen, D., and Jørgensen, B. B. (1981). Těkavé mastné kyseliny a hydrogeny jako substráty pro sulfát redukující bakterie v anaerobním mořském sedimentu. Appl. Environ. Microbiol. 42, 5-90.
Pubmed Abstract | Pubmed Full Text
Spormann, A. M., and Thauer, R. K. (1988). Anaerobní oxidace acetátu na CO2 pomocí Desulfotomaculum acetoxidans. Arch. Microbiol. 150, 374-380.
CrossRef Full Text
Stolper, D. A., Revsbech, N. P., and Canfield, D. E. (2010). Aerobní růst při nanomolárních koncentracích kyslíku. Proc. Nat. Acad. Sci. U.S.A. 107, 18755-18760.
CrossRef Full Text
Strous, M., Pelletier, E., Mangenot, S., Rattei, T., Lehner, A., Taylor, M. W., Horn, M., Daims, H., Bartol-Mavel, D., Wincker, P., Barbe, V., Fonknechten, N., Vallenet, D., Segurens, B., Schenowitz-Truong, C., Médigue, C., Collingro, A., Snel, B., Dutilh, B. E., Op den Camp, H. J. M., van der Drift, C., Cirpus, I., van de Pas- Schoonen, K. T., Harhangi, H. R., van Niftrik, L., Schmid, M., Keltjens, J., van de Vossenberg, J., Kartal, B., Meier, H., Frishman, D., Huynen, M. A., Mewes, H.-W., Weissenbach, J., Jetten, M. S. M., Wagner, M., and Le Paslier, D. (2006). Dešifrování evoluce a metabolismu anammoxové bakterie z genomu společenstva. Nature 440, 790-794.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stumm, W., and Morgan, J. J. (1981). Aquatic Chemistry (Chemie vodních organismů). An Introduction Emphasizing Chemical Equilibria in Natural Waters, 3rd Edn. New York: John Wiley & Sons, 1022.
Takai, K., Nakamura, K., Toki, T., Tsunogai, U., Miyazaki, M., Miyazaki, J., Hirayama, H., Nakagawa, S., Nunoura, T., and Horikoshi, K. (2008). Buněčná proliferace při 122 °C a produkce izotopicky těžkého CH4 hypertermofilním metanogenem při vysokotlaké kultivaci. Proc. Natl. Acad. Sci. U.S.A. 105, 10949-10954.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tewari, Y. B., Lang, B. E., Decker, S. R., and Goldberg, R. N. (2008). Thermodynamics of the hydrolysis reactions of 1,4-β-D-xylobiose, 1,4-β-D-xylotriose, D-cellobiose, and D-maltose. J. Chem. Thermodyn. 40, 1517-1526.
CrossRef Full Text
Tijhuis, L., van Loosdrecht, M. C. M., and Heijnen, J. J. (1993). Termodynamicky založená korelace pro udržovací Gibbsovy energetické požadavky při aerobním a anaerobním mikrobiálním růstu. Biotechnol. Bioeng. 42, 509-519.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Valentine, D. L. (2001). „Thermodynamic ecology of hydrogen-based syntrophy,“ in Cellular Origin, Life in Extreme Habitats and Astrobiology, Chap. 192. NewYork: Springer.
Wagman, D. D., Evans, W. H., Parker, V. B., Schumm, R. H., Halow, I., Bailey, S. M., Churney, K. L., and Nuttall, R. L. (1982). The NBS tables of chemical thermodynamic properties: selected values for anorganic and C1 and C2 organic substances in SI units (Tabulky chemických termodynamických vlastností NBS: vybrané hodnoty pro anorganické a organické látky C1 a C2 v jednotkách SI). J. Phys. Chem. Ref. Data 11, 392.
Wang, G. Z., Spivack, A. J., Rutherford, S., Manor, U., and D’Hondt, S. (2008). Quantification of co-occurring reaction rates in deep subseafloor sediments [Kvantifikace rychlosti souběžných reakcí v hlubokých podpovrchových sedimentech]. Geochim. Cosmochim. Acta 72, 3479-3488.
CrossRef Full Text
Whitman, W. B., Bowen, T. L., and Boone, D. R. (2006). „The methanogenic bacteria,“ in The Prokaryotes: An Evolving Electronic Resource for the Microbiological Community, eds M. Dworkin, S. Falkow, E. Rosenberg, K. H. Schleifer, and E. Stackebrandt (New York: Springer), 165-207.
Whitman, W. B., Coleman, D. C., and Wiebe, W. J. (1998). Prokaryota: neviditelná většina. Proc. Nat. Acad. Sci. U.S.A. 95, 6578-6583.
CrossRef Full Text
Wolin, M. J., and Miller, T. L. (1994). „Acetogeneze z CO2 v ekosystému lidského tlustého střeva,“ in Acetogenesis, ed. H. L. Drake (New York: Chapman and Hall), 365-385.
Wolin, M. J., Miller, T. L., Collins, M. D., and Lawson, P. A. (2003). Formátově závislý růst a homoacetogenní fermentace bakterií z lidských výkalů: popis Bryantella formatexigens gen. nov., sp. nov. Appl. Environ. Microbiol. 69, 6321-6326.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhilina, T. N., and Zavarzin, G. A. (1990). Extrémně halofilní, metylotrofní, anaerobní bakterie. FEMS Microbiol. Lett. 87, 315-321.
CrossRef Full Text
.