- Introduction
- Materiály a metody
- Materiály a chemikálie
- Příprava buněčných linií
- Příprava zebřiček
- Testy buněčné životaschopnosti a morfologická pozorování
- Apoptóza byla analyzována pomocí barvení DAPI a průtokové cytometrie
- Xenograft Animal Assay
- Analýza PCR v reálném čase (qPCR)
- Western Blot (WB) analýza
- Statistická analýza
- Výsledky
- Antiproliferační účinek TF
- Proapoptotický účinek TF
- In vivo účinek TF na Xenograft zebřičky
- Molekulární působení TF na exprese mRNA v buňkách A375
- Molekulární působení TB na expresi proteinů v buňkách A375
- Diskuse
- Závěr
- Potvrzení o dostupnosti údajů
- Etické prohlášení
- Příspěvek autora
- Financování
- Konflikt zájmů
- Zkratky
Introduction
Melanom je smrtelný typ rakoviny kůže s vysokým metastatickým potenciálem a obtížnou léčitelností (Yang et al., 2018). Pacienti s melanomem v pokročilých stadiích jsou vždy neresekabilní a mají horší prognózu (Leonardi et al., 2018). Chemoterapie je základem klinické léčby melanomu, ale účinnost chemoterapeutik je omezená kvůli jejich vedlejším účinkům na zdravé tkáně (Oliveira Pinho et al., 2019). V poslední době bylo vyvinuto několik imunoterapeutik, včetně inhibitorů receptorů CTLA-4 nebo PD-1, jako nové možnosti léčby melanomu, ale jejich účinnost je nespolehlivá a jejich vedlejší účinky jsou stále nezanedbatelné (Rodríguez-Cerdeira et al., 2017). Proto jsou naléhavě zapotřebí nové strategie s uspokojivou účinností a bezpečností. Tradiční čínská medicína (TČM) je doplňkovým přístupem a klinicky se používá již tisíce let, přičemž má určitou účinnost a méně vedlejších účinků. Podle teorie TCM je rakovina spojena s hromaděním hlenu, toxinů nebo zánětu v těle a bylinky působící proti hlenu, toxinům nebo zánětu mohou mít protirakovinné účinky (Wang a Cheng, 2019). Tato teorie byla podpořena mnoha případy. Například kurkumin v Rhizoma Curcumae longae působil cytotoxicky indukcí apoptózy a inhibicí angiogeneze melanomových buněk (Mirzaei et al., 2016) a vitexin ve Vitex negundo potlačoval růst melanomových buněk indukcí poškození DNA a zvýšením hladiny ROS (Liu et al., 2018). Bylinné složky TCM mají proto velký potenciál pro léčbu rakoviny, jako je melanom.
Čaj je jedním z nejrozšířenějších nápojů na světě. Je známý nejen díky svérázné chuti, ale také díky prospěšnosti pro zdraví. Vzhledem k rozdílnosti procesů se čaj dělí na tři hlavní druhy, mezi něž patří nefermentovaný zelený čaj, částečně fermentovaný čaj oolong a plně fermentovaný černý čaj neboli čaj pu-erh (Kuo et al., 2005). Čajové lístky byly charakterizovány jako bylina TCM s protihlenovými a protitoxickými vlastnostmi, což naznačuje jejich protirakovinný potenciál. Moderní studie uvádějí, že čajový nápoj je účinný v prevenci a léčbě rakoviny (Jin et al., 2018). Nedávno bylo zjištěno, že protirakovinnou aktivitu mají čajové polyfenoly, které mají lepší účinek než čajový nápoj (Mao et al., 2019). Theaflavin (TF) je takovou polyfenolovou složkou, která vzniká oxidací katechinů čajových lístků během fermentace a působí jako hlavní pigment pro barvu, chuť a bioaktivitu čaje (Roberts et al., 1957). Je schopen indukovat apoptózu u řady nádorových buněčných linií, jako jsou buněčné linie lidského karcinomu prsu (MCF-7, MDA-MB-231, T47D a ZR-75-1), buněčné linie karcinomu tlustého střeva (HCT-15 a HT-29) a buněčné linie karcinomu jater (HCCLM3 a Huh-7), což svědčí o jeho protinádorovém potenciálu (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Nicméně jejímu účinku vůči melanomu byla dosud věnována jen malá pozornost.
Vzhledem k uváděným proapoptotickým účinkům TF na mnoho nádorových buněčných linií (Lahiry et al., 2008) jsme předložili hypotézu, že TF působí proapoptoticky na melanomové buňky. K ověření tohoto tvrzení byly provedeny experimenty in vitro s cílem vyhodnotit cytotoxický proapoptotický účinek TF na lidské melanomové buňky a experiment in vivo s využitím modelu xenograftů na larvách zebřiček ke stanovení jejího nádorově inhibičního účinku. Kromě toho byl také zkoumán mechanismus působení TF.
Materiály a metody
Materiály a chemikálie
Theaflavin (TF, >95% čistoty) byl poskytnut společností Theabio Co, Ltd (Hangzhou, Čína) (číslo šarže: 20181211061). Dulbeccovo modifikované Eagleovo médium (DMEM) obsahující vysoký obsah glukózy (4,5 g/l) bylo získáno od společnosti HyClone Laboratories (UT, USA). Fetální hovězí sérum (FBS) bylo získáno od společnosti Cell Max (Peking, Čína). Trypsin (0,25 %) byl získán od společnosti Gibco (NY, USA). 3-(4,5-dimethylthiazol-2-yl)-2,5-difenyltetrazolium bromid (MTT) a dimethyl sulfoxid (DMSO) byly získány od firmy Sigma (St. Louis, MO, USA). Annexin-V: Souprava pro detekci apoptózy FITC byla získána od společnosti BD Biosciences (CA, USA). Roztok pro barvení 4′-6-diamidino-2-fenylindolem (DAPI) byl získán od společnosti Thermo Fisher Scientific (MA, USA). Primární protilátky byly získány od společnosti Cell Signaling Technology (MA, USA). Reagencie Trizol a souprava pro polymerázovou řetězovou reakci v reálném čase (real time PCR) byly získány od společnosti TaKaRa (Dalian, Čína).
Příprava buněčných linií
Lidské kožní fibroblasty HFF-1 a melanomová buněčná linie A375 byly získány od Shanghai Cell Bank of Chinese Academy of Sciences (Šanghaj, Čína) a lidská melanomová buněčná linie A875 byla získána od Kunming Cell Bank of Chinese Academy of Sciences (Kunming, Čína). Tyto buněčné linie byly kultivovány v médiu DMEM obsahujícím 10 % FBS při 37 °C ve zvlhčeném inkubátoru s 5 % CO2. Médium bylo denně obměňováno a buňky byly ošetřovány TF v jejich logaritmické růstové fázi.
Příprava zebřiček
Kmen AB zebřiček typu Wild byl získán z China Zebrafish Resource Center, Institute of Hydrobiology, China Academy of Science (Wuhan, Čína) a akreditován Association for Assessment and Accreditation of Laboratory Animal Care International (SYXK 2012-0171). Larvy zebřiček ve věku 2 dpf (dny po oplození) byly vyprodukovány přirozeným párováním a umístěny v akvakulturním zařízení s řízeným osvětlením a standardní fotoperiodou 14:10 h den/noc a krmeny živými krevetkami dvakrát denně a vločkami jednou denně.
Testy buněčné životaschopnosti a morfologická pozorování
MTT testy byly provedeny za účelem stanovení inhibičních účinků TF na melanomové buněčné linie, jak bylo popsáno dříve (Zhou et al., 2017). Buňky byly nasazeny do 96jamkových destiček v počtu 6 × 103 buněk/jamku do 200 μl média pro 24hodinovou adherenci, následně byly ošetřeny TF v koncentracích 0, 50, 100, 150, 200, 250, 300 a 400 μg/ml po dobu 24, 48 a 72 h. Poté bylo do každé jamky přidáno 20 μl roztoku MTT (5,0 mg/ml) a inkubováno při 37 °C po dobu 4 h. Na závěr byla provedena inkubace. Do každé jamky byl přidán DMSO (150 μl) a hodnota optické hustoty (OD) byla změřena při 490 nm pomocí mikrodestičkové čtečky Biorad (CA, USA). Míra inhibice (%) = × 100 %. Regresní analýzou byly vypočteny 50% inhibiční koncentrace (IC50) pro 24, 48 a 72 hodin. V souladu s tím byly 120, 240 a 360 μg/ml (232,3, 464,7 a 697,0 μM) označeny jako nízká, střední a vysoká dávka TF. Poté byly buněčné linie HFF-1, A375 a A875 vysety do 96jamkových destiček, jak je uvedeno výše, a ošetřeny střední dávkou TF po dobu 24 h. Morfologie buněk A375 byla pozorována pod fluorescenčním mikroskopem Carl Zeiss (Göttingen, Německo).
Apoptóza byla analyzována pomocí barvení DAPI a průtokové cytometrie
Buněčná apoptóza byla stanovena pomocí barvení DAPI a průtokové cytometrie založené na barvení annexinem-V/PI. Pro barvení DAPI byly buňky A375 nasazeny do 96jamkových destiček a ošetřeny TF v nízké, střední a vysoké koncentraci po dobu 24 h, následovala fixace 4% paraformaldehydem v PBS po dobu 30 min při pokojové teplotě a barvení DAPI po dobu 10 min ve tmě. Po trojím promytí byly buňky pozorovány pomocí pěti krycích sklíček pod fluorescenčním mikroskopem Carl Zeiss (Göttingen, Německo) a byly spočítány apoptotické buňky. Průtoková cytometrie byla provedena podle pokynů výrobce. Krátce, buňky A375 byly nasazeny do 6jamkových destiček v počtu 3×105 buněk/jamku po dobu 24 h a ošetřeny TF v nízké, střední a vysoké koncentraci po dobu dalších 48 h. Poté byly buňky dvakrát promyty a označeny roztokem annexinu V-fluorescein isothiokyanátu a PI ve vazebném pufru. Intenzita fluorescence buněk byla detekována průtokovou cytometrií BD C6 (CA, USA). Analýza byla opakována a byla vypočtena míra časných a pozdních apoptotických buněk (%).
Xenograft Animal Assay
Pro stanovení rozsahu dávek TF bylo použito celkem 300 larev zebřiček ve 3 dpf, které byly náhodně kultivovány do 6jamkových destiček po 30 rybkách. Do každé jamky byly rozpuštěny TF v koncentracích 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1 000 a 2 000 μg/ml po dobu 24 h. Poté byly ryby v každé skupině pozorovány pod stereoskopickým mikroskopem za účelem zaznamenání mortality a nežádoucích účinků. Jak bylo popsáno v naší předchozí studii, byla odhadnuta hladina bez pozorovaného nepříznivého účinku (NOAEL) TF a pro následující pokus byly použity 1/9 NOAEL, 1/3 NOAEL a NOAEL jako nízká, střední a vysoká dávka (Jin et al., 2018).
Pro vytvoření modelu xenotransplantátu byly buňky A375 obarveny CM-Dil (červená fluorescence) v ředění 1:1 000 a mikroinjektovány do žloutkového váčku larvální zebřičky (2 dpf) v dávce 200 buněk/ryba. Po 24hodinovém růstu nádoru byly všechny ryby pozorovány pod fluorescenčním mikroskopem (AZ100, Nikon, Tokio, Japonsko) pro ověření modelu. Ryby nesoucí A375 byly rozděleny do 5 skupin (po 30 rybách) a po dobu 24 h jim bylo podáváno 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL a NOAEL TF, resp. 15 μg/ml (50 μM) cisplatiny. Byla zjišťována intenzita fluorescence (FI) buněčné hmoty A375 zebřiček a míra inhibice byla vypočtena jako: míra inhibice (%) = × 100 %.
Analýza PCR v reálném čase (qPCR)
Pro odhalení molekulárního působení TF na buňky A375 byla použita qPCR na systému ABI QuantStudio™ 7 Flex Real-Time PCR (Applied Biosystems, CA, USA). Celková RNA buněk A375 byla extrahována pomocí činidla Trizol a reverzní transkripcí syntetizována do cDNA. Reakční systém qPCR měl objem 20,0 μl: 10 μl SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl PCR forward primer, 0,8 μl PCR reverse primer, 2,0 μl templátu cDNA, 0,4 μl referenčního barviva ROX a 6,0 μl ddH2O. Podmínky reakce qPCR byly nastaveny na 95 °C po dobu 30 s počáteční denaturace, 40 cyklů 95 °C po dobu 5 s denaturace, 60 °C po dobu 34 s žíhání a 72 °C po dobu 40 s prodlužování. Na konci každé reakce byla provedena analýza křivky tání. Jako referenční gen byl použit β-ACTIN a k analýze relativní exprese každého genu byla použita metoda 2-ΔΔCT (tabulka 1).

Tabulka 1 Sekvence primerů použité pro analýzu qPCR.
Western Blot (WB) analýza
Exprese proteinů buněk A375 při ošetření TF v koncentraci 0 μg/ml a 120 μg/ml (232,3 μM) byla analyzována pomocí WB analýzy. Celkové proteiny byly extrahovány pomocí lyzačního pufru (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1% Triton, 0,1% SDS, 5 μg/ml leupeptinu a 1 mM PMSF) po dobu 30 min na ledu s opakovaným zmrazováním a rozmrazováním. Cílené proteiny byly separovány pomocí denaturační polyakrylamidové gelové elektroforézy na dodecylsulfátu sodném (SDS-PAGE) (8~12 %) a poté přeneseny na polyvinylidenfluoridovou (PVDF) membránu (Millipore, MA, USA). Membrána byla blokována 5% odtučněným mlékem po dobu 2 h, následovala noční inkubace při 4 °C s protilátkami proti: ACTIN, ASK1, ATM, fosforylovaný ATM (p-ATM), ATR, fosforylovaný ATR (p-ATR), štěpená kaspáza 3 (c-CASP3), štěpená kaspáza 8 (c-CASP8), CHK1, CHK2, fosforylovaný CHK1 a CHK2 (p-CHK1 a p-CHK2), JNK, fosforylovaná JNK (p-JNK), C-JUN, fosforylovaná C-JUN (p-C-JUN), štěpená PARP (poly ADP-ribóza polymeráza), P53 a fosforylovaná P53 (p-P53). Po inkubaci se sekundární protilátkou byly tyto proteiny vizualizovány pomocí soupravy pro zvýšenou chemiluminiscenci (Amersham Pharmacia Biotech, Little Chalfort, Velká Británie) a detekovány pomocí chemiluminiscenčního analyzátoru.
Statistická analýza
Údaje byly vyjádřeny jako průměrné hodnoty ± SD a podrobeny jednocestné analýze ANOVA, po níž následovalo Fisherovo porovnání nejmenších významných rozdílů (LSD). Všechny analýzy byly provedeny pomocí aktualizované verze softwaru DPS (Tang a Zhang, 2013).
Výsledky
Antiproliferační účinek TF
Jak ukazuje obrázek 1A, TF v koncentraci 50 μg/ml (96.8 μM) významně inhiboval životaschopnost buněk A375 a míra inhibice se zvyšovala se zvyšující se koncentrací TF od 50 do 400 μg/ml (96,8 až 744,4 μM) (vždy P < 0,01 oproti normální hladině), což naznačuje způsob závislý na koncentraci. Míra inhibice se rovněž zvyšovala při léčbě TF od 24 do 72 h, s IC50 218,9 až 84,9 μg/ml (423,8 až 164,4 μM), resp. Poté jsme použili 120, 240 a 360 μg/ml (232,3, 464,7 a 697,0 μM) jako dávky TF-L, TF-M a TF-H v uvedeném pořadí. Jak ukazuje obrázek 1B, TF-M zjevně inhiboval životaschopnost buněk A375 a A875, ale na buňky HFF-1 měl malý účinek. Jak ukazuje obrázek 1C, morfologie buněk A375 se zjevně změnila a počet živých buněk se při léčbě TF ve zvyšujících se koncentracích snížil.

Obrázek 1 Životaschopnost buněk A375 při ošetření TF po 24, 48 a 72 h (A), životaschopnost buněk HFF-1, A375 a A875 při ošetření TF po 24 h (B) a morfologie buněk A375 při ošetření theaflavinem (TF) po 24 h (C). Údaje byly průměrné ± SD (n = 5). Pomocí vícenásobného porovnání podle Fishera (LSD) údaje (průměr ± SD) se stejným malým písmenem (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d) neznamenají žádný významný rozdíl mezi sebou, zatímco údaje s různými písmeny (a vs. b vs. c vs. b vs. e vs. f vs. g) znamenají významný rozdíl mezi sebou. Měřítko = 200 μm.
Proapoptotický účinek TF
K vyhodnocení proapoptotického účinku TF na buňky A375 bylo provedeno barvení DAPI a průtoková cytometrie. Výsledek barvení DAPI ukázal apoptotickou morfologii, včetně zmenšeného tvaru, karyopyknózy a jaderné fragmentace, u buněk A375 při léčbě TF od 120 do 360 μg/ml (232,3 až 697,0 μM) (obr. 2A). Počet apoptotických buněk se významně zvýšil při léčbě TF v dávkách 240 a 360 μg/ml (464,7 a 697,0 μM) (vždy P < 0,01 oproti NC) (obrázek 2C). Výsledek průtokové cytometrie ukázal TB indukovanou časnou apoptózu a pozdní apoptózu buněk A375 (obr. 2B). Počet časných a pozdních apoptotických buněk se zvýšil při léčbě TF v rozmezí 120 až 360 μg/ml (232,3 až 697,0 μM) (Obrázek 2B) a jejich podíl byl významně vyšší při léčbě TF v rozmezí 360 μg/ml (697,0 μM) (P < 0,01 a P < 0,05 oproti normální hladině) (Obrázek 2D, E). Výsledky naznačují, že TF indukoval apoptózu buněk A375 v závislosti na koncentraci.
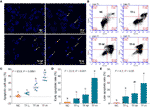
Obrázek 2 Pozorování barvení DAPI (A) a analýza průtokovou cytometrií (B) na buňkách A375 při léčbě teaflavinem (TF). Statistická analýza míry apoptotických buněk (C), statistická analýza časné apoptotické míry (D) a statistická analýza pozdní apoptotické míry (E). Pomocí vícenásobného porovnání podle Fishera (LSD) údaje (průměr ± SD) se stejným malým písmenem (a vs. ab; ab vs. b; b vs. b; c vs. c) neznamenají žádný významný rozdíl mezi sebou, zatímco údaje s různými písmeny (a vs. b vs. c) znamenají významný rozdíl mezi sebou. Měřítko = 100 μm.
In vivo účinek TF na Xenograft zebřičky
Křivky mortality a nežádoucích účinků zebřičky při léčbě TF byly zobrazeny na obr. 3A. Úhyn ryb způsobila TF v dávce 31,25 μg/ml (60,5 μM) a žádná ryba nepřežila při použití TF v dávce 125 μg/ml (242,0 μM), což ukazuje na maximální neletální dávku TF menší než 31,25 μg/ml (60,5 μM). Nežádoucí účinky, včetně abnormálního převrácení těla a edému, byly pozorovány při léčbě TF od 3,47 μg/ml (6,7 μM) do jeho vyšších dávek, což ukazuje na NOAEL TF menší než 3,47 μg/ml (6,7 μM). Po opakovaných testech byla nakonec NOAEL odhadnuta na 2,0 μg/ml (3,9 μM). Jako nízké, střední a vysoké dávky TF pro následný experiment byly tedy použity 0,22, 0,67 a 2,0 μg/ml (0,4, 1,3 a 3,9 μM).
Jak je znázorněno na obrázku 3B, byl vytvořen xenograftový model buněk A375 v larvách zebřiček a byla testována intenzita fluorescence buněčné hmoty v rybách. Po 24hodinové léčbě TF od 0,22 do 2,0 μg/ml (0,4, 1,3 a 3,9 μM) zjevně inhiboval růst nádoru A375 s mírou inhibice od 1,0 do 46,4 %. Inhibiční účinky TF v dávkách 0,67 a 2,0 μg/ml (1,3 a 3,9 μM) byly významné, pokud je porovnáme s modelovou skupinou (P < 0,01), a účinek TF v dávce 2,0 μg/ml (3,9 μM) byl dokonce vyšší než účinek cisplatiny při její NOAEL (50 μM).
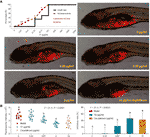
Obrázek 3 Mortalita a nežádoucí účinky larev zebřiček vyvolané teaflavinem (TF) a pozorování larev zebřiček xenotransplantovaných buňkami A375 při léčbě TF nebo cisplatinou (A), jakož i intenzita fluorescence a míra inhibice TF (B). Fluoreskující plocha v červené barvě představuje hmotnost buněk A375. Pomocí vícenásobného porovnání LSD údaje (průměr ± SD) se stejným malým písmenem (a vs. a; c vs. c) neznamenají žádný významný rozdíl mezi sebou, zatímco údaje s různými písmeny (a vs. b vs. c) znamenají významný rozdíl mezi sebou.
Molekulární působení TF na exprese mRNA v buňkách A375
Relativní exprese mRNA genů cílených na TF byly testovány pomocí qPCR testu. Jak ukazuje obr. 4, exprese BAX, BIM, C-MYC, P21, P53 a PUMA byly významně zvýšeny působením TF (každá P < 0,01 oproti úrovni NC), s výjimkou exprese BAX při působení TF v jeho nízké koncentraci. Ačkoli exprese BCL-2 byla TF regulována nahoru, poměry BAX/BCL-2 byly významně vyšší při léčbě TF v jeho středních až vysokých koncentracích než na úrovni NC (P < 0,01), což naznačuje hlavní roli BAX v působení TF.
Molekulární působení TB na expresi proteinů v buňkách A375
WB byl použit ke stanovení exprese a fosforylace proteinů cílených TF. Jak ukazuje obrázek 5, exprese ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8 a c-CASP3 byly významně zvýšeny působením TF při 120 μg/ml (232,3 μM) (každý P < 0,01 oproti úrovni NC). Kromě toho byly účinky TF na ATR, p-ATR, CHK2, P53, C-JUN (43 kd) a p-C-JUN (Ser 73) nevýznamné (každý P > 0,05 vs. hladina NC).
Diskuse
Ačkoli protinádorové účinky TF byly dobře zdokumentovány (Sur a Panda, 2017; Takemoto a Takemoto, 2018; Sajadimajd et al., 2020), poznatků o její účinnosti na melanom je stále málo. K vyplnění této mezery byly v této studii provedeny experimenty in vitro a in vivo s cílem studovat účinky a mechanismus působení TF proti melanomovým buňkám. Poprvé jsme prokázali cytotoxické proapoptotické a tumor-inhibiční účinky TF na buňky melanomu A375. Bylo navrženo, že jeho mechanismus je spojen s cestami P53 a JNK. Novinkou této studie je zjištění antimelanomové účinnosti TF, zatímco předchozí zprávy se zaměřovaly pouze na účinky TF na jiné nádory (Lin, 2002; Sur a Panda, 2017). Navíc se jedná také o první zprávu o molekulárním působení TF na dráhu JNK, zatímco mechanismus proapoptotického účinku TF na karcinomové buňky spojený s dráhou P53 byl popsán již dříve (Lahiry a kol., 2008).
V poslední době přitahují xenograftové modely nádorů využívající larvální zebřičky stále větší pozornost pro protinádorové studie, a to díky výhodám larválních zebřiček ve srovnání s jinými zvířecími modely: (1) absence imunitní rejekce vůči lidským buňkám zajišťuje vyšší úspěšnost xenotransplantace; (2) průhlednost těla umožňuje in vivo viditelné pozorování růstu nádoru a toxicity léčiv; a (3) velkoplošná tvorba a rychlá organogeneze zajišťuje kratší dobu experimentu (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). V této studii TF působila v závislosti na dávce inhibičně na nádorovou masu A375 u larválních zebřiček (obr. 3B), přičemž míra inhibice činila 46,4 % při její NOAEL (3,9 μM). Míra inhibice byla vyšší než u cisplatiny, což naznačuje, že TF byla účinnější než cisplatina v rámci příslušného bezpečného dávkového rozmezí. Navíc byla míra inhibice vyšší než u jiného čajového barviva (theabrowninu) (Jin et al., 2018), což naznačuje, že TF je nejúčinnější složkou čaje. Rozsah účinných dávek in vivo (1,3 až 3,9 μM) TF je však mnohem nižší než rozsah jeho účinných dávek in vitro (96,8 až 774,4 μM). Důvodem tohoto rozdílu může být to, že po perorálním podání mají metabolizované deriváty TF vyšší účinek než TF. To naznačuje, že orální aplikace může být pro TF účinnější než jiné cesty.
Podle pravidla přepočtu dávky lze účinné dávky (1,3 a 3,9 μM) TF u larválních zebřiček odhadnout na 0,03 až 0,09 mg/kg u člověka (Zhang et al., 2003). To naznačuje, že perorální podávání TF v takto nízkém dávkovém rozmezí může být účinné při léčbě pacientů s melanomem, což svědčí o dobré ekonomické efektivitě této sloučeniny. Pokud je nám známo, existuje pouze několik zpráv týkajících se klinického použití TF. Dvojitě zaslepená, randomizovaná, placebem kontrolovaná studie s paralelními skupinami aplikovala extrakt ze zeleného čaje obohacený o TF k léčbě pacientů s mírnou až střední hypercholesterolemií po dobu 12 týdnů (Maron et al., 2003). V této studii činil denní příjem 75 mg TF v extraktu ze zeleného čaje, který významně snížil celkový cholesterol, LDL-C a triglyceridy u dospělých hypercholesterolemiků, aniž by byly pozorovány významné nežádoucí účinky (Maron et al., 2003). V této studii byl rozsah účinných dávek TF mnohem nižší než uváděný, což naznačuje větší potenciál TF pro léčbu melanomu v klinice. Nicméně i když byl rozsah účinných dávek TF malý, jeho práh smrtelné dávky pro larvy zebřiček byl také nízký (<60,5 μM) a byl nižší než u jiných čajových barviv (obr. 3A) (Jin et al., 2018), což zanechává obavy z potenciální toxicity TF pro člověka. Zajímavé je, že jsme zjistili, že TF má malý účinek na normální buněčnou linii (kožní fibroblast HFF-1) (Obrázek 1B), což naznačuje klinickou proveditelnost jeho vnějšího použití, které může zabránit potenciální toxicitě jeho vnitřního použití.
Náš mechanistický experiment ukázal, že TF aktivuje ATM, CHK1/2, P53, CASP8/3 v dráze P53 a také aktivuje ASK1, JNK a C-JUN v dráze JNK, což souvisí s apoptózou buněk A375. Apoptóza byla stanovena barvením DAPI a průtokovou cytometrickou analýzou na buněčné úrovni (obr. 2) a byla zprostředkována nadměrnou expresí proapoptotických genů (P53, BAX, BIM a PUMA) a aktivací proteinů souvisejících s apoptózou (kaspázy a PARP) na molekulární úrovni (obr. 4 a 5). P53 (TP53) kóduje jaderný fosfoprotein vázající DNA s nádorovou supresorovou aktivitou, který působí jako transkripční faktor v centru sítě pro kontrolu apoptózy v reakci na buněčný stres (Martin et al., 2002). Aktivuje apoptózu stimulací transkripce genů rodiny Bcl-2, jako jsou BAX, BIM a PUMA (Levine a Oren, 2009). BAX a BIM kódují proapoptotické členy, které vyvolávají apoptózu a buněčnou smrt aktivací kaskády kaspáz v reakci na apoptotické podněty (Rossé et al., 1998; Youle a Strasser, 2008). PUMA jako P53 regulovaný modulátor apoptózy kóduje protein obsahující doménu BH3, který se lokalizuje v mitochondriích, interaguje s Bax a Bak a aktivuje kaspázovou kaskádu štěpením CASP3 (Nakano a Vousden, 2001; Letai, 2009). V této studii byly CASP8 a CASP3 štěpeny v reakci na aktivaci P53. CASP8 je iniciační kaspázou v apoptotické kaskádě, která aktivuje CASP3 pro apoptotickou fragmentaci DNA, což vede k následnému štěpení PARP (c-PARP) k provedení apoptotického procesu (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP je zodpovědný za opravu DNA a životaschopnost buněk v reakci na exogenní stres (Satoh a Lindahl, 1992). Může být štěpen CASP3, a tím usnadňuje rozpad buňky při apoptóze (Oliver et al., 1998). Množství štěpeného PARP (c-PARP) lze tedy použít jako marker buněčné apoptózy.
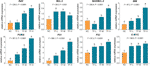
Obrázek 4 Relativní exprese mRNA genů cílených na theaflavin (TF) v buňkách A375 po 24hodinové léčbě. Pomocí vícenásobného porovnání Fisherova nejmenšího významného rozdílu (LSD) údaje (průměr ± SD) se stejným malým písmenem (a vs. a; b vs. b; c vs. c) neznamenají mezi sebou žádný významný rozdíl, zatímco údaje s různými písmeny (a vs. b vs. c vs. d) označují významné vzájemné rozdíly.
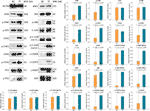
Obrázek 5 Exprese a fosforylace proteinů cílených na teaflavin (TF) v buňkách A375 po 24hodinové léčbě. Data (průměr ± SD) s různými malými písmeny se navzájem významně liší při vícenásobném porovnávání podle Fishera (LSD).
V našich předchozích studiích jsme uvedli, že indukce poškození DNA byla spojena s proapoptotickým mechanismem teabrowninu zprostředkovaným dráhou P53 (Wu et al., 2016; Jin et al., 2018). Ačkoli však TF i theabrownin aktivovaly dráhu P53 a indukovaly apoptózu nádorových buněk, v této studii jsme indukci poškození DNA při léčbě TF nezjistili. Alternativně jsme zjistili aktivaci kaskády ASK1-JNK-C-JUN, která rovněž funguje jako apoptotická dráha. V tomto signálním modulu je ASK1 (apoptosis signal-regulating kinase 1) mitogenem aktivovaná proteinkináza, která hraje klíčovou roli v apoptóze vyvolané cytokiny a stresem spuštěním mitochondriálně závislé dráhy (Matsuzawa a Ichijo, 2001; Zhang et al., 2003). Aktivuje navazující signalizaci JNK v reakci na různé typy stresu, což vede k apoptóze buněk prostřednictvím aktivace C-JUN a následné nadměrné exprese proapoptotických genů (Tobiume et al., 2001). Bylo zjištěno, že chemoterapeutika, jako je cisplatina, docetaxel a paklitaxel, indukují apoptózu melanomových buněk prostřednictvím dráhy JNK nezávisle na dráze P53 (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). To naznačuje, že TF může mít ve srovnání s těmito léčivy výhodu díky svému mechanismu účinku zprostředkovanému dvěma cestami, což bylo předběžně prokázáno vyššími tumor-inhibičními účinky TF než cisplatiny v této studii. Tato studie má však některá následující omezení: (1) působení cest P53 a JNK v navrhovaném mechanismu TF zprostředkovaném dvěma cestami nebylo ověřeno; (2) interakce mezi cestami P53 a JNK nebyla zkoumána a není známo, která cesta hraje hlavní roli; a (3) rozsah dávek in vitro a rozsah dávek in vivo se značně liší, což bylo vysvětleno, ale potřebuje experimentální důkazy. K řešení těchto otázek jsou v budoucnu zapotřebí další studie. Například by měly být použity siRNA nebo inhibitory P53 a JNK, aby se ověřilo působení těchto drah a prozkoumala vzájemná interakce, a měly by být chemicky analyzovány a farmakologicky studovány sérové metabolity TF, aby se ověřila naše hypotéza, že metabolizované deriváty TF mají vyšší účinek než TF. Navíc vzhledem k tomu, že neexistují žádné klinické zprávy o TF pro léčbu rakoviny, měla by být dále studována terapeutická účinnost a přínos TF na pacienty s rakovinou.
Závěr
Protože byl dobře zdokumentován protinádorový potenciál TF, zůstává nejisté, zda je TF účinný při léčbě melanomu. V této studii jsme pomocí buněčné linie melanomu a xenograftového modelu zebřičky zjistili cytotoxický proapoptotický a tumor-inhibiční účinek TF na melanomové buňky a odhalili jeho mechanismus v souvislosti s aktivací drah P53 a JNK. Jedná se o první studii popisující účinky a mechanismus působení TF na melanomové buňky. Vzhledem k tomu, že mechanismus působení TF nebyl závislý pouze na dráze P53, lze očekávat, že TF může být účinný při léčbě buněčných linií s mutací P53. K ověření této dedukce je třeba provést další studie. Celkově tato studie poskytuje důkazy o účinnosti TF proti melanomu, což přispívá k vývoji látek odvozených od TF pro terapii melanomu.
Potvrzení o dostupnosti údajů
Zpracované údaje podporující závěry tohoto článku jsou na základě odůvodněné žádosti k dispozici u odpovídajícího autora.
Etické prohlášení
Studie na zvířatech byla posouzena a schválena etickou komisí Zhejiang Chinese Medical University.
Příspěvek autora
LeZ provedl hlavní práci tohoto článku. BY provedl buněčné a molekulární experimenty. LiZ a SM přispěli k napsání tohoto rukopisu. WD poskytl nápady a finanční podporu této práce. YX provedl experiment se zebřičkami. LS navrhl tuto práci a vypracoval rukopis. TE zlepšil návrh a koncept této práce. Všichni autoři se podíleli na vzniku článku a schválili předloženou verzi.
Financování
Tato práce byla podpořena National Natural Science Foundation of China (granty č. 81774331, 81873049 a 81973873), Zhejiang Provincial Natural Science Foundation of China (grant č. LY18H270004), Zhejiang Provincial Science and Technology Project of Traditional Chinese Medicine of China (grant č. LY18H270004). 2016ZZ011), Zhejiang Provincial Key Construction University Superiority Characteristic Discipline (Traditional Chinese Pharmacology) a Opening Foundation of China (Grant No. ZYX2018006).
Konflikt zájmů
YX byl zaměstnán ve společnosti Hunter Biotechnology, Inc.
Ostatní autoři prohlašují, že výzkum byl proveden bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být považovány za potenciální střet zájmů.
Zkratky
DAPI, 4′-6-diamidino-2-fenylindol; DMEM, Dulbeccovo modifikované Eagleovo médium; DMSO, dimethylsulfoxid; dpf, dny po oplodnění; FBS, fetální hovězí sérum; FI, intenzita fluorescence; LSD, Fisherův nejmenší významný rozdíl; NOAEL, hladina bez pozorovaného nepříznivého účinku; MTT, 3-(4,5-dimethylthiazol-2-yl)-2,5-difenyltetrazolium bromid; PARP, poly ADP-ribóza polymeráza; SDS-PAGE, denaturační elektroforéza v polyakrylamidovém gelu dodecylsulfátu sodného; TCM, theaflavin; TF, tradiční čínská medicína.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Theaflaviny zpomalují migraci lidských buněk karcinomu prsu inhibicí NF-kappaB prostřednictvím zkříženého působení p53-ROS. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. (1999). Úloha štěpení poly(ADP-ribóza) polymerázy (PARP) v apoptóze. Kaspáza 3-rezistentní mutant PARP zvyšuje míru apoptózy u transfekovaných buněk. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). Kaspáza-3 je nezbytná pro fragmentaci DNA a morfologické změny spojené s apoptózou. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownin spouští poškození DNA k potlačení lidských osteosarkomových buněk U2OS aktivací signální dráhy p53. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebrafish xenografts as a tool for in vivo studies on human cancer. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Srovnávací studie hypolipidemických a růst potlačujících účinků listů oolong, černého, pu-erh a zeleného čaje u potkanů. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Contribution of p53-mediated Bax transactivation in theaflavin-induced mammary epithelial carcinoma cell apoptosis. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Theaflaviny se zaměřují na dráhy Fas/kaspase-8 a Akt/pBad a indukují apoptózu u lidských buněk karcinomu prsu s mutací p53. Carcinogenesis 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Zebřičky: nový model na farmaceutickém molu. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Kožní melanom: (Review): From pathogenesis to therapy (Od patogeneze k terapii). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma udeřila na Baxe. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.200903134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). Prvních 30 let p53: stále složitější. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Theaflaviny inhibují ATP syntázu a dýchací řetězec bez zvýšení produkce superoxidu. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Chemoprevence rakoviny pomocí čajových polyfenolů prostřednictvím modulace signálních transdukčních drah. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J. a další (2018). Sloučenina vitexinu 1, nový extrakt z čínské byliny, potlačuje růst melanomových buněk prostřednictvím poškození DNA zvýšením hladiny ROS. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatina indukuje proapoptotickou konformaci Bak v závislosti na deltaMEKK1. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Čaj a jeho složky zabraňují vzniku rakoviny: A review of the redox-related mechanism. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Cholesterol-lowering effect of a theaflavin-enriched green tea extract: a randomized controlled trial. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Integrace mutačních dat a strukturní analýzy tumor-supresorového proteinu TP53. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Molekulární mechanismy rozhodování mezi životem a smrtí: regulace apoptózy kinázou 1 regulující signál apoptózy. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Involvement of endoplasmic reticulum stress in Docetaxel-induced JNK-dependent apoptosis of human melanoma. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Kurkumin: Curkumin: nový kandidát na léčbu melanomu? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, nový proapoptotický gen, je indukován p53. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Nové nanotechnologické strategie pro systémovou chemoterapii proti melanomu. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Význam poly(ADP-ribóza) polymerázy a jejího štěpení v apoptóze. Poučení z neštěpitelného mutanta. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). High-throughput in vivo vertebrate screening. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). The phenolic substances of manufactured tea [Fenolické látky průmyslově vyráběného čaje]. I. Frakcionace a papírová chromatografie látek rozpustných ve vodě. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Pokroky v imunoterapii melanomu: komplexní přehled. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prodlužuje přežití buněk po uvolnění cytochromu c vyvolaného Bax. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Pokroky v oblasti přírodních polyfenolů jako protinádorových látek pro rakovinu kůže. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Role tvorby poly(ADP-ribózy) při opravě DNA. Nature 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Taxolem indukovaný mitochondriální stres v melanomových buňkách je zprostředkován aktivací c-Jun N-terminální kinázy (JNK) a dráhy p38 prostřednictvím uncoupling proteinu 2. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Theaflaviny potlačují růst a metastazování nádorů prostřednictvím blokády dráhy STAT3 u hepatocelulárního karcinomu. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). Pro-kaspáza-3 je hlavním fyziologickým cílem kaspázy-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Molekulární aspekty chemopreventivní a terapeutické účinnosti čaje a čajových polyfenolů proti rakovině. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Syntéza theaflavinů a jejich funkce. Mol. (Basel Switzerland) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Software Data Processing System (DPS) s experimentálním návrhem, statistickou analýzou a dolováním dat vyvinutý pro použití v entomologickém výzkumu. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 je nutná pro trvalou aktivaci JNK/p38 MAP kináz a apoptózu. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analýzy teorie patogeneze rakovinného toxinu a teorie „upevnění odolnosti organismu a vyčištění zdroje“. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Antiproliferační a apoptózu indukující účinek theabrowninu proti buňkám nemalobuněčného adenokarcinomu plic A549. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). Epidemiologický přehled stravy a kožního maligního melanomu. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). Rodina proteinů BCL-2: protichůdné aktivity, které zprostředkovávají buněčnou smrt. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Zebřičky: zvířecí model pro toxikologické studie. Curr. Proto je třeba se na ně zaměřit. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Theabrownin inhibuje progresi buněčného cyklu a růst nádoru karcinomu plic prostřednictvím mechanismu souvisejícího s c-myc. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar
.