hlavní funkční složka červené krvinky, která slouží jako bílkovina přenášející kyslík; je to typ hemoproteinu, v němž je každá molekula tetramer složený ze čtyř monomerů držených pohromadě slabými vazbami. Skládá se ze dvou párů polypeptidových řetězců, globinů, z nichž každý má připojenou molekulu hemu složenou ze železa a molekuly protoporfyrinu. Symbol Hb.
Atom železa má volnou valenci a může vázat jednu molekulu kyslíku. Každá molekula hemoglobinu tedy může vázat jednu molekulu kyslíku. Vazba kyslíku jedním monomerem zvyšuje afinitu kyslíků ostatních v tetrameru. Díky tomu je hemoglobin účinnější transportní bílkovinou než monomerní bílkovina, například myoglobin.
Okysličený hemoglobin (oxyhemoglobin) má jasně červenou barvu; hemoglobin bez vazby na kyslík (deoxyhemoglobin) je tmavší. To vysvětluje jasně červenou barvu arteriální krve, ve které je hemoglobin asi z 97 % nasycen kyslíkem. Žilní krev je tmavší, protože je nasycena pouze z 20 až 70 procent, v závislosti na tom, kolik kyslíku spotřebovávají tkáně. Afinita hemoglobinu k oxidu uhelnatému je 210krát silnější než jeho afinita ke kyslíku. Vzniklý komplex (karboxyhemoglobin) nemůže přenášet kyslík. Otrava oxidem uhelnatým tak vede k hypoxii a udušení.
Další formou hemoglobinu, která nemůže přenášet kyslík, je methemoglobin, v němž je atom železa oxidován do oxidačního stavu +3. V případě, že je hemoglobin oxidován do oxidačního stavu +3, dochází k jeho oxidaci. Během 120denní životnosti červené krvinky se hemoglobin pomalu oxiduje na methemoglobin. Nejméně čtyři různé enzymové systémy mohou přeměnit methemoglobin zpět na hemoglobin. Při jejich poruše nebo přetížení může dojít k methemoglobinémii, kdy vysoká hladina methemoglobinu způsobuje dušnost a cyanózu.
Druhotnou funkcí hemoglobinu je funkce součásti krevního pufru. Histidinové zbytky v globinových řetězcích působí jako slabé báze, které minimalizují změny pH krve, k nimž dochází při absorpci kyslíku a uvolňování oxidu uhličitého v plicích a při dodávce kyslíku a příjmu oxidu uhličitého z tkání.
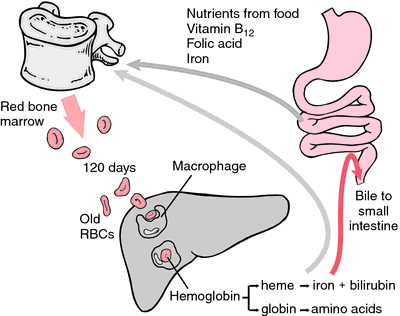
Při opotřebení nebo poškození erytrocytů je pohlcují makrofágy retikuloendoteliálního systému. Porfyrinový kruh hemu se přeměňuje na žlučové barvivo bilirubin, které se vylučuje játry. Železo je transportováno do kostní dřeně, kde je zabudováno do hemoglobinu nově vznikajících erytrocytů.
Koncentrace hemoglobinu v krvi se mění v závislosti na hematokritu. Normální hodnoty koncentrace hemoglobinu v krvi jsou 13,5 až 18,0 g/100 ml u mužů a 12,0 až 16,0 g/100 ml u žen. Normální střední koncentrace korpuskulárního hemoglobinu, což je koncentrace uvnitř červených krvinek, je 32 až 36 g/100 ml.
Bylo objeveno mnoho abnormálních hemoglobinů vzniklých mutacemi. Některé mají změněnou afinitu ke kyslíku, některé jsou nestabilní a u některých dochází k oxidaci atomu železa, což vede k vrozené methemoglobinémii. Některé mutace vedou ke snížené rychlosti syntézy hemoglobinu. Všechny tyto stavy se označují jako hemoglobinopatie.
Nejčastější hemoglobinopatií je srpkovitá choroba, způsobená mutací nahrazující šestou aminokyselinu v řetězci β, normálně kyselinu glutamovou, valinem. Varianta hemoglobinu α2βS2 je známá jako Hb S. Mutace vedoucí ke snížené syntéze jednoho z řetězců se nazývají talasemie. Mohou být důsledkem delece genu pro některý řetězec nebo mutace v regulačním genu, který řídí syntézu řetězce.
.