| Ed Davis, Ph. |
Úvod
Lentivirus a adenoasociovaný virus (AAV) se ukázaly jako neocenitelné pro vnášení genetického materiálu do savčích buněk, ať už v kultuře, nebo do celých zvířat. Oba systémy jsou velmi vhodné pro mnoho aplikací v základním výzkumu, jako je nadměrná exprese proteinů, produkce protilátek a knockout genů, a oba jsou slibné pro genovou terapii. Každý virový systém má však v závislosti na aplikaci své jedinečné výhody a nevýhody. Společnost GeneCopoeia nabízí rozsáhlé produktové řady pro lentivirus i AAV, které vám poskytnou výkonné a flexibilní možnosti pro doručení DNA do buněk. V této technické poznámce popisujeme technologie, které stojí za produktovými řadami Lentifect™ lentivirus a AAVPrime™ AAV společnosti GeneCopoeia, a diskutujeme o výhodách každé technologie pro různé aplikace, abychom vám pomohli vybrat, který systém nejlépe vyhovuje vašim potřebám.
Proč používat viry pro doručování DNA?
Jedním z nejběžnějších způsobů doručování DNA do buněk je transfekce založená na plazmidech, při níž jsou buňky ošetřeny chemickými sloučeninami, jako je fosforečnan vápenatý, nebo činidly na bázi lipidů. Transfekce plazmidy však není vždy žádoucí nebo praktická. Například některé buňky je velmi obtížné nebo nemožné transfekovat, zatímco většina kultivovaných buněk podporuje infekci (známou také jako transdukce) buď lenvirem, nebo AAV. Za druhé, transfekci plazmidem nelze použít pro doručení DNA in vivo, ale virovou transdukci ano. Jak lentivirus, tak AAV lze použít k mnoha aplikacím, jako je exprese proteinů z otevřených čtecích rámců (ORF), vyřazení genů pomocí RNA interference (RNAi) zprostředkované krátkou vlásenkovou RNA (shRNA), luciferázové a jiné testy reportérových genů a vyřazení genů zprostředkované systémem clustered, regularly-interspaced, short palindromic repeats-Cas9 (CRISPR-Cas9). Mnoho z těchto aplikací virových vektorů bylo úspěšně provedeno v kultivovaných imortalizovaných buněčných liniích savců, primárních buněčných kulturách, zvířecích modelech a v genové terapii na lidských pacientech.
Termín „lentivirus“ označuje třídu retrovirů, která zahrnuje virus lidské imunodeficience (HIV), a ve skutečnosti je většina v současnosti používaných lentivirálních systémů odvozena od HIV (přehled v Mátrai, et al., 2010; Sakuma a kol., 2012). Lentiviry nesoucí transgeny se při infekci integrují do genomu, a umožňují tak stabilní expresi v dělících se i nedělících se buňkách.
Lentivirální systémy byly z HIV po několik generací vysoce modifikovány, aby byly bezpečné pro manipulaci a použitelné pro aplikace. GeneCopoeia používá lentivirální systém 3. generace (Dull, et al. 1998), který vyžaduje čtyři samostatné plazmidy k produkci infekčních virových částic (virionů). Lentivirální plazmid GeneCopoeia nese pouze gen zájmu (GOI), který má být exprimován, selekční gen pro antibiotika a obalové signální sekvence. Někdy klon obsahuje také fluorescenční reportérový gen. Plazmid obsahující GOI se selekčním markerem a reportérovým genem může obsahovat inzerty o velikosti až 5-6 kb. (Obrázek 1), ačkoli virové titry dramaticky klesají, když velikost inzertu přesáhne přibližně 4 kb.
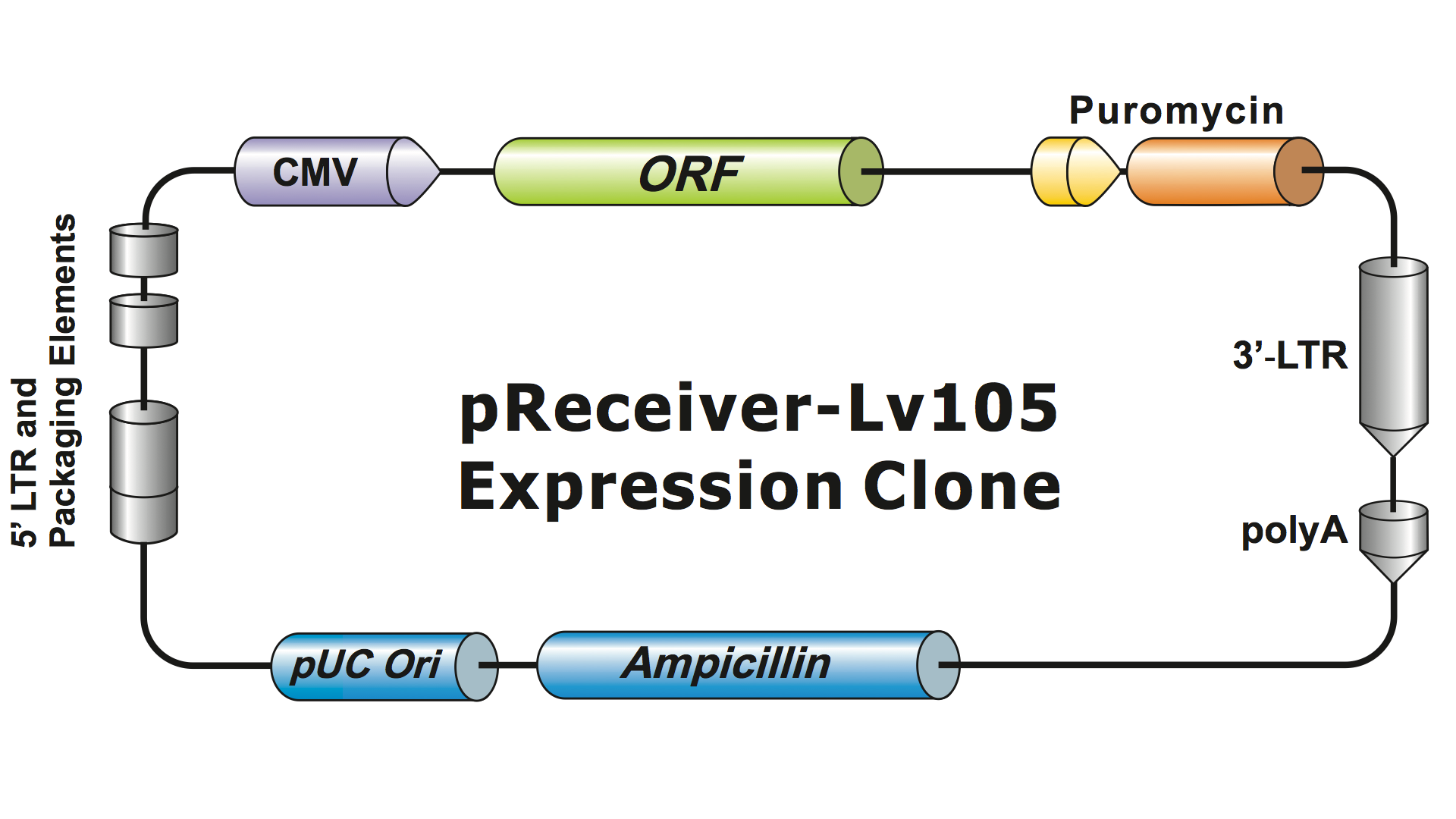 |
Obrázek 1. Příklad lentivirového expresního klonu GeneCopoeia |
Další plazmidy exprimují retrovirové elementy potřebné pro balení a integraci (gag, pol, env, Rev). Pokud jsou všechny čtyři plazmidy exprimovány v obalových buňkách, dochází k inkorporaci GOI RNA do částic. Protože retrovirální proteiny jsou exprimovány pouze během balení, infikované buňky nemohou produkovat infekční virus. Lentivirové částice Lentifect™ společnosti GeneCopoeia navíc obsahují deleci v oblasti U3 LTR, takže se samy inaktivují (SIN). Delece SIN zabraňuje replikaci lentivirových částic ve vzácném případě, kdy všechny čtyři plazmidy rekombinují a vytvoří jediný aktivní virový plazmid. Proto je manipulace s lentivirovými částicemi bezpečná, prakticky bez možnosti vzniku patogenního viru.
Kromě zvýšených bezpečnostních modifikací nesou lentivirové částice Lentifect™ společnosti GeneCopoeia glykoprotein viru vezikulární stomatitidy G (VSV-G) na místě divokého typu genu env HIV, což mění tkáňový tropismus viru z CD4+ T-buněk na prakticky jakýkoli typ savčích buněk. Lentiviry jsou proto široce používaným systémem pro kultivaci savčích buněk, zvířecí modely a aplikace genové terapie.
Protože byly lentivirální vektory upraveny těmito způsoby, mají lentivirální systémy Lentifect™ společnosti GeneCopoeia zvýšenou bezpečnost a mají následující vlastnosti, které je činí vysoce užitečnými pro doručování DNA:
- Infikují téměř všechny typy savčích buněk
- Mohou být použity k doručení relativně velkých sekvencí DNA – až do délky přibližně 5-6 kb
- Mohou být použity k vytvoření stabilních buněčných linií nebo k řízení stabilní genové exprese v orgánech a tkáních in vivo, díky integraci transgenu na náhodných místech genomu
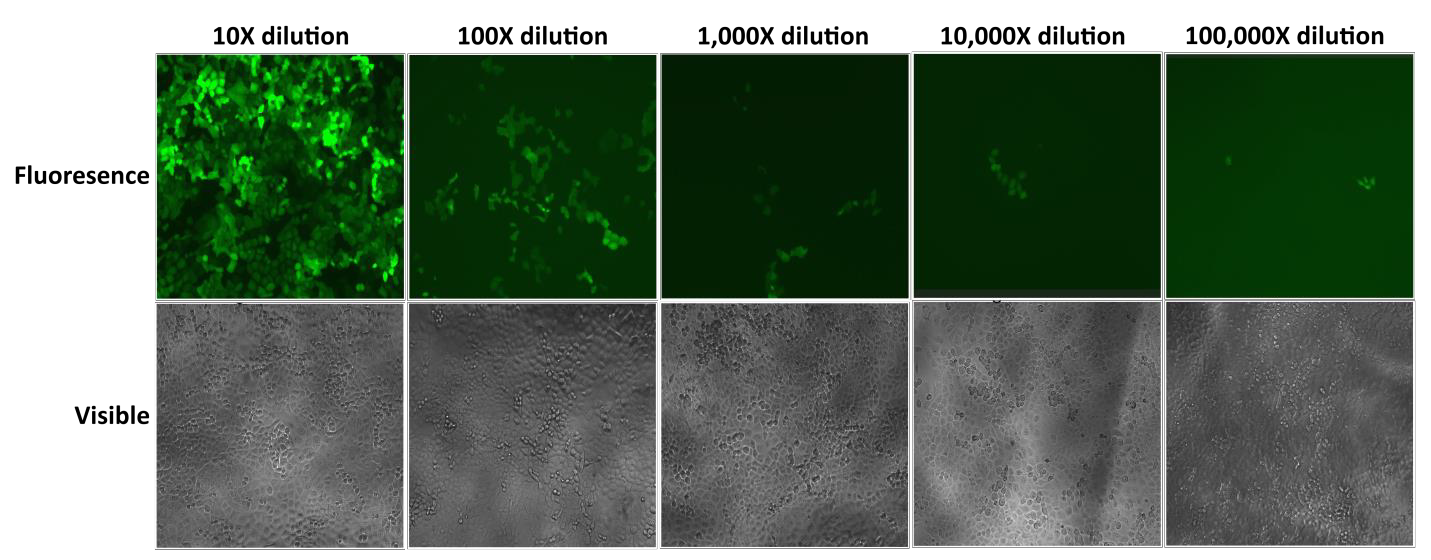
Lentivirové částice Lentifect™ společnosti GeneCopoeia poskytují vysoké titry, což výzkumníkům umožňuje účinně exprimovat geny, které je zajímají (obrázek 2).
|
Obrázek 2. Test sériových ředění lentivirových částic Lentifect™. eGFP fluorescence byla vyfotografována fluorescenčním mikroskopem 72 hodin po transdukci. |
|
GeneCopoeia nabízí jednu z nejširších řad lentivirových produktů v oboru (tabulka 1).
| Produkt/služba | Popis |
| Lentivirální klony a klonovací vektory | Předpřipravené a vlastní klony nesoucí ORF, promotory, shRNA, 3′ UTR miRNA, prekurzory a inhibitory, sgRNA a další. K dispozici s více promotory, značkami a reportéry. Vektory pro „do-it-yourself“ klonování zájmových sekvencí. |
| Lentivirové částice Lentifect™ | Předem vyrobené a na zakázku balené lentivirové částice připravené k použití. Vyrábějí se z rozsáhlých kolekcí genomových klonů společnosti GeneCopoeia nebo z klonů zaslaných zákazníkem. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Kompletní systém činidel pro výrobu lentivirových částic „udělej si sám“. Obsahuje obalovací plazmidy, obalovací buněčnou linii, roztok pro koncentraci částic a titrační soupravu. |
Tabulka 1. Řada lentivirových produktů a služeb společnosti GeneCopoeia.
Systémy založené na AAV
Na rozdíl od RNA genomu lentivirových virů má AAV jednovláknový genom DNA (Samulski a Muzyczka, 2014). AAV také není odvozen od patogenu; jedná se spíše o kontaminant adenoviru, kterému nejsou přisuzovány žádné patogenní podmínky. Přirozeně se vyskytující AAV se integruje do genomu podobně jako lentivirus, ale pouze v lokusu AAVS1 na chromozomu 19. Toto místo je také známé jako „bezpečný přístav“, protože se běžně používá pro vložení transgenu bez poškození buněk (DeKelver, et al., 2010).
Stejně jako lentivirus byl i AAV upraven pro bezpečnost a použitelnost. AAV vyžaduje koinfekci s pomocným virem. Genom AAV je dlouhý 4,7 kb a obsahuje 2 geny, Rep a Cap, které jsou nezbytné pro virovou replikaci a integraci. V AAVPrime™ jsou Rep a Cap odstraněny a zůstávají pouze 145 bp 5′ a 3′ invertované terminální repetice (ITR). Odstranění Rep a Cap slouží ke třem účelům: 1) eliminuje schopnost pomocného viru umožnit buňkám infikovaným AAV produkovat nové viriony AAV; 2) umožňuje vložení genů až do délky přibližně 4 kb (ačkoli titr viru se snižuje u transgenů delších než 3 kb); a 3) prakticky eliminuje schopnost AAV integrovat se. Malá velikost AAV představuje pro některé aplikace problém. Například pro editaci genomu pomocí CRISPR používají výzkumníci nukleázu Cas9 ze S. aureus, protože je asi o 30 % kratší než běžněji používaná Cas9 ze S. pyogenes (Ran, et al., 2015).
Pro balení byly Rep a Cap přesunuty na jiný plazmid a pomocné geny adenoviru jsou umístěny na třetím plazmidu, díky čemuž je celý balíčkovací systém bezpečný a neobsahuje pomocný virus (obr. 3).
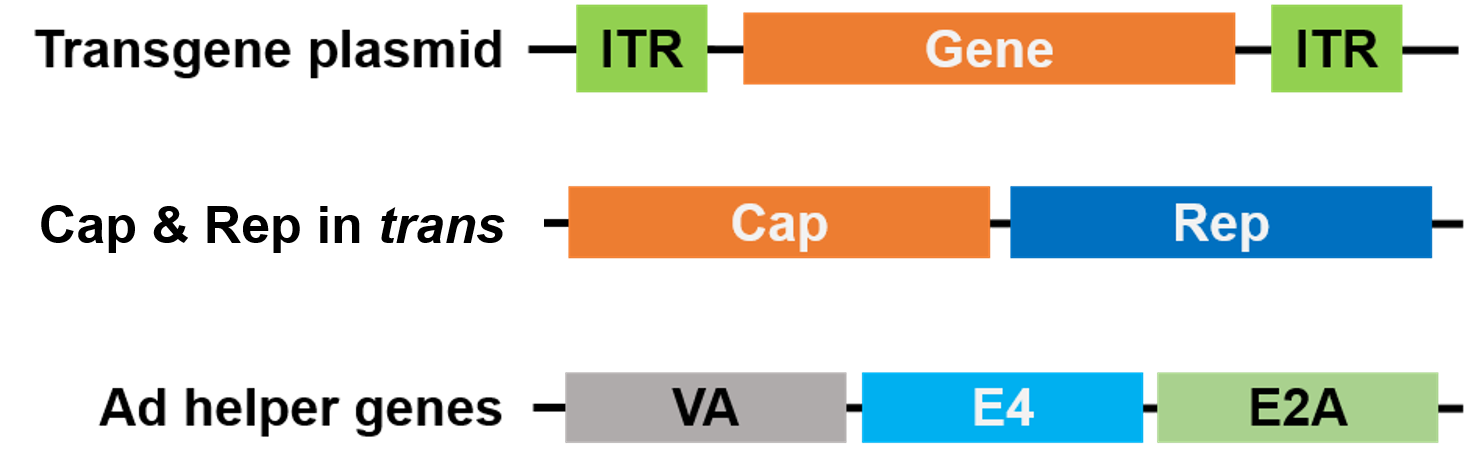 |
Obrázek 3. AAV bez pomocného viru. Pro balení jsou použity 3 plazmidy. Plazmid se zájmovým genem (nahoře) obsahuje invertované terminální repetice (ITR). Druhý plazmid (uprostřed) nese geny AAV Cap a Rep a třetí plazmid (dole) nese požadované geny z adenoviru (Ad) |
Dále AAV existuje v různých sérotypech, které ovlivňují tkáňovou specifitu infekce AAV. Více sérotypů umožňuje výzkumníkům buď a) infikovat širokou škálu hostitelských buněk, nebo b) omezit infekci na jednu nebo několik málo tkání. Částice AAVPrime™ společnosti GeneCopoeia jsou k dispozici ve více sérotypech (tabulka 2).
| Serotyp | Primární cílová tkáň | Popis |
| AAV-1 | Sval | Nejlepší pro srdeční sval, kosterní sval, neuronální a gliovou tkáň. |
| AAV-2 | Sval, játra, sítnice | Nejčastěji používaný sérotyp. Nejlepší pro neurony, svaly, játra a mozek. |
| AAV-3 | Megakaryocyty | Nejlepší pro megakaryocyty, svaly, játra, plíce a sítnici. |
| AAV-4 | Retina | Nejlepší pro neurony, svaly, mozek a sítnici. |
| AAV-5 | Plíce | Nejlepší pro plíce, neurony, synoviální kloub, sítnici a slinivku břišní. |
| AAV-6 | Sval, plíce | Nejlepší pro plíce, játra a srdce. |
| AAV-7 | Svaly, sítnice, neurony | Nejlepší pro svaly, neurony a játra. |
| AAV-8 | Játra | Nejlepší pro svaly, mozek, játra a sítnici. |
| AAV-9 | Různé | Nejlepší pro sval, srdce, játra, plíce a mozek. |
| AAV-10 | Pleura, CNS | Klonováno z Cynomolgus, téměř identické s AAVrh10 s výjimkou 12 aminokyselin ve VP1. Nejlepší pro plíce, svaly, srdce, NCS a játra. |
| AAV-DJ | Různé | Směs 8 přirozeně se vyskytujících sérotypů. Účinně transdukuje širokou škálu buněčných typů in vitro. |
| AAV-DJ/8 | Various | Varianta AAV-DJ s mutací domény vázající heparin (HBD), která umožňuje infekci jater i dalších tkání in vivo. |
Tabulka 2. Seznam široce používaných sérotypů AAV
Částice AAVPrime™ mají následující vlastnosti, které je činí velmi užitečnými pro přenos DNA:
- Vysoké titry. Titer purifikovaných částic může být až 10^14 GC/ml (kopií genomu/ml)
- Univerzální. Více sérotypů umožňuje použití v široké nebo omezené škále hostitelských buněk
- Nízká toxicita. Neintegruje se do genomu hostitele.
- Nízká imunogenita. Minimální imunitní odpověď hostitele.
- Bezpečný. Nesouvisí s žádným lidským onemocněním
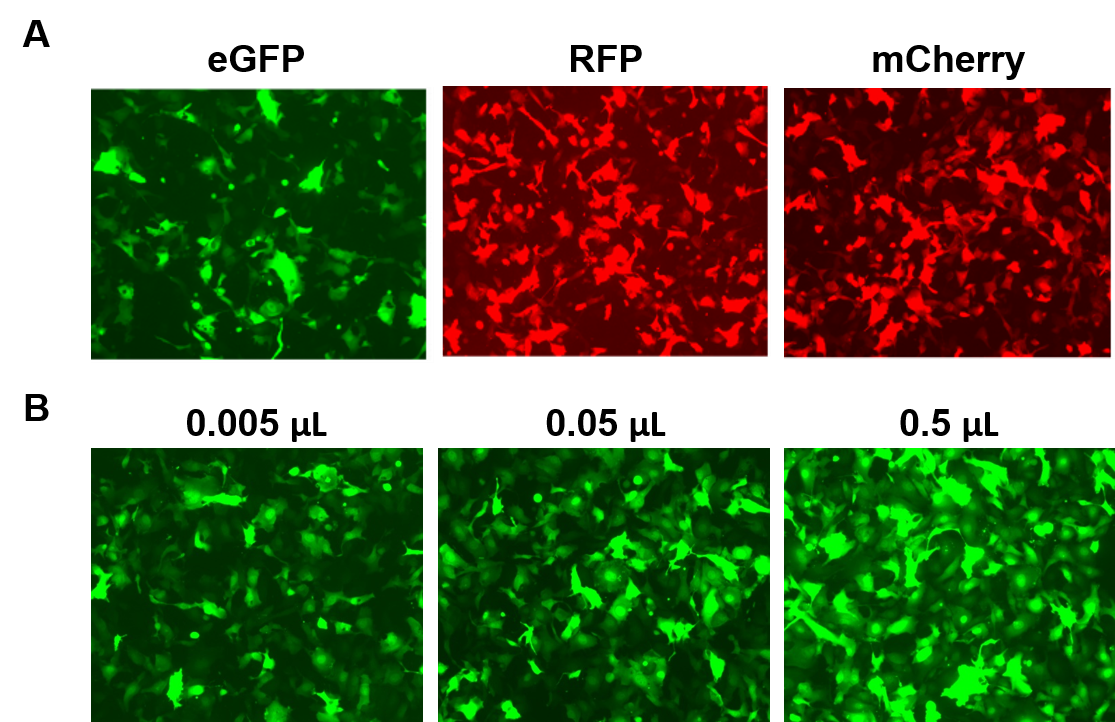
Částice AVPrime™ jsou k dispozici pro lidské a myší ORF do 3 kb, v několika sérotypech a variantách promotoru, buď ve standardní čistotě (pouze pro použití in vitro), nebo purifikované (pro použití in vivo). Zákazníci si mohou objednat klony plazmidů, částice vytvořené na zakázku pro geny, které je zajímají, nebo si vybrat z předem připravených možností exprimujících geny, jako jsou fluorescenční reportéry (Obrázek 4).
|
Obrázek 4. Výkonnost částic AAVPrime™ společnosti GeneCopoeia. A. Buňky HT1080 ve 24jamkových destičkách transdukované 0,5 µl AAV standardní čistoty exprimující rozšířený GFP (eGFP), červený fluorescenční protein (RFP) a monomerní Cherry (mCherry). B. Buňky HT1080 ve 24jamkových destičkách byly transdukovány různým množstvím purifikovaného AAV exprimujícího eGFP. Buňky byly vizualizovány pomocí fluorescenčního mikroskopu (doba expozice: 400 ms). |
|
Který mám vybrat:
Výběr mezi lenvirem a AAV závisí na mnoha faktorech. Například skutečnost, že se lentiviry integrují do genomu, může být výhodou i nevýhodou, podle toho, jaké jsou vaše potřeby. Při rozhodování vám pomůže níže uvedená tabulka:
| Větší inserty | Stabilní integrace | Ne integrace | Buněčná/tkáňová specifita | bezpečnost in vivo | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Pro více informací o virových systémech GeneCopoeia a pro objednání, navštivte naše webové stránky (https://www.genecopoeia.com/product/lentiviral-system/)
Závěry
Ve společnosti GeneCopoeia usilujeme o to, abychom vám poskytli produkty nejvyšší kvality a špičkové technologie v oblasti funkční genomiky a buněčné biologie. Nabízíme širokou škálu produktů od celogenomových sad klonů plasmidové DNA pro ORF, genové promotory, miRNA, shRNA a CRISPR, přes výkonné soupravy a reagencie až po produkty pro fluorescenční sondy buněčné struktury, kvantifikaci nukleových kyselin a značené protilátky. Chcete-li se dozvědět více, navštivte naše webové stránky www.genecopoeia.com nebo nás kontaktujte na adrese [email protected].
DeKelver, et al. (2010). Funkční genomika, proteomika a analýza regulační DNA v izogenním prostředí pomocí transgeneze řízené nukleázou zinkových prstů do lokusu bezpečného přístavu v lidském genomu. Genome Res 20, 1133.
Dull, et al. (1998). Lenvirový vektor třetí generace s podmíněným balíčkovacím systémem. J. Virol. 72, 8463.
Ran, et al. (2015). In vivo editace genomu pomocí Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Lentivirální vektory: od základních po translační. Biochem. J. 443, 603.
Samulski a Muzyczka (2014). Genová terapie zprostředkovaná AAV pro výzkumné a terapeutické účely. Annu. Rev. Virol. 1, 427.