Kun otetaan huomioon DNA:n suhteellinen rakenteellinen yksinkertaisuus ja toistuvuus, siitä seuraisi, että proteiineilla, jotka sitoutuvat siihen spesifisesti, voisi olla yhteisiä DNA:ta sitovia domeenimotiiveja, mutta joilla on erityisiä aminohappojen sivuketjuja, jotka mahdollistavat erityiset sitoutumisvuorovaikutukset.
- helix-turn-helix: esiintyy prokaryoottisissa DNA:ta sitovissa proteiineissa.
Kuvio: helix-turn-helix
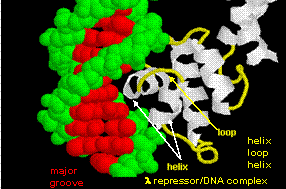
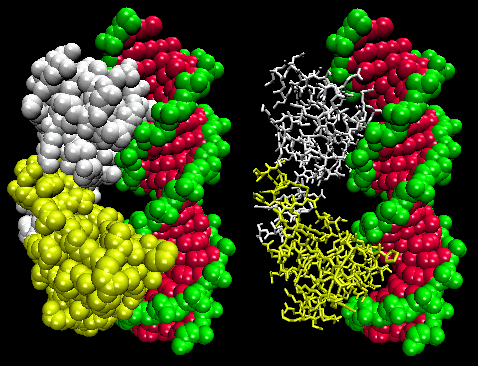
Kuvissa on esitetty kaksi tällaista proteiinia, cro-repressori bakteriofaagista 434 ja lambda-repressori bakteriofaagista lambda. (Bakteriofagit ovat viruksia, jotka infektoivat bakteereita.) Huomatkaa, miten spesifisyys saavutetaan osittain muodostamalla spesifisiä H-sidoksia proteiinin ja operaattori-DNA:n suurimman uran välille.
Kuva: Lambda-repressori/DNA-kompleksi
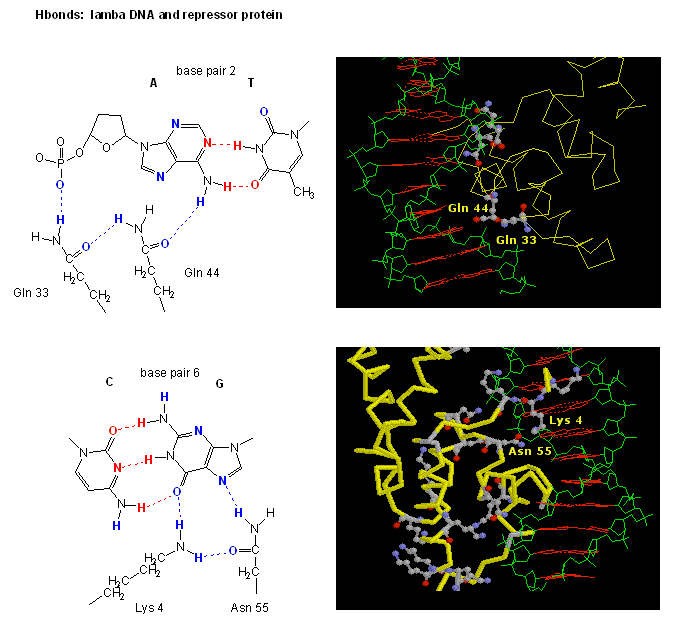
Kuva: H Bond -vuorovaikutuksetλ-repressorin ja DNA:n välillä
![]() Jmol: Jmol14 (Java) | JSMol (HTML5)
Jmol: Jmol14 (Java) | JSMol (HTML5)
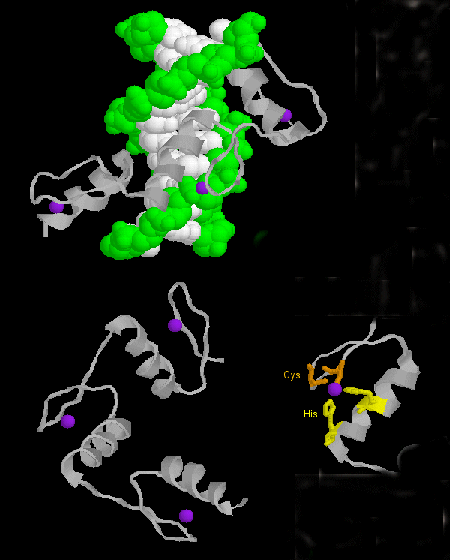
- sinkkisormi: (eukaryootit) Näillä proteiineilla on yhteinen sekvenssimotiivi X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4-, jossa X on mikä tahansa aminohappo. Zn2+ on tetraedrisesti koordinoitunut Cys- ja His-sivuketjujen kanssa, jotka ovat jommallakummalla kahdesta antiparalleelisesta beetasäikeestä ja vastaavasti alfakierteestä. Sinkkisormi, jota sinkki vakauttaa, sitoutuu DNA:n pääuraan. ]
Kuva: sinkkisormi
![]() Jmol: Päivitetty Zif268:DNA-kompleksi Jmol14 (Java) | JSMol (HTML5)
Jmol: Päivitetty Zif268:DNA-kompleksi Jmol14 (Java) | JSMol (HTML5)
Zn-sormiproteiineja, joita ihmisen genomissa on koodattu 900 kappaletta (mukaan lukien edellä kuvattu eukaryoottisia insulaattoreita sitova proteiini CTCF), voidaan mobilisoida varsinaiseen tiettyjen mutaatioiden korjaamiseen soluihin, mikä, jos se suoritetaan riittävän suuressa prosenttimäärässä mutanttisoluista soluja, voisi parantaa tietyt perinnölliset taudit, kuten tietyt vakavan yhdistelmäimmuunisairauden muodot. Tässä uudessa tekniikassa (Urnov et al., 2005) useita toisiinsa linkitettyjä Zn-sormea sitovia domeeneja (joko luonnossa esiintyviä tai laboratoriossa tuotettuja mutanttimuotoja), joista kukin on spesifinen tietylle nukleotidisekvenssille, yhdistetään FokI-entsyymistä peräisin olevaan epäspesifiseen endonukleaasiin. Nukleaasi on aktiivinen dimeerimuodossa, joten aktiivinen kompleksi vaatii kaksi endonukleaasidomeenia, jotka kumpikin ovat sitoutuneet neljään eri Zn-sormidomeeniin, kasatakseen kohdekohtaan. Sitoutumisen spesifisyys saavutetaan valitsemalla Zn-sormidomeenit. Tämän jälkeen nukleaasi tekee DNA:han niksauksen, ja isäntäsolun korjausmekanismit käynnistyvät. Tähän prosessiin kuuluu säikeiden erottuminen, nikkelöityneen alueen homologinen rekombinaatio komplementaarisen DNA:n kanssa solun sisällä ja nikkelin korjaaminen. Jos soluihin lisätään ylimääräistä villityyppistä (ei-mutatoitunutta) DNA:ta ja sitä käytetään mallina, normaali DNA:n korjausmutaatio korjaisi mutaation. Urnov ja muut ovat osoittaneet, että jopa 20 prosenttia mutaation sisältävistä viljellyistä soluista voidaan korjata laboratoriossa. Jos nämä solut saavat selektiivisen kasvuedun, mutaatioiden aiheuttamat solut korvattaisiin lopulta villityyppisillä soluilla.
- steroidihormonireseptorit: (eukaryootit) Toisin kuin useimmat hormonit, jotka sitoutuvat solupinnan reseptoreihin, steroidihormonit (kolesterolin johdannaiset) kulkevat solukalvon läpi ja sitoutuvat sytoplasman reseptoreihin hormonia sitovan domeenin kautta. Tämä muuttaa reseptorin muotoa, joka sitten sitoutuu DNA:ssa olevaan tiettyyn kohtaan (hormonivaste-elementti) DNA:ta sitovan domeenin kautta. Sinkkisormea vastaavassa rakenteessa Zn 2+ on tetraedrisesti koordinoituna neljään Cys:iin pallomaisessa rakenteessa, joka sitoutuu dimeerinä kahteen identtiseen, mutta käänteiseen DNA-sekvenssiin (palindromi) suuressa urassa. (Esimerkkejä palindromeista: Dennis ja Edna ruokailevat, sanoin minä, kun Enid ja Edna tekivät syntiä.
Tarkastellaan erityisenä esimerkkinä glukokortikoidireseptoria (GR). Se sitoo DNA:ta dimeerinä. Dimeerin kaksi DNA:ta sitovaa domeenia assosioituvat kahteen vierekkäiseen DNA:n pääuraan GR:n sitovassa sekvenssissä (GR binding sequence, GBS), joka on lyhyt DNA-sekvenssi promoottorin sisällä. Meijsing ym. ovat havainneet, että sen lisäksi, että GBS toimii GR:n sitoutumiskohtana ja mahdollistaa geenien transkription, se vaikuttaa myös reseptorin konformaatioon, jolloin geenien transkriptiota säädellään toisella tavalla. Ryhmä rakensi luciferaasi-”reportterigeenejä”, joissa GBS on yhdistetty proteiinin luciferaasin geeniin, joka ilmentäisi proteiinia luciferaasia (joka fluoresoi), jos niitä transkriboitaisiin, GBS:n kanssa. He havaitsivat, että suhteellinen transkriptionaalinen aktiivisuus ei korreloinut GR:n suhteelliseen sitoutumisaffiniteettiin GBS:ään. GBS:t, jotka olivat paljon aktiivisempia kuin muut, sitoutuivat vertailukelpoisesti vähemmän aktiivisten GBS:ien kanssa, kun taas GBS:t, joilla oli samanlainen transkriptionaalinen aktiivisuus, sitoutuivat eri affiniteetilla. Tämä osoittaa, että GBS antaa siihen liittyvälle GR:lle ainutlaatuisen toiminnon (eli transkriptioon ei vaikuta pelkästään se, onko GR sitoutunut GBS:ään vai ei). Reseptorin �vipuvarren� havaittiin tekevän konformaatiomuutoksia sitoutuessaan DNA:han, ja muutokset olivat spesifisiä sille sekvenssille, johon se oli sitoutunut. Mutanttiproteiinista, GR-γ:stä, tehtiin identtinen villityyppiproteiinin, GR-α:n, kanssa, paitsi vipuvarren osalta havaittiin, että sillä oli erilainen transkriptionaalinen aktiivisuus, vaikka ne sitoutuivat samaan kohtaan DNA:lla, mikä osoitti, että vipuvarsi ja sen konformaatio vaikuttavat transkriptioon.
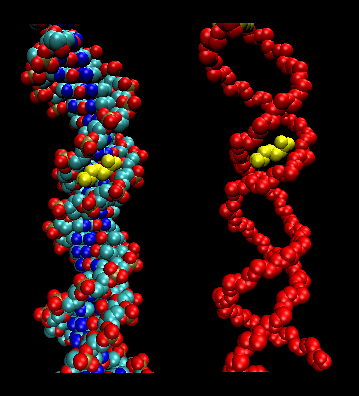
- Leusiini-vetoketjuja (tai saksia): (eukaryootit) Nämä proteiinit sisältävät 35 aminohapon pituisia jaksoja, joissa Leu esiintyy toistuvasti 7 aminohapon välein. Nämä proteiinin alueet muodostavat amfifiilisiä kierteitä, joissa Leu on toisella puolella, yksi Leu kahden kierroksen jälkeen kierteessä. Kaksi näistä proteiineista voi muodostaa dimeerin, jota vakauttaa näiden poolittomien, leusiinirikkaiden amfifiilisten kierteiden sitoutuminen toisiinsa, jolloin muodostuu kierre, aivan kuten lihasproteiini myosiinissa. Leusiinivetoketju edustaa proteiinin proteiineja sitovaa domeenia. DNA:ta sitova domeeni löytyy 30 ensimmäisestä N-terminaalisesta aminohaposta, jotka ovat emäksisiä ja muodostavat alfa-kierteen, kun proteiini sitoutuu DNA:han. Tämän jälkeen leusiinivetoketju yhdistää kaksi DNA:ta sitovaa proteiinia toisiinsa, jolloin N-terminaaliset emäskierteet voivat vuorovaikuttaa DNA:n suuren uran kanssa emäskohtaisesti. Valiini ja isoleusiini sekä leusiini esiintyvät usein aminohappojen jaksoissa, jotka voivat vuorovaikuttaa keskenään muodostaen muuntyyppisiä kierukkakeloja.
Kuva: leusiinivetoketjut (tehty VMD:llä)
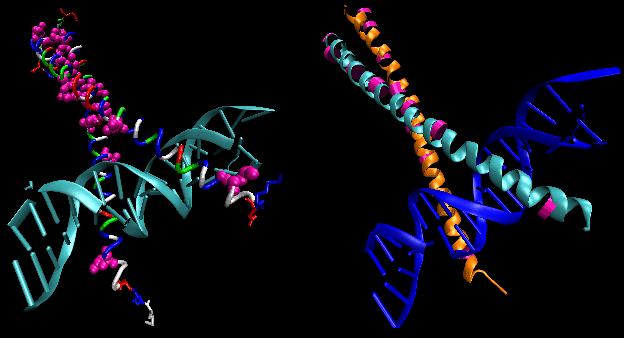
![]() Jmol: Päivitetty leusiinivetoketju Jmol14 (Java) | JSMol (HTML5)
Jmol: Päivitetty leusiinivetoketju Jmol14 (Java) | JSMol (HTML5)
Aivan kuten sinkkisormi-nukleaaseja on käytetty mutaatioiden korjaamisen indusoimiseen, eräässä toisessa rotan genomin tutkimuksessa käytettiin erityisesti suunniteltuja ZFN:iä aiheuttamaan ds-DNA:han katkoksia, jotka sisälsivät mutaatioita DNA:n korjaamismekanismin (NHEJ:n avulla) virheellisestä korjaantumisesta johtuvia mutaatioita ja jotka siten sisälsivät spesifisiä mutaatioita (Geurts, et al. 2009). Tämä prosessi, �knockout of the gene,� estää kohdegeenin normaalisti transkriboiman proteiinin tuotannon. Viisi- ja kuusisormisia ZFN:iä käytettiin, jotta saavutettiin korkea spesifisyys kohdennetussa sitoutumisessa geeniin kolmelle eri proteiinille: vihreää fluoresoivalle proteiinille (GFP), immunoglobuliini M:lle (IgM) ja Rab38:lle. Tyrmäys onnistui 12 prosentilla testatuista rotista; näillä eläimillä ei ollut villityyppistä proteiinia eikä ekspressiota. ZFN:t olivat riittävän spesifisiä, sillä mutaatioita ei havaittu yhdessäkään 20:stä ennustetusta ei-kohdekohdasta. Tämä tutkimus tukee transkription ja ekspression hallinnan elinkelpoisuutta sairauksien hoidossa ja spesifisen sitoutumisen merkitystä.
Olemme nähneet, että kaksi päätekijää vaikuttaa siihen, että proteiinit tunnistavat DNA:n spesifisesti; vetysidosten muodostuminen tiettyihin nukleotidien luovuttajiin ja aksepteereihin isossa urassa ja DNA-kierteen sekvenssistä riippuvaiset muodonmuutokset muuttuneisiin muotoihin, joilla on proteiiniligandien lisääntynyt affiniteetti. Esimerkiksi Tata Binding Protein (TBP) voi olla vuorovaikutuksessa TATA-laatikon laajentuneen pienen uran kanssa. Uudet havainnot tukevat sitä, että lisäksi proteiinit pystyvät käyttämään nukleotidisekvenssistä riippuen ”kaventuneissa” pienemmissä urissa olevaa informaatiota.
A:n rikastuttamat DNA:n raidat voivat johtaa vääntyviin konformaatioihin, jotka aiheuttavat emäsparien välisiä vetysidoksia suurimmissa urissa, mikä johtaa pienempien urien kaventumiseen. Suuret määrät AT-emäspareja keskittyvät kapeisiin minor-uriin (leveys <5,0 �) ja CG-emäspareja esiintyy useammin leveissä minor-urissa.
Miten minor-urien kaventuminen vaikuttaa DNA:n tunnistamiseen? Kapeat pienet urat parantavat DNA:n negatiivista sähköstaattista potentiaalia, mikä tekee siitä spesifisemmän ja tunnistettavamman paikan. DNA:n selkärangan fosfaatit ovat lähempänä uran keskikohtaa, kun ura on kapea, mikä korreloi kapeiden sivuurien ja negatiivisemman sähköstaattisen potentiaalin välillä.
Proteiinien pienen uran kanssa vuorovaikutuksessa olevat osat sisältävät arginiinia, jonka sivuketju mahtuu kapeampaan ja negatiivisempaan pieneen uraan. Arginiinit voivat sitoutua ja joissakin tapauksissa asettautua lyhyinä sekvenssimotiiveina, jotka parantavat DNA-muodon tunnistamisen spesifisyyttä. Arg on suositeltavampi kuin Lys, koska Argissa olevan varauksen efektiivinen säde on suurempi kuin Lysissä olevan varauksen kantajan. Tämä johtaisi Argin pienempään desolvaatioenergiaan, mikä edistäisi sen sitoutumista kaventuneeseen pääuraan. Tämä löytö osoittaa, että ”DNA:n muodon merkitys on otettava huomioon, kun annotoidaan koko genomia ja ennustetaan transkriptiotekijöiden sitoutumiskohtia”.
Kuvio: Arg in T3c Transposase binding in Narrowed Minor Grove of T3c Transposon
- Liukumalli proteiinin ja DNA:n välisille vuorovaikutuksille
Contributors and Attributions
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)