Brønsted-Lowry-definitionen af surhed og basiskhed
Vi vil begynde vores diskussion af syre-base-kemi med et par væsentlige definitioner. Den første af disse blev foreslået i 1923 af den danske kemiker Johannes Brønsted og den engelske kemiker Thomas Lowry, og den er blevet kendt som Brønsted-Lowry-definitionen af surhed og basiskhed. Ifølge Brønsted-Lowry-definitionen er en syre en art, der fungerer som protonedonor, mens en base er en protonacceptor. Vi har allerede i det foregående kapitel diskuteret et af de mest kendte eksempler på en Brønsted-Lowry-syre-base-reaktion, nemlig mellem saltsyre og hydroxidion:
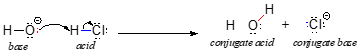
I denne reaktion overføres en proton fra HCl (syren, eller protonedonoren) til hydroxidionen (basen, eller protonacceptoren). Som vi lærte i det foregående kapitel, skildrer buede pile elektronernes bevægelse i denne bindingsbrydende og bindingsdannende proces.
Når en Brønsted-Lowry-syre afgiver en proton, kaldes det, der er tilbage, den konjugerede base. Kloridionen er således den konjugerede base for saltsyre. Omvendt bliver en Brønsted-Lowry-base, når den afgiver en proton, omdannet til sin konjugerede syreform: vand er således hydroxidionens konjugerede syre.
Her er en organisk syre-base-reaktion, mellem eddikesyre og methylamin:
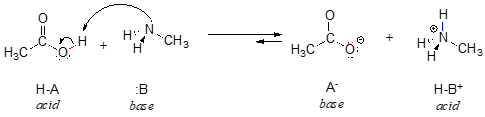
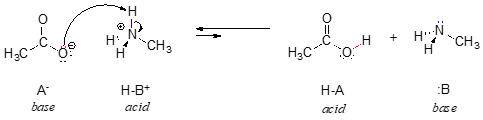
I den omvendte del af denne reaktion er acetat-ionen basen og methylammonium-ionen (protoneret methylamin) syren.
Hvad gør en forbindelse sur (tilbøjelig til at afgive en proton) eller basisk (tilbøjelig til at acceptere en proton)? At besvare dette spørgsmål er en af vores vigtigste opgaver i dette kapitel, og det vil kræve, at vi bruger meget af det, vi lærte om organisk struktur i de to første kapitler, samt de ideer om termodynamik, som vi gennemgik i kapitel 6.
For nu skal vi blot se på en fælles egenskab for baser: For at kunne fungere som base skal et molekyle have et reaktivt elektronpar. I alle de syre-base-reaktioner, som vi vil se i dette kapitel, har den basiske art et atom med et ensomt elektronpar. Når methylamin f.eks. optræder som base, bruges det ensomme elektronpar på nitrogenatomet til at danne en ny binding til en proton.
Det er klart, at methylammoniumionen ikke kan optræde som base – den har ikke et reaktivt elektronpar, hvormed den kan acceptere en proton.
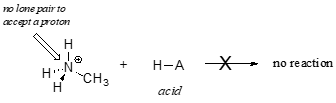
Sidst, i kapitel 14, vil vi studere reaktioner, hvor et elektronpar i en binding i en alken- eller aromatisk ring virker basisk – men for nu vil vi koncentrere os om basiskheden af ikke-bundende (lone pair) elektroner.
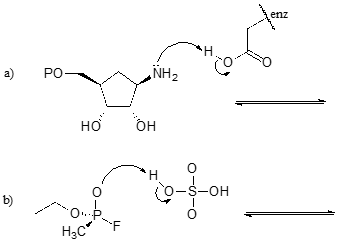
Ovelse \(\PageIndex{1}\)
Fuldfør nedenstående reaktioner – med andre ord, tegn strukturer for de manglende konjugerede syrer og konjugerede baser, som er resultatet af de angivne buede pile.