Definition af surhedskonstanten
Du er uden tvivl klar over, at nogle syrer er stærkere end andre. Den relative surhedsgrad af forskellige forbindelser eller funktionelle grupper – med andre ord deres relative evne til at afgive en proton til en fælles base under identiske forhold – kvantificeres ved et tal kaldet surhedsgraden konstant, forkortet \(K_a\). Den fælles base, der er valgt til sammenligning, er vand.
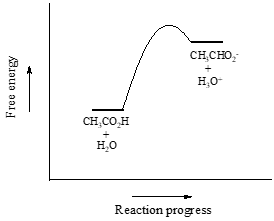
Vi vil betragte eddikesyre som vores første eksempel. Hvis vi laver en fortyndet opløsning af eddikesyre i vand, opstår der en syre-base-reaktion mellem syren (protonedonor) og vandet (protonacceptor).

Acetinsyre er en svag syre, så ligevægten favoriserer reaktanterne frem for produkterne – det er termodynamisk set “op ad bakke”. Dette er angivet i figuren ovenfor ved den relative længde af de fremadrettede og omvendte reaktionspile.
Gligevægtskonstanten \(K_{eq}\) er defineret som:
\}{} = \frac{}{}}\]
Husk, at der er tale om en fortyndet vandig opløsning: Vi har tilsat en lille mængde eddikesyre til en stor mængde vand. Derfor ændrer koncentrationen af vand (ca. 55,6 mol/L) sig meget lidt i løbet af reaktionen og kan derfor behandles som en konstant.
Hvis vi flytter det konstante udtryk for koncentrationen af vand til venstre side af udtrykket for ligevægtskonstanten, får vi udtrykket for \(K_a\), syrekonstanten for eddikesyre:
\ = \frac{}{}{}\]
I mere generelle vendinger udtrykkes dissociationskonstanten for en given syre HA eller HB+ som:
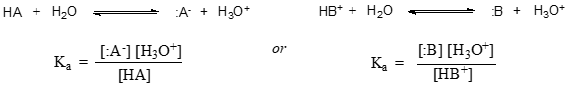
Værdien af \(K_a\) for eddikesyre er \(1.75 \ gange 10^{-5}\) – meget mindre end \(1\), hvilket indikerer, at der er meget mere eddikesyre i opløsningen ved ligevægt end acetat- og hydroniumioner.
Og omvendt undergår svovlsyre, med en \(K_a\) på ca. \(10^9\), eller saltsyre, med en \(K_a\) på ca. \(10^7\), begge en stort set fuldstændig dissociation i vand: de er meget stærke syrer.
Et tal som \(1,75 \ gange 10^{- 5}\) er ikke særlig let at sige, huske eller visualisere, så kemikere bruger normalt et mere praktisk udtryk til at udtrykke den relative surhedsgrad. Værdien \(pK_a\) for en syre er simpelthen logaritmen (base 10) af dens \(K_a\)-værdi.
\
Ved beregning finder vi, at \(pK_a\) for eddikesyre er \(4,8\). \(pK_a\) for svovlsyre er -10, og for saltsyre er -7. Brugen af \(pK_a\)-værdier giver os mulighed for at udtrykke den relative surhedsgrad af almindelige forbindelser og funktionelle grupper på en numerisk skala fra ca. -10 (for en meget stærk syre) til 50 (for en forbindelse, der slet ikke er sur). Jo lavere \(pK_a\)-værdien er, jo stærkere syre.
De ioniserbare (protonafgivende eller -accepterende) funktionelle grupper, der er relevante for biologisk organisk kemi, har generelt \(pK_a\)-værdier på mellem ca. 5 og ca. 20. De vigtigste af disse er opsummeret nedenfor, med meget grove \(pK_a\)-værdier for de konjugerede syreformer. Flere syreholdige grupper med \(pK_a\)-værdier nær nul er også medtaget som reference.
Typiske \(pK_a\) værdier
| gruppe | omtrentlige \(pK_a\) | |
|---|---|---|
| hydroniumion | 0 | |
| protoneret alkohol | 0 | |
| protoneret carbonyl | 0 | 0 |
| carboxylsyrer | 5 | |
| protonerede iminer | 7 | |
| protonerede aminer | ||
| protonerede aminer | 10 | |
| phenoler | 10 | |
| thioler | 10 | |
| alkoholer, vand | 15 | |
| \(\alpha\)-kulstofsyrer * | 20 |
*\(\alpha\)-kulstofsyrer vil blive forklaret i afsnit 7.6A
Det kan stærkt anbefales at huske disse grove værdier nu – hvis du så har brug for en mere præcis værdi, kan du altid slå den op i en mere komplet \(pK_a\)-tabel. Bilaget til denne bog indeholder en mere detaljeret tabel med typiske \(pK_a\)-værdier, og der findes langt mere komplette tabeller i kilder som Handbook of Chemistry and Physics.
\(pK_a\) vs. \(pH\)
Det er vigtigt at være opmærksom på, at \(pK_a\) ikke er det samme som \(pH\): førstnævnte er en iboende egenskab ved en forbindelse eller funktionel gruppe, mens sidstnævnte er et mål for hydroniumionkoncentrationen i en given vandig opløsning:
\\\]
Ved kendskab til \(pK_a\)-værdierne kan vi ikke kun sammenligne syrestyrken, men også basestyrken. Den vigtigste idé at huske er følgende: jo stærkere den konjugerede syre er, jo svagere er den konjugerede base. Vi kan konstatere, at hydroxidionen er en stærkere base end ammoniak (\(NH_3\)), fordi ammoniumionen (\(NH4^+\), \(pK_a = 9.2\))) er en stærkere syre end vand (\(pK_a = 15,7\)).
Ovelse \(\(\PageIndex{1}\)
Hvilken er den stærkere base, \(CH_3O^-\) eller \(CH_3S^-\)? Acetat-ion eller ammoniak? Hydroxid-ion eller acetat-ion?
Lad os bruge vores forståelse af \(pK_a\)-begrebet i forbindelse med et mere komplekst molekyle. Hvad er f.eks. \(pK_a\) for nedenstående forbindelse?

Vi skal vurdere den potentielle surhedsgrad for fire forskellige typer af protoner på molekylet og finde den mest sure af dem. De aromatiske protoner er ikke alle sure – deres \(pK_a\) er ca. 45. Amingruppen er heller ikke sur, dens \(pK_a\) er ca. 35. (Husk, at uladede aminer er basiske: det er positivt ladede protonerede aminer med \(pK_a\)-værdier omkring 10, der er svagt sure). Alkoholprotonen har en \(pK_a\) på ca. 15, og phenolprotonen har en \(pK_a\) på ca. 10: den mest sure gruppe på molekylet ovenfor er således phenolen. (Vær sikker på, at du kan genkende forskellen mellem en phenol og en alkohol – husk, at i en phenol er \(OH\)-gruppen bundet direkte til den aromatiske ring). Hvis dette molekyle skulle reagere med en molær ækvivalent af en stærk base som f.eks. natriumhydroxid, er det phenolprotonen, som vil blive doneret til dannelse af en phenolatanion.
Ovelse \(\PageIndex{2}\)
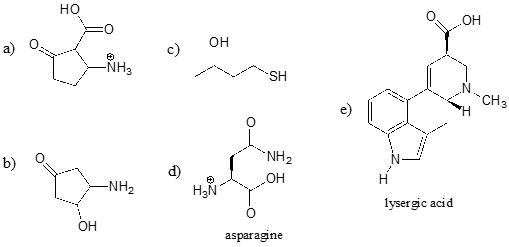
Identificer den mest sure funktionelle gruppe på hvert af nedenstående molekyler, og angiv dens omtrentlige \(pK_a\).