I betragtning af DNA’s relative strukturelle enkelhed og gentagelighed ville det følge heraf, at proteiner, der binder specifikt til det, kunne have fælles DNA-bindende domænemotiver, men med specifikke aminosyrer sidekæder, der giver mulighed for specifikke bindingsinteraktioner.
- helix-turn-helix: findes i prokaryote DNA-bindingsproteiner.
Figur: helix-turn-helix
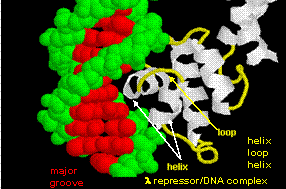
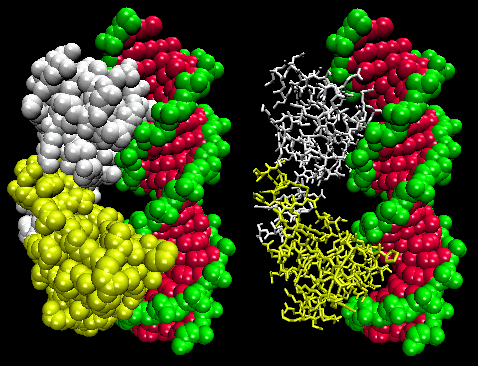
Figurerne viser to sådanne proteiner, cro-repressoren fra bakteriofagen 434 og lambda-repressoren fra bakteriofagen lambda. (Bakteriofager er vira, der inficerer bakterier.) Bemærk, hvordan specificitet opnås bl.a. ved dannelse af specifikke H-bindinger mellem proteinet og den store lunge i operator-DNA’et.
Figur: Lambda-repressor/DNA-kompleks
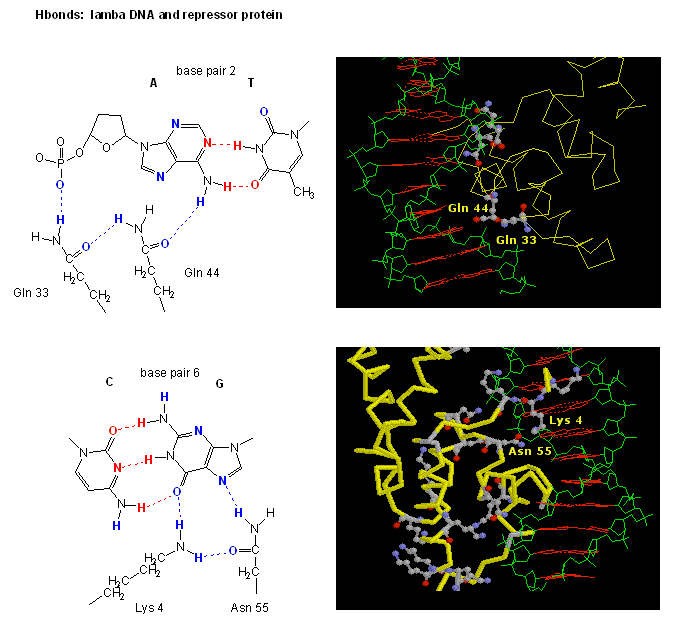
Figur: H-båndsinteraktioner mellemλ-repressor og DNA
![]() Jmol: Opdateret Lambda-repressor/DNA-kompleks Jmol14 (Java) | JSMol (HTML5)
Jmol: Opdateret Lambda-repressor/DNA-kompleks Jmol14 (Java) | JSMol (HTML5)
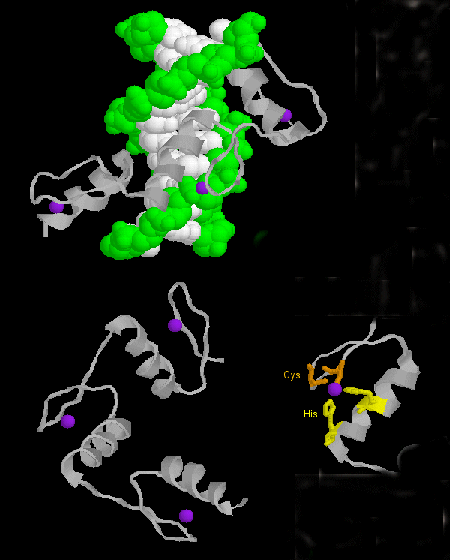
- zinkfinger: (eukaryoter) Disse proteiner har et fælles sekvensmotiv af X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4-, hvor X er en hvilken som helst aminosyre. Zn2+ er tetraedrisk koordineret med Cys- og His-sidekæderne, som befinder sig på henholdsvis en af to antiparallelle betastrømme og en alfa-helix. Zinkfingeren, der er stabiliseret af zinken, binder sig til DNA’s store rille. ]
Figur: Zinkfinger
![]() Jmol: Zif268:DNA-komplekset Jmol14 (Java) | JSMol (HTML5)
Jmol: Zif268:DNA-komplekset Jmol14 (Java) | JSMol (HTML5)
Zn-fingerproteiner, hvoraf 900 er kodet i det menneskelige genom (herunder det eukaryote isolatorbindende protein CTCF, der er beskrevet ovenfor), kan mobiliseres til faktisk at reparere specifikke mutationer i celler, hvilket, hvis det udføres i en tilstrækkelig høj procentdel af mutante celler, kan helbrede specifikke genetiske sygdomme som f.eks. nogle former for svær kombineret immundefekt. I denne nye teknik (Urnov et al., 2005) er flere forbundne Zn-finger-bindingsdomæner (et af de naturligt forekommende eller muterede former fremstillet i laboratoriet), som hver især er specifikke for en bestemt nukleotidsekvens, forbundet med en uspecifik endonuklease, der er afledt af enzymet FokI. Nukleasen er aktiv i dimerisk form, så det aktive kompleks kræver to endonuklease-domæner, der hver er bundet til fire forskellige Zn-fingerdomæner, for at samles på målstedet. Specificitet i bindingen opnås ved selektion af Zn-fingerdomænerne. Nukleasen laver derefter et hak i DNA’et, og værtscellens reparationsmekanismer følger. Denne proces omfatter separation af strengene, homolog rekombination af den indsnævrede region med komplementært DNA i cellen og reparation af indsnævringen. Hvis overskydende vild type (ikke-muteret) DNA tilføjes til cellerne og anvendes som skabelon, vil den normale DNA-reparationsmutation reparere mutationen. Urnov et al. har vist, at op til 20% af de dyrkede celler, der indeholder en mutation, kan repareres i laboratoriet. Hvis disse celler får en selektiv vækstfordel, vil de muterede celler i sidste ende blive erstattet af vildtypeceller.
- steroide hormonreceptorer: (eukaryoter) I modsætning til de fleste hormoner, som binder sig til receptorer på celleoverfladen, passerer steroidhormoner (derivater af kolesterol) gennem cellemembranen og binder sig til cytoplasmatiske receptorer gennem et hormonbindende domæne. Dette ændrer receptorens form, som derefter binder sig til et specifikt sted på DNA’et (hormonresponselementet) gennem et DNA-bindingsdomæne. I en struktur, der svarer til zinkfingeren, er Zn 2+ tetraedrisk koordineret til 4 Cys i en kuglelignende struktur, der binder som en dimer til to identiske, men omvendte DNA-sekvenser (palindrom) inden for den store lunge. (Eksempler på palindromer: Jeg var dygtig, før jeg så Elba; Dennis og Edna spiser, sagde jeg, mens Enid og Edna syndede.
Tænk på glukokortikoidreceptoren (GR) som et specifikt eksempel. Den binder DNA som en dimer. Dimerens to DNA-bindingsdomæner forbinder sig med to tilstødende store riller i DNA’et i GR-bindingssekvensen (GBS), en kort DNA-sekvens inden for promotoren. Meijsing, et al. har fundet ud af, at GBS ikke blot fungerer som et bindingssted for GR, hvilket muliggør transkription af gener, men at den også påvirker receptorens konformation, hvilket medfører, at gentranskriptionen reguleres på en anden måde. Gruppen konstruerede luciferase-“reportagergener”, som har GBS knyttet til genet for proteinet luciferase, der ville udtrykke proteinet luciferase (som fluorescerer), hvis de blev transskriberet, med GBS. De fandt, at den relative transkriptionelle aktivitet ikke korrelerede med den relative bindingsaffinitet af GR til GBS’et. GBS’er, der var meget mere aktive end andre, bandt på samme måde som dem med lavere aktivitet, mens GBS’er med lignende transkriptionel aktivitet bandt med forskellig affinitet. Dette viser, at GBS’et giver en unik funktion til den GR, der er knyttet til det (dvs. at transkriptionen ikke blot påvirkes af, om GR’et er bundet til GBS’et eller ej). Det blev konstateret, at en �leverarm� af receptoren undergår konformationsændringer, når den er bundet til DNA, med ændringer, der er specifikke for den sekvens, som den var bundet til. Et mutantprotein, GR-γ, blev fremstillet til at være identisk med vildtypeproteinet, GR-α, bortset fra i løftestangsarmen viste sig at have forskellig transkriptionel aktivitet, selv om de var bundet til det samme sted på DNA’et, hvilket viser, at løftestangsarmen og dens konformation påvirker transkriptionen.
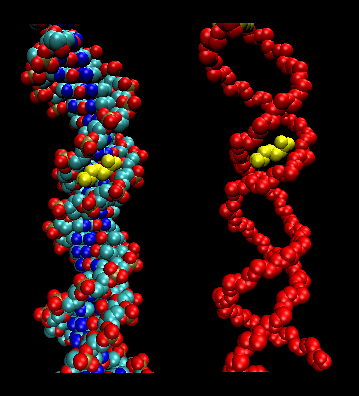
- leucine lynlåse (eller sakse): (eukaryoter) Disse proteiner indeholder strækninger på 35 aminosyrer, hvor Leu findes gentagne gange med 7 aminosyreintervaller. Disse områder af proteinet danner amfifile helikser, med Leu på den ene side, en Leu efter to vindinger af en helix. To af disse proteiner kan danne en dimer, der stabiliseres ved at binde disse upolære, leucinrige amfifile helikser til hinanden og danne en spiralspole, ligesom i muskelproteinet myosin. Leucin-zipperen repræsenterer proteinets proteinbindingsdomæne. DNA-bindingsdomænet findes i de første 30 N-terminale aminosyrer, som er basiske og danner en alfa-helix, når proteinet binder sig til DNA. Leucin-zipperen fungerer derefter til at bringe to DNA-bindingsproteiner sammen, således at de N-terminale baser helikser kan interagere med DNA’s store lunge på en base-specifik måde. Valin og isoleucin findes sammen med leucin ofte i strækninger af aminosyrer, der kan interagere for at danne andre typer af coiled coils.
Figur: leucin-zippers (lavet med VMD)
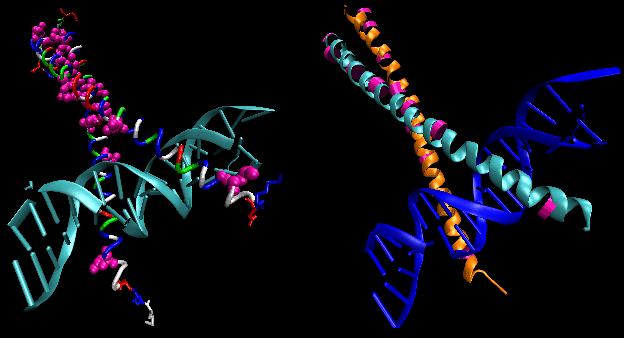
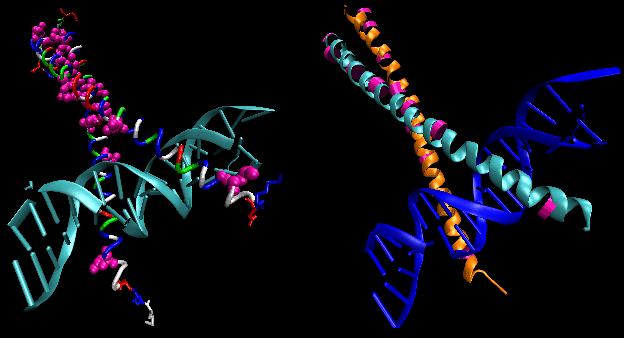
![]() Jmol: Opdateret leucin lynlås Jmol14 (Java) | JSMol (HTML5)
Jmol: Opdateret leucin lynlås Jmol14 (Java) | JSMol (HTML5)
Ligesom Zinkfingernukleaser er blevet brugt til at fremkalde reparation af mutationer, blev der i en anden undersøgelse af rottegenomet brugt specielt designede ZFN’er til at forårsage brud i ds-DNA, der indeholder mutationer fra unøjagtige DNA-reparationsmekanismer (ved NHEJ) og dermed indeholdt specifikke mutationer (Geurts, et al. 2009). Denne proces, �knockout of the gene,� forhindrer produktionen af det protein, der normalt transskriberes af målgenet. Der blev anvendt ZFN’er med fem og seks fingre for at opnå en høj grad af specificitet i den målrettede binding til genet for tre forskellige proteiner: grønt fluorescerende protein (GFP), immunoglobulin M (IgM) og Rab38. Knockout-proteinet lykkedes i 12 % af de testede rotter; disse dyr havde intet wild-type-protein og ingen ekspression. ZFN’erne var tilstrækkeligt specifikke til, at der ikke blev observeret nogen mutationer på nogen af de 20 forudsagte ikke-målesteder. Denne undersøgelse understøtter levedygtigheden af kontrol af transkription og ekspression til behandling af sygdomme og betydningen af specifik binding.
Vi har set, at to hovedfaktorer bidrager til proteiners specifikke genkendelse af DNA; dannelsen af hydrogenbindinger til specifikke nukleotiddonorer og -acceptorer i den store rille og sekvensafhængige deformationer af DNA-helixen til ændrede former med øget affinitet for proteinligander. F.eks. kan Tata Binding Protein (TBP) interagere med en udvidet mindre rille i TATA-boxen. Nye resultater understøtter, at proteiner desuden er i stand til at udnytte information i mindre riller, der er blevet “indsnævret” afhængigt af nukleotidsekvensen.
Spor af DNA, der er beriget med A, kan føre til snoede konformationer, der forårsager inter-basepar hydrogenbinding i de større riller, hvilket resulterer i indsnævring af mindre riller. Store mængder AT-basepar er koncentreret i smalle mindre riller (bredde <5,0 �), og CG-basepar findes hyppigere i brede mindre riller.
Hvordan påvirker indsnævring af mindre riller DNA-genkendelse? Smalle minor groves øger DNA’ets negative elektrostatiske potentiale, hvilket gør det til et mere specifikt og genkendeligt sted. DNA’s backbone-fosfater er tættere på midten af rillen, når den er smal, og dermed korrelerer smalle minor grooves med et mere negativt elektrostatisk potentiale.
De dele af proteiner, der interagerer med minor grove, indeholder arginin, hvis sidekæde kan rummes i den mere smalle og negative minor groove. Argininer kan binde og i nogle tilfælde indsætte sig selv som korte sekvensmotiver, der øger specificiteten af DNA-formgenkendelsen. Arg foretrækkes frem for Lys, da den effektive radius for ladningen i Arg er større end for ladningsbæreren i Lys. Dette ville føre til en lavere desolvationsenergi for Arg, hvilket ville fremme dets binding til den indsnævrede hovedrille. Denne opdagelse viser, at “DNA-formens rolle skal tages i betragtning ved annotering af hele genomet og forudsigelse af transkriptionsfaktor-bindingssteder”.
Figur: Arg i T3c Transposase binding i indsnævret mindre lund af T3c Transposon
- Sliding Model for protein/DNA Interactions
Kontributorer og tilskrivninger
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)