Editorial om forskningstemaet
The Role of AAA+ Proteins in Reparation og nedbrydning af proteiner
ATPaser, der er associeret med forskellige cellulære aktiviteter (AAA+), omfatter en superfamilie af proteiner, der udfører en lang række funktioner, som er afgørende for cellens fysiologi, herunder kontrol af proteinhomøostase, DNA-replikation, rekombination, kromatinomdannelse, ribosomal RNA-processering, molekylær målretning, organelbiogenese og membranfusion (Hanson og Whiteheart, 2005; Erzberger og Berger, 2006; Snider et al., 2008). Medlemmer af denne superfamilie er defineret ved tilstedeværelsen af det såkaldte AAA+-domæne, der indeholder de kanoniske Walker A- og B-motiver, som er nødvendige for ATP-binding og -hydrolyse (Hanson og Whiteheart, 2005). Typisk koder genomerne for ca. ti til flere hundrede AAA+-familiemedlemmer (tabel 1; Finn et al., 2017), som hver især menes at være tilpasset specifikke funktionelle nicher, der kræver præcise mekanismer for substratgenkendelse og -behandling (Hanson og Whiteheart, 2005). Den slående adaptive udstråling af AAA+-proteiner til at fungere i forskellige indstillinger illustrerer den alsidige anvendelighed af AAA+-domænet (Erzberger og Berger, 2006). AAA+-proteiner danner typisk hexameriske komplekser og fungerer som motorer til at remodellere andre proteiner, DNA/RNA eller multikomponentkomplekser (figur 1). Faktisk er eller har mange chaperoner og ATP-afhængige proteaser underenheder, der tilhører denne superfamilie (Figur 1; Olivares et al., 2016).
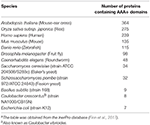
Tabel 1. Antal AAA+-proteiner i modelorganismera.
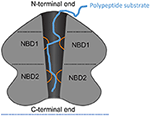
Figur 1. Skematisk fremstilling af ClpA som et eksempel på AAA+ hexamer. Skematisk fremstilling af domænearkitekturen og interaktionerne i ClpA som et eksempel på en AAA+ hexamer med to AAA+ domæner pr. monomer. Her vises et udsnit af ClpA-hexameren fra siden for at skildre den centrale, polypeptidledende kanal. ClpA indeholder tre domæner, herunder et N-terminalt domæne og to AAA+-domæner: nukleotidbindingsdomæne 1 og 2 (NBD1 og NBD2). Det N-terminale domæne interagerer med regulatorer af substratspecificitet, mens den C-terminale ende interagerer med kammerproteasen ClpP. Mobile loops fra NBD1 og NBD2 (orange) projicerer ind i den centrale kanal og engagerer polypeptid-substrat (blå) og muliggør derved kobling af ATP-hydrolyse til polypeptidtranslokation over den centrale kanal.
I løbet af de seneste år er der sket betydelige fremskridt med hensyn til at identificere strukturen og den funktionelle mekanisme af et stort antal AAA+-proteiner (Gates et al., 2017; Puchades et al., 2017; Ripstein et al., 2017; Zehr et al., 2017). I dette forskningsemne formidles flere elementer af dette spændende fremskridt i 21 artikler, som omfatter et detaljeret strukturelt og mekanistisk syn på flere AAA+ chaperoner og proteaser, herunder: ClpX (Alhuwaider og Dougan; Bittner et al.; Elsholz et al.; LaBreck et al.; LaBreck et al.; Vass et al.; Duran et al.; Franke et al.; Johnston et al.), Hsp78 (Abrahão et al.), ClpC (Alhuwaider og Dougan; Elsholz et al.), ClpE (Elsholz et al.), Pontin (Mao og Houry), Reptin (Mao og Houry), FtsH (Alhuwaider og Dougan), 19S proteasome (Snoberger et al.; Yedidi et al.), Lon (Alhuwaider og Dougan; Bittner et al.; Fishovitz et al.), p97 (Hänzelmann og Schindelin; Saffert et al.; Ye et al.), Pex1/6 (Saffert et al.), CbbQ (Mueller-Cajar), rubisco-aktivase (Bhat et al.), torsiner (Chase et al.) og mitokondrielle AAA+-proteaser (Glynn). Her introducerer vi disse fascinerende værker.
Studies on ClpXP, Lon, and Related ATP-Dependent Proteases
I deres forskningsartikel, “The Protein Chaperone ClpX Targets Native and Non-native Aggregated Substrates for Remodeling, Disassembly, and Degradation with ClpP,” LaBreck et al. en række elegante eksperimenter for at fastslå, at ClpX besidder disaggregaseaktivitet mod polypeptider, der indeholder specifikke ClpX-genkendelsessignaler (LaBreck et al.). I tilstedeværelse af ClpP kobler ClpX disaggregering af disse substrater til deres nedbrydning. Det er vigtigt, at de også fastslår, at ClpXP forhindrer ophobning af aggregater dannet af proteiner med ClpX-genkendelsessignaler in vivo (LaBreck et al.). Disse undersøgelser belyser ClpX som en protein disaggregase, som tidligere var undervurderet.
I deres forskningsartikel, “The Essential Role of ClpXP in Caulobacter crescentus Requires Species Constrained Substrate Specificity”, undersøger Vass et al. artsspecifikke funktioner af ClpX (Vass et al.). Mærkeligt nok er ClpX afgørende i nogle arter såsom C. crescentus, men ikke afgørende i andre bakterier såsom E. coli (Vass et al.). Det er vigtigt at bemærke, at E. coli ClpX ikke var i stand til at supplere C. crescentus ClpX in vivo (Vass et al.). Denne manglende aktivitet skyldtes artsspecifikke forskelle i det N-terminale domæne af ClpX, som er kritisk for behandling af replikationsklemme-læsserunderenheden DnaX i C. crescentus. Således kan små forskelle i ClpX-specificitet være særligt kritiske for specifikke bakteriearter.
I deres gennemgang om “Functional Diversity of AAA+ Protease Complexes in Bacillus subtilis,” diskuterer Elsholz et al: ClpCP, ClpEP, ClpXP, ClpYQ, LonA/B og FtsH (Elsholz et al.). De diskuterer, hvordan forskellige stressresponser styrer deres ekspression og de fænotyper, der observeres ved sletning af disse forskellige proteaser. Nogle af disse proteaser er i stand til at kontrollere kompetence, sporulation, motilitet og biofilmdannelse. Endelig diskuterer forfatterne målretning af disse proteaser med henblik på udvikling af nye antibiotika.
I deres gennemgang med titlen “AAA+ Machines of Protein Destruction in Mycobacteria” diskuterer Alhuwaider et al. (Alhuwaider og Dougan) de seneste fremskridt med hensyn til bestemmelse af struktur og funktion af AAA+ proteaser i mycobakterier. Disse proteaser er: ClpXP1P2, ClpC1P1P1P2, Lon, FtsH og Mpa. Forfatterne diskuterer også Pup-proteasomsystemet (PPS), der findes i mykobakterier, og som svarer til ubiquitin-proteasomsystemet i eukaryoter. Alhuwaider et al. afslutter derefter med en diskussion af nye forbindelser, der dysregulerer eller hæmmer aktiviteten af ClpP1P2 og andre, der dysregulerer ClpC1. Disse forbindelser har lovende aktiviteter mod mykobakterier.
I en forskningsartikel med titlen “The Copper Efflux Regulator CueR Is Subject to ATP-Dependent Proteolysis in Escherichia coli” viser Bittner et al., at AAA+ proteaserne Lon, ClpXP og ClpAP er ansvarlige for nedbrydningen af E. coli CueR, som er en transkriptionsfaktor, der styrer induktionen af kobberudstrømnings Cue-systemet (Bittner et al.). Forfatterne fandt, at genkendelse af CueR af AAA+-proteaserne kræver den tilgængelige C-terminus af CueR. De konkluderer, at ATP-afhængige proteaser er nødvendige for kobberhomeostase i E. coli.
Fishovitz et al. foretager en detaljeret sammenligning mellem menneskelig og E. coli Lon i deres forskningsartikel med titlen “Utilization of Mechanistic Enzymology to Evaluate the Significance of ADP Binding to Human Lon Protease” (Fishovitz et al.). Ved hjælp af en detaljeret mekanistisk undersøgelse fandt de, at menneskelig Lon i modsætning til E. coli Lon har lav affinitet for ADP til trods for, at den viser sammenlignelige kcat- og KM-værdier i ATPaseaktiviteten. De foreslår, at human Lon ikke reguleres af en substrat-promoveret ADP/ATP-udvekslingsmekanisme. Disse forskelle mellem menneskelig og E. coli Lon kan måske gøre det muligt i fremtiden at udvikle artsspecifikke Lon-hæmmere.
I sin gennemgang om “Multifunctional Mitochondrial AAA Proteases” diskuterer Dr. Glynn de to mitokondrielle AAA-proteaser, i-AAA og m-AAA (Glynn). Begge er mitokondrielle proteiner fra den indre membran. I-AAA projicerer dog ATPase- og protease-domænerne ind i det mitokondrielle intermembranrum, mens m-AAA-proteasen projicerer de katalytiske domæner ind i matrixen. Strukturen af disse proteaser samt deres funktionsmekanisme diskuteres. Proteaserne kan foretage fuldstændig substratnedbrydning, men kan også kun spalte visse substrater som for MrpL32 og Atg32.
ClpB og Hsp104
I deres mini-review, “Structural Elements Regulating AAA+ Protein Quality Control Machines,” Chang et al. diskuterer de, hvordan poreløkke-1, Inter-Subunit Signaling-motivet og Pre-Sensor I-indsættelsesmotivet kan bidrage til aktiviteten af to Hsp100-disaggregaser, bakteriel ClpB og gær Hsp104 (Chang et al.). De foreslår en model for, hvordan disse strukturelle elementer kan gøre det muligt at koble AAA+ ATPasecyklussen til substrattranslokation over den centrale kanal i ClpB og Hsp104. Denne proces med polypeptidtranslokation menes at understøtte, hvordan ClpB og Hsp104 ekstraherer polypeptider fra aggregerede strukturer (Chang et al.).
Duran et al. giver en “Comparative Analysis of the Structure and Function of AAA+ Motors ClpA, ClpB, and Hsp104: Common Threads and Disparate Functions” i deres gennemgang (Duran et al.). De diskuterer disse tre AAA+-proteiners (ClpA, ClpB og Hsp104) evne til at translokere polypeptider gennem deres hexameriske komplekser. Alle disse proteiner har to AAA+-domæner og er kendt for at udfolde proteiner. Det er vigtigt, at ClpB og Hsp104 også er kendt for at fungere som disaggregaser, mens ClpA kan danne et kompleks med ClpP-proteasen. Forfatterne fremhæver behovet for at anvende kinetiske metoder til at undersøge de kinetiske mekanismer for disse motorproteiner ved hjælp af transiente tilstandskinetiske metoder. De beskriver, hvordan brugen af sådanne metoder gjorde det muligt for dem at vise, at ClpA f.eks. translokerer polypeptider med ca. 20 aa s-1, mens ClpA i kompleks med ClpP-proteasen har en endnu højere translokationshastighed på ca. 35 aa s-1. Forfatterne diskuterer også betydningen af Hsp70-chaperonen i ClpB/Hsp104-funktionen og observationen af artsspecificitet i interaktionen mellem Hsp70 og ClpB/Hsp104.
I deres forskningsartikel med titlen “Mutant Analysis Reveals Allosteric Regulation of ClpB Disaggregase” udfører Franke et al. en mutationsanalyse på E. coli ClpB-disaggregase for at karakterisere dens allosteriske regulering (Franke et al.). ClpB kan opdeles i et N-terminalt domæne og to AAA+-domæner, der er adskilt af et spiralformet område, kaldet M-domænet. Forfatterne identificerer en meget konserveret rest i det første AAA+-domæne, A328. ClpB-A328V-mutanten viste sig at have en meget høj ATPaseaktivitet og udviste celletoksicitet. Uventet skyldtes ClpB-A328V’s høje ATPaseaktivitet hovedsagelig den anden AAA+-ring, som vurderet ved amidhydrogenudvekslingsmassespektrometri. Forfatterne konkluderer, at A328 er en afgørende rest i kontrollen af ATP-hydrolysen i begge AAA+-ringe af ClpB.
I deres forskningsartikel med titlen “Substrate Discrimination by ClpB and Hsp104” beskriver Johnston et al. de medfødte substratpræferencer for ClpB og Hsp104 i fravær af DnaK- og Hsp70-chaperonsystemerne (Johnston et al.). De viser, at substratspecificiteten er bestemt af det første AAA+-domæne i hvert protein. De nåede frem til denne konklusion ved at teste de to chaperoner for deres evne til at virke på flere modelsubstrater. De testede også forskellige kimærer af de to chaperoner.
I “Hsp78 (78 kDa Heat Shock Protein), a Representative AAA Family Member Found in the Mitochondrial Matrix of Saccharomyces cerevisiae”, diskuterer Abrahão et al. strukturen og funktionen af Hsp78 (Abrahao et al.). Hsp78 er den mitokondrielle paralog til Hsp104, som fungerer i forbindelse med proteindisaggregering og reaktivering (Abrahao et al.). Mærkeligt nok blev Hsp104 og Hsp78 tabt ved overgangen fra protozoer til metazoer (Abrahao et al.). Abrahao et al. diskuterer imidlertid eksistensen af ANKCLP, som optræder sammen med Hsp78 og Hsp104 i protozoer og overlever den evolutionære overgang til metazoer. ANKCLP besidder et AAA+-domæne, der ligner nukleotidbindende domæne 2 (NBD2) af Hsp104 og Hsp78, men er ellers meget divergerende. Det er interessant, at mutationer i ANKCLP forårsager 3-methylglutaconic aciduria, progressiv hjerneatrofi, intellektuel funktionsnedsættelse, medfødt neutropeni, grå stær og bevægelsesforstyrrelser hos mennesker (Abrahao et al.).
p97
I deres gennemgang, “Structure and Function of p97 and Pex1/6 Type II AAA+ Complexes”, diskuterer Saffert et al. to forskellige AAA+-komplekser, der remodellerer ubiquitinerede substratproteiner (Saffert et al.). En funktion af p97 er at forskyde ubiquitinerede substrater fra ER-membranen til proteasomet under ER-associeret nedbrydning (Saffert et al.). I modsætning hertil er Pex1/Pex6 en heterohexamerisk motor bestående af skiftende Pex1- og Pex6-underenheder, som er afgørende for peroxisombiogenese og -funktion. Nylige cryo-elektronmikroskopiske (cryo-EM) strukturer af p97 og Pex1/6 diskuteres, og centrale strukturelle forskelle fremhæves.
I deres gennemgang med titlen “A Mighty ‘Protein Extractor’ of the Cell: Structure and Function of the p97/CDC48 ATPase” opsummerer Ye et al. den nuværende viden om p97’s struktur og funktion og dens rolle i flere sygdomme (Ye et al.). p97 har to AAA+ domæner forbundet med en kort linker. Den har også et N-terminalt domæne, som formidler dens interaktioner med forskellige adaptorproteiner. Forfatterne giver en detaljeret diskussion af p97’s struktur og virkningen af nukleotider på dens forskellige konformationer. Disse undersøgelser er baseret på anvendelse af teknikker som EM, røntgenkrystallografi og atomkraftmikroskopi med høj hastighed. Forfatterne diskuterer derefter de multicellulære funktioner af dette meget bevarede protein, herunder dets roller i ER-associeret proteinnedbrydning (ERAD), mitochondria-associeret nedbrydning (MAD) ved at udtrække polypeptider fra mitochondriernes ydre membran og ribosom-associeret nedbrydning (RAD). Endelig giver Ye et al. en oversigt over p97-mutationer, der fører til flere menneskelige sygdomme såsom IBMPFD (Inclusion Body Myopathy associated with Paget’s disease of the bone and Frontotemporal Dementia)], FALS (familial amyotrophic lateral sclerosis), CMT2Y (Charcot-Marie-Tooth disease, type 2Y), hereditary spastic paraplegias (HSP), Parkinsons sygdom (PD) og Alzheimers sygdom (AD).
I deres gennemgang om p97 med titlen “The Interplay of Cofactor Interactions and Post-translational Modifications in the Regulation of the AAA+ ATPase p97” diskuterer Hänzelmann og Schindelin, hvordan forskellige cofaktorer modulerer aktiviteten af p97 ATPase (Hanzelmann og Schindelin). De fremhæver, at p97’s evne til at være involveret i et stort antal cellulære processer skyldes det store antal cofaktorer, der interagerer med dette protein. De belyser tre forskellige klasser af p97-kofaktorer, nemlig: (i) substratfremmende cofaktorer som UBA-UBX-proteiner og UFD1-NPL4, (ii) substratforarbejdende cofaktorer som ubiquitin (E3)-ligaser og deubiquitinaser (DUB’er) og (iii) regulerende cofaktorer som UBX-proteinerne, der kan seponere eller genbruge p97 hexamere. Forfatterne diskuterer også den rolle, som posttranslationelle modifikationer spiller for p97-aktiviteten og for dets interaktioner med dets cofaktorer og substrater.
AAA+ Proteins of the Proteasome
I “AAA-ATPases in Protein Degradation,” Yedidi et al. en gennemgang af aktiviteterne hos Rpt1, Rpt2, Rpt3, Rpt4, Rpt5 og Rpt6, som er AAA+ ATPaser i det eukaryote proteasom, samt nogle af deres bakterielle slægtninge såsom PAN, Mpa og VAT (Yedidi et al.). De fokuserer på nye teknologier til at forstå, hvordan disse AAA+ ATPaser fungerer ved at translokere ufoldede polypeptider ind i proteasens proteolytiske kammer (Yedidi et al.). Konformationsændringer i AAA+-ringen og proteasen med tilstødende kamre ser ud til at generere en peristaltisk pumpemekanisme til at levere substrater til nedbrydning (Yedidi et al.).
I deres forskningsartikel “The Proteasomal ATPases Use a Slow but Highly Processive Strategy to Unfold Proteins” (Proteasomale ATPaser anvender en langsom, men meget processiv strategi til at udfolde proteiner), beskriver Snoberger et al. fastslår de, at proteasomale AAA+-proteiner anvender en motorisk mekanisme med lav hastighed, men med høj processivitet til at levere substrater til proteasomets proteolytiske hulrum (Snoberger et al.). Denne mekanisme står i kontrast til ClpX, som anvender en motormekanisme med høj hastighed, men mindre processiv, til at levere substrater til ClpP-proteasen med henblik på nedbrydning. Disse forskelle i motormekanisme kan have udviklet sig som reaktion på forskellige krav fra deres specifikke klientel.
Rubisco Activases
I deres gennemgang om “Rubisco Activases: AAA+ Chaperones Adapted to Enzyme Repair” diskuterer Bhat et al. den unikke funktion af Rubisco activase (Rca) i remodellering af Rubisco (Bhat et al.). Rca er en AAA+ chaperon, der er stærkt bevaret i fotosyntetiske organismer fra bakterier til højere planter. Rubisco er et Ribulose-1,5-bisphosphatcarboxylase/oxygenase-enzym, som er involveret i at binde atmosfærisk CO2 under fotosyntesen. Det er det mest udbredte protein på jorden og er det vigtigste enzym i syntesen af alt organisk stof på planeten. Rubisco er imidlertid et dårligt enzym, som let hæmmes af sideprodukter fra dets katalytiske reaktioner eller af forbindelser, der syntetiseres af nogle planter under svage lysforhold. Rca fungerer til at afhjælpe eller “kurere” Rubisco fra sådanne problematiske hæmninger. Forfatterne diskuterer strukturen af Rca fra forskellige arter og de potentielle mekanismer for dens funktion.
Dr. Mueller-Cajar giver en gennemgang om “The Diverse AAA+ Machines that Repair Inhibited Rubisco Active Sites” (Mueller-Cajar). Han diskuterer tilstedeværelsen af tre evolutionært forskellige klasser af Rubisco-aktivaser (Rcas): (1) Rcas af grøn og (2) rød type, der hovedsagelig findes i fotosyntetiske eukaryoter af henholdsvis den grønne og den røde plastidlinje, og (3) CbbQO, der findes i kemoautotrofe bakterier. Han diskuterer udviklingen af disse aktivaser og deres potentielle anvendelse i syntetisk biologi til at øge Rubisco-aktiviteten i planter.
Torsin
I deres perspektiviske artikel, “Torsin ATPases: Harnessing Dynamic Instability for Function”, diskuterer Chase et al. torsinerne, som også er fylogenetisk beslægtet med NBD2 af Hsp104 i gær (Chase et al.). Torsinerne er de eneste AAA+ ATPaser, der er lokaliseret inde i ER og den forbundne kernehinde (Chase et al.). Det er interessant, at mutationer i TorsinA forårsager DYT1-dystoni, en neurologisk lidelse hos mennesker (Chase et al.). Torsiner udviser en svag ATPaseaktivitet, der øges via komplementering af det aktive sted som følge af sammontering med specifikke accessoriske cofaktorer LAP1 og LULL1 (Chase et al.). Chase et al. antyder, at dynamisk samling og adskillelse af Torsin/cofaktor-komplekser spiller vigtige roller i deres funktion i forbindelse med nuklear trafikering og samling af nuklear-pore-komplekser (Chase et al.).
Pontin og Reptin
I deres omfattende gennemgang om “The Role of Pontin and Reptin in Cellular Physiology and Cancer Etiology” diskuterer Mao og Houry de mange funktioner af de meget bevarede Pontin og Reptin AAA+ ATPaser (Mao og Houry). Disse to proteiner fungerer typisk sammen som et kompleks, men kan også fungere uafhængigt af hinanden. Forfatterne fremhæver Pontins og Reptins roller i kromatinomdannelse. De diskuterer også, hvordan Pontin og Reptin modulerer transkriptionelle aktiviteter af flere proto-onkogener såsom MYC og β-catenin. Mao og Houry belyser, hvordan Pontin og Reptin har vist sig at være nødvendige for samling af PIKK-signalkomplekser samt telomerase, mitotisk spindel, RNA-polymerase II og snoRNP’er. Forfatterne afslutter med en oversigt over de nuværende bestræbelser på at identificere inhibitorer af Pontin og Reptin, der skal udvikles som nye anti-kræftmidler.
Slutbemærkninger
Samlet set fremhæver denne samling af 21 artikler en række vigtige strukturelle og mekanistiske aspekter af AAA+-proteiner, der er involveret i proteinreparation og nedbrydning. Vi er spændte på at se, hvordan feltet vil fortsætte med at udvikle sig under den igangværende cryo-EM-revolution (Egelman, 2016). Vi forventer, at cryo-EM vil muliggøre en dybere forståelse af, hvordan disse fascinerende molekylære maskiner fungerer i forskellige situationer (Gates et al., 2017; Puchades et al., 2017; Ripstein et al., 2017; Zehr et al., 2017).
Author Contributions
Alle forfattere på listen har ydet et væsentligt, direkte og intellektuelt bidrag til arbejdet og har godkendt det til offentliggørelse.
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Arbejdet i WH’s laboratorium på dette område er finansieret af et projekttilskud fra Canadian Institutes of Health Research (PJT-148564). JS er støttet af NIH-tilskuddet R01GM099836.
Egelman, E. H. (2016). Den aktuelle revolution inden for kryo-EM. Biophys. J. 110, 1008-1012. doi: 10.1016/j.bpj.2016.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Erzberger, J. P., og Berger, J. M. (2006). Evolutionære relationer og strukturelle mekanismer for AAA+-proteiner. Annu. Rev. Biophys. Biomol. Struct. 35, 93-114. doi: 10.1146/annurev.biophys.35.040405.101933
PubMed Abstract | CrossRef Full Text | Google Scholar
Finn, R. D., Attwood, T. K., Babbitt, P. C., Bateman, A., Bork, P., Bridge, A. J., et al. (2017). InterPro i 2017 – ud over proteinfamilie- og domæneannotationer. Nucleic Acids Res. 45, D190-D199. doi: 10.1093/nar/gkw1107
PubMed Abstract | CrossRef Full Text | Google Scholar
Gates, S. N., Yokom, A. L., Lin, J., Jackrel, M. E., Rizo, A. N., Kendsersky, N. M., et al. (2017). Ratchet-lignende polypeptidtranslokationsmekanisme af AAA+ disaggregasen Hsp104. Science 357, 273-279. doi: 10.1126/science.aan1052
PubMed Abstract | CrossRef Full Text | Google Scholar
Hanson, P. I., og Whiteheart, S. W. (2005). AAA+-proteiner: har motor, vil arbejde. Nat. Rev. Mol.Cell Biol. 6, 519-529. doi: 10.1038/nrm1684
PubMed Abstract | CrossRef Full Text | Google Scholar
Olivares, A. O., Baker, T. A., og Sauer, R. T. (2016). Mekanistisk indsigt i bakterielle AAA+ proteaser og protein-remodelleringsmaskiner. Nat. Rev. Microbiol. 14, 33-44. doi: 10.1038/nrmicro.2015.4
PubMed Abstract | CrossRef Full Text | Google Scholar
Puchades, C., Rampello, A. J., Shin, M., Giuliano, C. J., Wiseman, R. L., Glynn, S. E., et al. (2017). Struktur af den mitokondrielle indre membran AAA+ protease YME1 giver indsigt i substratbehandling. Science 358:eaao0464. doi: 10.1126/science.aao0464
PubMed Abstract | CrossRef Full Text | Google Scholar
Ripstein, Z. A., Huang, R., Augustyniak, R., Kay, L. E., og Rubinstein, J. L. (2017). Struktur af en AAA+ unfoldase i processen med udfoldning af substrat. Elife 6:e25754. doi: 10.7554/eLife.25754
PubMed Abstract | CrossRef Full Text | Google Scholar
Snider, J., Thibault, G., og Houry, W. A. (2008). AAA+-superfamilien af funktionelt forskellige proteiner. Genome Biol. 9:216. doi: 10.1186/gb-2008-9-4-216
PubMed Abstract | CrossRef Full Text | Google Scholar
Zehr, E., Szyk, A., Piszczek, G., Szczesna, E., Zuo, X., og Roll-Mecak, A. (2017). Katanin spiral- og ringstrukturer kaster lys over kraftslag for mikrotubulusafskæring. Nat. Struct. Mol. Biol. 24, 717-725. doi: 10.1038/nsmb.3448
PubMed Abstract | CrossRef Full Text | Google Scholar