Introduktion
Serotonin (5-hydroxytryptamin, 5-HT) 2C-receptorer (5-HT2CR’er) er vidt udbredt i hjernen og medierer regulerende virkninger af 5-HT på angst, søvn, hormonel sekretion, fodringsadfærd, lokomotorisk aktivitet samt indlærings- og hukommelsesprocesser (Bagdy, 1998; Chagraoui et al., 2016). 5-HT2CR-dysfunktion er blevet impliceret i patologiske tilstande, såsom angst og depression (Chagraoui et al., 2016; Di Giovanni og De Deurwaerdere, 2016). På den anden side har adskillige antidepressiva, anxiolytika og antipsykotika affiniteter til 5-HT2CR’erne, som kan være involveret i de terapeutiske virkninger af disse lægemidler (Bagdy et al., 2001; Chagraoui et al., 2016; Di Giovanni og De Deurwaerdere, 2016). Således er 5-HT2CR et lovende farmakologisk mål i behandlingen af flere neuropsykiatriske lidelser (Chagraoui et al, 2016; Di Giovanni og De Deurwaerdere, 2016).
Stimulering af 5-HT2CR’er er blevet beskrevet for at producere angst, og til gengæld udøver subtypeselektive 5-HT2CR-antagonister som SB-242084 markante anxiolytiske virkninger (Dekeyne et al., 2000; Bagdy et al., 2001; Kantor et al., 2005). De selektive 5-HT2CR-antagonister RS-102221 og SB-242084 frembragte hurtigt indsættende antidepressivitetslignende virkninger hos mus (Opal et al., 2014). Desuden potentierede 5-HT2CR-antagonisme også de anxiolytiske og antidepressive virkninger af fluoxetin, en selektiv serotonin-genoptagelseshæmmer (SSRI), og reducerede desuden motoriske bivirkninger hos mus (Demireva et al., 2018). Det er vigtigt, at interaktionen mellem 5-HT- og dopamin (DA)-systemer er blevet foreslået at bidrage til disse virkninger (De De Deurwaerdere og Di Giovanni, 2017).
Varierende parametre på elektroencefalogrammet (EEG) under både vågenhed og søvn er blevet beskrevet for at give biomarkører for depression og individualiseret antidepressiv behandling (Steiger og Kimura, 2010). Gamma-svingninger er relativt højfrekvente (>30 Hz) komponenter af EEG’et, der giver vigtige ledetråde om neuronal populationsdynamik (Buzsaki og Wang, 2012). Gammaoscillationer er blevet forbundet med sensoriske og kognitive funktioner samt neuronal plasticitet og hukommelse hos dyr og mennesker (Cardin, 2016). På den anden side er unormal gammaaktivitet blevet impliceret i flere psykiatriske tilstande (Cardin, 2016). På baggrund af den voksende mængde af beviser, der tyder på, at gamma er involveret i depressionens patomekanisme, er ændringer i gamma-svingninger for nylig blevet foreslået som en ny biomarkør (eller endofænotype) for svær depression og endda til opfølgning af antidepressive behandlinger (Fitzgerald og Watson, 2018). Flere antidepressiva har vist sig at ændre gammaaktivitet (Fitzgerald og Watson, 2018). For eksempel har SSRI escitalopram vist sig at mindske gammaeffekten under hurtig øjenbevægelsessøvn (REMS) under akut behandling, mens kronisk escitalopram øgede gammaeffekten under slow-wave-søvnstadier (Papp et al., 2018). Det er dog stadig et åbent spørgsmål, om de lægemiddelinducerede ændringer af gammaaktivitet i forskellige vågenhedsstadier er indikatorer eller forårsagende mediatorer af terapeutisk virkning eller tegn på bivirkninger (Fitzgerald og Watson, 2018).
I henhold til vores viden er der et hul i litteraturen vedrørende virkningerne af selektive 5-HT2CR-antagonister på gamma-svingninger hos mennesker og hos gnavere. Så her undersøger vi, hvordan gammaeffekten (30-60 Hz) ændres i forskellige vigilancefaser (i) ved akut administration af den meget selektive 5-HT2CR-antagonist SB-242084, (ii) ved kronisk administration af den udbredte SSRI escitalopram, (iii) og ved deres kombination.
Metoder
Hanlige Wistar-rotter, købt fra den lokale dyrefacilitet (Semmelweis University, Budapest, Ungarn), blev brugt i eksperimenterne. Dyrene blev holdt under kontrollerede miljøforhold (21 ± 1 °C, 12/12 timers lys/mørke-cyklus med lys tændt kl. 10 om morgenen) og fik fri adgang til standard gnaverfoder og vand fra hanen. Alle opstaldningsforhold og dyreforsøg blev udført i overensstemmelse med EU-direktiv 2010/63/EU og National Institutes of Health’s “Principles of Laboratory Animal Care” (NIH Publications No. 85-23, revideret 1985) samt specifikke nationale love (den ungarske regerings bestemmelser om dyreforsøg 40/2013). Forsøgene blev godkendt af den nationale videnskabelige etiske komité for dyreforsøg. Alle bestræbelser blev gjort for at minimere smerte og ubehag for dyrene.
Elektroencefalografiske (EEG) og elektromyografiske (EMG) elektroder blev implanteret under 2 % halothanbedøvelse, som tidligere beskrevet (Jakus et al., 2003). Rotterne vejede 250-280 g ved operationen. For EEG blev rustfri stålskrueelektroder indsat epiduralt over venstre frontal cortex (L: 2.0 mm, A: 2.0 mm til bregma), venstre parietal cortex (L: 2.0 mm, A: 2:0 mm til lambda) og over cerebellum som en jordelektrode. Til EMG blev et par EMG-elektroder (fjederelektroder af rustfrit stål dækket af silikonegummi, Plastics One Inc., Roanoke, VA, USA) anbragt i nakkemuskulaturen. Efter genopretning (7 dage) blev rotterne fastgjort til EEG-systemet ved hjælp af et optagekabel og en elektrisk drejeledning, der var fastgjort over burene. Dyrene forblev tilsluttet under hele undersøgelsen.
Til kronisk forbehandling fik rotterne 10 mg/kg/dag escitalopram-oxalatopløsning (ESC Gedeon Richter Plc., Ungarn, opløst i en opløsning af 0,3 N HCl i destilleret vand) eller vehikel (VEH; opløsning af 0,3 N HCl i destilleret vand) via en osmotisk minipumpe (2ML4, ALZET, 2,5 μl/h, DURECT Corporation, USA) i 21 dage. På den 21. dag fik rotterne intraperitoneale injektioner af 1 mg/kg SB-242084 eller vehikel i et volumen på 1 ml/kg kropsvægt. Rotterne blev tilfældigt inddelt i fire grupper som følger VEH+veh (n = 6), VEH+SB (n = 6), ESC+veh (n = 6) og ESC+SB (n = 6).
EEG, EMG og motorisk aktivitet blev registreret i mindst 3 timer efter injektionerne, startende ved lysets begyndelse. Signalerne blev forstærket af analoge filtre (Coulburn Lablinc System, USA; filtrering under 0,50 Hz og over 100 Hz ved 6 dB/oktave) og underkastet analog til digital konvertering (MVRD-2200 V, Canopus, Japan) med en samplingfrekvens på 128 Hz. Dataene blev lagret på en computer med henblik på yderligere behandling.
De polygrafiske optagelser blev scoret ved hjælp af den automatiserede scoringfunktion i Sleep Sign for Animal (Kissei Comtec America Inc., USA) software for 4-s epokerne, efterfulgt af visuel overvågning. Der blev skelnet mellem seks vågenhedsstadier baseret på konventionelle kriterier (Kantor et al., 2004) som følger (se supplerende figur 1 for repræsentative spor). I aktiv vågenhed (AW) er EEG’et karakteriseret ved lavamplitudeaktivitet ved beta (14-29 Hz) og alfa (10-13 Hz) frekvenser ud over intens EMG- og motorisk aktivitet. Ved passiv vågenhed (PW) ligner EEG-mønsteret AW og ledsages af en relativt høj EMG-aktivitet og minimal eller ingen motorisk aktivitet. I let slow-wave-søvn (SWS-1) er EEG’et karakteriseret ved langsomme kortikale bølger med høj amplitude (0,5-4 Hz), afbrudt af spindler (6-15 Hz), ledsaget af reduceret EMG-aktivitet og ingen motorisk aktivitet. I dyb slow-wave-søvn (SWS-2) er EEG’et domineret af kontinuerlige langsomme kortikale bølger med høj amplitude med reduceret EMG-aktivitet og ingen motorisk aktivitet. I det mellemliggende søvnstadium (IS), der oftest forekommer før eller efter REMS, er EEG’et karakteriseret ved en sammensætning af spindler med høj amplitude og thetabølger (5-9 Hz). I REMS er EEG’et domineret af aktivitet med lav amplitude og høj frekvens med regelmæssige thetabølger ud over den tavse EMG og motorisk aktivitet med lejlighedsvise muskelkontraktioner (trækninger). Epokerne, der var forurenet med artefakter eller indeholdt overgang mellem vågenhedsstadier, blev udeladt.
Den kvantitative EEG-analyse (qEEG) blev beregnet for på hinanden følgende 4-s epokerne i frekvensområdet 0,5-60 Hz ved hjælp af hurtig Fourier-transformation (Hanning-vindue, frekvensopløsning på 0,25 Hz). Tilstødende 0,25 Hz-bins blev summeret til 1 Hz-bins, som er markeret med deres øvre grænser. Effektværdierne for epokerne i AW, PW, SWS-1, SWS-2, IS og REMS blev gennemsnitligt beregnet separat i de sammenfattede 3 timer eller i henholdsvis den første, anden og tredje time efter behandlingerne for at opnå værdier for effekttætheden for disse søvn-vågne stadier. I denne rapport fokuserede vi på 30-60 Hz-frekvensområdet i EEG-effektspektrene. Data inden for 49-51 Hz blev udelukket fra analysen for at undgå kontaminering af 50 Hz interferensstøj fra det elektriske netværk. Alle data blev log-transformeret før analyse.
For effektspektralanalyse blev sammenligninger mellem grupper udført ved tovejs ANOVA på gentagne foranstaltninger med to hovedfaktorer: behandling (ikke-gennemført) og gammafrekvensbins (gentaget), efterfulgt af Bonferroni post hoc-test. For at undersøge behandlingseffekter i hver h blev sammenfattede 30-60 Hz effektdata (eksklusive dataene for 49-51 Hz) analyseret ved hjælp af envejs ANOVA med hensyn til henholdsvis AW, PW, SWS-1, SWS-2, IS og REMS. Efter påvisning af en signifikant hovedbehandlingseffekt blev der udført post hoc Newman-Keuls-test. Statistisk signifikans blev accepteret, når p < 0,05.
I vores eksperimentelle design blev kontrolrotter (VEH+veh) udsat for de samme procedurer som de lægemiddelbehandlede. Således har sammenligningen af de lægemiddelbehandlede grupper og kontrolgruppen til formål at minimere den lidelse, der forårsages af injektionerne og tilstedeværelsen af minipumperne, hvilket gør det muligt at studere virkningerne af lægemidlerne. I forbindelse med spektralgraferne har vi af hensyn til en bedre synlighed (da EEG-effektdataene følger en faldende tendens med stigende frekvenser) normaliseret effektværdierne for de lægemiddelbehandlede rotter i forhold til de gennemsnitlige effektspektralværdier for kontrolgrupperne (VEH+veh-gruppen) og har således vist relative data. Absolutte data præsenteres på søjlediagrammerne som sammenfattede effektværdier. Data er udtrykt som gennemsnit ± SEM for seks dyr pr. gruppe.
Resultater
Virkninger af lægemidlerne (akut SB-242084, kronisk escitalopram og deres kombination) på qEEG i 30-60 Hz gammaområdet blev evalueret separat for de seks vigilancefaser ved at beregne et gennemsnit af effektdataene i de første 3 h af den passive fase (Figur 1). Analysen afslørede, at alle lægemidlerne forårsagede vigilancefaseafhængige ændringer i dette frekvensområde, med en tendens til forhøjelse i hver fase sammenlignet med VEH+veh-gruppen.
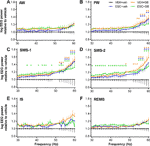
Figur 1 EEG-effektændringer i gammafrekvensområdet (30-60 Hz) efter indgift af akut SB-242084 (VEH+SB), kronisk escitalopram (ESC+veh) og deres kombination (ESC+SB) i de første 3 timer af den passive fase. Effektspektrer er vist i de følgende seks vigilancefaser: (A) aktiv (AW) og (B) passiv vågenhed (PW), (C) let (SWS-1) og (D) dyb slow-wave-søvn (SWS-2), (E) mellemstadie (IS) og (F) hurtig øjenbevægelsessøvn (REMS). EEG-effektdata præsenteres som gennemsnit ± SEM, i forhold til VEH+veh-kontrolgruppen (n = 6 dyr pr. gruppe). *Signifikante post hoc-resultater sammenlignet med kontrol, p < 0,05.
Under AW viste ANOVA-resultaterne ingen signifikante ændringer (behandlingseffekt: F3,20 = 1,917, p = 0,1594; behandling x frekvensinteraktion: F81,540 = 1,218, p = 0,1081; figur 1A). Under PW blev der imidlertid set en moderat forhøjet effektlinje i SB-grupperne, og ved de højere frekvenser også i ESC+veh-gruppen (behandlingseffekt: F3,20 = 2.217, p = 0.1176; signifikant interaktion mellem behandling x frekvens: F81,540 = 2.519, p < 0.001; Figur 1B).
De mest fremtrædende virkninger blev observeret under slow-wave søvnstadier, hvor den akutte SB-242084, den kroniske escitalopram og også den kombinerede behandling forårsagede en effektforhøjelse. Dette blev understøttet af signifikante ANOVA-resultater i SWS-1 (behandlingseffekt: F3,20 = 3,692, p = 0,0290; signifikant interaktion mellem behandling x frekvens: F81,540 = 2,693, p < 0,001; figur 1C), og i SWS-2 (signifikant behandlingseffekt: F3,20 = 4,787, p = 0,0113; signifikant interaktion mellem behandling x frekvens: F81,540 = 1.911, p < 0.001; Figur 1D).
Gammaeffektforøgelsen var ikke signifikant under IS (behandlingseffekt: F3,20 = 2.349, p = 0.1031, behandling x frekvensinteraktion: F81,540 = 1,241, p = 0,0878; figur 1E). Endelig under REMS påvirkede hverken den akutte SB-242084 eller den kroniske escitalopram EEG-effekten i dette frekvensområde (behandlingseffekt: F3,19 = 2.515, p = 0.0891; behandling x frekvensinteraktion: F81,513 = 1,226, p = 0,1014; figur 1F). Vi bemærker, at dataene for kun n = 5 dyr blev brugt i ESC + BSB-gruppen, da et dyr ikke tilbragte nogen tid i REMS i dette tidsinterval.
For signifikante Bonferroni post hoc forskelle efter de signifikante tovejs ANOVA-resultater beskrevet ovenfor, se Figur 1 for hvert vigilancetrin. Der blev ikke set nogen signifikante post hoc-forskelle i nogen af stadierne med hensyn til sammenligninger af henholdsvis VEH+SB vs. ESC+veh, VEH+SB vs. ESC+SB og ESC+veh vs. ESC+SB.
Den søvn-vågnestadiumsafhængige virkning af lægemidlerne på den samlede gammaeffekt blev analyseret hver time. Envejs ANOVA afslørede, at selv om behandlingseffekten i den første h af SWS-1 endnu ikke var signifikant (F3,20 = 2,544, p = 0,0851), var effektforhøjelserne signifikante i den anden (F3,20 = 3,331, p = 0,0403) og tredje h (F3,20 = 4,607, p = 0,0131). I SWS-2 viste ANOVA signifikante behandlingseffekter i hver h (F3,18 = 4,062, p = 0,0228; F3,20 = 5,348, p = 0,0072; F3,20 = 4,910, p = 0,0102, henholdsvis). Der blev også fundet en signifikant effekt i den anden time af IS (F3,20 = 3,452, p = 0,0360), men ikke i den første eller tredje time. Endelig blev der ikke fundet nogen signifikant behandlingseffekt i disse timer i AW, PW og REMS. For signifikante post hoc-resultater, se figur 2 for hvert vigilancetrin.
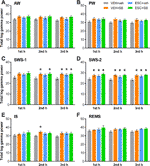
Figur 2 Samlet EEG-effekt i gammafrekvensområdet (30-60 Hz) efter indgivelse af akut SB-242084 (VEH+SB), kronisk escitalopram (ESC+veh) og deres kombination (ESC+SB) i den første, anden og tredje time af den passive fase, under (A) aktiv (AW) og (B) passiv vågenhed (PW), (C) let (SWS-1) og (D) dyb langsom bølgesøvn (SWS-2), (E) mellemstadie (IS) og (F) hurtig øjenbevægelsessøvn (REMS). Sammenfattede EEG-effektdata er præsenteret som gennemsnit ± SEM (for n = 6 dyr pr. gruppe). *Signifikante post hoc-resultater sammenlignet med kontrolgruppen (VEH+veh), p < 0,05.
Diskussion
Dette er den første undersøgelse, der undersøger de akutte virkninger af den selektive 5-HT2CR-antagonist SB-242084 på gammafrekvensbåndet i EEG-spektret i forskellige vigilancefaser. Desuden blev det testet med eller uden kronisk SSRI-forbehandling. Her rapporterer vi en øget gammabåndseffekt under SWS-2, SWS-1 og PW efter akut indgift af SB-242084 (1 mg/kg, ip.) hos rotter. Vores resultater om den yderligere 21-dages lange forbehandling med escitalopram (10 mg/kg/dag, osmotiske minipumper) viser, at SB-242084 ikke yderligere ændrede den gammakraft, der ændredes af den kroniske antidepressive behandling. Desuden syntes de akutte virkninger af SB-242084 og de kroniske virkninger af escitalopram på gammaeffekten at være meget ens i de fleste vågenhedsstadier. Virkningerne af kombinationen af disse to behandlinger blev imidlertid ikke anset for at være additive.
Hjernefunktioner relateret til gammaaktivitet blev diskuteret i det indledende afsnit. Gamma-svingninger er blevet beskrevet i flere områder af hjernen, såsom neocortex, entorhinal cortex, hippocampus, thalamus, amygdala, olfaktorisk pære og striatum. Deres generering er bundet til perisomatisk hæmning; mest af alt aktiviteten af parvalbumin-positive interneuroner via gamma-aminobuttersyre (GABA)A-synapser (Buzsaki og Wang, 2012). Gamma-svingninger menes at spille en vigtig rolle i depression, hvilket understøttes af både menneskelige og animalske fund. Gamma abnormiteter blev nemlig målt hos deprimerede patienter og også i dyremodeller af depression, hvor ændringer i gamma var forbundet med terapeutisk helbredelse (Khalid et al., 2016; Noda et al., 2017; Fitzgerald og Watson, 2018).
Forskellige farmakologiske (målrettet serotonin-, noradrenalin-, dopamin- og glutamatsystemer) og ikke-farmakologiske behandlinger af depression er blevet vist at ændre gammaaktivitet (Fitzgerald og Watson, 2018). For eksempel har escitalopram, det udbredte SSRI-antidepressivt middel, der virker på det serotonerge system, vist sig at reducere gammaeffekten under REMS ved akut behandling, mens dets kroniske administration øgede gammaeffekten i langsomtbølgesøvnstadier, hos rotter (Papp et al., 2018). Det er vigtigt, at antidepressiva, der virker på det noradrenerge system, såsom reboxetin og desipramin, øgede gamma- (såvel som theta-) kraften i det septo-hippocampale system efter akut behandling, mens SSRI fluvoxamin ikke kunne give en sådan effekt i samme undersøgelse (Hajos et al., 2003a). Den formodede næste generation af antidepressiva, såsom ketamin og dets metabolit (2R,6R)-hydroxynorketamin, har vist sig at øge gammaeffekten markant, når de anvendes i antidepressivt relevante doser. Disse virkninger og også deres antidepressivitetslignende virkninger blev forhindret ved forbehandling med en α-amino-3-hydroxy-5-methyl-4-isoxazol propionsyrereceptor (AMPAR) inhibitor (Zanos et al., 2016). Endelig har Fitzgerald og Watson for nylig foreslået, at gamma-signalering kan give en biomarkør for de antidepressive virkninger af alle klasser af antidepressiva, da alle klasser af antidepressiva ifølge deres hypotese kan have fælles endelige virkninger på det limbiske kredsløb (Fitzgerald og Watson, 2019).
I denne undersøgelse undersøgte vi lægemidler, der virker på 5-HT-systemet, nemlig en antagonist af 5-HT2CR og en SSRI med den primære virkning at øge det ekstracellulære niveau af 5-HT ved at hæmme dets synaptiske genoptagelse via 5-HT-transporteren. En voksende mængde dokumentation tyder på, at 5-HT2CR-antagonisme kan have gavnlige virkninger i behandlingen af depression og angst, selv om disse virkninger af de selektive 5-HT2CR-antagonister endnu ikke er blevet afprøvet i kliniske undersøgelser. Som støtte for relevansen af at kombinere 5-HT2CR-antagonister med SSRI’er har den akutte samtidige administration af de selektive 5-HT2CR-antagonister SB-242084 eller RS-102221 sammen med SSRI’en citalopram forstærket de citalopram-inducerede forhøjelser af 5-HT-niveauer i regioner, der er involveret i patofysiologien ved depressive lidelser, i en mikrodialyseundersøgelse hos rotter (Cremers et al., 2004). Forbehandling med SB-242084 vendte også den akutte citalopram-inducerede forstærkning af frygtudtryk hos rotter (Burghardt et al., 2007). Endvidere har en nylig artikel vist, at akut SB-242084-behandling efter kronisk (21 dage) fluoxetinbehandling reducerede angst- og depressionslignende adfærd og forbedrede de SSRI-inducerede bivirkninger hos mus (Demireva et al, 2018).
I den nuværende undersøgelse blev 1 mg/kg SB-242084-dosis valgt på baggrund af tidligere adfærdsundersøgelser (Kennett et al., 1997; Martin et al., 2002; Opal et al., 2014) og søvn- og/eller EEG-undersøgelser (Popa et al., 2005; Sorman et al., 2011; Bogathy et al., 2019) hos gnavere. Det er vigtigt, at Kantor et al. har vist, at selv om 0,3 og 1,0 mg/kg doser af lægemidlet producerede lignende anxiolytiske virkninger, var det kun den højere dosis, der påvirkede søvn-vågne-arkitekturen markant (vågnefremmende virkning med reduktion af SWS-2), hos Sprague-Dawley rotter (Kantor et al., 2005). En REMS-reducerende effekt er blevet fundet ved 1 mg/kg dosis i Wistar rotter, og theta effektforhøjelser under AW og REMS er også blevet observeret efter denne behandling (Kostyalik et al., 2014).
Effekten af SB-242084 og escitalopram på gammaaktivitet blev analyseret separat i vågenhedsstadier, da hjernefunktioner og tilhørende oscillatorisk aktivitet og neurotransmitterniveauer viser karakteristiske forskelle mellem stadierne. Gamma-svingninger spiller en rolle i funktioner forbundet med vågenhed som fokuseret opmærksomhed, kognition og sensorisk behandling er veldokumenteret (Cardin, 2016), men deres funktionelle betydning under søvn er mindre forstået. Under REMS er der blevet foreslået en rolle for gamma (ud over theta) svingninger i hukommelseskonsolidering (Montgomery et al., 2008). En nylig artikel har foreslået, at øget gammakraft i fasisk REMS-mikrotilstand i visse områder er forbundet med følelsesmæssig behandling, hos mennesker (Simor et al., 2019). Under ikke-REMS kan gamma-svingninger være forbundet med fasiske stigninger i neuronal aktivitet under langsomme svingninger (Valderrama et al., 2012). En mikroelektrode-undersøgelse i aber og mennesker har yderligere understreget rollen af gamma (og beta) svingninger under non-REMS, nemlig en høj svingnings kohærens tyder på et bidrag et bidrag et bidrag af gamma til hukommelseskonsolidering til hukommelseskonsolidering til hukommelseskonsolidering under non-REMS (Quyen et al, 2016).
Vi fandt, at en enkelt dosis SB-242084 forhøjede gammaeffekten under SWS-2, SWS-1 og – i mindre grad – PW, men ikke under REMS, IS og AW.
5-HT-neuroner fyrer mest aktivt under vågenhed, deres aktivitet falder under slow-wave-søvn og falder stille under REMS. 5-HT-systemet er således blevet betragtet som en nøglemodulator af søvn-vågne adfærd (Monti, 2011) og hjernens svingninger, selv om de cellulære mekanismer og de receptorer, der er involveret i disse processer, er komplekse og dårligt forstået (Puig og Gener, 2015). 5-HT i sig selv har vist sig at påvirke gammaaktivitet i rottepræfrontal cortex gennem 5-HT1ARs og 5-HT2ARs, men ikke 5-HT2CRs, hvilket resulterer i et generelt fald i amplituden hos bedøvede rotter (Puig et al., 2010). Desuden er der en stigende dokumentation, der understøtter DA-systemets betydning for synkronisering af hurtigt spikende interneuroner og dermed genererer/regulerer gamma-svingninger (Furth et al., 2013).
5-HT2CR er formodentlig den 5-HT-receptorsubtype med den mest udbredte fordeling i hjernen. Den er blevet beskrevet på GABAergiske interneuroner i mange regioner og udtrykkes også af DA-neuroner. Denne receptorsubtype udtrykkes imidlertid ikke af 5-HT- og noradrenerge (NA) neuroner. 5-HT2CR’ernes rolle i moduleringen af de monoaminerge og spændende nok DA-systemer er blevet understreget af flere prækliniske undersøgelser (Di Giovanni og De Deurwaerdere, 2016; De De Deurwaerdere og Di Giovanni, 2017). Lokal stimulering af 5-HT2CR’erne i specifikke hjerneområder producerede angst på en regionsafhængig måde, og til gengæld udøvede subtypeselektive 5-HT2CR-antagonister som SB-242084 markante anxiolytiske handlinger (Bagdy et al., 2001; Di Giovanni og De Deurwaerdere, 2016). Flere anxiolytika og antidepressiva besidder 5-HT2CR-antagonistiske egenskaber, for eksempel adskillige tricykliske antidepressiva, mianserin, mirtazapin, trazodon, nefazodon, fluoxetin og agomelatin (Martin et al., 2014). På den anden side er selektive 5-HT2CR-antagonister blevet foreslået som formodede hurtigt indsættende antidepressiva baseret på prækliniske undersøgelser (Opal et al., 2014).
Der er blevet offentliggjort få undersøgelser vedrørende kvalitative (påvirker søvn-vågn-arkitekturen) og kvantitative (påvirker effektspektrer, dvs. svingninger) søvn-vågn-effekter af 5-HT2CR-antagonister, og SB-242084 i særdeleshed. Kantor et al. har undersøgt de dosisafhængige virkninger af SB-242084 på angst, årvågenhed og EEG-spektrer under 30 Hz hos rotter. De har fundet øget theta-effekt i vågen tilstand (hvilket tyder på en mulig en mulig kognitionsfremmende effekt, da theta-aktivitet er forbundet med indlærings- og hukommelsesprocesser) selv ved en dosis på 0,1 mg/kg. I modsætning hertil øgede stoffet vågenhed og undertrykte SWS-2 i den første time af den passive fase kun ved 1 mg/kg dosis. Med hensyn til delta-, alfa- eller beta-frekvensbånd under vågen tilstand, REMS, SWS-1 eller SWS-2 er der ikke rapporteret nogen signifikant ændring i denne artikel (Kantor et al., 2005). Kostyalik et al. har beskrevet, at SB-242084 forhøjede PW-varigheden og undertrykte REMS, hvilken effekt blev dæmpet af kronisk ESC-forbehandling, hos rotter. Med hensyn til qEEG har de fundet øget theta-kraft under AW og også under REMS, som ikke blev yderligere modificeret af kronisk escitalopram-forbehandling (Kostyalik et al., 2014). Den theta-forstærkende effekt af 5-HT2CR-antagonisten og dermed 5-HT2CR’s rolle i reguleringen af theta-aktivitet er blevet understøttet af Hajos et al. (2003b).
Effekterne af escitalopram og andre SSRI’er på søvn-vågne-arkitektur og EEG-parametre hos mennesker og gnavere er mere omfattende undersøgt (Wilson og Argyropoulos, 2005; Vas et al., 2013; Fitzgerald og Watson, 2019). For nylig har vi rapporteret gammaeffektændringer efter akut (reduktion under REMS) og kronisk (forhøjelse under SWS-1 og SWS-2) administration til rotter (Papp et al., 2018).
Interessant nok lignede de akutte virkninger af SB-242084 dem, der blev forårsaget af kronisk escitalopram, med andre ord, selektiv antagonisme på 5-HT2CR producerede lignende virkninger på gammaaktivitet som den kroniske blokade af 5-HT-transporteren og yderligere virkninger escitalopram udøver. I så fald formoder vi, at virkninger af 5-HT, nemlig desensibilisering af 5-HT1AR (og muligvis også 5-HT2AR) kan forklare stigningen i gammaeffekt i disse stadier, som vi har foreslået i vores tidligere artikel (Papp et al., 2018).
For at forklare vores fund skal vi tage hensyn til, at 5-HT2CR’er kan modulere 5-HT, NA og, hvad der er vigtigt, DA-neuronal aktivitet (Di Giovanni og De Deurwaerdere, 2016). Konstitutiv aktivitet af 5-HT2CR’erne er blevet rapporteret til at udøve hæmmende kontrol på DA-neuronaktivitet, hvilket blev vendt ved systemisk administration af 5-HT2CR-antagonister. SB-242084 og SB-206553 øgede signifikant den basale DA-frigivelse i DA-innerverede områder af rottehjernen. Den SB-242084 fremkaldte DA-frigivelse var imidlertid lille og nåede et maksimum sammenlignet med SB-206553 (De De Deurwaerdere et al., 2004). Interessant nok er SSRI’er også blevet impliceret i regulering af DAerg signalering (hvilket kan indikere et muligt fælles træk ved de to undersøgte lægemidler), selv om de tilgængelige litteraturdata er tvetydige. Mens akut escitalopram er blevet rapporteret til at øge fyringshastigheden og bursting af neuroner i det ventrale tegmentale område (Schilstrom et al., 2011), har en anden undersøgelse vist, at en 2-ugers lang administration af escitalopram mindskede fyringshastigheden og bursting af disse neuroner, i bedøvede rotter (Dremencov et al., 2009).
Fundene i denne undersøgelse bør fortolkes i forbindelse med nogle begrænsninger. SB-242084 blev kun administreret i én dosis, og vi testede ikke, om den gammaforstærkende virkning af lægemidlet er dosisafhængig. Desuden var vores analyse begrænset til et maksimum på 60 Hz på grund af Nyquist-grænsen bestemt af den nominelle samplingfrekvens, så der er behov for yderligere arbejde for at undersøge hurtigere gammafrekvenser samt højfrekvente svingninger (HFO) og ripples.
Totalt set viser vores resultater lignende virkninger mellem akut SB-242084 og kronisk escitalopram på gammaaktivitet, hvilket understøtter prækliniske (og indirekte kliniske) beviser for, at akut eller kortvarig behandling med 5-HT2CR-antagonister kan have antidepressive virkninger. Vores arbejde kan således give yderligere beviser for, at 5-HT2CR-antagonister kan være gavnlige i behandlingen af depression og/eller angst. Hvorvidt ændringer af gammaaktivitet er markører for terapeutisk lægemiddelvirkning eller mediatorer af terapeutisk effekt, er fortsat et uløst spørgsmål, der kræver yderligere undersøgelser.
Datatilgængelighedserklæring
Datasættene genereret og analyseret under den aktuelle undersøgelse er ikke offentligt tilgængelige på grund af igangværende analyse med henblik på fremtidig offentliggørelse, men er tilgængelige fra den tilsvarende forfatter efter rimelig anmodning.
Ethisk erklæring
Alle opstaldningsforhold og dyreforsøg blev udført i overensstemmelse med EU-direktiv 2010/63/EU og National Institutes of Health “Principles of Laboratory Animal Care” (NIH Publications No. 85-23, revideret 1985), samt specifikke nationale love (den ungarske regeringsforordning om dyreforsøg 40/2013). Forsøgene blev godkendt af den nationale videnskabelige etiske komité for dyreforsøg og godkendt af regeringen (Direktoratet for fødevarekædesikkerhed og dyresundhed i det centrale landbrugskontor, tilladelse nr. 22.1/1375/7/2010).
Author Contributions
GB og TK planlagde forsøgene. DK, SV og PP udførte de eksperimentelle procedurer. GB, DK, SV og NP bidrog til dataanalysen. NP, SK, SV og GB fortolkede resultaterne. NP, SK og GB har skrevet det første udkast til manuskriptet. Alle forfattere har læst og godkendt det endelige manuskript.
Funding
Dette arbejde blev støttet af det nationale udviklingsagentur (KTIA_NAP_13-1-2013-0001) Hungarian Brain Research Program (Grant No. KTIA_13_NAP-A-II/14), NAP 2.0 (tilskud nr. 2017-1.2.1-NKP-2017-00002); ITM/NKFIH Thematic Excellence Programme, Semmelweis University; og SE-Neurology FIKP-tilskuddet fra EMMI.
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Anerkendelser
Vi takker Zita Kátai og Emese Bogáthy for deres hjælp til eksperimenterne og/eller analyse af dataene.
Supplementært materiale
Det supplerende materiale til denne artikel kan findes online på: https://www.frontiersin.org/articles/10.3389/fphar.2019.01636/full#supplementary-material
Bagdy, G., Graf, M., Anheuer, Z. E. E., Modos, E. A., Kantor, S. (2001). Angstlignende virkninger induceret af akut fluoxetin-, sertralin- eller m-CPP-behandling vendes ved forbehandling med 5-HT2C-receptorantagonisten SB-242084, men ikke med 5-HT1A-receptorantagonisten WAY-100635. Int. J. Neuropsychopharmacol. 4 (4), 399-408. doi: 10.1017/S1461145701002632
PubMed Abstract | CrossRef Full Text | Google Scholar
Bagdy, G. (1998). Serotonin, angst og stresshormoner. Fokus på 5-HT-receptorsubtyper, arter og kønsforskelle. Ann. N. Y. Acad. Sci. 851, 357-363. doi: 10.1111/j.1749-6632.1998.tb09009.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogathy, E., Papp, N., Tothfalusi, L., Vas, S., Bagdy, G. (2019). Additiv effekt af 5-HT2C- og CB1-receptorblokade på reguleringen af søvn-vågncyklus. BMC Neurosci. 20 (1), 14. doi: 10.1186/s12868-019-0495-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Burghardt, N. S., Bush, D. E., McEwen, B. S., McEwen, B. S., LeDoux, J. E. (2007). Akutte selektive serotonin-genoptagelseshæmmere øger betinget frygtudtryk: blokade med en 5-HT(2C)-receptorantagonist. Biol. Psychiatry 62 (10), 1111-1118. doi: 10.1016/j.biopsych.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., Wang, X. J. (2012). Mekanismer for gamma-svingninger. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
PubMed Abstract | CrossRef Full Text | Google Scholar
Cardin, J. A. (2016). Snapshots af hjernen i aktion: lokale kredsløbsoperationer gennem linsen af gamma-svingninger. J. Neurosci. 36 (41), 10496-10504. doi: 10.1523/JNEUROSCI.1021-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Chagraoui, A., Thibaut, F., Skiba, M., Thuillez, C., Bourin, M. (2016). 5-HT2C-receptorer i psykiatriske lidelser: en gennemgang. Prog. Neuropsychopharmacol. Biol. Psychiatry 66, 120-135. doi: 10.1016/j.pnpbp.2015.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Cremers, T. I., Giorgetti, M., Bosker, F. J., Hogg, S., Arnt, J., Mork, A., et al. (2004). Inaktivering af 5-HT(2C)-receptorer potenserer konsekvenserne af serotonin genoptagelsesblokade. Neuropsychopharmacology 29 (10), 1782-1789. doi: 10.1038/sj.npp.1300474
PubMed Abstract | CrossRef Full Text | Google Scholar
De De Deurwaerdere, P., Di Giovanni, G. (2017). Serotonerg modulation af aktiviteten af mesencephale dopaminerge systemer: terapeutiske implikationer. Prog. Neurobiol. 151, 175-236. doi: 10.1016/j.pneurobio.2016.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
De De Deurwaerdere, P., Navailles, S., Berg, K. A., Clarke, W. P., Spampinato, U. (2004). Konstitutiv aktivitet af serotonin2C-receptoren hæmmer in vivo dopaminfrigivelse i rottestriatum og nucleus accumbens. J. Neurosci. 24 (13), 3235-3241. doi: 10.1523/JNEUROSCI.0112-04.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Dekeyne, A., Denorme, B., Monneyron, S., Millan, M. J. (2000). Citalopram reducerer social interaktion hos rotter ved aktivering af serotonin (5-HT)(2C)-receptorer. Neuropharmacology 39 (6), 1114-1117. doi: 10.1016/s0028-3908(99)00268-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Demireva, E. Y., Suri, D., Morelli, E., Mahadevia, D., Chuhma, N., Teixeira, C. M., et al. (2018). 5-HT2C-receptorblokade vender SSRI-associeret basal gangliadysfunktion og potentierer terapeutisk effekt. Mol. Psychiatry. doi: 10.1038/s41380-018-0227-x
CrossRef Full Text | Google Scholar
Di Giovanni, G., De Deurwaerdere, P. (2016). Nye terapeutiske muligheder for 5-HT2C-receptorligander i neuropsykiatriske lidelser. Pharmacol. Ther. 157, 125-162. doi: 10.1016/j.pharmthera.2015.11.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Dremencov, E., El Mansari, M., Blier, P. (2009). Virkninger af vedvarende serotonin-genoptagelseshæmning på fyring af dopaminneuroner i rotte ventral tegmental område. J. Psychiatry Neurosci. 34 (3), 223-229.
PubMed Abstract | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2018). Gammaoscillationer som en biomarkør for større depression: et nyt emne. Transl. Psychiatry 8 (1), 177. doi: 10.1038/s41398-018-0239-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2019). In vivo elektrofysiologiske optagelser af virkningerne af antidepressive lægemidler. Exp. Brain Res. 237 (7), 1593-1614. doi: 10.1007/s00221-019-05556-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Furth, K. E., Mastwal, S., Wang, K. H., Buonanno, A., Vullhorst, D. (2013). Dopamin, kognitiv funktion og gamma-svingninger: rolle af D4-receptorer. Front. Cell Neurosci. 7, 102. doi: 10.3389/fncel.2013.00102
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Robinson, D. D., Yu, J. H., Yu, J. H., Hajos-Korcsok, E. (2003a). Norepinephrin-, men ikke serotonin-genoptagelseshæmmere øger theta- og gammaaktiviteten i det septo-hippocampale system. Neuropsychopharmacology 28 (5), 857-864. doi: 10.1038/sj.npp.1300116
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., W. E., Weaver, R. J. (2003b). Regulering af septo-hippocampal aktivitet af 5-hydroxytryptamin(2C)-receptorer. J. Pharmacol. Exp. Ther. 306 (2), 605-615. doi: 10.1124/jpet.103.051169
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakus, R., Graf, M., Juhasz, G., Gerber, K., Levay, G., Halasz, P., et al. (2003). 5-HT2C-receptorer hæmmer og 5-HT1A-receptorer aktiverer generering af spike-bølgeudladninger i en genetisk rottemodel af fraværsepilepsi. Exp. Neurol. 184 (2), 964-972. doi: 10.1016/S0014-4886(03)00352-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Balogh, B., Benko, A., Bagdy, G. (2004). Øget vågenhed, motorisk aktivitet og nedsat theta-aktivitet efter blokade af 5-HT2B-receptoren med den subtypeselektive antagonist SB-215505. Br. J. Pharmacol. 142 (8), 1332-1342. doi: 10.1038/sj.bjp.0705887
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Molnar, E., Gyongyosi, N., Toth, A., Detari, L., et al. (2005). På trods af lignende anxiolytisk potentiale producerede 5-hydroxytryptamin 2C-receptorantagonisten SB-242084 indolin] og chlordiazepoxid differentielle virkninger på elektroencefalogrammstrømspektrer. J. Pharmacol. Exp. Ther. 315 (2), 921-930. doi: 10.1124/jpet.105.086413
PubMed Abstract | CrossRef Full Text | Google Scholar
Kennett, G. A., Wood, M. D., Bright, F., Trail, B., Riley, G., Holland, V., et al. (1997). SB 242084, en selektiv og hjernepenetrerende 5-HT2C-receptorantagonist. Neuropharmacology 36 (4-5), 609-620. doi: 10.1016/s0028-3908(97)00038-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Khalid, A., Kim, B. S., Seo, B. A., Lee, S. T., Jung, K. H., Chu, K., et al. (2016). Gamma-oscillation i funktionelle hjernenetværk er involveret i den spontane remission af depressiv adfærd induceret af kronisk fastholdelsesstress hos mus. BMC Neurosci. 17, 4. doi: 10.1186/s1286868-016-0239-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyalik, D., Katai, Z., Vas, S., Pap, D., Petschner, P., Molnar, E., et al. (2014). Kronisk escitalopram-behandling forårsagede dissociativ tilpasning i serotonin (5-HT) 2C-receptorantagonist-inducerede virkninger i REM-søvn, vågen og thetabølgeaktivitet. Exp. Brain Res. 232 (3), 935-946. doi: 10.1007/s00221-013-3806-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, J. R., Ballard, T. M., T. M., Higgins, G. A. (2002). Indflydelse af 5-HT2C-receptorantagonisten SB-242084 i test af angst. Pharmacol. Biochem. Behav. 71 (4), 615-625. doi: 10.1016/s0091-3057(01)00713-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, C. B., Hamon, M., Lanfumey, L., Lanfumey, L., Mongeau, R. (2014). Kontroverser om 5-HT(2C)-receptorernes rolle i virkningsmekanismerne for antidepressive lægemidler. Neurosci. Biobehav. Rev. 42, 208-223. doi: 10.1016/j.neubiorev.2014.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Montgomery, S. M., Sirota, A., Buzsaki, G. (2008). Theta- og gamma-koordinering af hippocampale netværk under vågen og hurtig øjenbevægelsessøvn. J. Neurosci. 28 (26), 6731-6741. doi: 10.1523/JNEUROSCI.1227-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Monti, J. M. (2011). Serotonin kontrol af søvn-vågn adfærd. Sleep Med. Rev. 15 (4), 269-281. doi: 10.1016/j.smrv.2010.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Noda, Y., Zomorrodi, R., Saeki, T., Rajji, T. K., Blumberger, D. M., Daskalakis, Z. J., et al. (2017). Resting-state EEG gammakraft og theta-gamma koblingsforbedring efter højfrekvent venstre dorsolateral prefrontal rTMS hos patienter med depression. Clin. Neurophysiol. 128 (3), 424-432. doi: 10.1016/j.clinph.2016.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Opal, M. D., Klenotich, S. C., Morais, M., Bessa, J., Winkle, J., Doukas, D., et al. (2014). Serotonin 2C receptor antagonister inducerer hurtigt indsættende antidepressive virkninger. Mol. Psychiatry 19 (10), 1106-1114. doi: 10.1038/mp.2013.144
PubMed Abstract | CrossRef Full Text | Google Scholar
Papp, N., Vas, S., Bogathy, E., Katai, Z., Kostyalik, D., Bagdy, G. (2018). Akut og kronisk escitalopram ændrer EEG gamma-svingninger forskelligt: relevans for terapeutiske virkninger. Eur. J. Pharm. Sci. 121, 347-355. doi: 10.1016/j.ejps.2018.06.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Popa, D., Lena, C., Fabre, V., Prenat, C., Gingrich, J., Escourrou, P., et al. (2005). Bidrag fra 5-HT2-receptorsubtyper til søvn-vågnende og respiratorisk kontrol og funktionelle tilpasninger i knock-out mus, der mangler 5-HT2A-receptorer. J. Neurosci. 25 (49), 11231-11238. doi: 10.1523/JNEUROSCI.1724-05.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Gener, T. (2015). Serotoninmodulation af præfronto-hippocampale rytmer i sundhed og sygdom. ACS Chem. Neurosci. 6 (7), 1017-1025. doi: 10.1021/cn500350e
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Watakabe, A., Ushimaru, M., Yamamori, T., Kawaguchi, Y. (2010). Serotonin modulerer hurtigt spikende interneuron- og synkron aktivitet i rottepræfrontal cortex gennem 5-HT1A- og 5-HT2A-receptorer. J. Neurosci. 30 (6), 2211-2222. doi: 10.1523/JNEUROSCI.3335-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Quyen, M. L. V., Muller, L. E., Telenczuk, B., Halgren, E., Cash, S., Hatsopoulos, N. G., et al. (2016). Højfrekvente svingninger i menneskelig og abe neocortex under vågen-søvn cyklus. Proc. Natl. Acad. Sci. U. S. A. 113 (33), 9363-9368. doi: 10.1073/pnas.1523583113
PubMed Abstract | CrossRef Full Text | Google Scholar
Schilstrom, B., Konradsson-Geuken, A., Ivanov, V., Gertow, J., Feltmann, K., Marcus, M. M., et al. (2011). Effekter af S-citalopram, citalopram og R-citalopram på fyringsmønstre af dopaminneuroner i det ventrale tegmentale område, N-methyl-D-aspartat-receptormedieret transmission i den mediale præfrontale cortex og kognitiv funktion hos rotte. Synapse 65 (5), 357-367. doi: 10.1002/syn.20853
PubMed Abstract | CrossRef Full Text | Google Scholar
Simor, P., van Der Wijk, G., Gombos, F., Gombos, F., Kovacs, I. (2019). Paradokset af hurtig øjenbevægelsessøvn i lyset af oscillatorisk aktivitet og kortikal synkronisering under phasiske og toniske mikrotilstande. Neuroimage 202, 116066. doi: 10.1016/j.neuroimage.2019.116066
PubMed Abstract | CrossRef Full Text | Google Scholar
Sorman, E., Wang, D., Hajos, M., Kocsis, B. (2011). Kontrol af hippocampal theta-rytme af serotonin: rolle af 5-HT2c-receptorer. Neuropharmacology 61 (3), 489-494. doi: 10.1016/j.neuropharm.2011.01.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiger, A., Kimura, M. (2010). Vågne og søvn EEG giver biomarkører i depression. J. Psychiatr. Res. 44 (4), 242-252. doi: 10.1016/j.jpsychires.2009.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Valderrama, M., Crepon, B., Botella-Soler, V., Martinerie, J., Hasboun, D., Alvarado-Rojas, C., et al. (2012). Menneskelige gamma-svingninger under langsom bølgesøvn. PloS One 7 (4), e33477. doi: 10.1371/journal.pone.0033477
PubMed Abstract | CrossRef Full Text | Google Scholar
Vas, S., Katai, Z., Kostyalik, D., Pap, D., Molnar, E., Petschner, P., et al. (2013). Differentiel tilpasning af REM-søvnens latenstid, mellemstadie og thetakraftvirkninger af escitalopram efter kronisk behandling. J. Neural Transm. (Wien) 120 (1), 169-176. doi: 10.1007/s00702-012-0847-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilson, S., Argyropoulos, S. (2005). Antidepressiva og søvn: en kvalitativ gennemgang af litteraturen. Drugs 65 (7), 927-947. doi: 10.2165/00003495-200565070-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanos, P., Moaddel, R., Morris, P. J., Georgiou, P., Fischell, J., Elmer, G. I., et al. (2016). NMDAR-hæmningsuafhængige antidepressive virkninger af ketaminmetabolitter. Nature 533 (7604), 481-486. doi: 10.1038/nature17998
PubMed Abstract | CrossRef Full Text | Google Scholar