- Introduktion
- Materialer og metoder
- Materialer og kemikalier
- Cellelinjeforberedelse
- Zebrafiskforberedelse
- Celleviabilitetsassay og morfologisk observation
- Apoptoseanalyse ved DAPI-farvning og flowcytometri
- Xenograft Animal Assay
- Real Time PCR (qPCR)-analyse
- Western Blot (WB)-analyse
- Statistisk analyse
- Resultater
- Antiproliferativ virkning af TF
- Pro-apoptotisk virkning af TF
- In vivo effekt af TF på Xenograft Zebrafisk
- Molekylær virkning af TF på mRNA-ekspressioner i A375-celler
- Molekylær virkning af TB på proteinudtryk i A375-celler
- Diskussion
- Slutning
- Data Availability Statement
- Ethisk erklæring
- Author Contributions
- Funding
- Interessekonflikter
- Abkortelser
Introduktion
Melanom er en dødelig type hudkræft med højt metastatisk potentiale og uhåndterbarhed (Yang et al., 2018). Melanompatienter i fremskredne stadier er altid uoprettelige og har en dårligere prognose (Leonardi et al., 2018). Kemoterapi er en grundpille i den kliniske behandling af melanom, men effektiviteten af kemoterapeutika er begrænset på grund af deres bivirkninger på sundt væv (Oliveira Pinho et al., 2019). For nylig er flere immunterapier, herunder CTLA-4- eller PD-1-receptorinhibitorer, blevet udviklet som nye muligheder for behandling af melanom, men deres effektivitet er upålidelig, og deres bivirkninger er stadig ikke ubetydelige (Rodríguez-Cerdeira et al., 2017). Der er derfor et presserende behov for nye strategier med tilfredsstillende effektivitet og sikkerhed. Traditionel kinesisk medicin (TCM) er en komplementær tilgang og er blevet anvendt klinisk i tusindvis af år, idet den besidder en vis effektivitet og færre bivirkninger. Ifølge TCM-teorien er kræft forbundet med kroppens ophobning af slim, toksiner eller inflammation, og de anti-slimske, anti-toksiske eller anti-inflammatoriske urter kan besidde anti-kræftvirkninger (Wang og Cheng, 2019). Teorien er blevet understøttet af mange tilfælde. For eksempel udøvede curcumin i Rhizoma Curcumae longae cytotoksiske virkninger ved at inducere apoptose og hæmme angiogenese af melanomceller (Mirzaei et al., 2016), og vitexin i Vitex negundo undertrykte melanomcellevækst ved at inducere DNA-skader og øge ROS-niveauet (Liu et al., 2018). Derfor har TCM-urtekomponenter et stort potentiale til behandling af kræftformer, såsom melanom.
The er en af de mest udbredte drikkevarer i verden. Det er velkendt ikke kun for den ejendommelige smag, men også for fordelene for sundheden. På grund af forskellen i processen har te tre hovedtyper, herunder ugæret grøn te, delvis gæret oolong te og fuldt gæret sort te eller pu-erh te (Kuo et al., 2005). Te-blade er blevet karakteriseret som en TCM-urt med anti-slim- og anti-toksiske egenskaber, hvilket indikerer dens potentiale mod kræft. Moderne undersøgelser har rapporteret, at te-drik er effektiv til at forebygge og behandle kræft (Jin et al., 2018). For nylig har tepolyfenoler vist sig at besidde anti-canceraktivitet, som har en overlegen effekt i forhold til te-drik (Mao et al., 2019). Theaflavin (TF) er en sådan polyfenolkomponent, der produceres ved oxidation af katekiner fra teblade under fermentering og fungerer som et hovedpigment for farven, smagen og bioaktiviteten af te (Roberts et al., 1957). Det er i stand til at inducere apoptose i en række kræftcellelinjer, såsom humane brystkarcinomcellelinjer (MCF-7, MDA-MB-231, T47D og ZR-75-1), kolonkarcinomcellelinjer (HCT-15 og HT-29) og leverkarcinomcellelinjer (HCCLM3 og Huh-7), hvilket indikerer et anti-kræftpotentiale (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Ikke desto mindre er der endnu kun blevet lagt lidt vægt på dens virkning over for melanom.
I betragtning af de rapporterede pro-apoptotiske virkninger af TF på mange kræftcellelinjer (Lahiry et al., 2008), fremsætter vi en hypotese om, at TF udøver pro-apoptotiske virkninger på melanomceller. For at verificere dette udførte nærværende in vitro-eksperimenter for at evaluere den cytotoksiske pro-apoptotiske virkning af TF på humane melanomceller og udførte in vivo eksperiment ved hjælp af en xenograftmodel i larve zebrafisk for at bestemme dens tumorhæmmende virkning. Desuden blev TF’s mekanisme også udforsket.
Materialer og metoder
Materialer og kemikalier
Theaflavin (TF, >95% renhed) blev leveret af Theabio Co., Ltd (Hangzhou, Kina) (batchnummer: 20181211061). Dulbecco′s modificeret Eagle′s medium (DMEM) med højt glukoseindhold (4,5 g/l) blev fremstillet af HyClone Laboratories (UT, USA). Fetal bovin serum (FBS) blev fremstillet af Cell Max (Beijing, Kina). Trypsin (0,25 %) blev fremstillet af Gibco (NY, USA). 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid (MTT) og dimethylsulfoxid (DMSO) blev fremstillet af Sigma (St. Louis, MO, USA). Annexin-V: FITC-apoptosedetektionssæt blev fremstillet af BD Biosciences (CA, USA). 4′-6-diamidino-2-phenylindol (DAPI) farvningsopløsning blev fremstillet af Thermo Fisher Scientific (MA, USA). Primære antistoffer blev fremstillet af Cell Signaling Technology (MA, USA). Trizol-reagens og realtidspolymerasekædereaktionskit (realtids-PCR) blev opnået fra TaKaRa (Dalian, Kina).
Cellelinjeforberedelse
Human HFF-1 hudfibroblast og A375 melanomcellelinje blev opnået fra Shanghai Cell Bank of Chinese Academy of Sciences (Shanghai, Kina), og human A875 melanomcellelinje blev opnået fra Kunming Cell Bank of Chinese Academy of Sciences (Kunming, Kina). Disse cellelinjer blev dyrket i DMEM-medium indeholdende 10 % FBS ved 37 °C i et befugtet 5 % CO2-inkuberingsanlæg. Mediet blev skiftet dagligt, og cellerne blev behandlet med TF i deres logaritmiske vækstfase.
Zebrafiskforberedelse
Wild-type AB stamme af zebrafisk blev opnået fra China Zebrafish Resource Center, Institute of Hydrobiology, China Academy of Science (Wuhan, Kina) og akkrediteret af Association for Assessment and Accreditation of Laboratory Animal Care International (SYXK 2012-0171). Larve zebrafisk på 2 dpf (dage efter befrugtning) blev produceret ved naturlig parring og opstaldet i et lysstyret akvakulturanlæg med en standardfotoperiode på 14:10 timer dag/nat og fodret med levende saltvandsrejer to gange om dagen og yngelflager en gang om dagen.
Celleviabilitetsassay og morfologisk observation
MTT-assays blev udført for at bestemme de inhiberende virkninger af TF på melanomcellelinjer, som tidligere beskrevet (Zhou et al, 2017). Celler blev udsået i 96-well-plader ved 6 × 103 celler / brønd i 200 μl medium for 24 timer adhærens, efterfulgt af behandling med TF i koncentrationer på 0, 50, 100, 100, 150, 200, 250, 300 og 400 μg/ml i 24, 48 og 72 timer. Derefter blev 20 μl MTT-opløsning (5,0 mg/ml) tilsat til hver brønd og inkuberet ved 37 ° C i 4 timer. DMSO (150 μl) blev tilsat i hver brønd, og den optiske tæthedsværdi (OD-værdi) blev målt ved 490 nm med Biorad-mikropladelæser (CA, USA). Inhiberingsgrad (%) = × 100 %. De 50 % hæmmende koncentrationer (IC50) for 24, 48 og 72 timer blev beregnet ved regressionsanalyse. Følgelig blev 120, 240 og 360 μg/ml (232,3, 464,7 og 697,0 μM) betegnet som lav, middel og høj dosering af TF. Derefter blev HFF-1-, A375- og A875-cellelinjerne udsået i 96-well-plader som ovenfor og behandlet med middel dosis TF i 24 timer. Cellemorfologien af A375-celler blev observeret under Carl Zeiss fluorescensmikroskop (Göttingen, Tyskland).
Apoptoseanalyse ved DAPI-farvning og flowcytometri
Celleapoptose blev bestemt ved DAPI-farvning og annexin-V/PI-farvning-baseret flowcytometri. Til DAPI-farvning blev A375-celler udsået i 96-well-plader og behandlet med TF ved lave, middelhøje og høje koncentrationer i 24 timer, efterfulgt af fiksering med 4 % paraformaldehyd i PBS i 30 minutter ved stuetemperatur og farvning med DAPI i 10 minutter i mørke. Efter tre gange vask blev cellerne observeret ved hjælp af fem dækglas under Carl Zeiss fluorescensmikroskop (Göttingen, Tyskland), og de apoptotiske celler blev talt. Flowcytometri blev udført i henhold til producentens vejledning. Kort fortalt blev A375-cellerne udsået i 6-hulsplader med 3 × 105 celler pr. brønd i 24 timer og behandlet med TF i lave, middelhøje og høje koncentrationer i yderligere 48 timer. Derefter blev cellerne vasket to gange og mærket med annexin V-fluoresceinisothiocyanatopløsning og PI i bindingsbuffer. Fluorescensintensiteten af cellerne blev påvist ved BD C6 flowcytometri (CA, USA). Analysen blev gentaget, og de tidlige apoptotiske og sene apoptotiske cellerater (%) blev beregnet.
Xenograft Animal Assay
Til bestemmelse af TF’s dosisinterval blev der anvendt i alt 300 larve zebrafisk ved 3 dpf og tilfældigt opdrættet i 6-hulsplader med 30 fisk hver. TF blev opløst i hver brønd med henholdsvis 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1.000 og 2.000 μg/ml i 24 timer. Derefter blev fiskene i hver gruppe observeret under et stereoskopisk mikroskop for at registrere dødelighed og uønskede hændelser. Som beskrevet i vores tidligere undersøgelse blev NOAEL-niveauet (no observed adverse effect level) for TF estimeret, og 1/9 NOAEL, 1/3 NOAEL og NOAEL blev anvendt som de lave, midterste og høje doser i det følgende forsøg (Jin et al, 2018).
For at etablere xenograftmodellen blev A375-celler farvet med CM-Dil (rød fluorescens) i en fortynding på 1:1.000 og mikroinjiceret i æggeblommesækken af larve zebrafisk (2 dpf) i en dosis på 200 celler/fisk. Efter tumorvækst i 24 timer blev alle fisk observeret under et fluorescerende mikroskop (AZ100, Nikon, Tokyo, Japan) med henblik på modelverifikation. De A375-bærende fisk blev inddelt i 5 grupper (30 fisk hver) og behandlet med henholdsvis 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL og NOAEL af TF samt 15 μg/ml (50 μM) cisplatin i 24 h. Fluorescensintensiteten (FI) af A375-cellemassen af zebrafisk blev detekteret, og hæmningsraten blev beregnet som: hæmningsrate (%) = × 100 %.
Real Time PCR (qPCR)-analyse
For at afsløre de molekylære virkninger af TF på A375-celler blev qPCR anvendt på et ABI QuantStudio™ 7 Flex Real-Time PCR-system (Applied Biosystems, CA, USA). Det samlede RNA fra A375-celler blev ekstraheret ved hjælp af Trizol-reagens og syntetiseret til cDNA via omvendt transskription. qPCR-reaktionssystemet havde et volumen på 20,0 μl: 10 μl SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl PCR forward primer, 0,8 μl PCR reverse primer, 2,0 μl template cDNA, 0,4 μl ROX referencefarvestof og 6,0 μl ddH2O. qPCR-reaktionsbetingelserne blev indstillet til 95 °C i 30 s indledende denaturering, 40 cyklusser på 95 °C i 5 s denaturering, 60 °C i 34 s annealing og 72 °C i 40 s forlængelse. Ved afslutningen af hver reaktion blev der foretaget en smeltekurveanalyse. β-ACTIN blev anvendt som referencegen, og 2-ΔΔCT-metoden blev anvendt til at analysere den relative ekspression af hvert enkelt gen (tabel 1).

Tabel 1 Primersekvenser anvendt til qPCR-analyse.
Western Blot (WB)-analyse
Proteinekspressionen af A375-celler med TF-behandling ved 0 μg/ml og 120 μg/ml (232,3 μM) blev analyseret ved WB-analyse. De samlede proteiner blev ekstraheret ved hjælp af en lysisbuffer (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1% Triton, 0,1% SDS, 5 μg/ml leupeptin og 1 mM PMSF) i 30 min på is med gentagen nedfrysning og optøning. Målrettede proteiner blev separeret ved hjælp af denaturerende natriumdodecylsulfat-polyakrylamidgelelektroforese (SDS-PAGE) (8~12 %) og derefter overført til en polyvinylidenfluorid (PVDF)-membran (Millipore, MA, USA). Membranen blev blokeret med 5 % fedtfri mælk i 2 timer, efterfulgt af inkubation natten over ved 4 °C med antistoffer mod: ACTIN, ASK1, ATM, fosforyleret ATM (p-ATM), ATR, fosforyleret ATR (p-ATR), kløvet caspase 3 (c-CASP3), kløvet caspase 8 (c-CASP8), CHK1, CHK2, fosforyleret CHK1 og CHK2 (p-CHK1 og p-CHK2), JNK, fosforyleret JNK (p-JNK), C-JUN, fosforyleret C-JUN (p-C-JUN), spaltet PARP (poly ADP-ribosepolymerase), P53 og fosforyleret P53 (p-P53). Efter inkubation med det sekundære antistof blev disse proteiner visualiseret med et forstærket kemiluminescenssæt (Amersham Pharmacia Biotech, Little Chalfort, UK) og detekteret ved hjælp af en kemiluminescensanalysator.
Statistisk analyse
Data blev udtrykt som middelværdier ± SD og underkastet envejs ANOVA, efterfulgt af Fisher’s mindst signifikante forskel (LSD) sammenligning. Alle analyser blev udført ved hjælp af en opdateret version af DPS-software (Tang og Zhang, 2013).
Resultater
Antiproliferativ virkning af TF
Som vist i figur 1A, TF ved 50 μg/ml (96.8 μM) hæmmede signifikant levedygtigheden af A375-celler, og de hæmmende hastigheder blev øget med stigende TF-koncentrationer fra 50 til 400 μg/ml (96,8 til 744,4 μM) (hver P < 0,01 vs. normalt niveau), hvilket indikerer en koncentrationsafhængig måde. De hæmmende hastigheder blev også øget med TF-behandling fra 24 til 72 timer, med IC50 på henholdsvis 218,9 til 84,9 μg/ml (423,8 til 164,4 μM). Derefter anvendte vi 120, 240 og 360 μg/ml (232,3, 464,7 og 697,0 μM) som doser af henholdsvis TF-L, TF-M og TF-H. Som vist i figur 1B hæmmede TF-M tydeligvis levedygtigheden af A375- og A875-celler, men udøvede kun en lille virkning på HFF-1-celler. Som det fremgår af figur 1C, blev A375-cellernes morfologi tydeligvis ændret, og antallet af levende celler faldt med TF-behandling ved stigende koncentrationer.

Figur 1 Celleviabilitet for A375-celler med TF-behandling efter 24, 48 og 72 timer (A), celleviabilitet for HFF-1-, A375- og A875-celler med TF-behandling efter 24 timer (B) og morfologi for A375-celler med theaflavin (TF)-behandling efter 24 timer (C). Data var gennemsnit ± SD (n = 5). Ved hjælp af Fisher’s mindst signifikante forskel (LSD) multiple sammenligninger angiver data (gennemsnit ± SD) med samme lille bogstav (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d) ingen signifikant forskel mellem hinanden, mens data med forskellige bogstaver (a vs. b vs. c vs. b vs. b vs. e vs. f vs. g) angiver signifikant forskel med hinanden. Skala bar = 200 μm.
Pro-apoptotisk virkning af TF
DAPI-farvning og flowcytometri blev udført for at evaluere den pro-apoptotiske virkning af TF på A375-celler. Resultatet af DAPI-farvning viste apoptotisk morfologi, herunder skrumpet form, karyopyknose og kernefragmentering, i A375-celler med TF-behandling fra 120 til 360 μg/ml (232,3 til 697,0 μM) (figur 2A) (figur 2A). Antallet af apoptotiske celler blev signifikant forøget med TF-behandling ved 240 og 360 μg/ml (464,7 og 697,0 μM) (hver P < 0,01 vs. NC) (Figur 2C) (Figur 2C). Resultatet af flowcytometri viste TB-induceret tidlig apoptose og sen apoptose af A375-celler (Figur 2B). Antallet af tidlige og sene apoptotiske celler blev øget med TF-behandling fra 120 til 360 μg/ml (232,3 til 697,0 μM) (Figur 2B), og deres proportioner var signifikant højere med TF-behandling ved 360 μg/ml (697,0 μM) (P < 0,01 og P < 0,05 vs. normalt niveau) (Figur 2D, E). Resultaterne indikerede, at TF inducerede apoptose af A375-celler på en koncentrationsafhængig måde.
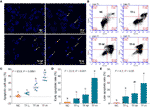
Figur 2 DAPI-farvningsobservation (A) og flowcytometrianalyse (B) på A375-celler med behandling med theaflavin (TF). Statistisk analyse af apoptotisk cellehyppighed (C), statistisk analyse af tidlig apoptotisk hyppighed (D) og statistisk analyse af sen apoptotisk hyppighed (E). Ved hjælp af Fisher’s mindst signifikante forskel (LSD) multiple sammenligninger angiver data (gennemsnit ± SD) med samme lille bogstav (a vs. ab; ab vs. b; b vs. b; c vs. c) ingen signifikant forskel mellem hinanden, mens data med forskellige bogstaver (a vs. b vs. c) angiver signifikant forskel mellem hinanden. Skala bar = 100 μm.
In vivo effekt af TF på Xenograft Zebrafisk
Kurverne for dødelighed og bivirkninger af zebrafisk med TF-behandling blev vist i Fig. 3A. Fiskedøden blev forårsaget af TF ved 31,25 μg/ml (60,5 μM), og ingen fisk blev overlevet med TF ved 125 μg/ml (242,0 μM), hvilket indikerer den maksimale ikke-dødelige dosis af TF mindre end 31,25 μg/ml (60,5 μM). De uønskede hændelser, herunder unormal kropsrulning og ødemer, blev observeret ved behandling med TF fra 3,47 μg/ml (6,7 μM) til de højere doser, hvilket indikerer NOAEL for TF på mindre end 3,47 μg/ml (6,7 μM). Efter gentagne forsøg blev NOAEL endelig anslået til 2,0 μg/ml (3,9 μM). Dermed blev 0,22, 0,67 og 2,0 μg/ml (0,4, 1,3 og 3,9 μM) anvendt som de lave, midterste og høje doser af TF til det efterfølgende eksperiment.
Som vist i figur 3B blev der etableret en xenograftmodel af A375-celler i larveformede zebrafisk, og de fluorescerende intensiteter af cellemassen i fiskene blev testet. Efter 24 timers behandling hindrede TF fra 0,22 til 2,0 μg/ml (0,4, 1,3 og 3,9 μM) tydeligvis A375-tumorvæksten med hæmningsrater fra 1,0 til 46,4 %. De hæmmende virkninger af TF ved 0,67 og 2,0 μg/ml (1,3 og 3,9 μM) var signifikante, hvis de blev sammenlignet med modelgruppen (P < 0,01), og virkningen af TF ved 2,0 μg/ml (3,9 μM) var endog højere end virkningen af cisplatin ved dets NOAEL (50 μM).
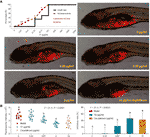
Figur 3 Dødelighed og bivirkninger hos larvezebrafiskerne induceret af theaflavin (TF) og observation af larvezebrafiskere xenotransplanteret med A375-celler med behandling med TF eller cisplatin (A) samt fluorescensintensiteten og de hæmmende hastigheder for TF (B). Fluorescerende område i rødt repræsenterer A375-cellemassen. Ved hjælp af LSD multiple sammenligninger angiver data (gennemsnit ± SD) med samme lille bogstav (a vs. a; c vs. c) ingen signifikant forskel mellem hinanden, mens data med forskellige bogstaver (a vs. b vs. c) angiver signifikant forskel med hinanden.
Molekylær virkning af TF på mRNA-ekspressioner i A375-celler
De relative mRNA-ekspressioner af TF-målrettede gener blev testet ved qPCR-assay. Som vist i fig. 4 blev udtrykkene af BAX, BIM, C-MYC, P21, P53 og PUMA signifikant opreguleret af TF (hver P < 0,01 vs. NC-niveau), undtagen for BAX med TF-behandling ved lav koncentration. Selv om ekspressionen af BCL-2 blev opreguleret af TF, var forholdet mellem BAX/BCL-2 signifikant højere med TF-behandling ved dens middelhøje til høje koncentrationer end ved NC-niveauet (P < 0,01), hvilket indikerer BAX’ hovedrolle i TF’s virkning.
Molekylær virkning af TB på proteinudtryk i A375-celler
WB blev anvendt til at bestemme ekspression og fosforylering af proteiner, som TF er målrettet mod. Som vist i figur 5 blev udtrykkene af ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8 og c-CASP3 signifikant opreguleret af TF ved 120 μg/ml (232,3 μM) (hver P < 0,01 vs. NC-niveau). Desuden var TF’s handlinger på ATR, p-ATR, CHK2, P53, C-JUN (43 kd) og p-C-JUN (Ser 73) ubetydelige (hver P > 0,05 vs. NC-niveau).
Diskussion
Selv om TF’s anti-canceraktiviteter er blevet veldokumenteret (Sur og Panda, 2017; Takemoto og Takemoto, 2018; Sajadimajd et al, 2020), er kendskabet til dets effektivitet på melanom stadig lidt. For at udfylde dette hul blev der i den foreliggende undersøgelse udført in vitro- og in vivo-eksperimenter for at undersøge virkningerne og mekanismen af TF mod melanomceller. For første gang påviste vi de cytotoksiske pro-apoptotiske og tumorhæmmende virkninger af TF på melanom A375-celler. Det blev foreslået, at mekanismen var forbundet med P53- og JNK-vejene. Det nye ved denne undersøgelse er fundet af TF′s anti-melanom-effekt, mens tidligere rapporter kun fokuserede på TF′s virkninger på andre tumorer (Lin, 2002; Sur og Panda, 2017). Endvidere er dette også den første rapport om TF′s molekylære virkning på JNK-banen, mens den P53-bane-associerede mekanisme af TF′s pro-apoptotiske virkning på karcinomceller tidligere er blevet rapporteret (Lahiry et al., 2008).
For nylig har xenograft-tumormodeller ved hjælp af larvezebrafisk tiltrukket sig stigende opmærksomhed til anti-cancerundersøgelser på grund af fordelene ved larvezebrafisk sammenlignet med andre dyremodeller: (1) den manglende immunafvisning mod menneskelige celler giver en højere succesrate for xenotransplantation; (2) kroppens gennemsigtighed giver in vivo synlig observation af tumorvækst og lægemiddeltoksicitet; og (3) storskala generation og hurtig organogenese giver kortere eksperimentelle perioder (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). I denne undersøgelse udøvede TF dosisafhængig hæmmende virkning på A375-tumormassen i larve zebrafisk (Figur 3B) med en hæmmende hastighed på 46,4 % ved dens NOAEL (3,9 μM). Hæmningsraten var højere end for cisplatin, hvilket indikerer, at TF var mere effektiv end cisplatin inden for deres respektive sikre dosisområde. Desuden var den hæmmende hastighed højere end den af et andet tepigment (theabrownin) (Jin et al., 2018), hvilket tyder på, at TF er den mest effektive komponent i te. Det effektive in vivo-dosisinterval (1,3 til 3,9 μM) af TF er imidlertid meget lavere end dets effektive in vitro-dosisinterval (96,8 til 774,4 μM). Årsagen til denne forskel kan være, at de metaboliserede TF-derivater efter oral indgift har en større virkning end TF efter oral indgift. Det tyder på, at oral anvendelse kan være mere effektiv end andre ruter for TF.
I henhold til dosisomregningsreglen kan de effektive doser (1,3 og 3,9 μM) af TF i larve zebrafiskes anslås som 0,03 til 0,09 mg/kg hos mennesker (Zhang et al., 2003). Det tyder på, at oral indgivelse af TF i et så lavt dosisinterval kan være effektiv til behandling af patienter med melanom, hvilket indikerer en god omkostningseffektivitet af dette stof. Så vidt vi ved, findes der kun få rapporter om den kliniske anvendelse af TF. Et dobbeltblindet, randomiseret, placebokontrolleret forsøg med parallelle grupper har anvendt TF-beriget grøn te-ekstrakt til behandling af patienter med let til moderat hyperkolesterolæmi i 12 uger (Maron et al., 2003). I dette forsøg var det daglige indtag af TF 75 mg i grøn te-ekstrakt, hvilket reducerede totalkolesterol, LDL-C og triglycerid signifikant hos voksne med hyperkolesterolæmi uden observation af væsentlige bivirkninger (Maron et al., 2003). I denne undersøgelse var det effektive dosisområde af TF meget lavere end det rapporterede, hvilket tyder på et større potentiale af TF til melanombehandling i klinikken. Men selv om det effektive dosisområde for TF var lille, var dets dødelige dosistærskel for zebrafisklarver også lav (<60,5 μM) og var lavere end andre tepigmenter (figur 3A) (Jin et al., 2018), hvilket efterlader en bekymring for TF’s potentielle toksicitet for mennesker. Interessant nok fandt vi, at TF udøvede lille effekt på den normale cellelinje (HFF-1 hudfibroblast) (Figur 1B), hvilket tyder på en klinisk gennemførlighed for dens eksterne brug, som kan undgå den potentielle toksicitet af dens interne brug.
Vores mekanistiske eksperiment viste, at TF aktiverede ATM, CHK1/2, P53, CASP8/3 i P53-vejen og også aktiverede ASK1, JNK og C-JUN i JNK-vejen, der associeres med A375-celleapoptose. Apoptosen blev bestemt ved DAPI-farvning og flowcytometrisk analyse på celleniveau (figur 2) og formidlet af overekspression af proapoptotiske gener (P53, BAX, BIM og PUMA) og aktivering af apoptose-relaterede proteiner (caspaser og PARP) på molekylært niveau (figur 4 og 5). P53 (TP53) koder for et DNA-bindende nukleært phosphoprotein med tumorsuppressoraktivitet, der fungerer som transkriptionsfaktor i centrum af et netværk til kontrol af apoptose som reaktion på cellulære belastninger (Martin et al., 2002). Det aktiverer apoptose ved at stimulere transkriptionen af gener fra Bcl-2-familien, såsom BAX, BIM og PUMA (Levine og Oren, 2009). BAX og BIM koder for pro-apoptotiske medlemmer, der fremkalder apoptose og celledød ved at aktivere caspase-kaskaden som reaktion på apoptotiske stimuli (Rossé et al., 1998; Youle og Strasser, 2008). PUMA, som en P53-opreguleret modulator af apoptose, koder for et BH3-domæne-holdigt protein, der lokaliseres til mitokondrierne, interagerer med Bax og Bak og aktiverer caspase-kaskaden ved spaltning af CASP3 (Nakano og Vousden, 2001; Letai, 2009). I denne undersøgelse blev CASP8 og CASP3 kløvet som reaktion på P53-aktivering. CASP8 er en initierende caspase i den apoptotiske kaskade, som aktiverer CASP3 til apoptotisk DNA-fragmentering, hvilket resulterer i efterfølgende spaltning af PARP (c-PARP) for at udføre den apoptotiske proces (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP er ansvarlig for DNA-reparation og cellens levedygtighed som reaktion på eksogen stress (Satoh og Lindahl, 1992). Det kan spaltes af CASP3 og letter derved den cellulære adskillelse i apoptose (Oliver et al., 1998). Således kan mængden af kløvet PARP (c-PARP) anvendes som markør for celleapoptose.
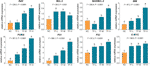
Figur 4 Relativ mRNA-ekspression af theaflavin (TF)-targeted gener i A375-celler efter 24 timers behandling. Ved hjælp af Fisher’s mindst signifikante forskel (LSD) multiple sammenligninger angiver data (gennemsnit ± SD) med samme lille bogstav (a vs. a; b vs. b; c vs. c) ingen signifikant forskel mellem hinanden, mens data med forskellige bogstaver (a vs. b vs. c vs. d) angiver signifikant forskel med hinanden.
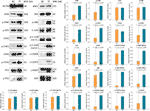
Figur 5 Ekspression og fosforylering af theaflavin (TF)-targeted proteiner i A375-celler efter 24 timers behandling. Data (gennemsnit ± SD) med forskellige små bogstaver er signifikant forskellige med hinanden ved Fisher’s mindst signifikante forskel (LSD) multiple sammenligninger.
I vores tidligere undersøgelser har vi rapporteret, at DNA-skadeinduktion var forbundet med P53-vejmedieret pro-apoptotisk mekanisme af theabrownin (Wu et al., 2016; Jin et al., 2018). Men selv om både TF og theabrownin aktiverede P53-vejen og inducerede tumorcelleapoptose, fandt vi imidlertid ikke DNA-skadeinduktion med TF-behandling i denne undersøgelse. Alternativt fandt vi aktivering af ASK1-JNK-C-JUN-kaskaden, som også fungerer som apoptotisk vej. I dette signalmodul er ASK1 (apoptosesignal-regulerende kinase 1) en mitogen-aktiveret proteinkinase, der spiller en nøglerolle i cytokin- og stressinduceret apoptose ved at udløse mitokondriafhængig vej (Matsuzawa og Ichijo, 2001; Zhang et al., 2003). Den aktiverer nedstrøms JNK-signalering som reaktion på forskellige typer stress, hvilket fører til celleapoptose gennem C-JUN-aktivering og efterfølgende overekspression af pro-apoptotiske gener (Tobiume et al., 2001). Kemoterapeutika, såsom cisplatin, docetaxel og paclitaxel, er blevet rapporteret til at inducere apoptose af melanomceller gennem JNK-vejen uafhængigt af P53-vejen (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). Dette indikerer, at TF kan have en fordel i forhold til disse lægemidler på grund af dens dobbeltvejsmedierede virkningsmekanisme, hvilket foreløbigt er blevet påvist ved de højere tumorhæmmende virkninger af TF end af cisplatin i denne undersøgelse. Der er imidlertid nogle begrænsninger i denne undersøgelse som følger: (1) virkningerne af P53- og JNK-veje i den foreslåede dobbeltvejsmedierede mekanisme for TF er ikke blevet verificeret; (2) interaktionen mellem P53- og JNK-veje er ikke blevet undersøgt, og hvilken vej der spiller den vigtigste rolle er ukendt; og (3) in vitro-dosisområdet og in vivo-dosisområdet er ret forskellige, hvilket er forklaret, men kræver eksperimentel dokumentation. For at løse disse problemer er der behov for yderligere undersøgelser i fremtiden. For eksempel bør der anvendes siRNA’er eller inhibitorer af P53 og JNK for at verificere virkningerne af disse veje og for at udforske interaktionen mellem hinanden, og serummetabolitterne af TF bør analyseres kemisk og undersøges farmakologisk for at teste vores hypotese om, at de metaboliserede TF-derivater har større virkning end TF. Da der desuden ikke er nogen kliniske rapporter om TF til kræftbehandling, bør den terapeutiske virkning og fordelene ved TF på kræftpatienter undersøges yderligere.
Slutning
Da TF’s anti-cancerpotentiale er veldokumenteret, er det fortsat usikkert, om TF er effektiv til behandling af melanom. I denne undersøgelse fandt vi ved hjælp af melanomcellelinje og xenograft zebrafiskmodel cytotoksiske pro-apoptotiske og tumorhæmmende virkninger af TF på melanomceller og afslørede dens mekanisme i forbindelse med aktivering af P53- og JNK-veje. Dette er den første undersøgelse, der beskriver virkningerne og mekanismen af TF mod melanomceller. Da TF’s mekanisme ikke kun var afhængig af P53-vejen, kan det forventes, at TF kan være effektiv i behandlingen af P53-muterede cellelinjer. Der er behov for yderligere undersøgelser for at verificere denne udledning. Alt i alt giver denne undersøgelse beviser for TF’s effektivitet mod melanom, hvilket bidrager til udviklingen af TF-afledte midler til melanombehandling.
Data Availability Statement
Råddataene, der understøtter konklusionerne i denne artikel, er tilgængelige fra den tilsvarende forfatter på rimelig anmodning.
Ethisk erklæring
Den dyreundersøgelse blev gennemgået og godkendt af den etiske komité for Zhejiang Chinese Medical University.
Author Contributions
LeZ udførte det vigtigste arbejde i denne artikel. BY udførte de cellulære og molekylære eksperimenter. LiZ og SM bidrog til at skrive dette manuskript. WD bidrog med ideer og finansieringsstøtte til dette arbejde. YX udførte zebrafiskeksperimentet. LS designede dette arbejde og udarbejdede manuskriptet. TE forbedrede udformningen og udkastet til denne artikel. Alle forfattere bidrog til artiklen og godkendte den indsendte version.
Funding
Dette arbejde blev støttet af National Natural Science Foundation of China (Grant No. 81774331, 81873049, og 81973873), Zhejiang Provincial Natural Science Foundation of China (Grant No. LY18H270004), Zhejiang Provincial Science and Technology Project of Traditional Chinese Medicine of China (Grant No. 2016ZZ011), Zhejiang Provincial Key Construction University Superiority Characteristic Discipline (Traditional Chinese Pharmacology) og Opening Foundation of China (Grant No. ZYX2018006).
Interessekonflikter
YX var ansat af virksomheden Hunter Biotechnology, Inc.
De øvrige forfattere erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Abkortelser
DAPI, 4′-6-diamidino-2-phenylindol; DMEM, Dulbecco′s modificeret Eagle′s medium; DMSO, dimethylsulfoxid; dpf, dage efter befrugtning; FBS, føtal bovin serum; FI, fluorescensintensitet; LSD, Fisher’s mindst signifikante forskel; NOAEL, no observed adverse effect level; MTT, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid; PARP, poly ADP-ribose polymerase; SDS-PAGE, denaturerende natriumdodecylsulfat-polyacrylamidgelelektroforese; TCM, theaflavin; TF, traditionel kinesisk medicin.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Theaflaviner forsinker human brystkræftcelles migration ved at hæmme NF-kappaB via p53-ROS cross-talk. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. (1999). Rollen af poly(ADP-ribose)polymerase (PARP)-spaltning i apoptose. Caspase 3-resistent PARP-mutant øger apoptosehastigheden i transficerede celler. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). Caspase-3 er nødvendig for DNA-fragmentering og morfologiske ændringer i forbindelse med apoptose. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownin udløser DNA-skader for at undertrykke humane osteosarcoma U2OS-celler ved at aktivere p53-signalvejen. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebrafisk xenografts som et værktøj til in vivo undersøgelser af kræft hos mennesker. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Sammenlignende undersøgelser af de hypolipidæmiske og vækstundertrykkende virkninger af oolong-, sort-, pu-erh- og grøn te-blade hos rotter. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Bidrag fra p53-medieret Bax-transaktivering i theaflavin-induceret mammaepithelkarcinomcelleapoptose. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Theaflaviner er rettet mod Fas/caspase-8- og Akt/pBad-veje for at fremkalde apoptose i p53-muterede humane brystkræftceller. Carcinogenesis 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Zebrafisk: en ny model på den farmaceutiske catwalk. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Kutant melanom: From pathogenesis to therapy (Review). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma strejker Bax. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.20090313134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). De første 30 år med p53: bliver stadig mere kompleks. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., S. B., Tu, Y. (2012). Theaflaviner hæmmer ATP-syntase og den respiratoriske kæde uden at øge superoxidproduktionen. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Kemoprævention af kræft ved hjælp af tepolyphenoler gennem modulering af signaltransduktionsveje. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Vitexinforbindelse 1, et nyt ekstrakt fra en kinesisk urt, undertrykker melanomcellevækst gennem DNA-skader ved at øge ROS-niveauerne. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatin inducerer den proapoptotiske konformation af Bak på en deltaMEKK1-afhængig måde. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Te og dens komponenter forebygger kræft: En gennemgang af den redox-relaterede mekanisme. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Kolesterolsænkende virkning af et theaflavinberiget grøn te-ekstrakt: et randomiseret kontrolleret forsøg. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Integrering af mutationsdata og strukturel analyse af TP53-tumor-suppressorproteinet. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Molekylære mekanismer for beslutningen mellem liv og død: regulering af apoptose ved hjælp af apoptosesignalregulerende kinase 1. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Inddragelse af endoplasmatisk reticulumstress i Docetaxel-induceret JNK-afhængig apoptose af humant melanom. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumin: En ny kandidat til melanombehandling? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, et nyt proapoptotisk gen, induceres af p53. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Nye nanoteknologiske strategier til systemisk kemoterapi mod melanom. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Betydningen af poly(ADP-ribose)polymerase og dens spaltning i apoptose. Lektion fra en uspaltelig mutant. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). High-throughput in vivo screening af hvirveldyr. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., R. A., Oldschool, M. (1957). De phenoliske stoffer i fremstillet te. I. Fraktionering og papirkromatografi af vandopløselige stoffer. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Fremskridt inden for immunterapi for melanom: En omfattende gennemgang. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Fremskridt vedrørende naturlige polyfenoler som kræftbekæmpende midler mod hudkræft. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Rollen af poly(ADP-ribose)dannelse i DNA-reparation. Nature 356 (6367), 356-358. doi: 10.1038/356356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Taxol-induceret mitokondriel stress i melanomceller medieres af aktivering af c-Jun N-terminal kinase (JNK) og p38-veje via afkoblingsprotein 2. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Theaflaviner undertrykker tumorvækst og metastase via blokering af STAT3-vejen i hepatocellulært karcinom. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). Pro-caspase-3 er et vigtigt fysiologisk mål for caspase-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Molekylære aspekter af kræft kemopræventive og terapeutiske virkninger af te og tepolyphenoler. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Syntese af theaflaviner og deres funktioner. Mol. (Basel Schweiz) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Data Processing System (DPS)-software med eksperimentelt design, statistisk analyse og data mining udviklet til brug i entomologisk forskning. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 er nødvendig for vedvarende aktivering af JNK/p38 MAP-kinaser og apoptose. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analyser af patogenese teorien om kræfttoksin og ‘konsolidering af kroppens modstandskraft og rydning af kilden’-teorien. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Anti-proliferativ og apoptose-inducerende effekt af theabrownin mod ikke-småcellet lunge adenocarcinom A549 celler. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T. T., Nan, H. (2018). En epidemiologisk gennemgang af kost og kutant malignt melanom. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). BCL-2-proteinfamilien: modsatrettede aktiviteter, der medierer celledød. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Zebrafisk: en dyremodel til toksikologiske undersøgelser. Curr. Protoc. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Theabrownin hæmmer cellecyklusprogression og tumorvækst af lungekarcinom gennem c-myc-relateret mekanisme. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar