- Introduktion
- Materialer og metoder
- Studiepopulation
- Studievariabler
- Resultater
- Fordeling af AB0/Rh-blodgruppe hos patienter med PCa
- Ingen signifikante forskelle i klinisk-patologiske karakteristika blandt PCa-patienter i henhold til AB0/Rh-blodgrupper
- Ingen signifikant prognostisk værdi af blodgruppe for BCR-fri overlevelse efter RP
- Diskussion
- Informeret samtykke
- Etisk erklæring
- Author Contributions
- Interessekonflikterklæring
Introduktion
Prostatacancer (PCa) er den mest almindelige maligne sygdom i vestlige lande og den næststørste årsag til kræftrelaterede dødsfald hos mænd (1). De mest anerkendte risikofaktorer for udvikling af PCa er stigende alder, etnisk oprindelse og familiehistorie (2). Den familiære prædisponering tyder på en arvelig genetisk komponent i sygdommen (3), men tegner sig kun for et mindretal (5-10 %) af PCa-tilfældene. Som følge heraf er de prædisponerende miljømæssige og genetiske faktorer for de fleste patienter stadig ukendte (4, 5). AB0-blodtype er en arvelig egenskab, der er blevet forbundet med forekomsten og prognosen for flere maligne sygdomme (6-8). Flere plausible mekanismer, herunder inflammation, immunovervågning af maligne celler, intercellulær adhæsion og membransignalering, er blevet foreslået for at forklare den observerede sammenhæng mellem AB0-blodgrupper og kræftrisiko.
AB0-blodgruppeantigener (ABH) er glykoproteiner, der udtrykkes på overfladen af røde blodlegemer. De fænotypiske A- og B-antigener er terminale kulhydrater, der syntetiseres ved addition af enkelte sukkerstoffer, som katalyseres af en række specifikke glykosyltransferaser. Fænotype 0 er kendetegnet ved fravær af A- og B-glykosyltransferaser, således at der kun er en proteinrygge, H-antigenet, til stede. Antigener fra røde blodlegemer har forskellige funktioner, herunder membranstrukturel integritet, transport af molekyler gennem membraner og adhæsion (9). Ud over deres ekspression på røde blodlegemer udtrykkes ABH-antigener også i en række epithelceller, herunder urothelium, gastrointestinale slimhinder og lunger. Flere undersøgelser påviste ændringer i ABH-ekspressionsmønsteret i kræftcellerne efter tumorgrad og sygdomsprogression, hvilket tyder på en mulig sammenhæng mellem AB0-blodgruppen og risikoen for visse epithelmaligniteter (8, 10). Nylige undersøgelser viste, at personer med blodgruppe A, AB eller B havde en øget forekomst af bugspytkirtelkræft sammenlignet med personer med blodgruppe 0, mens den højeste risiko blandt dem viste sig at være forbundet med blodgruppe B (8). På samme måde blev det rapporteret, at blodserotype A var forbundet med en højere risiko for mave-, bryst- og æggestokkræft (11). På den anden side var blodgruppe 0 forbundet med de højeste recidiv- og progressionsrater efter transurethral resektion af blæren og dermed forbundet med en dårligere prognose hos patienter med ikke-muskelinvasivt urothelialkarcinom i blæren (6).
Baseret på de nuværende beviser for blodgruppens prædiktive rolle ved flere maligniteter har vi opstillet den hypotese, at blodgruppetypen kan anvendes som en yderligere parameter, der letter risikovurderingen og hjælper med at vurdere prognosen efter operation hos patienter med PCa. I den nuværende litteratur er der kun begrænset klinisk evidens til rådighed vedrørende blodgruppe og PCa generelt, hvilket viste kontroversielle resultater (12-14) Desuden findes der i øjeblikket kun én undersøgelse med særligt fokus på blodgruppers indvirkning på resultatet hos patienter efter radikal prostatektomi (RP) (13). Ved hjælp af 555 patienter med PCa, der gennemgik RP, viste forfatterne, at AB0-blodgruppe var en uafhængig prædiktor for biokemisk recidiv (BCR) i den multivariable analyse, men ikke i den univariable analyse.
Derfor var formålet med denne undersøgelse at tilføje yderligere oplysninger til den igangværende debat ved at analysere sammenhængen mellem AB0/Rh-blodgruppe og dens fordeling inden for patienter med PCa, tumorpatologi, recidiv og mortalitet hos patienter med lokaliseret PCa, der gennemgår RP, ved hjælp af et stort datasæt fra et enkelt center på 3.574 patienter.
Materialer og metoder
Studiepopulation
Studiet blev godkendt af det institutionelle review board. I alt 3.582 patienter med klinisk lokaliseret PCa, der gennemgik RP på vores institution mellem 2009 og 2010, blev screenet med henblik på inklusion i undersøgelsen. De med ufuldstændige datasæt og manglende opfølgning blev ekskluderet (n = 8), hvilket efterlod 3.574 patienter til rådighed for analyse.
Radikal prostatektomi blev udført ved hjælp af en åben retropubisk tilgang (n = 3.220) eller robotassisteret laparoskopisk tilgang (n = 354), som tidligere beskrevet (15). Lymfeknudeudskillelse blev udført hos D’Amico intermediær risiko og højrisikopatienter i henhold til retningslinjerne fra European Association of Urology (EAU) for PCa (16). Kirurgiske prøver blev behandlet i henhold til histopatologiske standardprocedurer og vurderet af erfarne uropatologer i et center med stor volumen (>2.000 prostatektomiprøver pr. år). Tumorer blev stadieinddelt i henhold til 2007 American Joint Committee on Cancer TNM-stadiesystem, og histopatologisk klassificering blev tildelt i henhold til Gleason-systemet (17).
Alle deltagere gennemgik serologisk testning før RP. Laboratoriebekræftelse af AB0- og Rh-blodgruppe blev indhentet fra afdelingen for transfusionsmedicin, University Hospital Hamburg-Eppendorf. AB0-referencefordelingen i den tyske befolkning blev anvendt som kontrol (18).
Studievariabler
Studievariabler omfattede AB0/Rh-blodgruppe, alder, præoperativt prostataspecifikt antigen (PSA), prostatavolumen (transrektal ultralyd), Gleason-score (prøve), pT-stadie, pN-status, kirurgisk margin, BCR og mortalitet efter RP. Patientopfølgningen bestod af PSA-test hver 3-6 måned i de første 2 år efter RP, BCR blev defineret som PSA-niveau ≥0,2 ng/ml.
Sammenhængen mellem AB0-blodgruppe og klinisk-patologiske variabler blev vurderet ved hjælp af chi-kvadrat-test og t-test. I Cox-regressions multivariabel analyse (log-rank-test) blev virkningen af blodgruppe, præoperativ PSA, Gleason-score, pT-stadie, pN-status og kirurgisk margin på BCR-fri overlevelse vurderet med henblik på at evaluere de prognostiske værdier for overlevelse. Sandsynligheden for BCR-fri overlevelse blev sammenlignet i 0-, A-, B- og AB-grupperne ved hjælp af Kaplan-Meier-analyse og log-rank-test.
Alle tests var tosidede, og p-værdier <0,05 blev betragtet som statistisk signifikante. Statistiske analyser blev udført med JMP-software v9.0.2 (SAS Institute, Inc, Cary, NC, USA) og R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Resultater
I alt 3 574 patienter med klinisk lokaliseret PCa var berettiget til de endelige analyser, medianalderen ved operationen var 65 år (interval: 38-80), og medianopfølgningen var 36,9 måneder (tabel 1).

Tabel 1. Sammenhæng mellem AB0-blodgruppe og Rhesus-faktor og klinisk-patologiske karakteristika hos 3.574 patienter behandlet med radikal prostatektomi.
Fordeling af AB0/Rh-blodgruppe hos patienter med PCa
Fordelingen af AB0-blodgruppe blandt patienter med PCa forud for RP var som følger: Fordelingen af patienterne med blodtype AB-gruppe forud for PCA var følgende: 0 hos 1350 (38%), A hos 1660 (45%), B hos 445 (12%) og AB hos 174 (5%) patienter. 83% af patienterne var Rh-positive (Tabel 1). Referencefordelingen for den tyske befolkning er angivet som (18): 0 i 41 %; A i 43 %; B i 11 %; AB i 5 %; Rhesus-positiv: 85 %. Den samlede fordeling af AB0 såvel som Rh-blodgrupper i undersøgelseskohorten svarede til den fordeling, der blev observeret i den tyske mandlige befolkning.
Ingen signifikante forskelle i klinisk-patologiske karakteristika blandt PCa-patienter i henhold til AB0/Rh-blodgrupper
De fleste af patienterne havde klinisk lokaliseret PCa med intermediær risikoprofil. Den mest rapporterede Gleason-score var 3 + 4 (66,9 %), og 63,3 % af patienterne havde præoperative PSA-niveauer inden for intervallet 4-10 ng/ml. pT2-tumorer blev påvist hos 68,7 %, og negative marginer blev opnået hos 81,3 % af patienterne. Det mediane prostatavolumen var 40 ml, og lymfeknudeinvolvering blev diagnosticeret hos 224 (6,3 %) patienter (tabel 1). Der var ingen signifikante forskelle i de klinisk-patologiske karakteristika blandt patienter med forskellige AB0-blodgrupper. Der blev fundet en let øget procentdel af avancerede tumorstadier (≥pT3b) hos patienter med blodgruppe AB sammenlignet med blodgrupper 0, A og B (henholdsvis 16,1, 12,6, 9,9 og 13,7 %, p = 0,033). Patientpopulationen med AB viste også en moderat øget andel af negativ Rh-faktor (21,8 %) i forhold til de andre blodgrupper (16,9 %, p = 0,01) (tabel 1).
Ingen signifikant prognostisk værdi af blodgruppe for BCR-fri overlevelse efter RP
I henhold til multivariabel cox-regressionsanalyse korrelerede præoperativ PSA, Gleason-score, pT-stadie, pN-status og kirurgisk margin signifikant og uafhængigt med BCR-fri overlevelse (alle p < 0,05) (Tabel 2) (Tabel 2). Vi kunne imidlertid ikke observere nogen indvirkning af AB0-blodgruppen på BCR-raterne (Figur 1). Vi vurderede yderligere den prognostiske værdi af blodgruppe 0 sammenlignet med blodgrupper uden 0-blodgrupper samt inden for de alternative blodgrupper A/B/AB med insignifikante resultater (tabel 2). Selv hvis der blev foretaget subanalyser kun med patienter med positiv eller negativ marginstatus, forblev indflydelsen af AB0/Rh på BCR insignifikant (figur 2A,B). Desuden havde patienternes Rhesus-faktorstatus heller ingen indflydelse på den BCR-frie overlevelse (p = 0,74).
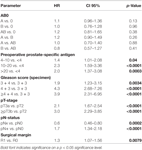
Tabel 2. Multivariable cox-regressionsmodeller for AB0 og standardprognostiske faktorer for biokemisk recidivfri overlevelse.
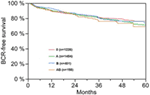
Figur 1. Biokemisk recidivfri (BCR)-fri overlevelse efter radikal prostatektomi stratificeret efter AB0-blodgrupper (p = 0,572).
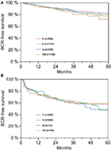
Figur 2. (A,B) Biokemisk recidiv (BCR)-fri overlevelse efter radikal prostatektomi stratificeret efter AB0 blodgrupper hos patienter med negativ og positiv kirurgisk marginstatus.
Diskussion
Mulige sammenhænge mellem AB0 blodgruppe og risikoen for nogle epithelmaligniteter, herunder bugspytkirtel-, kolorektal- og mavekræft er ofte blevet rapporteret (19, 20). Desuden er AB0/Rh-blodgrupperne tilgængelige for de fleste patienter før et kirurgisk indgreb, hvilket derfor foreslås som en ideel supplerende markør uden yderligere laboratoriebehandlingstrin.
For flere årtier siden viste immunohistokemiske undersøgelser, at patientafledte PCa-celler viser andre mønstre for ABH-ekspression end normale/benigne prostataceller (21). Da både AB0-blodgruppe og dens antigenudtryk på væv er blevet rapporteret at være forbundet med forekomst, sygdomsprogression og resultat i flere maligniteter (8, 22, 23), antydede et sådant ændret udtryk af ABH-antigen i prostatavæv en mulig indflydelse af blodgruppen på den maligne transformation af prostataceller.
En nylig undersøgelse offentliggjort af Markt og kolleger (14) analyserede forholdet mellem AB0-blodgruppe og risikoen for at have aggressiv PCa. Forfatterne analyserede et datasæt af 2.774 patienter med aggressiv PCa og 4.443 patienter uden PCa som kontrolpersoner. Ved hjælp af disse data kunne der ikke påvises en signifikant sammenhæng mellem AB0 blodtype eller “dosis” af A eller B alleler og aggressiv PCa risiko. Mens forfatterne også rapporterede kræftspecifik og samlet dødelighed stratificeret efter blodgrupper, indeholdt undersøgelsen ikke oplysninger om PCa-behandling. Desuden blev kun patienter med aggressive tumorer inkluderet, hvilket kan maskere den potentielle effekt af forskellige blodgrupper.
Disse resultater er i overensstemmelse med en undersøgelse udført af Kvist og kolleger, som ikke påviste nogen sammenhæng mellem AB0-blodtype og overlevelse hos patienter med PCa, der blev behandlet med watchful waiting. Denne undersøgelse var primært begrænset af det lille antal tilfælde (n = 279) (12). Interessant nok rapporterede den eneste undersøgelse, der fokuserer på patienter efter RP, herunder 555 japanske patienter, for nylig, at blodgruppe 0 var signifikant forbundet med en nedsat risiko for BCR efter RP i multivariabel, men ikke univariabel analyse (13). I subanalysen af patienter med en negativ kirurgisk margin var den 5-årige BCR-frie rate i blodgruppe 0 signifikant højere end i gruppe A (91,2 vs. 71,0 %; p = 0,026). I denne undersøgelseskohorte havde 46,3 % af patienterne positiv marginstatus på trods af et klinisk stadium T1c hos 74,2 % af patienterne. Det patologiske stadium (pT) blev ikke nævnt.
Vores retrospektive kohorte på 3.574 patienter med klinisk lokaliseret PCa er den største kohorte, der hidtil er blevet analyseret for at bestemme en mulig indvirkning af både AB0- og Rh-blodgrupper på tumorkarakteristika og resultat efter RP. I den foreliggende undersøgelse havde størstedelen af patienterne pT2-tumorer (68,7 %) og 18,6 % havde positiv marginstatus. Ved hjælp af disse data kunne vi ikke påvise nogen signifikant indvirkning af AB0/Rh-blodgrupper på klinisk-patologiske karakteristika (præoperativ PSA, Gleason-score, prostatavolumen, pT-stadie, pN-status og kirurgisk margin) og BCR-fri overlevelse efter kurativ RP. Ved udførelse af en subanalyse kun med patienter med positiv eller negativ marginstatus forblev AB0/Rh’s indflydelse på BCR desuden ubetydelig. Derfor kunne vi ikke reproducere resultaterne fra den japanske undersøgelse (13). I modsætning til andre maligniteter såsom bugspytkirtel- eller blærekræft gav AB0/Rh-blodgruppe ingen prognostisk værdi i PCa.
Der er flere vigtige begrænsninger i vores undersøgelse. Først og fremmest er de begrænsninger, der er forbundet med retrospektive analyser, og manglen på en kontrolgruppe. Desuden indeholder vores undersøgelseskohorte overvejende lokaliseret PCa med lav til intermediær risikoprofil (Gleason score 3 + 4 i 66,9 %, præoperativ PSA på 4-10 ng/ml i 63,3 %, pT2 i 68,7 % og negative marginer i 81,3 % af patienterne), hvilket giver mulighed for at foretage en forhåndsudvælgelse af patienter med gunstig prognose. Desuden er den samlede fordeling af AB – i modsætning til de andre blodgrupper – generelt lavt overfældet (4,9 %). Nogle observationer såsom den moderat øgede andel af negativ Rh-faktor (21,8 %) hos patienter med AB i forhold til de andre blodgrupper (16,9 %, p = 0,01) kunne muligvis være forstærket på grund af sjældenheden af Rh-negativ AB-type, hvilket forhindrer en statisk signifikant påvisning af en korrelation inden for denne undergruppe. Endelig manglede oplysninger om genotype for den pågældende blodgruppe.
Ud over de ovennævnte karakteristika kan miljømæssige, geografiske og racemæssige hensyn aldrig negligeres i forbindelse med diskussionen af sammenhænge mellem AB0-blodgruppe og kræft. De racemæssige og etniske forskelle i blodgrupper såvel som i PCa er velkendte (24, 25). I Europa, hvor PCa er den mest almindelige maligne sygdom og den næsthyppigste årsag til kræftrelaterede dødsfald hos mænd (1), er de hyppigste blodtyper A og 0, stigende til allel B fra vest til øst. I modsætning hertil er asiatiske lande med den laveste forekomst og lav grad af PCa karakteriseret ved en høj forekomst af type B og en relativt lav frekvens af 0, samt en mindre befolkning med negativ Rh-faktor (26). I denne henseende adskiller vores resultater sig fra den aktuelle undersøgelse af japanske patienter med relativt høj positiv marginstatus og BCR efter kurativ RP (13).
Flere mekanismer er blevet foreslået for at forklare, hvordan blodgruppe påvirker kræftforekomst og progression; de er dog stadig uklare. I tilfælde af blærekræft blev der foreslået en kromosomal aberration, fordi AB0-genet er placeret på kromosom 9q34, et område, der ofte er ændret i blærekræft (27). Da AB0-genet faktisk koder for glykosyltransferaser, som katalyserer overførslen af sukkerstoffer til H-antigenet (0), er forekomsten af blærekræft potentielt korreleret med blodgruppe 0. I modsætning hertil er det blevet rapporteret, at personer med ikke-0-blodgrupper (A, AB og B) har en forhøjet risiko for at udvikle mavekræft og indikerer en kræftspecifik rolle for blodgruppen.
Med hensyn til PCa er der flere bestræbelser i gang for at belyse blodgruppens rolle for overlevelsen efter behandling. Det er allerede blevet rapporteret, at patienter med blodtype ikke-0 skulle have en øget risiko for venøs tromboemboli efter RP, hvilket kan have indflydelse på resultatet (28). Selv en nylig offentliggjort undersøgelse viste, at serumantistoffer mod blodgruppe A forudsiger overlevelsen efter PROSTVAC-VF (en poxvirusbaseret terapeutisk kræftvaccine i kliniske fase III-forsøg til behandling af avanceret PCa) og bør betragtes som en ny potentielt prædiktiv biomarkør for PROSTVAC-VF (29). Selv om vi ikke observerede nogen klar sammenhæng mellem AB0/Rh-blodgruppe og tumorpatologi og resultat i vores undersøgelse, tyder sådanne beviser stadig på en prædiktiv rolle for blodgruppen i PCa epidemiologi og klinisk resultat, især med henblik på behandlingsrespons.
Denne nuværende undersøgelse med 3.574 patienter er den hidtil største undersøgelse, der analyserer virkningen af AB0- eller Rh-blodgrupper på patologi og resultat efter RP og tilføjer vigtig viden til litteraturen.
Sammenfattende tyder vores data ikke på nogen relevant sammenhæng mellem AB0/Rhesus-blodgruppe og negative klinisk-patologiske tumorkarakteristika eller onkologisk resultat efter operation i modsætning til flere andre maligniteter. Ikke desto mindre er yderligere forskning indiceret for at vurdere en mulig sammenhæng mellem blodgruppens genotype eller dens antigenekspression på PCa-væv og prognose inden for forskellige terapigrupper, herunder højgrads eller avanceret PCa, som ikke var tilstrækkeligt afspejlet i vores undersøgelsesgruppe.
Informeret samtykke
Informeret samtykke blev indhentet fra alle individuelle deltagere, der indgik i undersøgelsen.
Etisk erklæring
Alle procedurer, der blev udført i undersøgelser med menneskelige deltagere, var i overensstemmelse med de etiske standarder for den institutionelle og/eller nationale forskningskomité og med Helsinki-erklæringen fra 1964 og dens senere ændringer eller sammenlignelige etiske standarder.
Author Contributions
SO, DT og TS: væsentlige bidrag til udformning eller design af arbejdet, udarbejdelse af arbejdet, endelig godkendelse af den version, der skal offentliggøres. PM: væsentlige bidrag til udformning eller design af arbejdet, udarbejdelse af arbejdet, endelig godkendelse af den version, der skal offentliggøres. FC: indhentning, analyse eller fortolkning af data til arbejdet, kritisk revision af det med henblik på vigtigt intellektuelt indhold, endelig godkendelse af den version, der skal offentliggøres. PT: indhentning, analyse eller fortolkning af data til arbejdet, kritisk revision af det for vigtigt intellektuelt indhold, endelig godkendelse af den version, der skal offentliggøres. SP: indsamling, analyse eller fortolkning af data til arbejdet, kritisk revision med henblik på vigtigt intellektuelt indhold, endelig godkendelse af den version, der skal offentliggøres. JLH, JH og MG: indsamling, analyse eller fortolkning af data til arbejdet, kritisk revision med henblik på vigtigt intellektuelt indhold, endelig godkendelse af den version, der skal offentliggøres. Alle forfattere indvilligede i at være ansvarlige for alle aspekter af arbejdet ved at sikre, at spørgsmål vedrørende nøjagtigheden eller integriteten af enhver del af arbejdet bliver undersøgt og løst på passende vis.
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Den behandlende redaktør erklærede et fælles tilhørsforhold, men intet andet samarbejde, med flere af forfatterne (FC, SP, JH og DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Risikofaktorer for prostatakræft. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Genetisk ætiologi af arvelig prostatakræft. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Rapporteret familiehistorie om kræft i screeningsforsøget for prostatakræft, lungekræft, kolorektalkræft og kræft i æggestokkene. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Miljømæssige og arvelige faktorer i forbindelse med forårsager af kræft – analyser af kohorter af tvillinger fra Sverige, Danmark og Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Indflydelse af ABO blodtype på resultaterne hos patienter med primær ikke-muskelinvasiv blærekræft. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blodgruppe og FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreaskræftrisiko og ABO-blodgruppealleler: resultater fra konsortiet for pancreaskræftkohorten. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. Genet, der koder for blodgruppe I-antigenet: gennemgang af et I for et øje. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. Ekspression af blodgruppeantigener A, B og H i karcinomvæv korrelerer med en dårlig prognose for patienter med kolorektal cancer. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO-blodgruppe og forekomst af epithelial ovariecancer. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Prognostiske variabler hos patienter med prostatakræft: indflydelse af blodgruppe ABO (H), Rhesus-systemet, alder, differentiering, tumorstadie og metastaser. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF0255050636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Sammenhænge mellem ABO-blodgrupper og biokemisk recidiv efter radikal prostatektomi. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO-blodgruppealleler og risiko for prostatakræft: resultater fra konsortiet for bryst- og prostatakræftkohorte (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovaskulær struktur-adjacent frozen-section-undersøgelse (NeuroSAFE) øger nervebesparende frekvens og reducerer positive kirurgiske marginer ved åben og robotassisteret laparoskopisk radikal prostatektomi: erfaring efter 11 069 konsekutive patienter. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Retningslinjer om prostatakræft 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Forudsigelse af prognosen for prostata adenocarcinom ved kombineret histologisk klassificering og klinisk stadieinddeling. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blodgruppe er afgørende for incidensen af bugspytkirtelkræft i Tyskland. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO-blodgrupper og kræft. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. ABO- og Lewis-blodgruppesystemet. Immunokemi, genetik og relation til sygdomme hos mennesker. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM19690501012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Påvisning af blodgruppeantigener i frosne sektioner af prostataepitel. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Ekspression af ABH/Lewis-relaterede antigener som prognostiske faktorer hos patienter med brystkræft. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. Transkriptet af blodgruppe ABO-genet er nedreguleret i humane blæretumorer og vækststimulerede urothelcellelinjer. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Comparative studies of prostate cancer in Japan versus the United States. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Modelbaserede mønstre i dødeligheden af prostatakræft på verdensplan. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. ABO- og Rh(D)-fænotypefrekvenser for forskellige racemæssige/etniske grupper i USA. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Genotypisk og fænotypisk karakterisering af histoblodgruppen ABO(H) i primære blæretumorer. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Prostatakræft: ikke-O-blodtype er VTE-risikofaktor efter radikal prostatektomi. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Serumantistoffer mod blodgruppe A forudsiger overlevelsen på PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar