| Ed Davis, Ph.D. |
Indledning
Lentivirus og Adeno-associeret virus (AAV) har vist sig at være uvurderlige til at indføre genetisk materiale i pattedyrceller, enten i kultur eller hele dyr. Begge systemer er yderst velegnede til mange grundforskningsanvendelser, f.eks. overekspression af proteiner, produktion af antistoffer og knockout af gener, og begge er lovende for genterapi. Hvert virussystem har dog sine egne unikke fordele og ulemper, afhængigt af anvendelsen. GeneCopoeia tilbyder omfattende produktlinjer for både lentivirus og AAV, hvilket giver dig stærke og fleksible muligheder for at levere DNA til celler. I denne tekniske note beskriver vi teknologierne bag GeneCopoeias Lentifect™ lentivirus- og AAVPrime™ AAV-produktlinjer og diskuterer fordelene ved hver teknologi til forskellige anvendelser for at hjælpe dig med at vælge det system, der passer bedst til dine behov.
Hvorfor bruge vira til DNA-levering?
En af de mest almindelige måder at levere DNA til celler er gennem plasmidbaseret transfektion, hvor celler behandles med kemiske forbindelser som calciumphosphat eller med lipidbaserede reagenser. Plasmidtransfektion er imidlertid ikke altid ønskelig eller praktisk. Nogle celler er f.eks. meget vanskelige eller umulige at transficere, mens de fleste dyrkede celler understøtter infektion (også kendt som transduktion) med enten lentivirus eller AAV. For det andet kan plasmidtransfektion ikke anvendes til in vivo-dna-levering, men det kan viral transduktion derimod. Både lentivirus og AAV kan anvendes til en lang række anvendelser, f.eks. proteinekspression fra åbne læserammer (ORF’er), nedbrydning af gener ved RNA-interferens (RNAi) medieret af short hairpin RNA (shRNA), luciferase- og andre reportergenassays og genknockout medieret af clustered, regularly-interspaced, short palindromic repeats-Cas9 (CRISPR-Cas9)-systemet. Mange af disse anvendelser af virale vektorer er blevet udført med succes i dyrkede immortaliserede pattedyrscellelinjer, primær cellekultur, dyremodeller og i genterapi på menneskelige patienter.
Tegningen “Lentivirus” henviser til den klasse af retrovirus, der omfatter humant immundefektvirus (HIV), og faktisk er de fleste lentivirale systemer, der i øjeblikket anvendes, afledt af HIV (gennemgået i Mátrai, et al, 2010; Sakuma, et al., 2012). Lentivirusser, der bærer transgener, integreres i genomet ved infektion og muliggør således stabil ekspression i både delende og ikke-delende celler.
Lentivirale systemer er blevet stærkt modificeret fra HIV over flere generationer for at gøre dem sikre at håndtere og nyttige til anvendelser. GeneCopoeia anvender den 3. generation af det lentivirale system (Dull, et al. 1998), som kræver fire separate plasmider for at producere infektiøse virale partikler (virioner). Et lentiviralt plasmid fra GeneCopoeia indeholder kun det gen af interesse (GOI), der skal udtrykkes, et antibiotisk selektionsgen og pakningssignalsekvenserne. Undertiden vil klonen også indeholde et fluorescerende reportergen. Plasmidet, der indeholder GOI, med den selekterbare markør og reportergenet, kan rumme indsatser på op til ca. 5-6 kb. (Figur 1), selv om virale titre falder dramatisk, når insertstørrelsen overstiger ca. 4 kb.
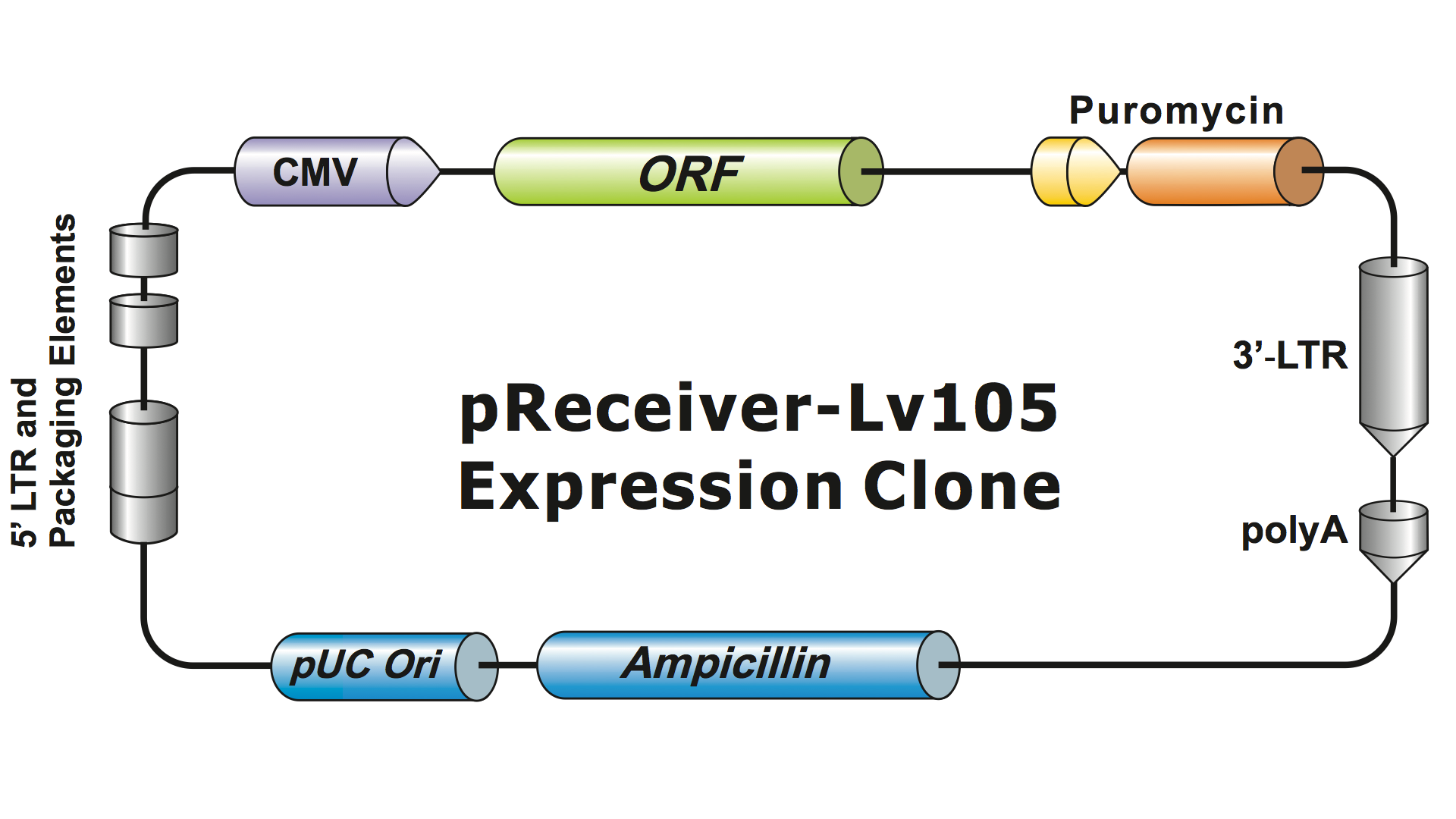 |
Figur 1. Eksempel på en GeneCopoeia lentiviral ekspressionsklon |
De yderligere plasmider udtrykker de retrovirale elementer, der er nødvendige for pakning og integration (gag, pol, env, Rev). Når alle fire plasmider udtrykkes i pakningsceller, integreres GOI-RNA’et i partikler. Da de retrovirale proteiner kun udtrykkes under pakning, kan inficerede celler ikke producere infektiøst virus. Desuden indeholder GeneCopoeia’s Lentifect™ lentivirale partikler en deletion i U3-regionen af LTR’erne, hvilket gør dem selvinaktiverende (SIN). SIN-deletionen forhindrer lentiviral replikation i det sjældne tilfælde, at alle fire plasmider rekombinerer for at skabe et enkelt aktivt virusplasmid. Derfor er lentivirale partikler sikre at håndtere, og der er stort set ingen chance for at generere patogen virus.
Ud over de forbedrede sikkerhedsmodifikationer bærer GeneCopoeias Lentifect™ lentivirale partikler vesikulær stomatitisvirus G (VSV-G)-glykoproteinet i stedet for wild type HIV env-genet, hvilket ændrer virusets vævstropisme fra CD4+ T-celler til stort set alle pattedyrcelletyper. Lentivirusser er derfor et meget anvendt system til dyrkning af pattedyrsceller, dyremodeller og genterapi.
Da lentivirale vektorer er blevet modificeret på disse måder, har GeneCopoeia’s Lentifect™ lentivirale systemer forbedret sikkerhed og har følgende egenskaber, der gør dem yderst anvendelige til DNA-levering:
- De inficerer næsten alle pattedyrcelletyper
- De kan bruges til at levere relativt store DNA-sekvenser – op til ca. 5-6 kb i længde
- De kan bruges til at generere stabile cellelinjer eller til at drive stabil genekspression i organer og væv in vivo, på grund af integration af transgenet på tilfældige steder i genomet
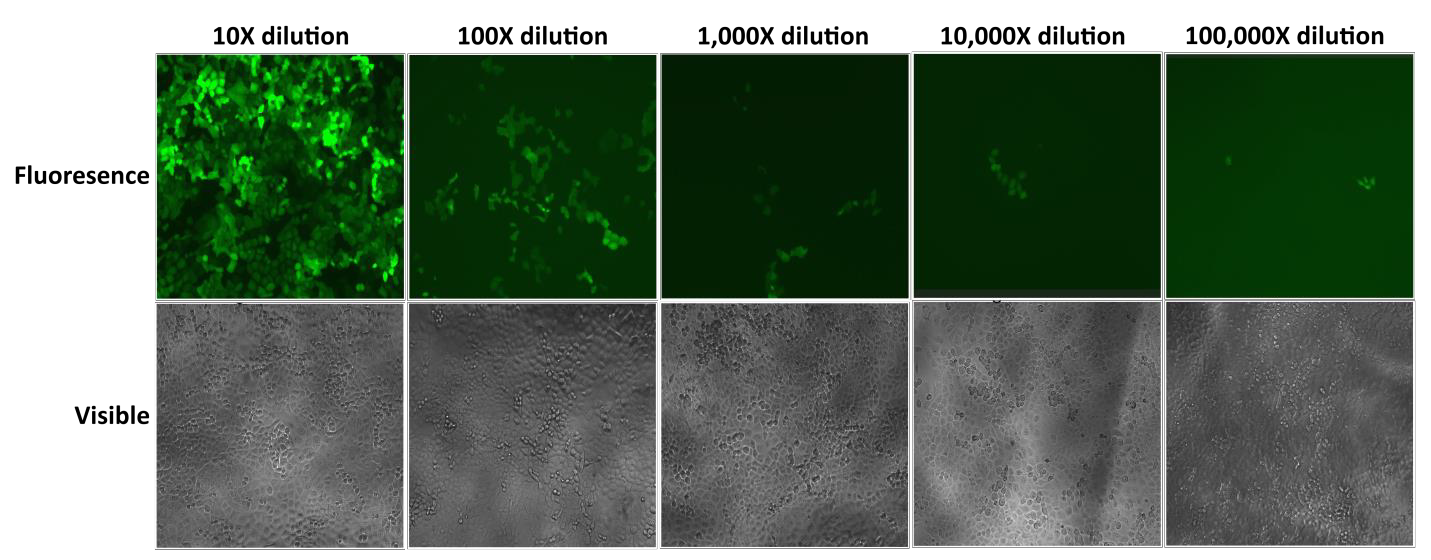
GeneCopoeia’s Lentifect™ lentivirale partikler giver høje titre, hvilket giver forskerne mulighed for effektivt at udtrykke gener af interesse (figur 2).
|
Figur 2. Test af serielle fortyndinger af Lentifect™ lentivirale partikler. eGFP-fluorescens blev fotograferet med et fluorescensmikroskop 72 timer efter transduktion. |
|
GeneCopoeia tilbyder et af de mest omfattende sortimenter af lentivirale produkter i branchen (tabel 1).
| Produkt/service | Beskrivelse |
| Lentivirale kloner og kloningsvektorer | Fremstillede og specialfremstillede kloner med ORF’er, promotorer, shRNA’er, miRNA 3′ UTR’er, forløbere og inhibitorer, sgRNA’er og meget mere. Fås med flere promotorer, tags og reportere. Vektorer til gør-det-selv-kloning af sekvenser af interesse. |
| Lentifect™ lentivirale partikler | Færdiglavede og specialpakkede, klar til brug lentivirale partikler. Produceret fra GeneCopoeias omfattende, genom-dækkende klonsamlinger eller fra kloner indsendt af kunden. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Komplet system af reagenser til gør-det-selv-produktion af lentivirale partikelpartikler. Indeholder pakningsplasmider, pakningscellelinje, partikelkoncentrationsopløsning og titreringssæt. |
Tabel 1. GeneCopoeias sortiment af lentivirale produkter og tjenester.
AAV-baserede systemer
I modsætning til lentivirers RNA-genom har AAV et enkeltstrenget DNA-genom (Samulski og Muzyczka, 2014). AAV er heller ikke afledt af et patogen; det er snarere en kontaminant af adenovirus, uden at der tilskrives det nogen patogene forhold. Naturligt forekommende AAV integrerer sig i genomet ligesom lentivirus, men kun ved AAVS1-lokussen på kromosom 19. Dette sted er også kendt som “Safe Harbor”, fordi det almindeligvis anvendes til transgenindsættelse uden at skade cellerne (DeKelver, et al., 2010).
Lignende lentivirus er AAV blevet modificeret med henblik på sikkerhed og anvendelighed. AAV kræver co-infektion med et hjælpevirus. AAV-genomet er 4,7 kb langt og indeholder 2 gener, Rep og Cap, som er nødvendige for viral replikation og integration. I AAVPrime™ er Rep og Cap slettet, så kun de 145 bp 5′- og 3′-inverterede terminale gentagelser (ITR’er) er tilbage. Slettelse af Rep og Cap tjener tre formål: 1) Det eliminerer hjælpevirusets evne til at tillade AAV-inficerede celler at producere nye AAV-virioner, 2) det tillader indsættelse af gener med en længde på op til ca. 4 kb (selv om viral titer mindskes med transgener, der er længere end 3 kb), og 3) det eliminerer praktisk taget AAV’s evne til at integrere. AAV’s lille størrelse udgør en udfordring for visse anvendelser. Til CRISPR-genomredigering anvender forskerne f.eks. Cas9-nuklease fra S. aureus, fordi den er ca. 30 % kortere end den mere almindeligt anvendte S. pyogenes Cas9 (Ran, et al, 2015).
Til pakning er Rep og Cap blevet flyttet til et andet plasmid, og Adenovirus-hjælpergenerne er placeret på et tredje plasmid, hvilket gør hele pakningssystemet sikkert og hjælpervirusfrit (figur 3).
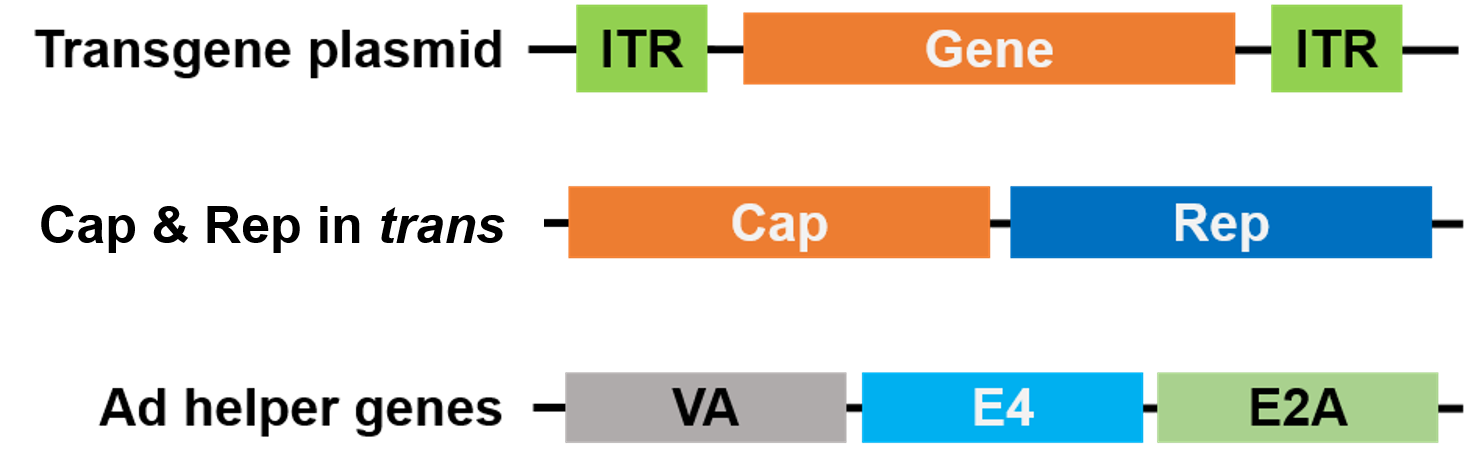 |
Figur 3. Hjælpervirusfri AAV. Der er anvendt 3 plasmider til pakning. Plasmidet med genet af interesse (øverst) indeholder de inverterede terminale gentagelser (ITR’er). Et 2. plasmid (i midten) bærer AAV Cap- og Rep-generne, og det 3. plasmid (nederst) bærer de nødvendige gener fra Adenovirus (Ad) |
Der findes desuden AAV i forskellige serotyper, hvilket påvirker vævsspecificiteten af AAV-infektion. Flere serotyper giver forskerne mulighed for enten a) at inficere en bred vifte af værtsceller eller b) at begrænse infektionen til et eller få væv. GeneCopoeia’s AAVPrime™ AAV-partikler fås i flere serotyper (tabel 2).
| Serotype | Primært målvæv | Beskrivelse | |
| AAV-1 | Muskel | Bedst til hjertemuskel, skeletmuskel, neuronalt og glialt væv. | |
| AAV-2 | Muskel, lever, nethinde | Den mest almindeligt anvendte serotype. Bedst til neuroner, muskler, lever og hjerne. | |
| AAV-3 | Megakaryocytter | Bedst til megakaryocytter, muskler, lever, lunge og nethinde. | |
| AAV-4 | Retina | Bedst til neuroner, muskler, hjerne og nethinde. | |
| AAV-5 | Lunge | Best til lunge, neuroner, synovialled, nethinde og bugspytkirtel. | |
| AAV-6 | Muskel, Lunge | Bedst til lunge, lever og hjerte. | |
| AAV-7 | Muskel, nethinde, neuroner | Bedst til muskel, neuroner og lever. | |
| AAV-8 | AAV-8 | Lever | Bedst til muskel, hjerne, lever og nethinde. |
| AAV-9 | Varierende | Bedst til muskel, hjerte, lever, lunge og hjerne. | |
| AAV-10 | Pleura, CNS | Kloneret fra Cynomolgus, næsten identisk med AAVrh10 bortset fra 12 aminosyrer i VP1. Bedst til lunge, muskel, hjerte, NCS og lever. | |
| AAV-DJ | Various | En blanding af 8 naturligt forekommende serotyper. Transducerer effektivt en lang række celletyper in vitro. | |
| AAV-DJ/8 | Various | En variant af AAV-DJ med en heparinbindingsdomæne (HBD)-mutation, som muliggør infektion af lever såvel som andre væv in vivo. |
Tabel 2. Liste over almindeligt anvendte AAV-serotyper
AAVPrime™ AAV-partikler har følgende egenskaber, som gør dem yderst anvendelige til DNA-levering:
- Høje titre. Titer af rensede partikler kan være op til 10^14 GC/ml (genomkopier/ml)
- Alsidig. Flere serotyper muliggør anvendelse i enten et bredt eller begrænset udvalg af værtsceller
- Lav toksicitet. Integrerer ikke i værtsgenomet.
- Lav immunogenicitet. Minimalt værtsimmunrespons.
- Sikker. Ikke forbundet med nogen menneskelig sygdom
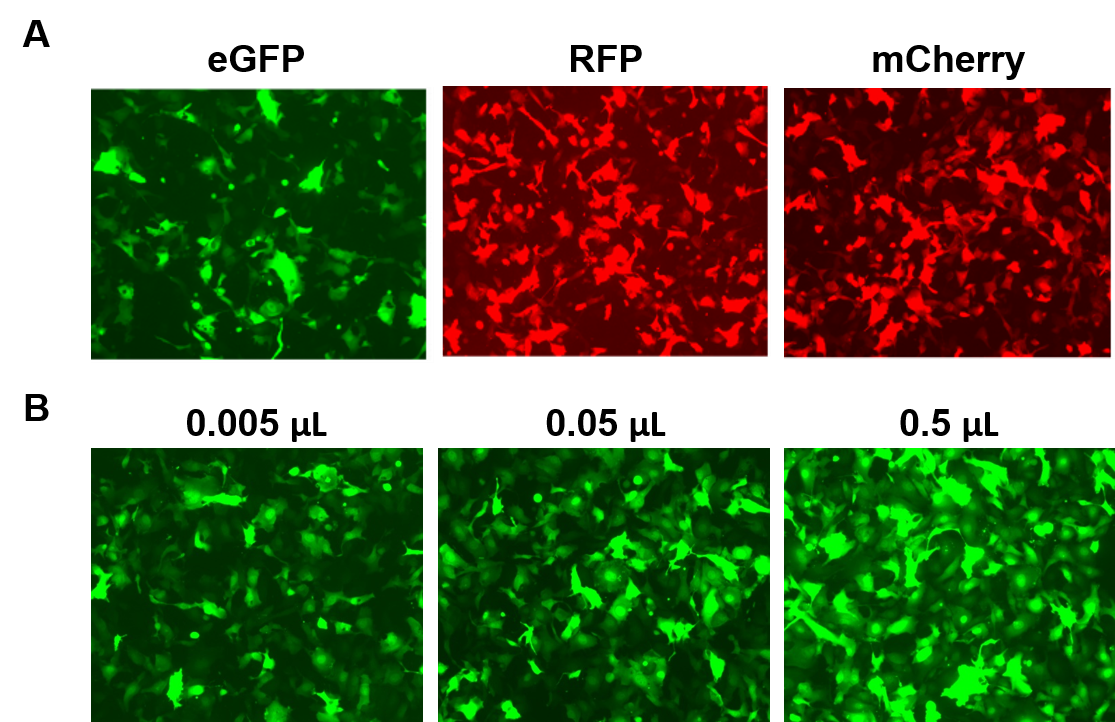
AAVPrime™-partikler er tilgængelige for humane og mus-ORF’er på op til 3 kb, i flere serotyper og promotormuligheder, i enten standardrenhed (kun til in vitro-brug) eller renset (til in vivo-brug). Kunder kan bestille plasmidkloner, specialfremstillede partikler til gener af interesse eller vælge mellem præfabrikerede muligheder, der udtrykker gener som f.eks. fluorescerende reportere (figur 4).
|
Figur 4. Ydelsen af GeneCopoeia’s AAVPrime™-partikler. A. HT1080-celler i 24-hulsplader transduceret med 0,5 µL AAV af standardrenhed, der udtrykker forstærket GFP (eGFP), rødt fluorescerende protein (RFP) og monomer kirsebær (mCherry). B. HT1080-celler i 24-hulsplader blev transduceret med varierende mængder af renset AAV, der udtrykker eGFP. Cellerne blev visualiseret med et fluorescensmikroskop (eksponeringstid: 400 ms). |
|
Hvad skal jeg vælge: Lentivirus eller AAV?
Det afhænger af mange faktorer, om man skal vælge lentivirus eller AAV. F.eks. kan det forhold, at lentivirusser integrerer i genomet, være både en fordel og en ulempe, afhængigt af hvad dine behov er. Se nedenstående tabel for at hjælpe dig med at træffe en beslutning:
| Større indsatse | Stabil integration | Nej integration | Celle/vævsspecificitet | in vivo sikkerhed | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
For at få mere at vide om GeneCopoeia’s virussystemer og for at bestille, besøge vores hjemmeside (https://www.genecopoeia.com/product/lentiviral-system/)
Konklusioner
Vi hos GeneCopoeia bestræber os på at give dig produkter af højeste kvalitet og banebrydende teknologi til funktionel genomforskning og cellebiologi. Vi tilbyder en bred vifte af produkter fra genom-dækkende sæt af plasmid-DNA-kloner til ORF’er, genpromotorer, miRNA’er, shRNA og CRISPR, til kraftfulde kits og reagenser, til produkter til fluorescerende cellestrukturprober, nukleinsyrekvantitering og mærkede antistoffer. Hvis du vil vide mere, kan du besøge vores websted, www.genecopoeia.com, eller kontakte os på [email protected].
DeKelver, et al. (2010). Funktionel genomik, proteomik og regulatorisk DNA-analyse i isogene omgivelser ved hjælp af zinkfingernuklease-drevet transgenese til et safe harbor-lokus i det menneskelige genom. Genome Res 20, 1133.
Dull, et al. (1998). En tredje generation af lentivirusvektor med et betinget pakningssystem. J. Virol. 72, 8463.
Ran, et al. (2015). In vivo-genomredigering ved hjælp af Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Lentivirale vektorer: grundlæggende til translationelle. Biochem. J. 443, 603.
Samulski og Muzyczka (2014). AAV-medieret genterapi til forskning og terapeutiske formål. Annu. Rev. Virol. 1, 427.