A: Definition der Säurekonstante
Sie wissen zweifellos, dass einige Säuren stärker sind als andere. Die relative Acidität verschiedener Verbindungen oder funktioneller Gruppen – also ihre relative Fähigkeit, unter gleichen Bedingungen ein Proton an eine gemeinsame Base abzugeben – wird durch eine Zahl quantifiziert, die als Aciditätskonstante, abgekürzt Ka, bezeichnet wird. Die zum Vergleich gewählte gemeinsame Base ist Wasser.
Als erstes Beispiel betrachten wir Essigsäure. Wenn man eine verdünnte Lösung von Essigsäure in Wasser herstellt, kommt es zu einer Säure-Base-Reaktion zwischen der Säure (Protonendonator) und dem Wasser (Protonenakzeptor).
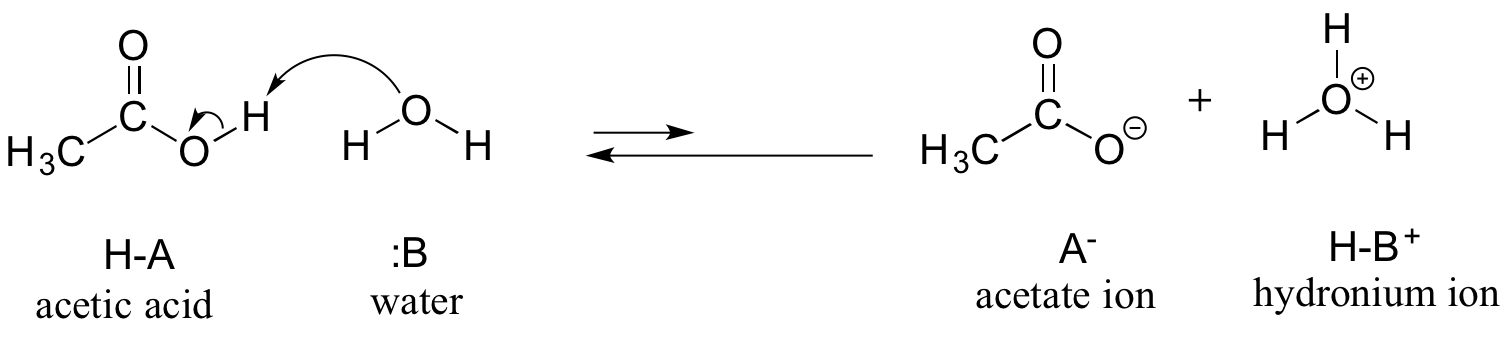
Essigsäure ist eine schwache Säure, so dass das Gleichgewicht die Reaktanten gegenüber den Produkten bevorzugt – es geht thermodynamisch „bergauf“, wie in der Abbildung oben durch die relative Länge der Vorwärts- und Rückwärtsreaktionspfeile und im Reaktionskoordinatendiagramm unten angedeutet wird, in dem die Produkte eine höhere Energie haben als die Reaktanten.
Wie Sie wissen, ist die Gleichgewichtskonstante Keq wie folgt definiert:
![]()
Jeder Ausdruck der Gleichgewichtskonstante ist eigentlich ein Verhältnis der Aktivitäten aller an der Reaktion beteiligten Arten. Um die Verwendung von Aktivitäten zu vermeiden und experimentelle Messungen zu vereinfachen, werden die Aktivitäten von gelösten Stoffen und Gasen in verdünnten Lösungen in der Gleichgewichtskonstante der Konzentration durch ihre jeweiligen Molaritäten angenähert. Die Aktivitäten von Feststoffen, reinen Flüssigkeiten und Lösungsmitteln werden jedoch nicht durch ihre Molaritäten angenähert. Stattdessen werden diese Aktivitäten so definiert, dass sie den Wert 1 (eins) haben.
Wenn wir also anerkennen, dass die Aktivität von Wasser in einer verdünnten Lösung durch den Wert 1 angenähert wird, können wir durch 1 dividieren, um die allgemeine Form des Ausdrucks für Ka, die Säurekonstante für Essigsäure, zu erhalten:
\}{(1)} = \dfrac{}{}
In der Tat wird für eine verdünnte wässrige Lösung die Aktivität von Wasser mit dem Wert 1 angenähert, so dass die allgemeine Dissoziationskonstante für eine gegebene Säure HA oder HB+ ausgedrückt wird als:
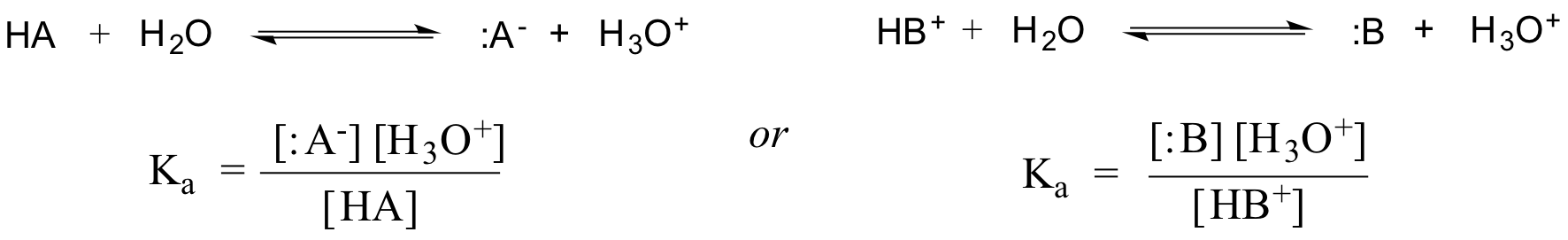
Der Wert von Ka für Essigsäure ist 1.75 x 10-5 – viel weniger als 1, was bedeutet, dass im Gleichgewicht viel mehr Essigsäure in Lösung ist als Acetat- und Hydronium-Ionen.
Umgekehrt werden Schwefelsäure mit einem Ka-Wert von etwa 109 und Salzsäure mit einem Ka-Wert von etwa 107 in Wasser im Wesentlichen vollständig dissoziiert: Sie sind sehr starke Säuren.
Eine Zahl wie 1,75 x 10-5 ist nicht sehr leicht auszusprechen, zu merken oder zu veranschaulichen, so dass Chemiker gewöhnlich einen bequemeren Begriff verwenden, um die relative Säure auszudrücken. Der pKa-Wert einer Säure ist einfach der Logarithmus (Basis 10) ihres Ka-Wertes.
pKa = -log Ka Ka = 10-pKa
Bei der Berechnung ergibt sich, dass der pKa-Wert von Essigsäure 4,8 beträgt. Der pKa-Wert von Schwefelsäure beträgt -10 und der von Salzsäure -7. Die Verwendung von pKa-Werten ermöglicht es uns, den relativen Säuregrad gängiger Verbindungen und funktioneller Gruppen auf einer numerischen Skala von etwa -10 (für eine sehr starke Säure) bis 50 (für eine Verbindung, die überhaupt nicht sauer ist) auszudrücken. Je niedriger der pKa-Wert ist, desto stärker ist die Säure.
Die ionisierbaren (Protonen abgebenden oder aufnehmenden) funktionellen Gruppen, die für die biologische organische Chemie relevant sind, haben im Allgemeinen pKa-Werte von etwa 5 bis etwa 20. Die wichtigsten davon sind im Folgenden zusammengefasst, mit sehr groben pKa-Werten für die konjugierten Säureformen. Weitere saure Gruppen mit pKa-Werten nahe Null sind ebenfalls als Referenz aufgeführt.
Ungefähre pKa-Werte zum Kennenlernen
Hydronium-Ion (H3O+) : 0
protonierter Alkohol: 0
protoniertes Carbonyl: 0
Carbonsäuren: 5
protonierte Imine: 7
protonierte Amine: 10
Phenole: 10
Thiole: 10
Wasser: 14
Alkohole: 15-18
Alpha-Kohlenstoffsäuren*: 20
*Alpha-Kohlenstoffsäuren werden später in diesem Kapitel besprochen
Es wird dringend empfohlen, diese groben Werte jetzt auswendig zu lernen – wenn du dann einen genaueren Wert brauchst, kannst du ihn jederzeit in einer pKa-Tabelle nachschlagen.
Achtung! pKa ist nicht dasselbe wie pH!
Es ist wichtig zu wissen, dass pKa nicht dasselbe ist wie der pH-Wert: Ersterer ist eine inhärente Eigenschaft einer Verbindung oder funktionellen Gruppe, während letzterer ein Maß für die Hydroniumionenkonzentration in einer gegebenen wässrigen Lösung ist:
pH = -log
Die Kenntnis der pKa-Werte ermöglicht nicht nur den Vergleich der Säurestärke, sondern auch der Basenstärke. Der wichtigste Gedanke, den man sich merken sollte, ist folgender: Je stärker die konjugierte Säure, desto schwächer die konjugierte Base. Wir können feststellen, dass das Hydroxid-Ion eine stärkere Base ist als Ammoniak (NH3), weil das Ammonium-Ion (NH4+, pKa = 9,2) eine stärkere Säure ist als Wasser (pKa = 14,0).
Übung 7.2.1
Welche ist die stärkere Base, CH3O- oder CH3S-? Acetat-Ion oder Ammoniak? Hydroxid-Ion oder Acetat-Ion?
Lösung
Lassen Sie uns unser Verständnis des pKa-Konzepts im Zusammenhang mit einem komplexeren Molekül anwenden. Wie lautet zum Beispiel der pKa-Wert der nachstehenden Verbindung?
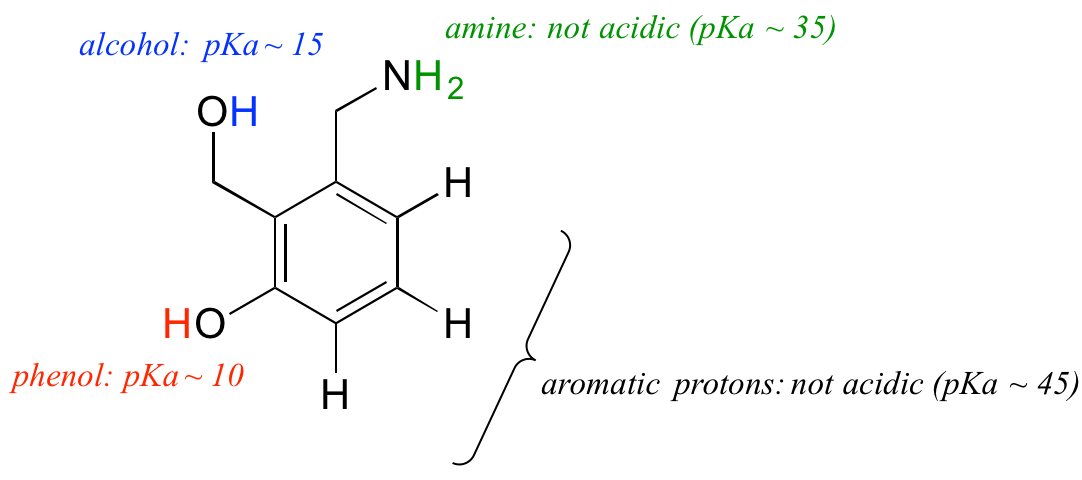
Wir müssen den potenziellen Säuregrad von vier verschiedenen Protonentypen des Moleküls bewerten und den sauersten finden. Die aromatischen Protonen sind nicht alle sauer – ihr pKa-Wert liegt bei 45. Die Amingruppe ist ebenfalls nicht sauer, ihr pKa-Wert liegt bei 35. (Zur Erinnerung: ungeladene Amine sind basisch; nur positiv geladene, protonierte Amine mit pKa-Werten um 10 sind schwach sauer). Das Proton des Alkohols hat einen pKa-Wert von ca. 15 und das Proton des Phenols einen pKa-Wert von ca. 10: Die sauerste Gruppe des obigen Moleküls ist also das Phenol. (Achten Sie darauf, dass Sie den Unterschied zwischen einem Phenol und einem Alkohol erkennen – denken Sie daran, dass bei einem Phenol die OH-Gruppe direkt an den aromatischen Ring gebunden ist). Wenn dieses Molekül mit einem Moläquivalent einer starken Base wie Natriumhydroxid reagieren würde, würde das Phenolproton zur Bildung eines Phenolatanions abgegeben.
Übung 7.2.2
Bestimmen Sie die sauerste funktionelle Gruppe an jedem der folgenden Moleküle und geben Sie ihren ungefähren pKa-Wert an.

Lösung