Die Brønsted-Lowry-Definition von Säure und Basizität
Wir beginnen unsere Diskussion über die Säure-Base-Chemie mit einer Reihe von grundlegenden Definitionen. Die erste dieser Definitionen wurde 1923 von dem dänischen Chemiker Johannes Brønsted und dem englischen Chemiker Thomas Lowry vorgeschlagen und ist als Brønsted-Lowry-Definition von Säure und Basizität bekannt geworden. Nach der Brønsted-Lowry-Definition ist eine Säure eine Spezies, die als Protonendonator wirkt, während eine Base ein Protonenakzeptor ist. Eines der bekanntesten Beispiele für eine Säure-Base-Reaktion nach Brønsted-Lowry, nämlich die Reaktion zwischen Salzsäure und Hydroxid-Ionen, haben wir bereits im vorigen Kapitel besprochen:
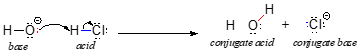
In dieser Reaktion wird ein Proton von HCl (der Säure oder dem Protonendonator) auf das Hydroxid-Ion (die Base oder den Protonenakzeptor) übertragen. Wie wir im vorigen Kapitel gelernt haben, stellen die gekrümmten Pfeile die Bewegung der Elektronen in diesem bindungsbrechenden und bindungsbildenden Prozess dar.
Nachdem eine Brønsted-Lowry-Säure ein Proton abgibt, nennt man das, was übrig bleibt, die konjugierte Base. Das Chloridion ist also die konjugierte Base der Salzsäure. Umgekehrt wird eine Brønsted-Lowry-Base, wenn sie ein Proton aufnimmt, in ihre konjugierte Säureform umgewandelt: so ist Wasser die konjugierte Säure des Hydroxidions.
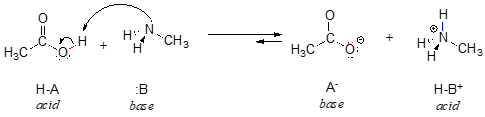
Hier ist eine organische Säure-Base-Reaktion zwischen Essigsäure und Methylamin:
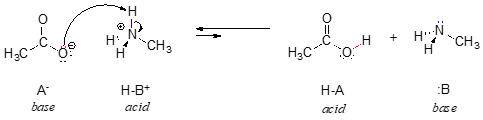
In der Umkehrung dieser Reaktion ist das Acetat-Ion die Base und das Methylammonium-Ion (protoniertes Methylamin) die Säure.
Was macht eine Verbindung sauer (gibt wahrscheinlich ein Proton ab) oder basisch (nimmt wahrscheinlich ein Proton auf)? Die Beantwortung dieser Frage ist eine unserer Hauptaufgaben in diesem Kapitel und erfordert, dass wir viel von dem anwenden, was wir in den ersten beiden Kapiteln über die organische Struktur gelernt haben, sowie die Ideen zur Thermodynamik, die wir in Kapitel 6 besprochen haben.
Betrachten wir zunächst eine gemeinsame Eigenschaft von Basen: Um als Base zu wirken, muss ein Molekül ein reaktives Elektronenpaar haben. Bei allen Säure-Base-Reaktionen, die wir in diesem Kapitel sehen werden, hat die basische Spezies ein Atom mit einem einsamen Elektronenpaar. Wenn Methylamin beispielsweise als Base wirkt, wird das einsame Elektronenpaar am Stickstoffatom verwendet, um eine neue Bindung zu einem Proton zu bilden.
Das Methylammonium-Ion kann eindeutig nicht als Base wirken – es hat kein reaktives Elektronenpaar, mit dem es ein Proton aufnehmen kann.
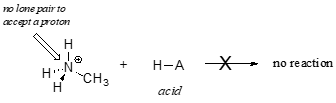
Später, in Kapitel 14, werden wir Reaktionen untersuchen, bei denen ein Elektronenpaar in einer Bindung eines Alkens oder eines aromatischen Rings basisch wirkt – aber für den Moment werden wir uns auf die Basizität von nicht-bindenden (einsamen) Elektronenpaaren konzentrieren.
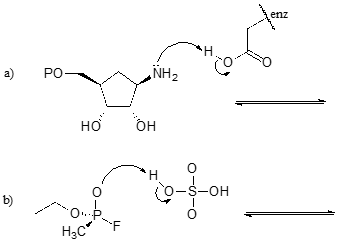
Übung \(\PageIndex{1}\)
Vervollständigen Sie die folgenden Reaktionen, d.h. zeichnen Sie die Strukturen für die fehlenden konjugierten Säuren und konjugierten Basen, die sich aus den angegebenen gekrümmten Pfeilen ergeben.