- Einführung
- Materialien und Methoden
- Materialien und Chemikalien
- Zelllinienvorbereitung
- Zebrafisch-Zubereitung
- Zellviabilitätstest und morphologische Beobachtung
- Apoptose-Analyse durch DAPI-Färbung und Durchflusszytometrie
- Xenograft Animal Assay
- Real Time PCR (qPCR)-Analyse
- Western Blot (WB)-Analyse
- Statistische Analyse
- Ergebnisse
- Anti-Proliferative Wirkung von TF
- Pro-apoptotische Wirkung von TF
- In-vivo-Effekt von TF auf Xenograft-Zebrafische
- Molekulare Wirkung von TF auf mRNA-Expressionen in A375-Zellen
- Molekulare Wirkung von TB auf Proteinexpressionen in A375-Zellen
- Diskussion
- Schlussfolgerung
- Data Availability Statement
- Erklärung zur Ethik
- Beiträge der Autoren
- Finanzierung
- Interessenkonflikt
- Abkürzungen
Einführung
Melanom ist eine tödliche Art von Hautkrebs, mit hohem Metastasierungspotenzial und Unheilbarkeit (Yang et al., 2018). Melanompatienten in fortgeschrittenen Stadien sind immer inoperabel und haben eine schlechtere Prognose (Leonardi et al., 2018). Die Chemotherapie ist ein Hauptpfeiler der klinischen Behandlung des Melanoms, aber die Wirksamkeit von Chemotherapeutika ist aufgrund ihrer Nebenwirkungen auf gesundes Gewebe begrenzt (Oliveira Pinho et al., 2019). In jüngster Zeit wurden mehrere Immuntherapien, darunter CTLA-4- oder PD-1-Rezeptor-Inhibitoren, als neue Optionen für die Behandlung des Melanoms entwickelt, aber ihre Wirksamkeit ist unzuverlässig und ihre Nebenwirkungen sind immer noch nicht vernachlässigbar (Rodríguez-Cerdeira et al., 2017). Daher werden dringend neue Strategien mit zufriedenstellender Wirksamkeit und Sicherheit benötigt. Die Traditionelle Chinesische Medizin (TCM) ist ein komplementärer Ansatz, der seit Tausenden von Jahren klinisch angewendet wird und eine gewisse Wirksamkeit und weniger Nebenwirkungen aufweist. Nach der TCM-Theorie ist Krebs mit einer Anhäufung von Schleim, Toxinen oder Entzündungen im Körper verbunden, und die schleimlösenden, antitoxischen oder entzündungshemmenden Kräuter können eine krebshemmende Wirkung haben (Wang und Cheng, 2019). Diese Theorie wurde durch viele Fälle gestützt. Zum Beispiel hatte Curcumin in Rhizoma Curcumae longae zytotoxische Wirkungen, indem es Apoptose induzierte und die Angiogenese von Melanomzellen hemmte (Mirzaei et al., 2016), und Vitexin in Vitex negundo unterdrückte das Wachstum von Melanomzellen, indem es DNA-Schäden induzierte und die ROS-Werte erhöhte (Liu et al., 2018). Daher haben TCM-Kräuterkomponenten ein großes Potenzial für die Behandlung von Krebserkrankungen wie dem Melanom.
Tee ist eines der am weitesten verbreiteten Getränke der Welt. Er ist nicht nur für seinen besonderen Geschmack, sondern auch für seinen gesundheitlichen Nutzen bekannt. Aufgrund der unterschiedlichen Verfahren gibt es drei Haupttypen von Tee: unfermentierten grünen Tee, teilweise fermentierten Oolong-Tee und vollständig fermentierten schwarzen Tee oder Pu-Erh-Tee (Kuo et al., 2005). Teeblätter wurden als TCM-Kraut mit schleimlösenden und antitoxischen Eigenschaften charakterisiert, was auf ihr krebshemmendes Potenzial hinweist. Moderne Studien haben berichtet, dass Teegetränke bei der Prävention und Behandlung von Krebserkrankungen wirksam sind (Jin et al., 2018). Kürzlich wurde festgestellt, dass Tee-Polyphenole eine krebshemmende Wirkung haben, die der von Teegetränken überlegen ist (Mao et al., 2019). Theaflavin (TF) ist eine solche Polyphenolkomponente, die durch Oxidation von Catechinen aus Teeblättern während der Fermentation entsteht und als Hauptpigment für die Farbe, den Geschmack und die Bioaktivität von Tee verantwortlich ist (Roberts et al., 1957). Es ist in der Lage, Apoptose in einer Vielzahl von Krebszelllinien zu induzieren, wie z. B. in menschlichen Brustkrebszelllinien (MCF-7, MDA-MB-231, T47D und ZR-75-1), Kolonkarzinomzelllinien (HCT-15 und HT-29) und Leberkrebszelllinien (HCCLM3 und Huh-7), was auf ein Anti-Krebs-Potenzial hinweist (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Dennoch wurde seiner Wirkung auf Melanome bisher nur wenig Aufmerksamkeit geschenkt.
In Anbetracht der berichteten pro-apoptotischen Wirkungen von TF auf viele Krebszelllinien (Lahiry et al., 2008) stellten wir die Hypothese auf, dass TF pro-apoptotische Wirkungen auf Melanomzellen ausübt. Um dies zu überprüfen, führten wir In-vitro-Experimente durch, um die zytotoxische pro-apoptotische Wirkung von TF auf menschliche Melanomzellen zu bewerten, und führten In-vivo-Experimente mit einem Xenotransplantationsmodell in larvalen Zebrafischen durch, um seine tumorhemmende Wirkung zu bestimmen. Außerdem wurde der Mechanismus von TF erforscht.
Materialien und Methoden
Materialien und Chemikalien
Theaflavin (TF, >95% Reinheit) wurde von Theabio Co., Ltd (Hangzhou, China) zur Verfügung gestellt (Chargennummer: 20181211061). Dulbecco′s modifiziertes Eagle′s Medium (DMEM) mit hohem Glukosegehalt (4,5 g/l) wurde von HyClone Laboratories (UT, USA) bezogen. Fötales Rinderserum (FBS) wurde von Cell Max (Beijing, China) bezogen. Trypsin (0,25 %) wurde von Gibco (NY, USA) bezogen. 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid (MTT) und Dimethylsulfoxid (DMSO) wurden von Sigma (St. Louis, MO, USA) bezogen. Annexin-V: FITC-Apoptose-Nachweiskit wurde von BD Biosciences (CA, USA) bezogen. 4′-6-Diamidino-2-Phenylindol (DAPI)-Färbelösung wurde von Thermo Fisher Scientific (MA, USA) bezogen. Die primären Antikörper wurden von Cell Signaling Technology (MA, USA) bezogen. Das Trizol-Reagenz und das Kit für die Echtzeit-Polymerase-Kettenreaktion (Real Time PCR) wurden von TaKaRa (Dalian, China) bezogen.
Zelllinienvorbereitung
Die menschliche HFF-1-Hautfibroblasten- und A375-Melanom-Zelllinie wurde von der Shanghai Cell Bank of Chinese Academy of Sciences (Shanghai, China) und die menschliche A875-Melanom-Zelllinie von der Kunming Cell Bank of Chinese Academy of Sciences (Kunming, China) bezogen. Diese Zelllinien wurden in DMEM-Medium mit 10 % FBS bei 37 °C in einem befeuchteten Inkubator mit 5 % CO2 kultiviert. Das Medium wurde täglich gewechselt, und die Zellen wurden in der logarithmischen Wachstumsphase mit TF behandelt.
Zebrafisch-Zubereitung
Der Wildtyp AB-Stamm der Zebrafische wurde vom China Zebrafish Resource Center, Institute of Hydrobiology, China Academy of Science (Wuhan, China) bezogen und von der Association for Assessment and Accreditation of Laboratory Animal Care International (SYXK 2012-0171) akkreditiert. Larven von Zebrafischen im Alter von 2 dpf (Tage nach der Befruchtung) wurden durch natürliche Paarung erzeugt und in einer lichtgesteuerten Aquakulturanlage mit einer Standard-Photoperiode von 14:10 Stunden Tag/Nacht untergebracht und zweimal täglich mit lebenden Salinenkrebsen und einmal täglich mit Fischflocken gefüttert.
Zellviabilitätstest und morphologische Beobachtung
MTT-Tests wurden durchgeführt, um die hemmenden Effekte von TF auf Melanomzelllinien zu bestimmen, wie zuvor beschrieben (Zhou et al, 2017). Die Zellen wurden in 96-Well-Platten mit 6×103 Zellen/Well in 200 μl Medium für eine 24-stündige Adhärenz ausgesät, gefolgt von einer Behandlung mit TF in Konzentrationen von 0, 50, 100, 150, 200, 250, 300 und 400 μg/ml für 24, 48 und 72 Stunden. Dann wurden 20 μl MTT-Lösung (5,0 mg/ml) in jede Vertiefung gegeben und 4 Stunden bei 37 °C inkubiert. DMSO (150 μl) wurde in jede Vertiefung gegeben, und der optische Dichtewert (OD-Wert) wurde bei 490 nm mit einem Biorad-Mikroplattenlesegerät (CA, USA) gemessen. Hemmungsrate (%) = × 100%. Die 50%igen Hemmkonzentrationen (IC50) für 24, 48 und 72 Stunden wurden durch Regressionsanalyse berechnet. Dementsprechend wurden 120, 240 und 360 μg/ml (232,3, 464,7 und 697,0 μM) als niedrige, mittlere und hohe TF-Dosen bezeichnet. Anschließend wurden die Zelllinien HFF-1, A375 und A875 wie oben beschrieben in 96-Well-Platten ausgesät und 24 Stunden lang mit der mittleren TF-Dosis behandelt. Die Zellmorphologie der A375-Zellen wurde unter dem Fluoreszenzmikroskop von Carl Zeiss (Göttingen, Deutschland) beobachtet.
Apoptose-Analyse durch DAPI-Färbung und Durchflusszytometrie
Die Zellapoptose wurde durch DAPI-Färbung und Annexin-V/PI-Färbung mittels Durchflusszytometrie bestimmt. Für die DAPI-Färbung wurden A375-Zellen in 96-Well-Platten ausgesät und 24 Stunden lang mit TF in niedrigen, mittleren und hohen Konzentrationen behandelt. Anschließend wurden die Zellen 30 Minuten lang bei Raumtemperatur mit 4% Paraformaldehyd in PBS fixiert und 10 Minuten lang im Dunkeln mit DAPI gefärbt. Nach dreimaligem Waschen wurden die Zellen mit fünf Deckgläsern unter dem Fluoreszenzmikroskop von Carl Zeiss (Göttingen, Deutschland) beobachtet und die apoptotischen Zellen gezählt. Die Durchflusszytometrie wurde nach den Anweisungen des Herstellers durchgeführt. Kurz gesagt, A375-Zellen wurden 24 Stunden lang in 6-Well-Platten mit 3×105 Zellen/Well ausgesät und weitere 48 Stunden lang mit TF in niedrigen, mittleren und hohen Konzentrationen behandelt. Die Fluoreszenzintensität der Zellen wurde mit BD C6-Durchflusszytometrie (CA, USA) ermittelt. Die Analyse wurde wiederholt und die frühen und späten apoptotischen Zellraten (%) wurden berechnet.
Xenograft Animal Assay
Für die Bestimmung des Dosisbereichs von TF wurden insgesamt 300 larvale Zebrafische im Alter von 3 dpf verwendet und nach dem Zufallsprinzip in 6-Well-Platten mit jeweils 30 Fischen kultiviert. In jeder Vertiefung wurde TF in einer Konzentration von 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1.000 und 2.000 μg/ml für 24 Stunden aufgelöst. Anschließend wurden die Fische in jeder Gruppe unter dem Stereomikroskop beobachtet, um die Sterblichkeit und unerwünschte Ereignisse zu erfassen. Wie in unserer früheren Studie beschrieben, wurde der NOAEL-Wert (no observed adverse effect level) von TF geschätzt, und 1/9 NOAEL, 1/3 NOAEL und NOAEL wurden als niedrige, mittlere und hohe Dosen für das folgende Experiment verwendet (Jin et al, 2018).
Um das Xenotransplantationsmodell zu etablieren, wurden A375-Zellen mit CM-Dil (rote Fluoreszenz) in einer Verdünnung von 1:1.000 angefärbt und in den Dottersack von larvalen Zebrafischen (2 dpf) in einer Dosis von 200 Zellen/Fisch mikroinjiziert. Nach einem Tumorwachstum von 24 Stunden wurden alle Fische zur Modellüberprüfung unter einem Fluoreszenzmikroskop (AZ100, Nikon, Tokio, Japan) beobachtet. Die A375-tragenden Fische wurden in 5 Gruppen (je 30 Fische) eingeteilt und mit 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL und NOAEL von TF bzw. 15 μg/ml (50 μM) Cisplatin für 24 h behandelt. Die Fluoreszenzintensität (FI) der A375-Zellmasse der Zebrafische wurde ermittelt und die Hemmungsrate wurde wie folgt berechnet: Hemmungsrate (%) = × 100%.
Real Time PCR (qPCR)-Analyse
Um die molekularen Wirkungen von TF auf A375-Zellen aufzudecken, wurde qPCR auf einem ABI QuantStudio™ 7 Flex Real-Time PCR System (Applied Biosystems, CA, USA) eingesetzt. Die Gesamt-RNA der A375-Zellen wurde mit Trizol-Reagenz extrahiert und durch reverse Transkription zu cDNA synthetisiert. Das qPCR-Reaktionssystem hatte ein Volumen von 20,0 μl: 10 μl SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl PCR-Vorwärtsprimer, 0,8 μl PCR-Rückwärtsprimer, 2,0 μl Template-cDNA, 0,4 μl ROX-Referenzfarbstoff und 6,0 μl ddH2O. Die qPCR-Reaktionsbedingungen wurden auf 95°C für 30 s initiale Denaturierung, 40 Zyklen von 95°C für 5 s Denaturierung, 60°C für 34 s Annealing und 72°C für 40 s Extension eingestellt. Am Ende jeder Reaktion wurde eine Schmelzkurvenanalyse durchgeführt. β-ACTIN wurde als Referenzgen verwendet, und die 2-ΔΔCT-Methode wurde angewandt, um die relative Expression jedes Gens zu analysieren (Tabelle 1).

Table 1 Primer-Sequenzen für die qPCR-Analyse.
Western Blot (WB)-Analyse
Die Proteinexpression von A375-Zellen mit TF-Behandlung bei 0 μg/ml und 120 μg/ml (232,3 μM) wurde durch WB-Analyse analysiert. Die Gesamtproteine wurden mit einem Lysepuffer (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1 % Triton, 0,1 % SDS, 5 μg/ml Leupeptin und 1 mM PMSF) für 30 Minuten auf Eis extrahiert und wiederholt eingefroren und aufgetaut. Die Zielproteine wurden mittels denaturierender Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese (SDS-PAGE) (8~12%) aufgetrennt und anschließend auf eine Polyvinylidenfluorid (PVDF)-Membran (Millipore, MA, USA) übertragen. Die Membran wurde 2 Stunden lang mit 5 % fettfreier Milch blockiert und anschließend über Nacht bei 4 °C mit den Antikörpern gegen: ACTIN, ASK1, ATM, phosphorylierter ATM (p-ATM), ATR, phosphorylierter ATR (p-ATR), gespaltene Caspase 3 (c-CASP3), gespaltene Caspase 8 (c-CASP8), CHK1, CHK2, phosphorylierter CHK1 und CHK2 (p-CHK1 und p-CHK2), JNK, phosphorylierter JNK (p-JNK), C-JUN, phosphorylierter C-JUN (p-C-JUN), gespaltenes PARP (Poly-ADP-Ribose-Polymerase), P53 und phosphorylierter P53 (p-P53). Nach der Inkubation mit dem sekundären Antikörper wurden diese Proteine mit einem verstärkten Chemilumineszenz-Kit (Amersham Pharmacia Biotech, Little Chalfort, UK) sichtbar gemacht und mit einem Chemilumineszenz-Analysegerät nachgewiesen.
Statistische Analyse
Daten wurden als Mittelwerte ± SD ausgedrückt und einer einseitigen ANOVA unterzogen, gefolgt von einem Vergleich mit der kleinsten signifikanten Differenz (LSD) nach Fisher. Alle Analysen wurden mit einer aktualisierten Version der DPS-Software (Tang und Zhang, 2013) durchgeführt.
Ergebnisse
Anti-Proliferative Wirkung von TF
Wie in Abbildung 1A gezeigt, hemmte TF bei 50 μg/ml (96.8 μM) die Lebensfähigkeit von A375-Zellen signifikant hemmte und die Hemmungsraten mit steigender TF-Konzentration von 50 bis 400 μg/ml (96,8 bis 744,4 μM) zunahmen (jeweils P < 0,01 vs. Normalwert), was auf eine konzentrationsabhängige Wirkung hinweist. Die Hemmungsraten stiegen ebenfalls mit der TF-Behandlung von 24 bis 72 Stunden, mit IC50 von 218,9 bis 84,9 μg/ml (423,8 bis 164,4 μM). Anschließend verabreichten wir 120, 240 und 360 μg/ml (232,3, 464,7 und 697,0 μM) als Dosis von TF-L, TF-M bzw. TF-H. Wie in Abbildung 1B gezeigt, hemmte TF-M offensichtlich die Lebensfähigkeit von A375- und A875-Zellen, hatte aber nur eine geringe Wirkung auf HFF-1-Zellen. Wie in Abbildung 1C gezeigt, war die Morphologie der A375-Zellen deutlich verändert und die Anzahl der lebenden Zellen nahm mit der TF-Behandlung bei steigenden Konzentrationen ab.

Abbildung 1 Zellviabilität von A375-Zellen mit TF-Behandlung nach 24, 48 und 72 Stunden (A), Zellviabilität von HFF-1-, A375- und A875-Zellen mit TF-Behandlung nach 24 Stunden (B) und Morphologie von A375-Zellen mit Theaflavin (TF)-Behandlung nach 24 Stunden (C). Die Daten sind Mittelwerte ± SD (n = 5). Mittels Fisher’s Least Significant Difference (LSD) Mehrfachvergleiche, Daten (Mittelwert ± SD) mit gleichem Kleinbuchstaben (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d) zeigen keinen signifikanten Unterschied untereinander, während Daten mit unterschiedlichen Buchstaben (a vs. b vs. c vs. b vs. e vs. f vs. g) einen signifikanten Unterschied untereinander anzeigen. Skalenbalken = 200 μm.
Pro-apoptotische Wirkung von TF
DAPI-Färbung und Durchflusszytometrie wurden durchgeführt, um die pro-apoptotische Wirkung von TF auf A375-Zellen zu bewerten. Das Ergebnis der DAPI-Färbung zeigte eine apoptotische Morphologie, einschließlich einer geschrumpften Form, Karyopyknose und Kernfragmentierung, in A375-Zellen mit einer TF-Behandlung von 120 bis 360 μg/ml (232,3 bis 697,0 μM) (Abbildung 2A). Die Zahl der apoptotischen Zellen war bei einer TF-Behandlung mit 240 und 360 μg/ml (464,7 und 697,0 μM) signifikant erhöht (jeweils P < 0,01 vs. NC) (Abbildung 2C). Das Ergebnis der Durchflusszytometrie zeigte die TB-induzierte frühe Apoptose und späte Apoptose von A375-Zellen (Abbildung 2B). Die Anzahl der frühen und späten apoptotischen Zellen war bei einer TF-Behandlung von 120 bis 360 μg/ml (232,3 bis 697,0 μM) erhöht (Abbildung 2B), und ihr Anteil war bei einer TF-Behandlung von 360 μg/ml (697,0 μM) signifikant höher (P < 0,01 und P < 0,05 gegenüber dem Normalwert) (Abbildungen 2D, E). Die Ergebnisse deuten darauf hin, dass TF die Apoptose von A375-Zellen in einer konzentrationsabhängigen Weise induziert.
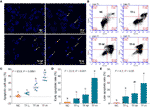
Abbildung 2 DAPI-Färbung (A) und Durchflusszytometrie-Analyse (B) auf A375-Zellen mit Theaflavin (TF) Behandlung. Statistische Analyse der apoptotischen Zellrate (C), statistische Analyse der frühen apoptotischen Rate (D) und statistische Analyse der späten apoptotischen Rate (E). Mittels Fisher’s Least Significant Difference (LSD) Mehrfachvergleiche, Daten (Mittelwert ± SD) mit gleichem Kleinbuchstaben (a vs. ab; ab vs. b; b vs. b; c vs. c) zeigen keinen signifikanten Unterschied untereinander, während Daten mit unterschiedlichen Buchstaben (a vs. b vs. c) einen signifikanten Unterschied untereinander anzeigen. Maßstabsbalken = 100 μm.
In-vivo-Effekt von TF auf Xenograft-Zebrafische
Die Kurven der Sterblichkeit und der unerwünschten Ereignisse bei Zebrafischen mit TF-Behandlung sind in Abb. 3A dargestellt. Der Fischtod wurde durch TF bei 31,25 μg/ml (60,5 μM) verursacht, und kein Fisch überlebte mit TF bei 125 μg/ml (242,0 μM), was darauf hinweist, dass die maximale nicht tödliche Dosis von TF unter 31,25 μg/ml (60,5 μM) lag. Die unerwünschten Ereignisse, einschließlich abnormaler Körperüberschläge und Ödeme, wurden bei der Behandlung mit TF ab 3,47 μg/ml (6,7 μM) bis zu den höheren Dosen beobachtet, was auf einen NOAEL von TF von weniger als 3,47 μg/ml (6,7 μM) hinweist. Nach wiederholten Tests wurde der NOAEL schließlich auf 2,0 μg/ml (3,9 μM) geschätzt. Dabei wurden 0,22, 0,67 und 2,0 μg/ml (0,4, 1,3 und 3,9 μM) als niedrige, mittlere und hohe TF-Dosis für das nachfolgende Experiment verwendet.
Wie in Abbildung 3B dargestellt, wurde ein Xenotransplantationsmodell von A375-Zellen in larvalen Zebrafischen erstellt und die Fluoreszenzintensitäten der Zellmasse in den Fischen getestet. Nach 24-stündiger Behandlung hemmte TF in einer Konzentration von 0,22 bis 2,0 μg/ml (0,4, 1,3 und 3,9 μM) offensichtlich das Wachstum des A375-Tumors mit Hemmungsraten von 1,0 bis 46,4 %. Die hemmende Wirkung von TF bei 0,67 und 2,0 μg/ml (1,3 und 3,9 μM) war im Vergleich zur Modellgruppe signifikant (P < 0,01), und die Wirkung von TF bei 2,0 μg/ml (3,9 μM) war sogar höher als die von Cisplatin bei dessen NOAEL (50 μM).
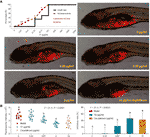
Abbildung 3 Mortalität und unerwünschte Ereignisse bei larvalen Zebrafischen, die durch Theaflavin (TF) induziert wurden, und Beobachtung larvaler Zebrafische, die mit A375-Zellen xenotransplantiert und mit TF oder Cisplatin behandelt wurden (A), sowie die Fluoreszenzintensität und die Hemmungsraten von TF (B). Die rot fluoreszierende Fläche stellt die Masse der A375-Zellen dar. Mittels LSD-Mehrfachvergleichen zeigen Daten (Mittelwert ± SD) mit gleichem Kleinbuchstaben (a vs. a; c vs. c) keinen signifikanten Unterschied untereinander an, während Daten mit unterschiedlichen Buchstaben (a vs. b vs. c) einen signifikanten Unterschied zueinander anzeigen.
Molekulare Wirkung von TF auf mRNA-Expressionen in A375-Zellen
Die relativen mRNA-Expressionen von TF-gesteuerten Genen wurden mittels qPCR-Assay getestet. Wie in Abb. 4 gezeigt, wurden die Expressionen von BAX, BIM, C-MYC, P21, P53 und PUMA durch TF signifikant hochreguliert (jeweils P < 0,01 im Vergleich zum NC-Niveau), mit Ausnahme der Expression von BAX bei TF-Behandlung in niedriger Konzentration. Obwohl die Expression von BCL-2 durch TF hochreguliert wurde, waren die Verhältnisse von BAX/BCL-2 bei TF-Behandlung in mittleren bis hohen Konzentrationen signifikant höher als auf NC-Niveau (P < 0,01), was auf die Hauptrolle von BAX bei der Wirkung von TF hinweist.
Molekulare Wirkung von TB auf Proteinexpressionen in A375-Zellen
WB wurde angewendet, um die Expression und Phosphorylierung von Proteinen zu bestimmen, auf die TF abzielt. Wie in Abbildung 5 dargestellt, wurden die Expressionen von ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8 und c-CASP3 durch TF bei 120 μg/ml (232,3 μM) signifikant hochreguliert (jeweils P < 0,01 gegenüber dem NC-Niveau). Außerdem waren die Wirkungen von TF auf ATR, p-ATR, CHK2, P53, C-JUN (43 kd) und p-C-JUN (Ser 73) unbedeutend (jeweils P > 0,05 vs. NC-Niveau).
Diskussion
Obwohl die Anti-Krebs-Aktivitäten von TF gut dokumentiert sind (Sur und Panda, 2017; Takemoto und Takemoto, 2018; Sajadimajd et al, 2020), aber das Wissen über seine Wirksamkeit bei Melanomen ist noch gering. Um diese Lücke zu schließen, wurden in der vorliegenden Studie In-vitro- und In-vivo-Experimente durchgeführt, um die Wirkung und den Mechanismus von TF gegen Melanomzellen zu untersuchen. Zum ersten Mal konnten wir die zytotoxischen, pro-apoptotischen und tumorhemmenden Wirkungen von TF auf Melanomzellen A375 nachweisen. Es wurde vermutet, dass dieser Mechanismus mit den P53- und JNK-Signalwegen zusammenhängt. Das Neue an dieser Studie ist die Feststellung der Anti-Melanom-Wirksamkeit von TF, während frühere Berichte sich nur auf die Auswirkungen von TF auf andere Tumore konzentrierten (Lin, 2002; Sur und Panda, 2017). Darüber hinaus ist dies der erste Bericht über die molekulare Wirkung von TF auf den JNK-Signalweg, während der mit dem P53-Signalweg verbundene Mechanismus der pro-apoptotischen Wirkung von TF auf Karzinomzellen bereits früher berichtet wurde (Lahiry et al., 2008).
In jüngster Zeit haben Xenotransplantations-Tumormodelle, bei denen Larven von Zebrafischen verwendet werden, aufgrund der Vorteile von Larven von Zebrafischen im Vergleich zu anderen Tiermodellen zunehmende Aufmerksamkeit für Studien zur Krebsbekämpfung auf sich gezogen: (1) das Fehlen einer Immunabstoßung gegen menschliche Zellen führt zu einer höheren Erfolgsrate bei der Xenotransplantation; (2) die Transparenz des Körpers ermöglicht eine in vivo sichtbare Beobachtung des Tumorwachstums und der Medikamententoxizität; und (3) die Generierung in großem Maßstab und die schnelle Organogenese ermöglichen kürzere Versuchszeiten (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). In dieser Studie übte TF eine dosisabhängige hemmende Wirkung auf die A375-Tumormasse bei larvalen Zebrafischen aus (Abbildung 3B), mit einer Hemmungsrate von 46,4 % bei seinem NOAEL (3,9 μM). Die Hemmungsrate war höher als die von Cisplatin, was darauf hindeutet, dass TF innerhalb ihres jeweiligen sicheren Dosisbereichs wirksamer war als Cisplatin. Außerdem war die Hemmungsrate höher als die eines anderen Teepigments (Theabrownin) (Jin et al., 2018), was darauf hindeutet, dass TF der wirksamste Bestandteil von Tee ist. Der wirksame in vivo-Dosisbereich (1,3 bis 3,9 μM) von TF ist jedoch viel niedriger als sein wirksamer in vitro-Dosisbereich (96,8 bis 774,4 μM). Der Grund für diesen Unterschied könnte darin liegen, dass die metabolisierten TF-Derivate nach oraler Verabreichung eine stärkere Wirkung haben als TF selbst. Dies deutet darauf hin, dass die orale Verabreichung von TF möglicherweise effizienter ist als andere Verabreichungswege.
Nach der Dosisumrechnungsregel können die wirksamen Dosen (1,3 und 3,9 μM) von TF bei larvalen Zebrafischen auf 0,03 bis 0,09 mg/kg beim Menschen geschätzt werden (Zhang et al., 2003). Dies deutet darauf hin, dass die orale Verabreichung von TF in einem so niedrigen Dosisbereich bei der Behandlung von Patienten mit Melanomen wirksam sein kann, was auf ein gutes Kosten-Nutzen-Verhältnis dieser Verbindung hindeutet. Unseres Wissens gibt es nur wenige Berichte über die klinische Anwendung von TF. In einer doppelblinden, randomisierten, placebokontrollierten Parallelgruppenstudie wurde mit TF angereicherter Grüntee-Extrakt 12 Wochen lang zur Behandlung von Patienten mit leichter bis mittlerer Hypercholesterinämie eingesetzt (Maron et al., 2003). In dieser Studie betrug die tägliche Zufuhr von TF in Form von Grüntee-Extrakt 75 mg, wodurch das Gesamtcholesterin, das LDL-C und die Triglyceride bei Erwachsenen mit Hypercholesterinämie signifikant gesenkt werden konnten, ohne dass signifikante unerwünschte Ereignisse beobachtet wurden (Maron et al., 2003). In dieser Studie war der Bereich der wirksamen Dosis von TF viel niedriger als der berichtete, was auf ein größeres Potenzial von TF für die Melanombehandlung in der Klinik schließen lässt. Obwohl der wirksame Dosisbereich von TF klein war, war seine tödliche Dosisschwelle für Zebrafischlarven ebenfalls niedrig (<60,5 μM) und lag unter der anderer Teepigmente (Abbildung 3A) (Jin et al., 2018), was Anlass zur Sorge über die potenzielle Toxizität von TF für den Menschen gibt. Interessanterweise stellten wir fest, dass TF nur eine geringe Wirkung auf die normale Zelllinie (HFF-1 Hautfibroblasten) ausübte (Abbildung 1B), was auf eine klinische Durchführbarkeit seiner externen Verwendung hindeutet, die die potenzielle Toxizität seiner internen Verwendung vermeiden kann.
Unser mechanistisches Experiment zeigte, dass TF ATM, CHK1/2, P53, CASP8/3 im P53-Signalweg aktivierte und auch ASK1, JNK und C-JUN im JNK-Signalweg aktivierte, was mit der Apoptose der A375-Zelle einherging. Die Apoptose wurde durch DAPI-Färbung und durchflusszytometrische Analyse auf zellulärer Ebene bestimmt (Abbildung 2) und durch die Überexpression von pro-apoptotischen Genen (P53, BAX, BIM und PUMA) und die Aktivierung von apoptosebezogenen Proteinen (Caspasen und PARP) auf molekularer Ebene vermittelt (Abbildungen 4 und 5). P53 (TP53) kodiert für ein DNA-bindendes nukleares Phosphoprotein mit Tumorsuppressor-Aktivität, das als Transkriptionsfaktor im Zentrum eines Netzwerks zur Kontrolle der Apoptose als Reaktion auf zelluläre Stressfaktoren fungiert (Martin et al., 2002). Es aktiviert die Apoptose, indem es die Transkription von Genen der Bcl-2-Familie, wie BAX, BIM und PUMA, stimuliert (Levine und Oren, 2009). BAX und BIM kodieren pro-apoptotische Mitglieder, die Apoptose und Zelltod durch Aktivierung der Caspase-Kaskade als Reaktion auf apoptotische Stimuli auslösen (Rossé et al., 1998; Youle und Strasser, 2008). PUMA, ein von P53 hochregulierter Modulator der Apoptose, kodiert ein BH3-Domäne enthaltendes Protein, das in den Mitochondrien lokalisiert ist, mit Bax und Bak interagiert und die Caspase-Kaskade durch Spaltung von CASP3 aktiviert (Nakano und Vousden, 2001; Letai, 2009). In dieser Studie wurden CASP8 und CASP3 als Reaktion auf die P53-Aktivierung gespalten. CASP8 ist eine initiierende Caspase in der apoptotischen Kaskade, die CASP3 für die apoptotische DNA-Fragmentierung aktiviert, was zur anschließenden Spaltung von PARP (c-PARP) führt, um den apoptotischen Prozess durchzuführen (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP ist für die DNA-Reparatur und die Lebensfähigkeit der Zellen als Reaktion auf exogenen Stress verantwortlich (Satoh und Lindahl, 1992). Es kann von CASP3 gespalten werden und erleichtert dadurch den Zellabbau in der Apoptose (Oliver et al., 1998). Daher kann die Menge an gespaltenem PARP (c-PARP) als Marker für die Zellapoptose verwendet werden.
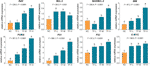
Abbildung 4 Relative mRNA-Expression von Theaflavin (TF)-gezielten Genen in A375-Zellen nach 24 Stunden Behandlung. Mittels Fisher’s Least Significant Difference (LSD) Mehrfachvergleiche, Daten (Mittelwert ± SD) mit gleichem Kleinbuchstaben (a vs. a; b vs. b; c vs. c) zeigen keinen signifikanten Unterschied untereinander, während Daten mit unterschiedlichen Buchstaben (a vs. b vs. c vs. d) b vs. c vs. d) bedeuten einen signifikanten Unterschied zueinander.
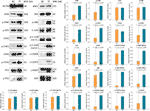
Abbildung 5 Expression und Phosphorylierung von Theaflavin (TF)-gezielten Proteinen in A375-Zellen nach 24-stündiger Behandlung. Daten (Mittelwert ± SD) mit unterschiedlichen Kleinbuchstaben unterscheiden sich signifikant voneinander bei Fisher’s Least Significant Difference (LSD) Mehrfachvergleichen.
In unseren früheren Studien haben wir berichtet, dass die Induktion von DNA-Schäden mit dem P53-Signalweg-vermittelten pro-apoptotischen Mechanismus von Theabrownin verbunden war (Wu et al., 2016; Jin et al., 2018). Doch obwohl sowohl TF als auch Theabrownin den P53-Signalweg aktivierten und die Apoptose von Tumorzellen auslösten, konnten wir in dieser Studie keine Induktion von DNA-Schäden durch die TF-Behandlung feststellen. Alternativ fanden wir die Aktivierung der ASK1-JNK-C-JUN-Kaskade, die auch als apoptotischer Signalweg fungiert. In diesem Signalmodul ist ASK1 (apoptosis signal-regulating kinase 1) eine mitogen-aktivierte Proteinkinase, die eine Schlüsselrolle bei der zytokin- und stressinduzierten Apoptose spielt, indem sie einen mitochondrienabhängigen Signalweg auslöst (Matsuzawa und Ichijo, 2001; Zhang et al., 2003). Als Reaktion auf verschiedene Arten von Stress aktiviert es die nachgeschaltete JNK-Signalgebung, die durch die Aktivierung von C-JUN und die anschließende Überexpression pro-apoptotischer Gene zur Zellapoptose führt (Tobiume et al., 2001). Es wurde berichtet, dass Chemotherapeutika wie Cisplatin, Docetaxel und Paclitaxel die Apoptose von Melanomzellen über den JNK-Signalweg unabhängig vom P53-Signalweg auslösen (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). Dies deutet darauf hin, dass TF im Vergleich zu diesen Medikamenten aufgrund seines über zwei Signalwege vermittelten Wirkmechanismus einen Vorteil haben könnte, was in dieser Studie durch die stärkere tumorhemmende Wirkung von TF im Vergleich zu Cisplatin vorläufig nachgewiesen wurde. Allerdings gibt es in dieser Studie einige Einschränkungen: (1) die Wirkungen der P53- und JNK-Signalwege in dem vorgeschlagenen, durch zwei Signalwege vermittelten Mechanismus von TF wurden nicht verifiziert; (2) die Interaktion zwischen den P53- und JNK-Signalwegen wurde nicht untersucht, und es ist nicht bekannt, welcher Signalweg die Hauptrolle spielt; und (3) der In-vitro-Dosisbereich und der In-vivo-Dosisbereich sind recht unterschiedlich, was zwar erklärt wurde, aber noch experimentell nachgewiesen werden muss. Zur Klärung dieser Fragen sind in Zukunft weitere Studien erforderlich. So sollten beispielsweise siRNAs oder Inhibitoren von P53 und JNK verwendet werden, um die Wirkung dieser Signalwege zu überprüfen und die Wechselwirkung zwischen ihnen zu erforschen, und die Serummetaboliten von TF sollten chemisch analysiert und pharmakologisch untersucht werden, um unsere Hypothese zu testen, dass die metabolisierten TF-Derivate eine stärkere Wirkung haben als TF selbst. Da es außerdem keine klinischen Berichte über TF zur Krebsbehandlung gibt, sollten die therapeutische Wirksamkeit und der Nutzen von TF bei Krebspatienten weiter untersucht werden.
Schlussfolgerung
Da das krebsbekämpfende Potenzial von TF gut dokumentiert ist, bleibt es ungewiss, ob TF bei der Behandlung von Melanomen wirksam ist. In dieser Studie haben wir unter Verwendung der Melanomzelllinie und des Zebrafischmodells zytotoxische, pro-apoptotische und tumorhemmende Wirkungen von TF auf Melanomzellen festgestellt und ihren Mechanismus in Verbindung mit der Aktivierung der P53- und JNK-Signalwege aufgezeigt. Dies ist die erste Studie, die die Wirkung und den Mechanismus von TF gegen Melanomzellen beschreibt. Da der Mechanismus von TF nicht nur vom P53-Signalweg abhängt, kann davon ausgegangen werden, dass TF bei der Behandlung von P53-mutierten Zelllinien wirksam sein könnte. Weitere Studien sind erforderlich, um diese Schlussfolgerung zu verifizieren. Insgesamt liefert diese Studie Beweise für die Wirksamkeit von TF gegen Melanome, was zur Entwicklung von TF-abgeleiteten Wirkstoffen für die Melanomtherapie beiträgt.
Data Availability Statement
Die Rohdaten, die die Schlussfolgerungen dieses Artikels untermauern, sind auf begründete Anfrage beim entsprechenden Autor erhältlich.
Erklärung zur Ethik
Die Tierstudie wurde von der Ethikkommission der Zhejiang Chinese Medical University geprüft und genehmigt.
Beiträge der Autoren
LeZ hat die Hauptarbeit an diesem Artikel geleistet. BY führte die zellulären und molekularen Experimente durch. LiZ und SM trugen zum Verfassen dieses Manuskripts bei. WD lieferte Ideen und finanzielle Unterstützung für diese Arbeit. YX führte das Zebrafisch-Experiment durch. LS konzipierte diese Arbeit und verfasste das Manuskript. TE verbesserte das Design und den Entwurf dieser Arbeit. Alle Autoren trugen zum Artikel bei und genehmigten die eingereichte Version.
Finanzierung
Diese Arbeit wurde von der National Natural Science Foundation of China (Grant No. 81774331, 81873049, and 81973873), der Zhejiang Provincial Natural Science Foundation of China (Grant No. LY18H270004), dem Zhejiang Provincial Science and Technology Project of Traditional Chinese Medicine of China (Grant No. 2016ZZ011), der Zhejiang Provincial Key Construction University Superiority Characteristic Discipline (Traditional Chinese Pharmacology) und der Opening Foundation of China (Grant No. ZYX2018006).
Interessenkonflikt
YX war bei der Firma Hunter Biotechnology, Inc. angestellt.
Die übrigen Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Abkürzungen
DAPI, 4′-6-Diamidino-2-Phenylindol; DMEM, Dulbecco′s modified Eagle′s medium; DMSO, Dimethylsulfoxid; dpf, days post fertilization; FBS, fötales Rinderserum; FI, Fluoreszenzintensität; LSD, Fisher’s least significant difference; NOAEL, no observed adverse effect level; MTT, 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid; PARP, Poly-ADP-Ribose-Polymerase; SDS-PAGE, denaturierende Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese; TCM, Theaflavin; TF, traditionelle chinesische Medizin.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Theaflavine verzögern die Migration menschlicher Brustkrebszellen durch Hemmung von NF-kappaB über p53-ROS Cross-Talk. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. (1999). Die Rolle der Poly(ADP-Ribose)-Polymerase (PARP)-Spaltung bei der Apoptose. Caspase-3-resistente PARP-Mutante erhöht die Apoptoserate in transfizierten Zellen. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). Caspase-3 ist für die DNA-Fragmentierung und morphologische Veränderungen im Zusammenhang mit Apoptose erforderlich. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownin löst DNA-Schäden aus, um menschliche Osteosarkom U2OS-Zellen durch Aktivierung des p53-Signalwegs zu unterdrücken. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebrafisch-Xenografts als Werkzeug für In-vivo-Studien über menschlichen Krebs. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Vergleichende Studien über die hypolipidämische und wachstumshemmende Wirkung von Oolong-, Schwarz-, Pu-Erh- und Grünteeblättern bei Ratten. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Beitrag der p53-vermittelten Bax-Transaktivierung zur Theaflavin-induzierten Apoptose von Mammaepithelkarzinomzellen. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Theaflavine zielen auf Fas/Caspase-8- und Akt/pBad-Signalwege ab, um Apoptose in p53-mutierten menschlichen Brustkrebszellen zu induzieren. Carcinogenesis 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Zebrafisch: ein neues Modell auf dem pharmazeutischen Laufsteg. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Cutaneous melanoma: From pathogenesis to therapy (Review). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma strikes Bax. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.200903134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). Die ersten 30 Jahre von p53: Es wird immer komplexer. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Theaflavine hemmen die ATP-Synthase und die Atmungskette, ohne die Superoxidproduktion zu erhöhen. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Krebs-Chemoprävention durch Tee-Polyphenole durch Modulation von Signaltransduktionswegen. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Vitexin compound 1, ein neuartiger Extrakt aus einem chinesischen Kraut, unterdrückt das Wachstum von Melanomzellen durch DNA-Schäden, indem es die ROS-Werte erhöht. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatin induziert die proapoptotische Konformation von Bak in einer deltaMEKK1-abhängigen Weise. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Tea and its components prevent cancer: A review of the redox-related mechanism. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Cholesterinsenkende Wirkung eines mit Theaflavin angereicherten Grüntee-Extrakts: eine randomisierte kontrollierte Studie. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Integration von Mutationsdaten und Strukturanalyse des Tumorsuppressorproteins TP53. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Molekulare Mechanismen der Entscheidung zwischen Leben und Tod: Regulation der Apoptose durch die Apoptose-Signal-regulierende Kinase 1. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Beteiligung des Stresses des endoplasmatischen Retikulums an der Docetaxel-induzierten JNK-abhängigen Apoptose des menschlichen Melanoms. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumin: Ein neuer Kandidat für die Melanomtherapie? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, ein neues proapoptotisches Gen, wird durch p53 induziert. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Emergente nanotechnologische Strategien für die systemische Chemotherapie gegen das Melanom. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Die Bedeutung der Poly(ADP-Ribose)-Polymerase und ihrer Spaltung in der Apoptose. Lesson from an uncleavable mutant. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). Hochdurchsatz-Screening in vivo bei Wirbeltieren. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). The phenolic substances of manufactured tea. I. Fraktionierung und Papierchromatographie der wasserlöslichen Substanzen. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Advances in immunotherapy for melanoma: A comprehensive review. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prolongiert das Zellüberleben nach Bax-induzierter Freisetzung von Cytochrom c. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Fortschritte bei natürlichen Polyphenolen als Antikrebsmittel für Hautkrebs. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Die Rolle der Poly(ADP-Ribose)-Bildung bei der DNA-Reparatur. Nature 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Taxol-induzierter mitochondrialer Stress in Melanomzellen wird durch die Aktivierung der c-Jun N-terminalen Kinase (JNK) und des p38-Signalwegs über das uncoupling protein 2 vermittelt. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Theaflavine unterdrücken das Tumorwachstum und die Metastasierung über die Blockade des STAT3-Signalwegs beim hepatozellulären Karzinom. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). Pro-Caspase-3 ist ein wichtiges physiologisches Ziel von Caspase-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Molekulare Aspekte der chemopräventiven und therapeutischen Wirksamkeit von Tee und Teepolyphenolen gegen Krebs. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Synthese von Theaflavinen und ihre Funktionen. Mol. (Basel Schweiz) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Data Processing System (DPS) Software mit Versuchsplanung, statistischer Analyse und Data Mining entwickelt für den Einsatz in der entomologischen Forschung. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 ist für die anhaltende Aktivierung von JNK/p38 MAP-Kinasen und Apoptose erforderlich. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analysen zur Pathogenese-Theorie des Krebstoxins und zur Theorie der „Konsolidierung des Körperwiderstands und der Beseitigung der Quelle“. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Anti-proliferative und Apoptose-induzierende Wirkung von Theabrownin gegen das nicht-kleinzellige Lungenadenokarzinom A549 Zellen. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). Eine epidemiologische Überprüfung von Ernährung und kutanem malignem Melanom. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). Die BCL-2-Proteinfamilie: Gegensätzliche Aktivitäten, die den Zelltod vermitteln. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Zebrafisch: ein Tiermodell für toxikologische Studien. Curr. Protoc. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Theabrownin hemmt die Zellzyklusprogression und das Tumorwachstum von Lungenkarzinomen durch einen mit c-myc verbundenen Mechanismus. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar