- Einführung
- Materialien und Methoden
- Studienpopulation
- Studienvariablen
- Ergebnisse
- Verteilung der AB0/Rh-Blutgruppe bei Patienten mit PCa
- Keine signifikanten Unterschiede in den klinisch-pathologischen Merkmalen bei PCa-Patienten nach AB0/Rh-Blutgruppen
- Kein signifikanter prognostischer Wert der Blutgruppe für das BCR-freie Überleben nach RP
- Diskussion
- Informierte Zustimmung
- Ethikerklärung
- Beiträge der Autoren
- Erklärung zu Interessenkonflikten
Einführung
Prostatakrebs (PCa) ist die häufigste bösartige Erkrankung in den westlichen Ländern und die zweithäufigste Ursache für krebsbedingte Todesfälle bei Männern (1). Die bekanntesten Risikofaktoren für die Entwicklung eines PCa sind das zunehmende Alter, die ethnische Herkunft und die familiäre Vorbelastung (2). Die familiäre Veranlagung lässt auf eine vererbte genetische Komponente der Krankheit schließen (3), macht aber nur eine Minderheit (5-10 %) der PCa-Fälle aus. Folglich sind die prädisponierenden umweltbedingten und genetischen Faktoren für die meisten Patienten noch unbekannt (4, 5). Die Blutgruppe AB0 ist ein vererbtes Merkmal, das mit der Häufigkeit und der Prognose verschiedener bösartiger Erkrankungen in Verbindung gebracht wurde (6-8). Zur Erklärung des beobachteten Zusammenhangs zwischen AB0-Blutgruppen und Krebsrisiko wurden mehrere plausible Mechanismen vorgeschlagen, darunter Entzündung, Immunüberwachung für bösartige Zellen, interzelluläre Adhäsion und Membransignalisierung.
AB0-Blutgruppenantigene (ABH) sind Glykoproteine, die auf der Oberfläche roter Blutkörperchen exprimiert werden. Die phänotypischen A- und B-Antigene sind endständige Kohlenhydrate, die durch die Addition von Einfachzuckern synthetisiert werden, die durch eine Reihe spezifischer Glykosyltransferasen katalysiert werden. Der Phänotyp 0 ist durch das Fehlen von A- und B-Glykosyltransferasen gekennzeichnet, so dass nur ein Proteingerüst, das H-Antigen, vorhanden ist. Erythrozytenantigene haben verschiedene Funktionen, darunter die strukturelle Integrität der Membranen, den Transport von Molekülen durch die Membranen und die Adhäsion (9). Neben ihrer Expression auf roten Blutkörperchen werden ABH-Antigene auch in einer Vielzahl von Epithelzellen wie Urothel, Magen-Darm-Schleimhaut und Lunge exprimiert. Mehrere Studien haben gezeigt, dass sich das ABH-Expressionsmuster in den Krebszellen je nach Tumorgrad und Krankheitsverlauf verändert, was auf einen möglichen Zusammenhang zwischen der AB0-Blutgruppe und dem Risiko einiger epithelialer Malignome schließen lässt (8, 10). Jüngste Studien haben gezeigt, dass Personen mit der Blutgruppe A, AB oder B im Vergleich zu Personen mit der Blutgruppe 0 häufiger an Bauchspeicheldrüsenkrebs erkranken, wobei das höchste Risiko mit der Blutgruppe B verbunden ist (8). In ähnlicher Weise wurde berichtet, dass der Blutserotyp A mit einem höheren Risiko für Magen-, Brust- und Eierstockkrebs verbunden ist (11). Andererseits korrelierte die Blutgruppe 0 mit den höchsten Rezidiv- und Progressionsraten nach transurethraler Blasenresektion und war somit mit einer schlechteren Prognose bei Patienten mit nicht-muskelinvasivem Urothelkarzinom der Harnblase verbunden (6).
Auf der Grundlage der aktuellen Belege für die prädiktive Rolle der Blutgruppe bei verschiedenen malignen Erkrankungen stellten wir die Hypothese auf, dass die Blutgruppenart als zusätzlicher Parameter verwendet werden kann, der die Risikobewertung erleichtert und hilft, die Prognose nach der Operation bei Patienten mit PCa abzuschätzen. In der aktuellen Literatur gibt es nur begrenzte klinische Erkenntnisse über die Blutgruppe und das PCa im Allgemeinen, die zu kontroversen Ergebnissen führten (12-14). Darüber hinaus gibt es derzeit nur eine Studie, die sich speziell mit den Auswirkungen der Blutgruppe auf das Ergebnis bei Patienten nach radikaler Prostatektomie (RP) befasst (13). Anhand von 555 Patienten mit PCa, die sich einer RP unterzogen, zeigten die Autoren, dass die Blutgruppe AB0 in der multivariablen Analyse, nicht aber in der univariablen Analyse ein unabhängiger Prädiktor für ein biochemisches Rezidiv (BCR) ist.
Ziel der vorliegenden Studie war es daher, weitere Informationen zur laufenden Debatte beizutragen, indem die Korrelation zwischen der AB0/Rh-Blutgruppe und ihrer Verteilung innerhalb der Patienten mit PCa, der Tumorpathologie, dem Rezidiv und der Sterblichkeit bei Patienten mit lokalisiertem PCa, die sich einer RP unterziehen, anhand eines großen Datensatzes eines einzigen Zentrums mit 3.574 Patienten analysiert wurde.
Materialien und Methoden
Studienpopulation
Die Studie wurde vom institutionellen Prüfungsausschuss genehmigt. Insgesamt wurden 3.582 Patienten mit klinisch lokalisiertem PCa, die sich zwischen 2009 und 2010 in unserer Einrichtung einer RP unterzogen hatten, für die Studie ausgewählt. Diejenigen mit unvollständigen Datensätzen und fehlender Nachuntersuchung wurden ausgeschlossen (n = 8), so dass 3.574 Patienten für die Analyse zur Verfügung standen.
Die radikale Prostatektomie wurde mit einem offenen retropubischen Zugang (n = 3.220) oder einem robotergestützten laparoskopischen Zugang (n = 354) durchgeführt, wie zuvor beschrieben (15). Die Lymphknotendissektion wurde bei D’Amico-Patienten mit mittlerem und hohem Risiko gemäß den Leitlinien der European Association of Urology (EAU) für PCa durchgeführt (16). Die chirurgischen Präparate wurden nach histopathologischen Standardverfahren aufbereitet und von erfahrenen Uropathologen in einem Zentrum mit hohem Aufkommen (>2.000 Prostatektomiepräparate pro Jahr) bewertet. Die Tumore wurden nach dem TNM-Staging-System des American Joint Committee on Cancer von 2007 eingestuft, und die histopathologische Einstufung erfolgte nach dem Gleason-System (17).
Alle Teilnehmer wurden vor der RP serologisch untersucht. Die Laborbestätigung der AB0- und Rh-Blutgruppe wurde von der Abteilung für Transfusionsmedizin des Universitätsklinikums Hamburg-Eppendorf eingeholt. Die AB0-Referenzverteilung der deutschen Bevölkerung wurde als Kontrolle verwendet (18).
Studienvariablen
Zu den Studienvariablen gehörten AB0/Rh-Blutgruppe, Alter, präoperatives prostataspezifisches Antigen (PSA), Prostatavolumen (transrektaler Ultraschall), Gleason-Score (Probe), pT-Stadium, pN-Status, chirurgischer Rand, BCR und Mortalität nach RP. Die Nachbeobachtung der Patienten bestand aus PSA-Tests alle 3-6 Monate während der ersten 2 Jahre nach der RP, BCR wurde als PSA-Wert ≥0,2 ng/ml definiert.
Die Beziehung zwischen der AB0-Blutgruppe und den klinisch-pathologischen Variablen wurde mithilfe von Chi-Quadrat-Tests und t-Tests bewertet. In der multivariablen Cox-Regressionsanalyse (Log-Rank-Tests) wurden die Auswirkungen von Blutgruppe, präoperativem PSA, Gleason-Score, pT-Stadium, pN-Status und chirurgischem Rand auf das BCR-freie Überleben untersucht, um die prognostischen Werte für das Überleben zu bewerten. Die Wahrscheinlichkeit des BCR-freien Überlebens wurde in den Gruppen 0, A, B und AB mit Hilfe der Kaplan-Meier-Analyse und des Log-Rank-Tests verglichen.
Alle Tests waren zweiseitige Tests und p-Werte <0,05 wurden als statistisch signifikant angesehen. Die statistischen Analysen wurden mit der JMP-Software v9.0.2 (SAS Institute, Inc., Cary, NC, USA) und R v2.13.1 (R Project for Statistical Computing, www.R-project.org) durchgeführt.
Ergebnisse
Insgesamt kamen 3.574 Patienten mit klinisch lokalisiertem PCa für die endgültigen Analysen in Frage, das mediane Alter bei der Operation lag bei 65 Jahren (Spanne: 38-80) und die mediane Nachbeobachtungszeit betrug 36,9 Monate (Tabelle 1).

Tabelle 1. Assoziation der AB0-Blutgruppe und des Rhesusfaktors mit klinisch-pathologischen Merkmalen von 3.574 Patienten, die mit radikaler Prostatektomie behandelt wurden.
Verteilung der AB0/Rh-Blutgruppe bei Patienten mit PCa
Die Verteilung der AB0-Blutgruppe bei Patienten mit PCa vor der RP war wie folgt: 0 bei 1.350 (38%), A bei 1.605 (45%), B bei 445 (12%) und AB bei 174 (5%) Patienten, 83% der Patienten waren Rh positiv (Tabelle 1). Die Referenzverteilung für die deutsche Bevölkerung wird wie folgt angegeben (18): 0 in 41%; A in 43%; B in 11%; AB in 5%; Rhesus positiv: 85%. Die Gesamtverteilung der AB0- sowie der Rhesus-Blutgruppen in der Studienkohorte entsprach der in der deutschen männlichen Bevölkerung beobachteten Verteilung.
Keine signifikanten Unterschiede in den klinisch-pathologischen Merkmalen bei PCa-Patienten nach AB0/Rh-Blutgruppen
Die Mehrheit der Patienten hatte ein klinisch lokalisiertes PCa mit intermediärem Risikoprofil. Der am häufigsten gemeldete Gleason-Score war 3 + 4 (66,9 %), und 63,3 % der Patienten hatten präoperative PSA-Werte im Bereich von 4-10 ng/ml. pT2-Tumore wurden bei 68,7 % festgestellt, und bei 81,3 % der Patienten wurden negative Ränder erreicht. Das mediane Prostatavolumen betrug 40 ml, und bei 224 (6,3 %) Patienten wurde ein Lymphknotenbefall diagnostiziert (Tabelle 1). Es gab keine signifikanten Unterschiede in den klinisch-pathologischen Merkmalen zwischen Patienten mit verschiedenen AB0-Blutgruppen. Ein leicht erhöhter Prozentsatz an fortgeschrittenen Tumorstadien (≥pT3b) wurde bei Patienten mit Blutgruppe AB im Vergleich zu den Blutgruppen 0, A und B festgestellt (16,1, 12,6, 9,9 bzw. 13,7%, p = 0,033). Die Patientenpopulation mit AB zeigte auch einen leicht erhöhten Anteil an negativem Rh-Faktor (21,8%) im Vergleich zu den anderen Blutgruppen (16,9%, p = 0,01) (Tabelle 1).
Kein signifikanter prognostischer Wert der Blutgruppe für das BCR-freie Überleben nach RP
Nach der multivariablen Cox-Regressionsanalyse korrelierten präoperatives PSA, Gleason-Score, pT-Stadium, pN-Status und chirurgischer Rand signifikant und unabhängig mit dem BCR-freien Überleben (alle p < 0,05) (Tabelle 2). Wir konnten jedoch keinen Einfluss der Blutgruppe AB0 auf die BCR-Raten feststellen (Abbildung 1). Darüber hinaus untersuchten wir den prognostischen Wert der Blutgruppe 0 im Vergleich zu anderen Blutgruppen als 0 sowie innerhalb der alternativen Blutgruppen A/B/AB mit nicht signifikanten Ergebnissen (Tabelle 2). Selbst wenn eine Subanalyse nur mit Patienten mit positivem oder negativem Randstatus durchgeführt wurde, blieb der Einfluss von AB0/Rh auf die BCR unbedeutend (Abbildungen 2A und B). Darüber hinaus hatte auch der Rhesusfaktor-Status der Patienten keinen Einfluss auf das BCR-freie Überleben (p = 0,74).
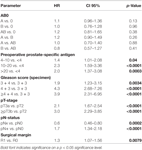
Table 2. Multivariable Cox-Regressionsmodelle von AB0 und Standardprognosefaktoren für das biochemische rezidivfreie Überleben.
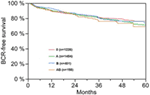
Abbildung 1. Biochemisches rezidivfreies Überleben (BCR) nach radikaler Prostatektomie stratifiziert nach AB0-Blutgruppen (p = 0,572).
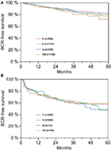
Abbildung 2. (A,B) Biochemisches Rezidiv (BCR)-freies Überleben nach radikaler Prostatektomie, stratifiziert nach AB0-Blutgruppen bei Patienten mit negativem und positivem chirurgischem Randstatus.
Diskussion
Mögliche Assoziationen zwischen der AB0-Blutgruppe und dem Risiko einiger epithelialer Malignome, einschließlich Bauchspeicheldrüsen-, Kolorektal- und Magenkrebs, sind häufig berichtet worden (19, 20). Darüber hinaus sind die AB0/Rh-Blutgruppen bei den meisten Patienten vor einem chirurgischen Eingriff verfügbar, so dass sie sich als idealer zusätzlicher Marker ohne zusätzliche Laborverarbeitungsschritte anbieten.
Vor einigen Jahrzehnten wiesen immunhistochemische Studien darauf hin, dass von Patienten stammende PCa-Zellen andere Muster der ABH-Expression aufweisen als normale/gutartige Prostatazellen (21). Da sowohl die AB0-Blutgruppe als auch ihre Antigenexpression im Gewebe mit der Inzidenz, dem Krankheitsverlauf und dem Ergebnis bei verschiedenen bösartigen Erkrankungen in Verbindung gebracht wurden (8, 22, 23), deutete diese veränderte Expression des ABH-Antigens im Prostatagewebe auf einen möglichen Einfluss der Blutgruppe auf die bösartige Transformation von Prostatazellen hin.
In einer kürzlich von Markt und Kollegen veröffentlichten Studie (14) wurde der Zusammenhang zwischen der AB0-Blutgruppe und dem Risiko, ein aggressives PCa zu entwickeln, analysiert. Die Autoren analysierten einen Datensatz von 2.774 Patienten mit aggressivem PCa und 4.443 Patienten ohne PCa als Kontrollen. Anhand dieser Daten konnte kein signifikanter Zusammenhang zwischen der AB0-Blutgruppe oder der „Dosis“ von A- oder B-Allelen und dem Risiko für aggressive PCa nachgewiesen werden. Die Autoren berichteten zwar auch über die krebsspezifische und die Gesamtsterblichkeit nach Blutgruppen, doch enthielt die Studie keine Informationen über die PCa-Behandlung. Außerdem wurden nur Patienten mit aggressiven Tumoren eingeschlossen, was den potenziellen Effekt der verschiedenen Blutgruppen überdecken könnte.
Diese Ergebnisse stehen im Einklang mit einer Studie von Kvist und Kollegen, die keinen Zusammenhang zwischen der Blutgruppe AB0 und dem Überleben von Patienten mit PCa, die mit Watchful Waiting behandelt wurden, nachweisen konnte. Diese Studie war vor allem durch die geringe Fallzahl (n = 279) begrenzt (12). Interessanterweise wurde in der einzigen Studie, die sich auf Patienten nach RP konzentrierte und 555 japanische Patienten umfasste, vor kurzem berichtet, dass die Blutgruppe 0 in einer multivariablen, aber nicht in einer univariablen Analyse signifikant mit einem geringeren BCR-Risiko nach RP verbunden war (13). In der Subanalyse von Patienten mit negativem Operationsrand war die 5-Jahres-BCR-freie Rate in der Blutgruppe 0 signifikant höher als in der Gruppe A (91,2 vs. 71,0%; p = 0,026). In dieser Studienkohorte hatten 46,3 % der Patienten einen positiven Randstatus, obwohl 74,2 % der Patienten ein klinisches Stadium von T1c aufwiesen. Das pathologische Stadium (pT) wurde nicht erwähnt.
Unsere retrospektive Kohorte von 3.574 Patienten mit klinisch lokalisiertem PCa ist die größte Kohorte, die bisher analysiert wurde, um einen möglichen Einfluss sowohl der AB0- als auch der Rh-Blutgruppe auf die Tumoreigenschaften und das Ergebnis nach RP zu ermitteln. In der vorliegenden Studie hatte die Mehrheit der Patienten pT2-Tumore (68,7 %) und 18,6 % hatten einen positiven Randstatus. Anhand dieser Daten konnten wir keinen signifikanten Einfluss der AB0/Rh-Blutgruppen auf die klinisch-pathologischen Merkmale (präoperatives PSA, Gleason-Score, Prostatavolumen, pT-Stadium, pN-Status und Operationsrand) und das BCR-freie Überleben nach kurativer RP nachweisen. Bei der Durchführung einer Subanalyse nur mit Patienten mit positivem oder negativem Randstatus blieb der Einfluss von AB0/Rh auf das BCR unbedeutend. Daher konnten wir die Ergebnisse der japanischen Studie nicht reproduzieren (13). Im Gegensatz zu anderen malignen Erkrankungen wie Bauchspeicheldrüsen- oder Blasenkrebs hat die AB0/Rh-Blutgruppe beim PCa keinen prognostischen Wert.
Es gibt mehrere wichtige Einschränkungen unserer Studie. An erster Stelle stehen die Einschränkungen, die mit retrospektiven Analysen verbunden sind, und das Fehlen einer Kontrollgruppe. Darüber hinaus enthält unsere Studienkohorte überwiegend lokalisierte PCa mit niedrigem bis mittlerem Risikoprofil (Gleason-Score 3 + 4 bei 66,9 %, präoperatives PSA von 4-10 ng/ml bei 63,3 %, pT2 bei 68,7 % und negative Ränder bei 81,3 % der Patienten), was eine Vorauswahl von Patienten mit günstiger Prognose ermöglicht. Darüber hinaus ist die Gesamtverteilung von AB – im Gegensatz zu den anderen Blutgruppen – im Allgemeinen niedrig (4,9 %). Einige Beobachtungen wie der mäßig erhöhte Anteil des negativen Rh-Faktors (21,8 %) bei Patienten mit AB im Vergleich zu den anderen Blutgruppen (16,9 %, p = 0,01) könnten möglicherweise durch die Seltenheit des Rh-negativen AB-Typs verstärkt werden, was einen statisch signifikanten Nachweis einer Korrelation innerhalb dieser Untergruppe verhindert. Schließlich fehlten Informationen über den Genotyp der jeweiligen Blutgruppe.
Zusätzlich zu den oben genannten Merkmalen dürfen bei der Erörterung von Korrelationen zwischen der AB0-Blutgruppe und Krebserkrankungen umweltbedingte, geografische und rassische Aspekte nicht außer Acht gelassen werden. Die rassischen und ethnischen Unterschiede bei den Blutgruppen und beim PCa sind bekannt (24, 25). In Europa, wo PCa die häufigste bösartige Erkrankung und die zweithäufigste krebsbedingte Todesursache bei Männern ist (1), sind die häufigsten Blutgruppen A und 0, die von West nach Ost zu Allel B ansteigen. Im Gegensatz dazu sind die asiatischen Länder mit der niedrigsten Inzidenz und dem niedrigsten Grad von PCa durch ein hohes Vorkommen von Typ B und eine relativ geringe Häufigkeit von 0 sowie eine kleinere Bevölkerung mit negativem Rh-Faktor gekennzeichnet (26). In dieser Hinsicht unterscheiden sich unsere Ergebnisse von der aktuellen Studie bei japanischen Patienten mit relativ hohem positivem Margenstatus und BCR nach kurativer RP (13).
Es wurden verschiedene Mechanismen vorgeschlagen, um zu erklären, wie die Blutgruppe die Krebsinzidenz und -progression beeinflusst; sie bleiben jedoch weiterhin unklar. Im Falle von Blasenkrebs wurde eine Chromosomenaberration vorgeschlagen, da das AB0-Gen auf Chromosom 9q34 liegt, einem Bereich, der bei Blasenkrebs häufig verändert ist (27). Da das AB0-Gen eigentlich für Glykosyltransferasen kodiert, die die Übertragung von Zuckern auf das H-Antigen (0) katalysieren, könnte das Auftreten von Blasenkrebs mit der Blutgruppe 0 korreliert sein. Im Gegensatz dazu wurde berichtet, dass Personen mit Nicht-0-Blutgruppen (A, AB und B) ein erhöhtes Risiko haben, an Magenkrebs zu erkranken, was auf eine krebsspezifische Rolle der Blutgruppe hinweist.
Beim PCa gibt es mehrere Bemühungen, die Rolle der Blutgruppe für das Überleben nach der Therapie zu klären. Es wurde bereits berichtet, dass Patienten mit einer Blutgruppe, die nicht 0 ist, nach einer RP ein erhöhtes Risiko für venöse Thromboembolien haben, was einen Einfluss auf das Ergebnis haben könnte (28). Auch eine kürzlich veröffentlichte Studie hat gezeigt, dass Serumantikörper gegen die Blutgruppe A das Überleben nach PROSTVAC-VF (einem therapeutischen Krebsimpfstoff auf Pockenvirenbasis, der sich in Phase III der klinischen Prüfung zur Behandlung des fortgeschrittenen PCa befindet) vorhersagen und als neuer potenziell prädiktiver Biomarker für PROSTVAC-VF in Betracht gezogen werden sollten (29). Obwohl wir in unserer Studie keine eindeutige Assoziation zwischen der AB0/Rh-Blutgruppe und der Tumorpathologie und dem Ergebnis beobachten konnten, deuten diese Hinweise dennoch auf eine prädiktive Rolle der Blutgruppe in der PCa-Epidemiologie und im klinischen Ergebnis hin, insbesondere im Hinblick auf das Ansprechen auf die Therapie.
Die vorliegende Studie mit 3.574 Patienten ist die bisher größte, die den Einfluss von AB0- oder Rhesus-Blutgruppen auf die Pathologie und das Ergebnis nach RP analysiert und fügt der Literatur wichtige Erkenntnisse hinzu.
Zusammenfassend deuten unsere Daten darauf hin, dass im Gegensatz zu mehreren anderen malignen Erkrankungen kein relevanter Zusammenhang zwischen der AB0/Rhesus-Blutgruppe und ungünstigen klinisch-pathologischen Tumormerkmalen oder dem onkologischen Ergebnis nach der Operation besteht. Dennoch sind weitere Untersuchungen angezeigt, um einen möglichen Zusammenhang zwischen dem Genotyp der Blutgruppe oder ihrer Antigenexpression auf PCa-Gewebe und der Prognose in verschiedenen Therapiegruppen, einschließlich hochgradiger oder fortgeschrittener PCa, die in unserer Studiengruppe nicht ausreichend vertreten waren, zu bewerten.
Informierte Zustimmung
Die informierte Zustimmung wurde von allen in die Studie einbezogenen Teilnehmern eingeholt.
Ethikerklärung
Alle Verfahren, die in Studien mit menschlichen Teilnehmern durchgeführt wurden, entsprachen den ethischen Standards der institutionellen und/oder nationalen Forschungskommission und der Deklaration von Helsinki von 1964 und ihren späteren Änderungen oder vergleichbaren ethischen Standards.
Beiträge der Autoren
SO, DT und TS: wesentliche Beiträge zur Konzeption oder Gestaltung der Arbeit, Entwurf der Arbeit, endgültige Genehmigung der zu veröffentlichenden Version. PM: Wesentliche Beiträge zur Konzeption oder zum Design der Arbeit, Entwurf der Arbeit, endgültige Genehmigung der zu veröffentlichenden Version. FC: Beschaffung, Analyse oder Interpretation von Daten für die Arbeit, kritische Überarbeitung für wichtige intellektuelle Inhalte, endgültige Genehmigung der zu veröffentlichenden Version. PT: Beschaffung, Analyse oder Interpretation von Daten für die Arbeit, kritische Überarbeitung für wichtige intellektuelle Inhalte, endgültige Genehmigung der zu veröffentlichenden Version. SP: Beschaffung, Analyse oder Interpretation der Daten für die Arbeit, kritische Überarbeitung für wichtige intellektuelle Inhalte, endgültige Genehmigung der zu veröffentlichenden Version. JLH, JH und MG: Beschaffung, Analyse oder Interpretation der Daten für die Arbeit, kritische Überarbeitung für wichtige intellektuelle Inhalte, endgültige Genehmigung der zu veröffentlichenden Version. Alle Autoren erklärten sich bereit, für alle Aspekte der Arbeit verantwortlich zu sein und sicherzustellen, dass Fragen im Zusammenhang mit der Genauigkeit oder Integrität eines Teils der Arbeit angemessen untersucht und gelöst werden.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Der bearbeitende Redakteur erklärte, dass er mit mehreren der Autoren (FC, SP, JH und DT) in Verbindung steht, jedoch nicht anderweitig zusammenarbeitet.
1. Siegel R, Ma J, Zou Z, Jemal A. Cancer Statistics, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Risk factors for prostate cancer. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Genetische Ätiologie des vererbbaren Prostatakrebses. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Reported family history of cancer in the prostate, lung, colorectal, and ovarian cancer screening trial. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impact of ABO blood type on outcomes in patients with primary nonmuscle invasive bladder cancer. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreatic cancer risk and ABO blood group alleles: results from the pancreatic cancer cohort consortium. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. The gene encoding the I blood group antigen: review of an I for an eye. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. Expression der Blutgruppenantigene A, B und H in Karzinomgewebe korreliert mit einer schlechten Prognose für Darmkrebspatienten. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO-Blutgruppe und Inzidenz von epithelialem Eierstockkrebs. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Prognostische Variablen bei Patienten mit Prostatakrebs: Einfluss von Blutgruppe ABO (H), Rhesus-System, Alter, Differenzierung, Tumorstadium und Metastasen. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associations between ABO blood groups and biochemical recurrence after radical prostatectomy. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO-Blutgruppenallele und Prostatakrebsrisiko: Ergebnisse aus dem Brust- und Prostatakrebs-Kohortenkonsortium (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) increases nerve-sparing frequency and reduces positive surgical margins in open and robot-assisted laparoscopic radical prostatectomy: experience after 11,069 consecutive patients. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Guidelines on Prostate Cancer 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blood group determinates incidence for pancreatic cancer in Germany. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO blood groups and cancer. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. Das ABO- und Lewis-Blutgruppensystem. Immunochemie, Genetik und Beziehung zu menschlichen Krankheiten. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Detection of blood group antigens in frozen sections of prostatic epithelium. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Expression von ABH/Lewis-verwandten Antigenen als prognostische Faktoren bei Patienten mit Brustkrebs. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. Das ABO-Blutgruppentranskript ist in menschlichen Blasentumoren und wachstumsstimulierten Urothelzelllinien herunterreguliert. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Comparative studies of prostate cancer in Japan versus the United States. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Model-based patterns in prostate cancer mortality worldwide. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. ABO- und Rh(D)-Phänotyp-Häufigkeiten verschiedener rassischer/ethnischer Gruppen in den Vereinigten Staaten. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Genotypische und phänotypische Charakterisierung der Histoblutgruppe ABO(H) in primären Blasentumoren. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Prostate cancer: non-O blood type is VTE risk factor after radical prostatectomy. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Serumantikörper gegen Blutgruppe A sagen das Überleben nach PROSTVAC-VF voraus. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar