- Einführung
- MS/DBB Cholinerge Neuronenaktivität und Acetylcholinfreisetzung im CA1 des Hippocampus
- Auswirkungen der Muscarinrezeptor-Aktivierung auf inhibitorische Interneuronen im Hippocampus CA1
- Aktivierung von Muscarin-Rezeptoren in CA1-Interneuronen des Hippocampus nach Acetylcholin-Freisetzung
- Auswirkungen der Aktivierung von Nikotinrezeptoren auf CA1-Interneuronen im Hippocampus
- Aktivierung von Nikotinrezeptoren in Interneuronen des Hippocampus CA1 nach Acetylcholinfreisetzung
- Auswirkungen der Acetylcholinfreisetzung auf die Funktion des CA1-Netzwerks im Hippocampus aus der Perspektive des Membranpotentials der Interneuronen
- Erklärung zu Interessenkonflikten
- Anerkennung
Einführung
Acetylcholin wird im gesamten Zentralnervensystem (ZNS) von Säugetieren freigesetzt, wo es sich auf die globale Gehirnfunktion auswirkt, indem es den Schlaf-Wach-Rhythmus, die Aufmerksamkeit und die Gedächtnisbildung beeinflusst. Eine Region des Gehirns, die stark von cholinergen Afferenzen aus dem medialen Septum und dem diagonalen Band des Broca-Komplexes (MS/DBB) innerviert wird, ist der Hippocampus (Dutar et al., 1995). Es wird angenommen, dass die Acetylcholinfreisetzung im Hippocampus in Abhängigkeit von der extrazellulären Acetylcholin-Konzentration zur Bildung oder zum Abruf von Erinnerungen beiträgt (Power et al., 2003; Hasselmo und Giocomo, 2006; Kenney und Gould, 2008; Deiana et al., 2011; Hasselmo und Sarter, 2011; Easton et al., 2012; Blake et al., 2014). Der Mechanismus, durch den cholinerge MS/DBB-Terminals die Funktion des Hippocampus-Netzwerks beeinflussen, erfolgt über die Aktivierung von Muscarin- und Nikotinrezeptoren, die sich auf Dendriten, Zellkörpern und Axonenden von Pyramidenneuronen und hemmenden Interneuronen sowie auf Astrozyten befinden (Cobb und Davies, 2005; Teles-Grilo Ruivo und Mellor, 2013). Obwohl Acetylcholin an mehreren Stellen auf verschiedene Zelltypen einwirkt, geht ein Teil seines Einflusses wahrscheinlich auf seine Auswirkungen auf die Funktion der Interneuronen zurück.
Inhibitorische Interneuronen spielen eine entscheidende Rolle bei der Informationsverarbeitung im Hippocampus. Interneuronen sind sehr vielfältig in ihrer anatomischen Struktur und vermuteten Funktion (Freund und Buzsaki, 1996; Klausberger und Somogyi, 2008). Je nach Subtyp des Interneurons und der Stelle, an der es die Pyramidenzelle innerviert, kann ein einzelnes Interneuron die Aktivität in einem Dendriten vollständig blockieren, die Phase der Abfeuerung des Aktionspotenzials am Soma verändern oder die Abfeuerung des Aktionspotenzials am Pyramidenzellkörper vollständig verhindern (Miles et al., 1996; Larkum et al., 1999). Auf der Netzwerkebene tragen Interneuronen zur Erzeugung synchroner Aktivität zwischen Populationen von Hauptneuronen mit einer Vielzahl von verhaltensrelevanten Frequenzen bei (Buzsaki, 2002; Buzsaki und Wang, 2012). Angesichts des bedeutenden Einflusses, den einzelne Interneuronen auf die Funktion des neuronalen Netzwerks haben, ist es wahrscheinlich, dass ein beträchtlicher Teil des Einflusses von Acetylcholin auf die Aktivität des Hippocampus durch die Modulation von Interneuronen entsteht. Obwohl gezeigt wurde, dass cholinerge Rezeptoren hemmende präsynaptische Terminals (Behrends und Ten Bruggencate, 1993; Tang et al., 2011) und die Erregbarkeit von Interneuronen beeinflussen (McQuiston und Madison, 1999b; Griguoli et al., 2009; Cea-Del Rio et al, 2010, 2011), beschränkt sich dieser Mini-Überblick auf neuere Studien, die die Wirkung der Acetylcholinfreisetzung auf Veränderungen des Interneuronen-Membranpotenzials, insbesondere in CA1 des Hippocampus, untersucht haben.
MS/DBB Cholinerge Neuronenaktivität und Acetylcholinfreisetzung im CA1 des Hippocampus
Die Auswirkungen der Acetylcholinfreisetzung im CA1 des Hippocampus und das Ausmaß, in dem verschiedene Interneuronen-Subtypen betroffen sind, hängen von der spezifischen Lage und Dichte der cholinergen Axonendigungen sowie dem inaktivierenden Enzym, der Acetylcholinesterase, ab. Es hat sich gezeigt, dass sowohl die cholinergen Fasern als auch die Acetylcholinesterase in den verschiedenen Schichten des Hippocampus CA1 unterschiedlich verteilt sind. Bei Mäusen waren die cholinergen Fasern gleichmäßig verteilt, mit Ausnahme von zwei Bändern mit höherer Dichte im Stratum pyamidale (SP) und an der Grenze zwischen dem Stratum radiatum (SR) und dem Stratum lacunosum-moleculare (SLM) (Aznavour et al., 2002). Bei der Ratte wurden ähnliche Banden mit höherer Dichte im SP und an der Grenze zwischen SR und SLM beobachtet. Im Vergleich zum Stratum oriens (SO) wurden jedoch geringere Dichten im SR und noch geringere Dichten im SLM festgestellt (SO > SR > SLM) (Aznavour et al., 2002). Die Verteilung der Acetylcholinesterase im CA1 des Hippocampus ist komplementär zu der des cholinergen Inputs, wobei höhere Dichten zwischen SP und SO sowie eine weitere Spitze im SLM nahe der Grenze zum SR beobachtet wurden (Storm-Mathisen, 1970). In Übereinstimmung mit diesen anatomischen Daten haben Messungen der erhöhten Acetylcholinfreisetzung während Theta-Rhythmen gezeigt, dass die Acetylcholin-Konzentrationen in der Nähe des Stratum pyramidale am höchsten waren (Zhang et al., 2010). Diese unterschiedliche Verteilung von cholinergen Fasern und extrazellulären Acetylcholinspiegeln ist besonders wichtig, wenn man bedenkt, dass nicht alle cholinergen Terminals im Hippocampus Acetylcholin synaptisch übertragen. Sowohl im Hippocampus als auch im Neokortex haben schätzungsweise 85-93 % der cholinergen Axonendigungen keine postsynaptische Spezialisierung, so dass man davon ausging, dass die Mehrheit der cholinergen Endigungen Acetylcholin durch Volumen oder nicht-synaptische Übertragung überträgt (Umbriaco et al., 1994, 1995). Andere Gruppen haben jedoch geschätzt, dass die Mehrheit der cholinergen Terminals (66-67 %) im Neokortex klassische synaptische Verbindungen herstellen (Smiley et al., 1997; Turrini et al., 2001). Ungeachtet dieser Diskrepanz scheint ein erheblicher Teil der Terminals Acetylcholin auf parakrine Weise in den extrazellulären Raum abzugeben. Dies setzt voraus, dass das endständig freigesetzte Acetylcholin über weite Strecken an der Acetylcholinesterase vorbeidiffundiert, um an Rezeptoren auf postsynaptischen Elementen zu binden. Daher können Regionen oder Schichten mit einer günstigen Dichte an cholinergen Terminals (höher) und/oder Acetylcholinesterase (niedriger) zu größeren extrazellulären Acetylcholinkonzentrationen führen, die bei der Übertragung von Acetylcholin durch Volumenübertragung effektiver sein können. Darüber hinaus ist es möglich, dass es eine Untergruppe von Terminals gibt, die aktiver sind, eine höhere Freisetzungswahrscheinlichkeit haben oder mehr Neurotransmitter freisetzen können. Diese Terminals sind möglicherweise effektiver bei der Vermittlung der Volumenübertragung und der Beeinflussung nahe gelegener hemmender Interneuronen.
Die Freisetzung von Acetylcholin aus cholinergen Terminals hängt von der Aktivität der cholinergen Neuronen im MS/DBB ab. Die Feuermuster der cholinergen Neuronen in MS/DBB, über die in der Literatur berichtet wird, weisen jedoch eine gewisse Variabilität auf (Barrenechea et al., 1995; Brazhnik und Fox, 1997, 1999; Simon et al., 2006). Eine kleine Anzahl anatomisch identifizierter cholinerger MS/DBB-Neuronen, die in wachen, gefesselten Nagetieren aufgezeichnet wurden, weisen geringe unregelmäßige Feuerungsraten auf (<2 Hz) (Simon et al., 2006). Im Gegensatz dazu wurde berichtet, dass anatomisch nicht identifizierte Neuronen mit Aktionspotenzial-Wellenformen, die mit cholinergen MS/DBB-Neuronen übereinstimmen, mit Raten von bis zu 30 Hz feuern (Brazhnik und Fox, 1999). Daher bleibt unklar, welche Frequenzen die Feuermuster der cholinergen Neuronen in der MS/DBB am besten beschreiben oder ob sie in ein breites Kontinuum fallen. Dennoch könnten potenzielle Unterschiede in der Feuerungsfrequenz oder der Aktivitätsdauer cholinerger Neuronen durch lokale Unterschiede in der Acetylcholin-Konzentration variable Auswirkungen auf verschiedene Interneuron-Subtypen haben.
Auswirkungen der Muscarinrezeptor-Aktivierung auf inhibitorische Interneuronen im Hippocampus CA1
Die Unterbrechung der cholinergen Funktion von MS/DBB durch systemische Blockade von Muscarinrezeptoren oder direkte Injektion von Muscarinrezeptor-Antagonisten in den Hippocampus kann das Gedächtnis und die Codierung räumlicher Informationen beeinträchtigen (Blokland et al., 1992; Atri et al., 2004; Hasselmo, 2006). Eine mögliche Rolle der inhibitorischen Interneuronen bei der Modulation der Hippocampusfunktion durch Muskarinrezeptoren basierte zunächst auf der Beobachtung, dass die exogene Verabreichung von cholinergen Agonisten zu einem Anstieg der spontanen inhibitorischen postsynaptischen Ströme (sIPSCs) in CA1-Pyramidenneuronen führte (Pitler und Alger, 1992). Diese Daten deuteten indirekt darauf hin, dass eine Untergruppe von inhibitorischen Interneuronen durch die Aktivierung von Muscarinrezeptoren depolarisiert werden kann, und wurden später durch direkte Ableitungen bestätigt (Parra et al., 1998; McQuiston und Madison, 1999a). Allerdings reagierten nicht alle Interneuronen auf die Aktivierung von Muskarinrezeptoren mit einer Depolarisation. Einige Interneuronen waren hyperpolarisiert oder zeigten biphasische Reaktionen, und einige reagierten nicht auf die exogene Gabe von Muscarin-Agonisten (Parra et al., 1998; McQuiston und Madison, 1999a). Außerdem konnte nicht jeder Muscarin-Antworttyp mit einem morphologischen Subtyp des Interneurons korreliert werden. Diese Ergebnisse wurden zusätzlich durch die Beobachtung erschwert, dass Muscarinrezeptoren die Freisetzung von GABA aus einer Untergruppe von perisomatischen inhibitorischen Interneuronen hemmen können (Behrends und Ten Bruggencate, 1993; Fukudome et al., 2004; Szabo et al., 2010) und dass die Aktivierung von Muscarinrezeptoren die Erregbarkeit von Interneuronen durch die Erzeugung von Nachdepolarisationen erhöhen kann (McQuiston und Madison, 1999b; Lawrence et al., 2006). Die Auswirkungen der Acetylcholinfreisetzung auf die Interneuronenpopulation sind also komplex und führen zur Rekrutierung einiger Interneuronen, während andere gehemmt werden.
Aktivierung von Muscarin-Rezeptoren in CA1-Interneuronen des Hippocampus nach Acetylcholin-Freisetzung
Obwohl cholinerge muscarinische synaptische Reaktionen erstmals 1983 in CA1-Pyramidalneuronen gemessen wurden (Cole und Nicoll, 1983), wurden erst 2006 muscarinische Reaktionen auf elektrisch evozierte Acetylcholin-Freisetzung in inhibitorischen Interneuronen des Hippocampus CA1 gemessen (Widmer et al., 2006). Diese Studie zeigte, dass terminal freigesetztes Acetylcholin unterschiedliche Auswirkungen auf verschiedene Interneuron-Subtypen hatte. Interneuronen konnten mit Depolarisation, Hyperpolarisation oder mit biphasischen Reaktionen reagieren. Insgesamt führte die Mehrheit der antwortenden Interneuronen zu Depolarisationen (64 %), während Hyperpolarisationen nur selten beobachtet wurden (13 %) (Widmer et al., 2006). Wie in früheren Studien, in denen exogene Muscarin-Agonisten eingesetzt wurden (Parra et al., 1998; McQuiston und Madison, 1999a), konnten die verschiedenen elektrisch evozierten Muscarin-Antworttypen nicht mit spezifischen anatomischen Subtypen von Interneuronen korreliert werden (Widmer et al., 2006). Diese Ergebnisse wurden kürzlich durch optogenetische Studien bestätigt, bei denen die evozierte Freisetzung als Reaktion auf Lichtaktivierung untersucht wurde (Nagode et al., 2011; Bell et al., 2013). In einer dieser optogenetischen Studien waren die Interneuronen, die mit biphasischen (25 %), hyperpolarisierenden (35 %) und depolarisierenden (40 %) muskarinischen Reaktionen reagierten, jedoch gleichmäßiger auf die verschiedenen Reaktionstypen verteilt (Bell et al., 2013). Wichtig ist, dass optogenetisch freigesetztes Acetylcholin überwiegend muskarinische Antworten (80 %) im Vergleich zu nikotinischen Antworten (17 %) hervorrief. Die verbleibenden 3 % der antwortenden Interneuronen zeigten sowohl muskarinische als auch nikotinische Antworten. Außerdem wurden die Muscarin-Hyperpolarisationen durch die Aktivierung von M4-Rezeptoren vermittelt, während die Depolarisationen wahrscheinlich durch die Aktivierung von M3-Rezeptoren verursacht wurden (Bell et al., 2013). Ähnlich wie bei den Studien zur elektrischen Stimulation konnte die Art der muskarinischen Reaktion nicht mit den anatomischen Subtypen der Interneuronen korreliert werden. Wichtig ist, dass beide Studien zeigten, dass perisomatisch projizierende Interneuronen (wahrscheinlich Parvalbumin-exprimierende Korbzellen) auf die Freisetzung von Acetylcholin mit einem der drei Muscarin-Reaktionstypen reagieren können (Widmer et al., 2006; Bell et al., 2013). In verschiedenen optogenetischen Studien wurde das Membranpotenzial von CA1-Interneuronen indirekt durch Messung der sIPSC-Frequenz in CA1-Pyramidenneuronen ermittelt (Nagode et al., 2011, 2014). Optogenetisch freigesetztes Acetylcholin führte zu einem Anstieg der sIPSCs mit großer Amplitude und Frequenzen, die in die Theta-Bandbreite (4-12 Hz) fielen (Nagode et al., 2011). Wichtig ist, dass dieser Anstieg der sIPSCs durch Endocannabinoide gehemmt werden konnte, was darauf hindeutet, dass sie auf die Aktivierung von Cholecystokinin-positiven Interneuronen zurückzuführen sind (Nagode et al., 2011). Darüber hinaus wurden die sIPSCs durch die optogenetische Unterdrückung von Parvalbumin-positiven Zellen nicht beeinflusst, was darauf hindeutet, dass sie nicht durch die Aktivierung von Parvalbumin-Korbzellen, axo-axonischen, bistratifizierten oder oriens-lacunosum-moleculare Interneuronen entstanden sind (Nagode et al., 2014). Diese Ergebnisse stimmen mit Studien zur synaptischen Stimulation überein, die von einem Interneuron mit Cholecystokinin-Korbzellenmorphologie aufgezeichnet wurden, das eine biphasische Reaktion auf die Freisetzung von Acetylcholin zeigte (Widmer et al., 2006). Daher haben endogen aktivierte Muscarinrezeptoren auf CA1-Interneuronen im Hippocampus allein aufgrund der Auswirkungen auf das Membranpotenzial komplexe Auswirkungen auf die Netzwerkfunktion (siehe Tabelle 1).
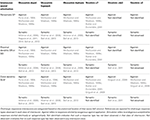
Tabelle 1. Cholinerge Antworten variieren in ähnlichen und unterschiedlichen anatomischen Interneuron-Subtypen.
Obwohl verschiedene muskarinerge Antworttypen fast einheitlich in CA1-Interneuronen beobachtet wurden, ließen sich nicht alle Antworttypen so leicht durch optogenetische Stimulation hervorrufen (Bell et al., 2013). In Übereinstimmung mit einigen In-vivo-Aufzeichnungen (Brazhnik und Fox, 1999) konnte Acetylcholin, das von cholinergen MS/DBB-Terminals durch blaue Lichtblitze mit einer Frequenz von 20 Hz freigesetzt wurde, jeden Reaktionstyp in CA1-Interneuronen des Hippocampus hervorrufen (Bell et al., 2013). Die Anzahl der Blitze beeinflusste jedoch die Wahrscheinlichkeit, einen bestimmten Reaktionstyp zu beobachten. Bei hyperpolarisierenden Interneuronen reichten 10 Blitze aus (91 % der hyperpolarisierenden Interneuronen), um eine Reaktion zu beobachten. Im Gegensatz dazu reichten 10 Blitze nicht aus, um bei der Mehrheit der depolarisierenden Interneuronen (58 %) eine Reaktion zu erzeugen. Ebenso konnte die depolarisierende Phase bei der Mehrheit der biphasischen Interneuronen (55 %) nicht beobachtet werden, wenn nur 10 Reize abgegeben wurden. Daher erfordern muskarinische Hyperpolarisationen möglicherweise eine geringere präsynaptische cholinerge MS/DBB-Aktivität im Vergleich zu depolarisierenden Reaktionen in CA1-Interneuronen des Hippocampus. Es könnte sein, dass die Unterdrückung der Interneuronen-Erregbarkeit der vorherrschende Effekt als Reaktion auf geringe MS/DBB-cholinerge Aktivität ist.
Auswirkungen der Aktivierung von Nikotinrezeptoren auf CA1-Interneuronen im Hippocampus
Die Aktivierung von Nikotinrezeptoren im Hippocampus hat einen bedeutenden Einfluss auf die physiologische und pathophysiologische Gedächtnisbildung (Levin, 2002; Levin et al., 2002, 2009; Buccafusco et al., 2005; Davis und Gould, 2006, 2009; Nott und Levin, 2006; Davis et al., 2007). Von den 11 verschiedenen Nikotinrezeptor-Untereinheiten, die im ZNS von Säugetieren vorkommen, wurden 9 in CA1-Neuronen des Hippocampus nachgewiesen (Sudweeks und Yakel, 2000). Durch exogene Applikation von Nikotin-Agonisten konnten funktionelle Nikotin-Rezeptoren, die α7 enthalten (Alkondon et al., 1997; Jones und Yakel, 1997; Frazier et al, 1998b; McQuiston und Madison, 1999c), α4β2 (McQuiston und Madison, 1999c; Sudweeks und Yakel, 2000) oder α2-Untereinheiten (McQuiston und Madison, 1999c; Sudweeks und Yakel, 2000; Jia et al., 2009) enthalten, wurden in CA1-Interneuronen des Hippocampus beobachtet. Obwohl die Interneuronen des Hippocampus offenbar eine Vielzahl von Nikotinrezeptor-Subtypen exprimieren, wurden α7-Rezeptoren häufiger beobachtet und erzeugten größere Reaktionen (McQuiston und Madison, 1999c; Sudweeks und Yakel, 2000). In der Tat werden α7-Nikotinrezeptoren im Hippocampus mit der Gedächtnisbildung in Verbindung gebracht (Levin, 2002; Levin et al., 2002; Nott und Levin, 2006), und ihre Fehlfunktion könnte bei einigen Formen der Schizophrenie eine Rolle spielen (Freedman et al., 1994; Leonard et al., 1996; Adler et al., 1998). Trotz ihrer geringeren Expression wurde jedoch berichtet, dass die α4β2 enthaltenden Nikotinrezeptoren eine wichtige Rolle bei der Gedächtnisbildung (Davis und Gould, 2006; Davis et al., 2007) und bei der hippocampusabhängigen Nikotinsucht (Perry et al., 1999; Davis und Gould, 2009). α4β2-Rezeptoren wurden auch mit kognitiven Defiziten im Zusammenhang mit dem Altern und der Alzheimer-Krankheit in Verbindung gebracht (Kellar et al., 1987; Wu et al., 2004; Gahring et al., 2005). Um die Rolle, die die verschiedenen Nikotin-Untereinheiten im Hippocampus spielen, vollständig zu verstehen, hat man begonnen, die Wirkung von endogen freigesetztem Acetylcholin auf einzelne Hippocampuszellen und das Hippocampus-Netzwerk zu untersuchen.
Aktivierung von Nikotinrezeptoren in Interneuronen des Hippocampus CA1 nach Acetylcholinfreisetzung
Acetylcholinfreisetzung aus cholinergen MS/DBB-Terminals im Hippocampus CA1 aktiviert nachweislich Nikotinrezeptoren auf Interneuronen (Alkondon et al., 1998; Frazier et al., 1998a; Stone, 2007). Nikotinische exzitatorische postsynaptische Ströme (EPSCs) wurden zum ersten Mal mit Hilfe elektrischer Stimulation und Ganzzell-Patch-Clamping in akuten Rattenhirnschnitten beobachtet. Diese nikotinischen EPSCs hatten eine schnelle Kinetik und wurden durch α7-Nikotinrezeptor-Antagonisten blockiert (Alkondon et al., 1998; Frazier et al., 1998a), was mit Studien übereinstimmt, in denen Nikotinrezeptor-Agonisten direkt auf Interneuron-Zellkörper appliziert wurden (Alkondon et al., 1997; Jones und Yakel, 1997; Frazier et al., 1998b; McQuiston und Madison, 1999c). Neuere optogenetische Studien an Gehirnschnitten von Mäusen konnten diese früheren Beobachtungen jedoch nicht reproduzieren (Bell et al., 2011). Stattdessen aktivierte optogenetisch freigesetztes Acetylcholin in erster Linie nikotinische Rezeptoren, die α4β2-Untereinheiten enthielten. Außerdem waren die α4β2-Reaktionen meist unterschwellig und hatten eine sehr langsame Kinetik. Diese Daten deuten darauf hin, dass Acetylcholin über eine beträchtliche Distanz diffundiert, bevor es sich an die α4β2 enthaltenden Nikotinrezeptoren bindet (McQuiston und Madison, 1999c; Bennett et al., 2012), was mit einer voluminösen oder nicht-synaptischen Übertragung übereinstimmt (Vizi et al., 2010). Obwohl sich diese kleinen nikotinischen Antworten zeitlich summieren konnten, war ihre Fähigkeit, Interneuronen zu erregen, durch die präsynaptische Muskarinhemmung begrenzt. Da die nikotinischen Antworten meist unterschwellig waren, könnte die nikotinische Übertragung auf CA1-Interneuronen in erster Linie modulatorischer Natur sein. In den optogenetischen Studien wurden die nicotinischen Antworten auch mit Hilfe der Bildgebung mit spannungsempfindlichem Farbstoff (VSD) untersucht. Die nikotinischen VSD-Signale wurden durch den α4β2-Rezeptor-Antagonisten DHβE vollständig blockiert, und es wurde festgestellt, dass sie in der distalen dendritischen Region der CA1-Pyramidalneuronen, die sich mit den Eingängen aus dem entorhinalen Kortex und dem Nucleus reuniens des Thalamus überschneidet, signifikant größer sind (Bell et al., 2011). Da die VSD alle Elemente des Gewebes färbt, deuten die VSD-Daten darauf hin, dass α4β2 enthaltende nikotinische Rezeptoren der am weitesten verbreitete Rezeptor sind, der depolarisierende nikotinische Reaktionen im CA1 des Maus-Hippocampus vermittelt. Bemerkenswert ist, dass nikotinische Reaktionen durch einen einzigen Lichtblitz ausgelöst werden können (Bell et al., 2011), was darauf hindeutet, dass die Freisetzung von Acetylcholin aus cholinergen MS/DBB-Terminals dazu beitragen kann, Interneuronen über die Aktivierung von Nikotinrezeptoren zu rekrutieren, bevor sie durch die Aktivierung von Muscarinrezeptoren beeinflusst werden.
Auswirkungen der Acetylcholinfreisetzung auf die Funktion des CA1-Netzwerks im Hippocampus aus der Perspektive des Membranpotentials der Interneuronen
Da die Membranpotentiale der inhibitorischen Interneuronen des CA1 nach der Acetylcholinfreisetzung sowohl durch die Aktivierung von Muscarin- als auch von Nikotinrezeptoren unterschiedlich moduliert werden können, sind die daraus resultierenden Auswirkungen auf die Netzwerkfunktion zweifellos komplex. Die Aktivierung von Muscarinrezeptoren kann zu unterschiedlichen und gegensätzlichen Effekten führen, sogar innerhalb desselben Interneurons (siehe Tabelle 1). Leider ist unser Verständnis darüber, wie die einzelnen Subtypen von Interneuronen durch die Aktivierung von Muscarin- oder Nikotinrezeptoren beeinflusst werden können, noch unvollständig. Nichtsdestotrotz variierte die Anzahl der Stimuli, die erforderlich sind, um jede Art von Reaktion hervorzurufen, in konsistenter Weise. Nikotinische Reaktionen wurden am leichtesten hervorgerufen, wobei die geringste Anzahl von Reizen erforderlich war (Bell et al., 2011), während depolarisierende muskarinische Reaktionen am schwierigsten zu erzeugen waren und die größte Anzahl von Reizen erforderten (Bell et al., 2013). Daher kann die Hypothese aufgestellt werden, dass niedrige Niveaus der MS/DBB cholinergen Neuronenaktivität und niedrigere Konzentrationen von extrazellulärem Acetylcholin die Aktivierung nikotinischer Rezeptoren oder eine muskarinische Hyperpolarisation in spezifischen Untergruppen von CA1-Interneuronen begünstigen.
Da die muskarinische Hyperpolarisation von CA1-Interneuronen eine geringere präsynaptische cholinerge Aktivität erfordert, könnte die Enthemmung (indirekte Aktivierung) von CA1-Pyramidenzellen im Hippocampus bei geringer cholinerger MS/DBB-Aktivität begünstigt werden (Abbildung 1B). Wenn man davon ausgeht, dass nikotinische Reaktionen bevorzugt Interneuronen betreffen, die selektiv andere Interneuronen hemmen (Interneuron-selektiv oder IS), kann die Aktivierung des nikotinischen Rezeptors auch zur Enthemmung von CA1-Pyramidenzellen führen (Abbildung 1A). Zusammengenommen würden niedrige Niveaus der cholinergen MS/DBB-Aktivität eine Netto-Enthemmung von CA1 im Hippocampus begünstigen, was eine höhere Wahrscheinlichkeit des Outputs von CA1-Pyramidenneuronen ermöglicht. Ein erhöhter Output von CA1 könnte zu einer Erleichterung des Abrufs und der Gedächtniskonsolidierung in anderen Bereichen des ZNS führen, wie es vermutlich während des Slow-Wave-Schlafs geschieht (Gais und Born, 2004; Hasselmo und McGaughy, 2004). Im Gegensatz dazu rekrutiert eine höhere Aktivität der cholinergen MS/DBB-Neuronen in Verbindung mit höheren extrazellulären Acetylcholin-Konzentrationen verschiedene Untergruppen von Interneuronen, die mit muskarinischen Depolarisationen reagieren. Einige dieser depolarisierenden Interneuronen können eine rhythmische Hemmung von CA1-Pyramidalneuronen bei Theta-Frequenzen bewirken (Nagode et al., 2011, 2014), ein Netzwerkrhythmus, der bei höheren Acetylcholinfreisetzungen beobachtet wird (Zhang et al., 2010). Dies würde zu einer (teilweise rhythmischen) Hemmung der Leistung der CA1-Pyramidenzellen im Hippocampus führen und gleichzeitig die synaptische Integration in den Dendriten der CA1-Pyramidenzellen im Hippocampus durch cholinerge Wirkungen auf glutamaterge Rezeptoren und dendritische Funktionen erleichtern (Abbildung 1C) (Tsubokawa und Ross, 1997; Tsubokawa, 2000; Fernandez De Sevilla und Buno, 2010; Giessel und Sabatini, 2010). Eine solche dynamische Rolle der Acetylcholin-Konzentrationen beim Lernen und bei der Gedächtnisbildung wurde bereits früher vorgeschlagen (Hasselmo, 2006; Hasselmo und Giocomo, 2006; Giocomo und Hasselmo, 2007; Hasselmo und Sarter, 2011). In diesem Schema ermöglichen niedrigere Acetylcholinkonzentrationen, dass intrahippocampale (Schaffer-Kollaterale) synaptische Interaktionen dominieren, wodurch der Output im CA1 des Hippocampus und der Gedächtnisabruf erhöht werden, während höhere Acetylcholinkonzentrationen die Verarbeitung von Inputs von außerhalb des Hippocampus begünstigen und die vorübergehende Bildung von Erinnerungen im CA1 des Hippocampus ermöglichen. Daher kann die kombinierte Wirkung der Acetylcholinfreisetzung auf glutamaterge Eingänge und die Funktion der Interneuronen eine wichtige Rolle bei der Abstimmung des CA1-Netzwerks im Hippocampus für den Abruf oder die Bildung neuer Erinnerungen spielen.

Abbildung 1. Hypothese, dass cholinerge MS/DBB-Eingänge in Abhängigkeit von der Aktivität cholinerger Neuronen Interneuron-Netzwerke im CA1 des Hippocampus entweder unterdrücken oder aktivieren. (A) Niedrige Werte der cholinergen MS/DBB-Aktivität aktivieren bevorzugt Untergruppen von Interneuronen durch die Aktivierung von Nikotinrezeptoren. Wir gehen davon aus, dass nikotingesteuerte Interneuronen selektive Interneuronen (IS, gelbe Aktivierung) sind, die andere Interneuronen (blau) spezifisch hemmen. Eine Erhöhung ihrer Aktivität führt zu einer Enthemmung von Pyramidenneuronen (P, gelbe Aktivierung, und erhöhte Leistung). (B) Eine geringe cholinerge MS/DBB-Aktivität hyperpolarisiert auch Untergruppen von Interneuronen durch die Aktivierung von Muscarinrezeptoren (I, blaue Unterdrückung), was zu einer Enthemmung von Pyramidenneuronen führt (P, gelbe Aktivierung und erhöhte Leistung). (C) Zunehmende cholinerge Neuronenaktivität bewirkt, dass Untergruppen von Interneuronen durch Muscarinrezeptoraktivierung depolarisiert werden (I, Rot-Aktivierung und erhöhte synaptische Hemmung), was zur Unterdrückung von Pyramidenneuronen führt (P, blau-unterdrückter Output).
Erklärung zu Interessenkonflikten
Der Autor erklärt, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Anerkennung
Diese Arbeit wurde durch Zuschüsse des NIMH/NIH 5R01MH094626 und 1R21MH103695 unterstützt.
Adler, L. E., Olincy, A., Waldo, M., Harris, J. G., Griffith, J., Stevens, K., et al. (1998). Schizophrenie, sensorisches Gating und nikotinische Rezeptoren. Schizophr. Bull. 24, 189-202. doi: 10.1093/oxfordjournals.schbul.a033320
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alkondon, M., Pereira, E. F., and Albuquerque, E. X. (1998). alpha-Bungarotoxin- und Methyllycaconitin-empfindliche nikotinische Rezeptoren vermitteln die schnelle synaptische Übertragung in Interneuronen von Ratten-Hippocampusscheiben. Brain Res. 810, 257-263. doi: 10.1016/S0006-8993(98)00880-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alkondon, M., Pereira, E. F., Barbosa, C. T., and Albuquerque, E. X. (1997). Neuronale nikotinische Acetylcholinrezeptoraktivierung moduliert die Freisetzung von Gamma-Aminobuttersäure aus CA1-Neuronen von Ratten-Hippocampusscheiben. J. Pharmacol. Exp. Ther. 283, 1396-1411.
Pubmed Abstract | Pubmed Full Text
Atri, A., Sherman, S., Norman, K. A., Kirchhoff, B. A., Nicolas, M. M., Greicius, M. D., et al. (2004). Die Blockade zentraler cholinerger Rezeptoren beeinträchtigt das Neulernen und erhöht die proaktive Interferenz in einer Wortpaar-Gedächtnisaufgabe. Behav. Neurosci. 118, 223-236. doi: 10.1037/0735-7044.118.1.223
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Aznavour, N., Mechawar, N., and Descarries, L. (2002). Vergleichende Analyse der cholinergen Innervation im dorsalen Hippocampus von erwachsenen Mäusen und Ratten: eine quantitative immunzytochemische Studie. Hippocampus 12, 206-217. doi: 10.1002/hipo.1108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barrenechea, C., Pedemonte, M., Nunez, A., and Garcia-Austt, E. (1995). In vivo intrazelluläre Aufzeichnungen der medialen septalen und diagonalen Bande der Broca-Neuronen: Beziehungen zum Theta-Rhythmus. Exp. Brain Res. 103, 31-40. doi: 10.1007/BF00241962
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Behrends, J. C., und Ten Bruggencate, G. (1993). Cholinerge Modulation der synaptischen Hemmung im Meerschweinchen-Hippocampus in vitro: Erregung von GABAergen Interneuronen und Hemmung der GABA-Freisetzung. J. Neurophysiol. 69, 626-629.
Pubmed Abstract | Pubmed Full Text
Bell, K. A., Shim, H., Chen, C. K., and McQuiston, A. R. (2011). Nikotinische exzitatorische postsynaptische Potenziale in CA1-Interneuronen des Hippocampus werden vorwiegend durch nikotinische Rezeptoren vermittelt, die alpha4- und beta2-Untereinheiten enthalten. Neuropharmacology 61, 1379-1388. doi: 10.1016/j.neuropharm.2011.08.024
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bell, L. A., Bell, K. A., and McQuiston, A. R. (2013). Synaptische Muscarin-Reaktionstypen in CA1-Interneuronen des Hippocampus hängen von verschiedenen Niveaus präsynaptischer Aktivität und verschiedenen Muscarin-Rezeptor-Subtypen ab. Neuropharmacology 73, 160-173. doi: 10.1016/j.neuropharm.2013.05.026
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bennett, C., Arroyo, S., Berns, D., and Hestrin, S. (2012). Mechanismen, die nikotinische Zweikomponenten-EPSCs in kortikalen Interneuronen erzeugen. J. Neurosci. 32, 17287-17296. doi: 10.1523/JNEUROSCI.3565-12.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Blake, M. G., Krawczyk, M. C., Baratti, C. M., and Boccia, M. M. (2014). Neuropharmakologie der Gedächtniskonsolidierung und Rekonsolidierung: Erkenntnisse über zentrale cholinerge Mechanismen. J. Physiol. Paris. doi: 10.1016/j.jphysparis.2014.04.005.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Blokland, A., Honig, W., and Raaijmakers, W. G. (1992). Auswirkungen von intra-hippocampalen Scopolamin-Injektionen bei einer wiederholten räumlichen Aufnahmeaufgabe bei der Ratte. Psychopharmacology (Berl). 109, 373-376. doi: 10.1007/BF02245886
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brazhnik, E. S., and Fox, S. E. (1997). Intrazelluläre Aufzeichnungen von medialen septalen Neuronen während des Theta-Rhythmus im Hippocampus. Exp. Brain Res. 114, 442-453. doi: 10.1007/PL00005653
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brazhnik, E. S., and Fox, S. E. (1999). Aktionspotentiale und Beziehungen zum Theta-Rhythmus medialer septaler Neuronen in vivo. Exp. Brain Res. 127, 244-258. doi: 10.1007/s002210050794
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Buccafusco, J. J., Letchworth, S. R., Bencherif, M., und Lippiello, P. M. (2005). Lang anhaltende kognitive Verbesserung mit Nikotinrezeptor-Agonisten: Mechanismen der pharmakokinetisch-pharmakodynamischen Diskordanz. Trends Pharmacol. Sci. 26, 352-360. doi: 10.1016/j.tips.2005.05.007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Buhler, A. V., und Dunwiddie, T. V. (2001). Regulation der Aktivität von hippocampalen Stratum-oriens-Interneuronen durch Alpha7-Nicotin-Acetylcholin-Rezeptoren. Neuroscience 106, 55-67. doi: 10.1016/S0306-4522(01)00257-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Buzsaki, G. (2002). Theta-Oszillationen im Hippocampus. Neuron 33, 325-340. doi: 10.1016/S0896-6273(02)00586-X
CrossRef Full Text
Buzsaki, G., and Wang, X. J. (2012). Mechanisms of gamma oscillations. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cea-Del Rio, C. A., Lawrence, J. J., Erdelyi, F., Szabo, G., und McBain, C. J. (2011). Cholinerge Modulation verstärkt die intrinsischen oszillatorischen Eigenschaften von Cholecystokinin-positiven Interneuronen im CA1-Hippocampus. J. Physiol. 589, 609-627. doi: 10.1113/jphysiol.2010.199422
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cea-Del Rio, C. A., Lawrence, J. J., Tricoire, L., Erdelyi, F., Szabo, G., and McBain, C. J. (2010). Die Expression des muscarinischen Acetylcholinrezeptors M3 verleiht neurochemisch unterschiedlichen Subtypen von Korbzellen im Hippocampus eine unterschiedliche cholinerge Modulation. J. Neurosci. 30, 6011-6024. doi: 10.1523/JNEUROSCI.5040-09.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cobb, S. R., and Davies, C. H. (2005). Cholinerge Modulation von Zellen und Schaltkreisen im Hippocampus. J. Physiol. 562, 81-88. doi: 10.1113/jphysiol.2004.076539
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cole, A. E., and Nicoll, R. A. (1983). Acetylcholin vermittelt ein langsames synaptisches Potential in pyramidalen Zellen des Hippocampus. Science 221, 1299-1301. doi: 10.1126/science.6612345
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davis, J. A., und Gould, T. J. (2006). Die Auswirkungen von DHBE und MLA auf die nikotininduzierte Verstärkung der kontextuellen Angstkonditionierung bei C57BL/6-Mäusen. Psychopharmacology (Berl). 184, 345-352. doi: 10.1007/s00213-005-0047-y
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davis, J. A., and Gould, T. J. (2009). Hippocampale nAChRs vermitteln nikotinentzugsbedingte Lerndefizite. Eur. Neuropsychopharmacol. 19, 551-561. doi: 10.1016/j.euroneuro.2009.02.003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davis, J. A., Kenney, J. W., and Gould, T. J. (2007). Beteiligung des nikotinischen Acetylcholinrezeptors alpha4beta2 im Hippocampus an der verstärkenden Wirkung von akutem Nikotin auf die kontextuelle Angstkonditionierung. J. Neurosci. 27, 10870-10877. doi: 10.1523/JNEUROSCI.3242-07.2007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Deiana, S., Platt, B., and Riedel, G. (2011). Das cholinerge System und räumliches Lernen. Behav. Brain Res. 221, 389-411. doi: 10.1016/j.bbr.2010.11.036
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dutar, P., Bassant, M. H., Senut, M. C., and Lamour, Y. (1995). Die septohippocampale Bahn: Struktur und Funktion eines zentralen cholinergen Systems. Physiol. Rev. 75, 393-427.
Pubmed Abstract | Pubmed Full Text
Easton, A., Douchamps, V., Eacott, M., and Lever, C. (2012). Eine spezifische Rolle für septohippocampales Acetylcholin im Gedächtnis? Neuropsychologia 50, 3156-3168. doi: 10.1016/j.neuropsychologia.2012.07.022
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fernandez De Sevilla, D., and Buno, W. (2010). Die muskarinische Langzeitverstärkung der NMDA- und AMPA-Rezeptor-vermittelten Übertragung an Schaffer-Kollateralsynapsen entsteht durch unterschiedliche intrazelluläre Mechanismen. J. Neurosci. 30, 11032-11042. doi: 10.1523/JNEUROSCI.1848-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Frazier, C. J., Buhler, A. V., Weiner, J. L., and Dunwiddie, T. V. (1998a). Synaptische Potentiale, die über Alpha-Bungarotoxin-empfindliche nikotinische Acetylcholinrezeptoren in hippocampalen Interneuronen der Ratte vermittelt werden. J. Neurosci. 18, 8228-8235.
Pubmed Abstract | Pubmed Full Text
Frazier, C. J., Rollins, Y. D., Breese, C. R., Leonard, S., Freedman, R., and Dunwiddie, T. V. (1998b). Acetylcholin aktiviert einen Alpha-Bungarotoxin-empfindlichen nikotinischen Strom in hippocampalen Interneuronen der Ratte, aber nicht in Pyramidenzellen. J. Neurosci. 18, 1187-1195.
Pubmed Abstract | Pubmed Full Text
Freedman, R., Adler, L. E., Bickford, P., Byerley, W., Coon, H., Cullum, C. M., et al. (1994). Schizophrenie und nikotinische Rezeptoren. Harv. Rev. Psychiatry 2, 179-192. doi: 10.3109/10673229409017136
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Freund, T. F., und Buzsaki, G. (1996). Interneurons of the hippocampus. Hippocampus 6, 347-470.
Pubmed Abstract | Pubmed Full Text
Fukudome, Y., Ohno-Shosaku, T., Matsui, M., Omori, Y., Fukaya, M., Tsubokawa, H., et al. (2004). Zwei verschiedene Klassen von Muscarin-Wirkungen auf inhibitorische Synapsen im Hippocampus: M2-vermittelte direkte Unterdrückung und M1/M3-vermittelte indirekte Unterdrückung durch Endocannabinoid-Signalisierung. Eur. J. Neurosci. 19, 2682-2692. doi: 10.1111/j.0953-816X.2004.03384.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gahring, L. C., Persiyanov, K., and Rogers, S. W. (2005). Mausstamm-spezifische Veränderungen in der Expression von Nikotinrezeptoren mit dem Alter. Neurobiol. Aging 26, 973-980. doi: 10.1016/j.neurobiolaging.2004.07.005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gais, S., and Born, J. (2004). Niedriges Acetylcholin während des Slow-Wave-Schlafs ist entscheidend für die Konsolidierung des deklarativen Gedächtnisses. Proc. Natl. Acad. Sci. U.S.A. 101, 2140-2144. doi: 10.1073/pnas.0305404101
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Giessel, A. J., and Sabatini, B. L. (2010). M1-Muscarinrezeptoren verstärken synaptische Potenziale und Kalziumeinstrom in dendritischen Dornen durch Hemmung postsynaptischer SK-Kanäle. Neuron 68, 936-947. doi: 10.1016/j.neuron.2010.09.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Giocomo, L. M., and Hasselmo, M. E. (2007). Neuromodulation durch Glutamat und Acetylcholin kann die Schaltkreisdynamik durch Regulierung des relativen Einflusses von afferentem Input und erregender Rückkopplung verändern. Mol. Neurobiol. 36, 184-200. doi: 10.1007/s12035-007-0032-z
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Griguoli, M., Scuri, R., Ragozzino, D., and Cherubini, E. (2009). Die Aktivierung von nikotinischen Acetylcholinrezeptoren verstärkt eine langsame Kalzium-abhängige Kalium-Leitfähigkeit und reduziert das Feuern von Stratum-Oriens-Interneuronen. Eur. J. Neurosci. 30, 1011-1022. doi: 10.1111/j.1460-9568.2009.06914.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E. (2006). Die Rolle von Acetylcholin beim Lernen und Gedächtnis. Curr. Opin. Neurobiol. 16, 710-715. doi: 10.1016/j.conb.2006.09.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E., and Giocomo, L. M. (2006). Cholinerge Modulation der kortikalen Funktion. J. Mol. Neurosci. 30, 133-135. doi: 10.1385/JMN:30:1:133
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E., und McGaughy, J. (2004). Hohe Acetylcholinspiegel bestimmen die Schaltkreisdynamik für Aufmerksamkeit und Enkodierung und niedrige Acetylcholinspiegel bestimmen die Dynamik für die Konsolidierung. Prog. Brain Res. 145, 207-231. doi: 10.1016/S0079-6123(03)45015-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E., and Sarter, M. (2011). Modi und Modelle der cholinergen Neuromodulation der Kognition im Vorderhirn. Neuropsychopharmacology 36, 52-73. doi: 10.1038/npp.2010.104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jia, Y., Yamazaki, Y., Nakauchi, S., and Sumikawa, K. (2009). Alpha2-Nikotinrezeptoren fungieren als molekularer Schalter zur kontinuierlichen Erregung einer Untergruppe von Interneuronen in Hippocampus-Schaltkreisen der Ratte. Eur. J. Neurosci. 29, 1588-1603. doi: 10.1111/j.1460-9568.2009.06706.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jones, S., and Yakel, J. L. (1997). Funktionelle nikotinische ACh-Rezeptoren auf Interneuronen im Hippocampus der Ratte. J. Physiol. 504(Pt 3), 603-610. doi: 10.1111/j.1469-7793.1997.603bd.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kellar, K. J., Whitehouse, P. J., Martino-Barrows, A. M., Marcus, K., and Price, D. L. (1987). Muscarinische und nikotinerge cholinerge Bindungsstellen in der Großhirnrinde der Alzheimer-Krankheit. Brain Res. 436, 62-68. doi: 10.1016/0006-8993(87)91556-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kenney, J. W., and Gould, T. J. (2008). Modulation des Hippocampus-abhängigen Lernens und der synaptischen Plastizität durch Nikotin. Mol. Neurobiol. 38, 101-121. doi: 10.1007/s12035-008-8037-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Klausberger, T., and Somogyi, P. (2008). Neuronale Vielfalt und zeitliche Dynamik: die Einheit der Schaltkreisoperationen im Hippocampus. Science 321, 53-57. doi: 10.1126/science.1149381
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Larkum, M. E., Zhu, J. J., and Sakmann, B. (1999). Ein neuer zellulärer Mechanismus zur Kopplung von Eingaben, die in verschiedenen kortikalen Schichten ankommen. Nature 398, 338-341. doi: 10.1038/18686
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Lawrence, J. J., Statland, J. M., Grinspan, Z. M., und McBain, C. J. (2006). Zelltypspezifische Abhängigkeit der Muscarin-Signalübertragung in Stratum-oriens-Interneuronen des Hippocampus der Maus. J. Physiol. 570, 595-610. doi: 10.1113/jphysiol.2005.100875
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Leonard, S., Adams, C., Breese, C. R., Adler, L. E., Bickford, P., Byerley, W., et al. (1996). Die Funktion von Nikotinrezeptoren bei Schizophrenie. Schizophr. Bull. 22, 431-445. doi: 10.1093/schbul/22.3.431
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levin, E. D. (2002). Nikotinrezeptor-Subtypen und kognitive Funktion. J. Neurobiol. 53, 633-640. doi: 10.1002/neu.10151
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levin, E. D., Bradley, A., Addy, N., and Sigurani, N. (2002). Hippocampale Alpha-7- und Alpha-4-Beta-2-Nikotinrezeptoren und Arbeitsgedächtnis. Neuroscience 109, 757-765. doi: 10.1016/S0306-4522(01)00538-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levin, E. D., Petro, A., Rezvani, A. H., Pollard, N., Christopher, N. C., Strauss, M., et al. (2009). Knockout des Alpha7- oder Beta2-Rezeptors: Auswirkungen auf das Lernen im Radialarm-Labyrinth und den langfristigen Nikotinkonsum bei Mäusen. Behav. Brain Res. 196, 207-213. doi: 10.1016/j.bbr.2008.08.048
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
McQuiston, A. R., and Madison, D. V. (1999a). Muscarinische Rezeptoraktivität hat vielfältige Auswirkungen auf die Ruhemembranpotentiale von CA1 hippocampalen Interneuronen. J. Neurosci. 19, 5693-5702.
Pubmed Abstract | Pubmed Full Text
McQuiston, A. R., and Madison, D. V. (1999b). Muscarinische Rezeptoraktivität induziert eine Nachdepolarisation in einer Subpopulation von CA1-Interneuronen des Hippocampus. J. Neurosci. 19, 5703-5710.
Pubmed Abstract | Pubmed Full Text
McQuiston, A. R., and Madison, D. V. (1999c). Die Aktivierung von Nikotinrezeptoren erregt verschiedene Subtypen von Interneuronen im Hippocampus der Ratte. J. Neurosci. 19, 2887-2896.
Pubmed Abstract | Pubmed Full Text
Miles, R., Toth, K., Gulyas, A. I., Hajos, N., and Freund, T. F. (1996). Unterschiede zwischen somatischer und dendritischer Hemmung im Hippocampus. Neuron 16, 815-823. doi: 10.1016/S0896-6273(00)80101-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nagode, D. A., Tang, A. H., Karson, M. A., Klugmann, M., and Alger, B. E. (2011). Optogenetische Freisetzung von ACh induziert rhythmische Schübe von perisomatischen IPSCs im Hippocampus. PLoS ONE 6:e27691. doi: 10.1371/journal.pone.0027691
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nagode, D. A., Tang, A. H., Yang, K., and Alger, B. E. (2014). Optogenetische Identifizierung eines intrinsischen, cholinergisch getriebenen inhibitorischen Oszillators, der empfindlich auf Cannabinoide und Opioide im hippocampalen CA1 reagiert. J. Physiol. 592, 103-123. doi: 10.1113/jphysiol.2013.257428
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nott, A., and Levin, E. D. (2006). Dorsale hippocampale alpha7 und alpha4beta2 Nikotinrezeptoren und Gedächtnis. Brain Res. 1081, 72-78. doi: 10.1016/j.brainres.2006.01.052
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Parra, P., Gulyas, A. I., and Miles, R. (1998). Wie viele Subtypen von hemmenden Zellen im Hippocampus? Neuron 20, 983-993. doi: 10.1016/S0896-6273(00)80479-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., und Kellar, K. J. (1999). Erhöhte Nikotinrezeptoren im Gehirn von Rauchern: Membranbindungs- und Autoradiographiestudien. J. Pharmacol. Exp. Ther. 289, 1545-1552.
Pubmed Abstract | Pubmed Full Text
Pitler, T. A., and Alger, B. E. (1992). Cholinerge Erregung von GABAergen Interneuronen im Hippocampusschnitt der Ratte. J. Physiol. 450, 127-142.
Pubmed Abstract | Pubmed Full Text
Power, A. E., Vazdarjanova, A., and McGaugh, J. L. (2003). Muscarinische cholinerge Einflüsse bei der Gedächtniskonsolidierung. Neurobiol. Learn. Mem. 80, 178-193. doi: 10.1016/S1074-7427(03)00086-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Simon, A. P., Poindessous-Jazat, F., Dutar, P., Epelbaum, J., and Bassant, M. H. (2006). Feuereigenschaften anatomisch identifizierter Neuronen im medialen Septum von betäubten und nicht betäubten, gefesselten Ratten. J. Neurosci. 26, 9038-9046. doi: 10.1523/JNEUROSCI.1401-06.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Smiley, J. F., Morrell, F., and Mesulam, M. M. (1997). Cholinerge Synapsen in der menschlichen Großhirnrinde: eine ultrastrukturelle Studie in seriellen Schnitten. Exp. Neurol. 144, 361-368. doi: 10.1006/exnr.1997.6413
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stone, T. W. (2007). Kynurensäure blockiert die nikotinische synaptische Übertragung auf hippocampale Interneuronen in jungen Ratten. Eur. J. Neurosci. 25, 2656-2665. doi: 10.1111/j.1460-9568.2007.05540.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Storm-Mathisen, J. (1970). Quantitative Histochemie der Acetylcholinesterase in der Hippocampusregion der Ratte in Korrelation mit histochemischen Färbungen. J. Neurochem. 17, 739-750. doi: 10.1111/j.1471-4159.1970.tb03344.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sudweeks, S. N., and Yakel, J. L. (2000). Funktionelle und molekulare Charakterisierung von neuronalen nikotinischen ACh-Rezeptoren in CA1-Hippocampus-Neuronen der Ratte. J. Physiol. 527(Pt 3), 515-528. doi: 10.1111/j.1469-7793.2000.00515.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Szabo, G. G., Holderith, N., Gulyas, A. I., Freund, T. F., and Hajos, N. (2010). Unterschiedliche synaptische Eigenschaften perisomatischer inhibitorischer Zelltypen und ihre unterschiedliche Modulation durch cholinerge Rezeptoraktivierung in der CA3-Region des Hippocampus der Maus. Eur. J. Neurosci. 31, 2234-2246. doi: 10.1111/j.1460-9568.2010.07292.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tang, A. H., Karson, M. A., Nagode, D. A., McIntosh, J. M., Uebele, V. N., Renger, J. J., et al. (2011). Nervenendständige nikotinische Acetylcholinrezeptoren initiieren die quantitative GABA-Freisetzung aus perisomatischen Interneuronen durch Aktivierung von axonalen T-Typ (Cav3) Ca(2)(+)-Kanälen und Ca(2)(+)-Freisetzung aus Speichern. J. Neurosci. 31, 13546-13561. doi: 10.1523/JNEUROSCI.2781-11.2011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Teles-Grilo Ruivo, L. M., and Mellor, J. R. (2013). Cholinerge Modulation der Funktion des hippocampalen Netzwerks. Front. Synaptic Neurosci. 5:2. doi: 10.3389/fnsyn.2013.00002
Pubmed Abstract | Pubmed Full Text | Riff Full Text
Tsubokawa, H. (2000). Control of Na+ spike backpropagation by intracellular signaling in the pyramidal neuron dendrites. Mol. Neurobiol. 22, 129-141. doi: 10.1385/MN:22:1-3:129
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tsubokawa, H., and Ross, W. N. (1997). Muscarinische Modulation der Spike-Backpropagation in den apikalen Dendriten von CA1-Pyramidalneuronen des Hippocampus. J. Neurosci. 17, 5782-5791.
Pubmed Abstract | Pubmed Full Text
Turrini, P., Casu, M. A., Wong, T. P., De, K. Y., Ribeiro-Da-Silva, A., and Cuello, A. C. (2001). Cholinerge Nervenendigungen bilden klassische Synapsen in der Großhirnrinde der Ratte: synaptische Muster und altersbedingte Atrophie. Neuroscience 105, 277-285. doi: 10.1016/S0306-4522(01)00172-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Umbriaco, D., Garcia, S., Beaulieu, C., and Descarries, L. (1995). Relationale Merkmale von Acetylcholin-, Noradrenalin-, Serotonin- und GABA-Axonendigungen im Stratum radiatum des adulten Hippocampus (CA1) der Ratte. Hippocampus 5, 605-620. doi: 10.1002/hipo.450050611
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Umbriaco, D., Watkins, K. C., Descarries, L., Cozzari, C., and Hartman, B. K. (1994). Ultrastrukturelle und morphometrische Merkmale der Acetylcholin-Innervation im parietalen Kortex adulter Ratten: eine elektronenmikroskopische Studie in Serienschnitten. J. Comp. Neurol. 348, 351-373. doi: 10.1002/cne.903480304
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vizi, E. S., Fekete, A., Karoly, R., and Mike, A. (2010). Nicht-synaptische Rezeptoren und Transporter, die an Hirnfunktionen beteiligt sind und Ziele der medikamentösen Behandlung darstellen. Br. J. Pharmacol. 160, 785-809. doi: 10.1111/j.1476-5381.2009.00624.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Widmer, H., Ferrigan, L., Davies, C. H., and Cobb, S. R. (2006). Evozierte langsame muscarinische acetylcholinerge synaptische Potentiale in hippocampalen Interneuronen der Ratte. Hippocampus 16, 617-628. doi: 10.1002/hipo.20191
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wu, J., Kuo, Y. P., George, A. A, Xu, L., Hu, J., and Lukas, R. J. (2004). beta-Amyloid hemmt direkt menschliche alpha4beta2-nicotinische Acetylcholinrezeptoren, die heterolog in menschlichen SH-EP1-Zellen exprimiert werden. J. Biol. Chem. 279, 37842-37851. doi: 10.1074/jbc.M400335200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhang, H., Lin, S. C., and Nicolelis, M. A. (2010). Raum-zeitliche Kopplung zwischen hippocampaler Acetylcholinfreisetzung und Theta-Oszillationen in vivo. J. Neurosci. 30, 13431-13440. doi: 10.1523/JNEUROSCI.1144-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text