Schlüsselwörter
Abdominales zystisches Lymphangiom; Erwachsene; Diagnostische Bildgebungsstudien; Histopathologie; Chirurgisches Ergebnis
Einführung
Lymphangiome sind seltene gutartige Tumore lymphatischen Ursprungs. Sie sind bei Kindern bevorzugt im Kopf- und Halsbereich (75%) und in der Axilla (20%) zu finden. Lymphangiome in der Bauchhöhle sind jedoch extrem selten (5 %), insbesondere bei Erwachsenen. Im Bauchraum sind sie meist vom zystischen Typ und treten im Mesenterium auf, gefolgt vom Omentum, Mesocolon und Retroperitoneum. Die Ätiologie ist unklar, aber man geht davon aus, dass sie in erster Linie kongenitalen Ursprungs sind. Das klinische Erscheinungsbild von abdominalen zystischen Lymphangiomen (ACL) ist variabel und unspezifisch und in der Regel nicht hilfreich bei der Diagnosestellung. Abdomensonographie (US) und Computertomographie (CT) sind notwendig, um die Zyste zu beschreiben und wichtige Informationen über ihre Lage, Größe und die Beteiligung benachbarter Organe zu erhalten, reichen aber nicht aus, um eine genaue präoperative Diagnose von Lymphangiomen zu stellen. Darüber hinaus ist die Differentialdiagnose intraabdominaler zystischer Läsionen breit gefächert und umfasst neben dem zystischen Lymphangiom auch andere gutartige und bösartige zystenartige Läsionen wie Pankreaspseudozysten, zystische Teratome, Ovarialzysten, Duplikationszysten, zystische Mesotheliome, bösartige Mesenchymome, undifferenzierte Sarkome und Adnexverdrehungen. Alle diese Erkrankungen stellen eine große präoperative Schwierigkeit bei der Diagnose des ACL dar. Diese Studie wurde durchgeführt, um die verschiedenen klinischen Präsentationen, diagnostischen Schwierigkeiten und chirurgischen Ergebnisse von abdominalen zystischen Lymphangiomen (ACL) bei Erwachsenen zu berichten.
Patienten und Methoden
Die Krankenakten von dreizehn erwachsenen Patienten mit abdominalen zystischen Lymphangiomen (ACL), die im Zeitraum von 1998 bis 2013 (15 Jahre) in der chirurgischen Abteilung des Universitätskrankenhauses Tanta behandelt wurden, wurden im Hinblick auf Alter, Geschlecht, klinische Präsentationen, diagnostische Bildgebungsstudien, chirurgische Eingriffe, histopathologische Merkmale, Nachuntersuchungen und Ergebnisse überprüft. Bei 12 Patienten wurden ein CT und eine US-Untersuchung des Abdomens durchgeführt, während die Zyste bei einem Patienten zufällig während einer Appendektomie entdeckt wurde. Alle Patienten erwiesen sich nach der Operation und der histopathologischen Untersuchung der entnommenen Präparate als ACL.
Ergebnisse
Diese retrospektive Studie umfasste dreizehn Patienten (8 Männer und 5 Frauen) mit abdominalen zystischen Lymphangiomen. Ihr Alter lag zwischen 19 und 52 Jahren (Mittelwert 38,3 Jahre). Bei neun Patienten wurde eine abdominale Masse festgestellt, bei drei Patienten war der Bauch aufgrund der großen Zyste stark vergrößert, bei vier Patienten traten Bauchschmerzen auf, und bei einem Patienten wurde die Zyste zufällig während einer laparoskopischen Appendektomie bei akuter Appendizitis entdeckt. Weitere Begleiterscheinungen waren Blässe, Anorexie, Fieber und Verstopfung. Das Röntgenbild des Abdomens zeigte bei sieben Patienten eine gaslose, raumfordernde Läsion, die die Darmschlingen verdrängte. Bei zwölf Patienten wurden eine Ultraschalluntersuchung des Abdomens und eine CT-Kontrastuntersuchung des Beckens durchgeführt. Die Ultraschalluntersuchung zeigte eine hypoechoische zystische Masse mit feinen Septen, aber der Ursprung war in den meisten Fällen unklar, während die Kontrast-CT eine homogene ein- oder mehrzellige zystische Masse mit verstärkten Septen zeigte. Sie gibt auch Aufschluss über die Größe der Masse, ihre anatomische Lage und die betroffenen Nachbarorgane (Abbildung 1). Die präoperative Diagnose ACL wurde bei zwei Patienten vermutet, bei zwei Patienten fälschlicherweise als Ovarialzyste und adnexales Malignom diagnostiziert und bei einem Patienten vom Internisten zunächst als Aszites diagnostiziert; bei diesem Patienten wurde vor der chirurgischen Konsultation eine diagnostische Parazentese durchgeführt.
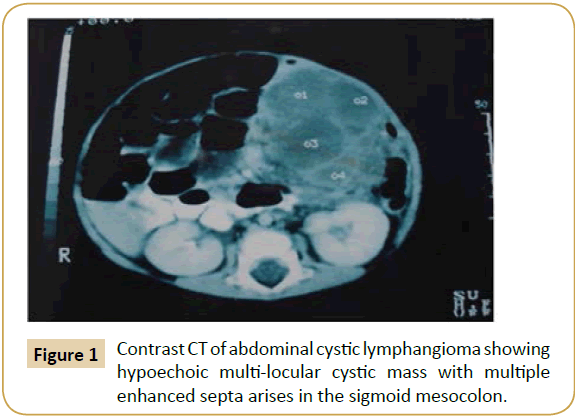
Abbildung 1: Koaleszierende Pusteln, erythematöse Papeln und Plaques auf der lateralen Seite des Rumpfes.
Bei der Exploration wurde die Zyste bei sechs Patienten im Mesenterium des Dünndarms (Ileum n=4, Jejunum n=2) (Abbildung 2), an der Wurzel des Mesenteriums (n=2), im Omentum major (n=2), im transversalen Mesokolon (n=1) (Abbildung 3), im sigmoiden Mesokolon (n=1) und im Retroperitoneum (n=1) gefunden. Die intraoperative vorläufige Diagnose eines ACL wurde nur bei drei Patienten gestellt. Die Größe der Zysten war unterschiedlich (Tabelle 1), und die enthaltene Flüssigkeit reichte von 150 cm³ bis 5 Liter.
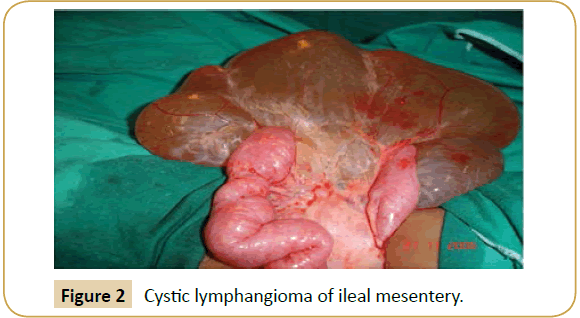
Abbildung 2: Zystisches Lymphangiom des Mesenteriums des Ileums.
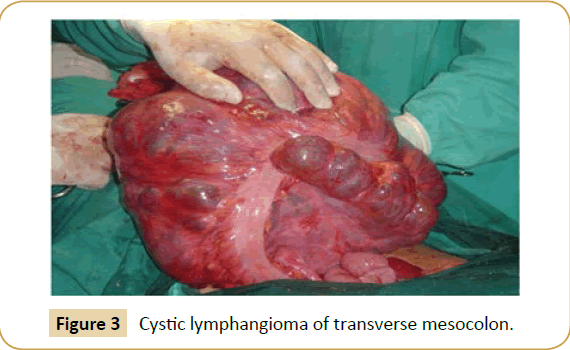
Abbildung 3: Zystisches Lymphangiom des transversalen Mesokolons.
| Fall Nr. | Alter (J) | Geschlecht | Klinisches Erscheinungsbild | Bildgebende Untersuchungen | Lage der Zyste | Größe der Zyste | Operation | Ergebnis | Bemerkungen |
| 1 | 38 | F | Mobile abdominale Masse | US, CT | Großes Omentum | 18 cm × 10 cm × 6 cm | Zystektomie | Leben & gut | Fehldiagnose als Ovarialzyste |
| 2 | 41 | M | Abdominalmasse | AXR, US, CT | Mesenterium des Jejunums | 9 cm × 6 cm × 4 cm | Exzision der Zyste mit einem Teil des Darms | Leben & gut | |
| 3 | 43 | M | Abdominalvergrößerung &Beschwerden |
AXR, US, CT | Transversales Mesokolon | 20 cm × 22 cm × 9 cm | Zystektomie | Leben& gut | |
| 4 | 36 | F | Bauchumfang, Vage Bauchschmerzen und Verstopfung |
AXR, US, CT | Wurzel des Mesenteriums | 17 cm × 12 cm × 10 cm | Zystektomie | Leben & gut | |
| 5 | 47 | F | Linke pelviabdominale Masse &Bauchschmerzen | US, CT | Sigmoid mesocolon | 10 cm × 9 cm × 4 cm | Exzision der Zyste mit einem Teil des Darms | Leben & gut | Fehldiagnose als Adnexalmasse |
| 6 | 19 | M | Rechte Unterbauchschmerzen, Übelkeit, Erbrechen, Fieber | Entdeckt bei Laparoskopie | Ileales Mesenterium | 6 cm × 5 cm × 3 cm | Laparoskopische Zystenexzision& Appendektomie | Leben & gut | Zufällig entdeckt |
| 7 | 27 | F | Bauchmassage & Rezidivierende Bauchschmerzen |
US, CT | Mesenterium des Darms | Durchmesser 10 cm | Exzision der Zyste mit einem Teil des Darms | Lebt & gut | |
| 8 | 45 | M | Abdominalmasse | AXR, US, CT | Retro-Peritoneum | 27 cm ×22 cm × 15cm | Teilzyste Exzision& Marsupialisation | Wiederauftreten | |
| 9 | 31 | M | Diffuse abdominale Vergrößerung & Ballottement | AXR, US, CT | Großes Omentum | 26 cm im Durchmesser | Zystektomie | Leben & gut | Fehldiagnose als Aszites |
| 10 | 52 | F | Bauchmassage, Schmerzen in der Epigastrie | US, CT | Jejunalmesenterium | 17 cm ×11 cm ×6 cm | Exzision der Zyste mit einem Teil des Darms | Leben & gut | |
| 11 | 34 | M | Abdominalmasse, Blässe | US, CT | Ilearmesenterium | 11 cm × 7cm × 5 cm | Zystektomie | Leben & gut | |
| 12 | 46 | M | Bauchmassage | AXR, US, CT | Wurzel des Mesenteriums | 21 cm × 14cm ×7 cm | Inkomplette Zyste Exzision | Adhäsives IO | |
| 13 | 39 | M | Bauchmasse | US, CT | Ilearmesenterium | 13 cm × 8 cm × 7cm | Zystektomie | Leben & gut |
Zystektomie=vollständige Exzision nur der Zyste
Tabelle 1: Demographie, Präsentation, bildgebende Untersuchungen, chirurgischer Eingriff und Ergebnis von dreizehn Patienten mit abdominalem zystischem Lymphangiom (ACL).
Die vollständige chirurgische Exzision der Zyste (Zystektomie) konnte bei sieben Patienten (53,8%) durchgeführt werden, die Exzision der Zyste mit dem angrenzenden Darmteil, der eng mit ihr verwachsen ist, bei vier Patienten (30.8%), die teilweise Exzision einer großen Zyste mit intraperitonealer Marsupialisation bei einem Patienten (7,7%) und die unvollständige Exzision der Zyste, wobei ein kleiner Teil der hinteren Wand an den oberen Mesenterialgefäßen haften blieb, bei einem Patienten (Tabelle 1). Nach der Operation wurden die entnommenen Präparate zur histopathologischen Untersuchung eingesandt und erwiesen sich als zystisches Lymphangiom mit den charakteristischen histologischen Kriterien von Lymphräumen, die von flachen Endothelzellen, lymphatischen Aggregaten und Schaumzellen mit lipoidem Material im Stroma und glatten Muskelfasern in ihren Wänden ausgekleidet sind (Abbildung 4). Das Zystenlumen enthält chyloide oder seröse Flüssigkeit. Die Nachbeobachtungszeit der Patienten lag zwischen zwei und sechs Jahren, wobei keine Mortalität oder Morbidität auftrat, mit Ausnahme eines Rezidivs der Zyste bei einem Patienten (7,7 %), drei Jahre nach der Operation, und einer adhäsiven Darmobstruktion, die eine Adhäsolyse erforderte, zwei Jahre nach der Operation, bei einem anderen Patienten.
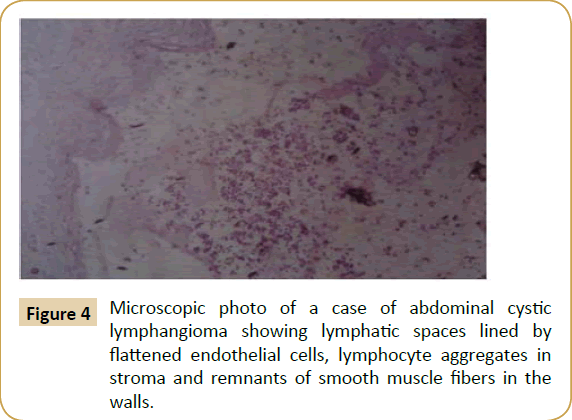
Abbildung 4: Mikroskopische Aufnahme eines Falles eines abdominalen zystischen Lymphangioms, das von abgeflachten Endothelzellen ausgekleidete Lymphräume, Lymphozytenaggregate im Stroma und Reste von glatten Muskelfasern in den Wänden zeigt.
Diskussion
Obwohl das abdominale Lymphangiom selten ist, stellt es eine diagnostische Herausforderung für Ärzte und Chirurgen dar. In dieser Serie wurde das ACL präoperativ nur bei zwei Patientinnen vermutet und bei drei Patientinnen als Ovarialzyste, Adnexopathie und Aszites fehldiagnostiziert. Die endgültige Diagnose wird jedoch bei allen Patientinnen nach der histopathologischen Untersuchung der exzidierten Proben gestellt.
Im Bauchraum ist die häufigste Lokalisation des Lymphangioms das Mesenterium (mesenterisches Lymphangiom), in dem sich die meisten Lymphbahnen befinden. Das Lymphangiom des Dünndarmmesenteriums ist die häufigste (70 %) der intraperitonealen Lokalisationen, wobei 50 bis 60 % aller Zysten im Mesenterium des Ileums lokalisiert sind. Obwohl Mesenterialzysten und mesenteriale zystische Lymphangiome seltene und klinisch verwirrende Läsionen sind, deuten histologische und ultrastrukturelle Beweise darauf hin, dass sie pathologisch unterschiedlich sind und unterschieden werden sollten, da sich Lymphangiome anders verhalten. Weitere mögliche Lokalisationen sind das Omentum (Omentalzyste), das Retroperitoneum, das Mesokolon, das Pankreas, die Milz und die Nebenniere. Das am häufigsten verwendete Klassifizierungssystem für Lymphangiome ist nach wie vor das von Wegner, der sie in einfache, zystische oder kavernöse Lymphangiome einteilte. Losanoff et al. haben jedoch eine weitere Klassifizierung in gestielte, sessile, retroperitoneal ausgedehnte oder multizentrische Lymphangiome vorgenommen, die bei ihrer Behandlungsstrategie hilfreich sein kann. Alle Fälle in dieser Studie waren vom zystischen Typ und 66,7 % der intraperitonealen Typen entstehen im Dünndarm-Mesenterium, 33,3 % im Ileus-Mesenterium, 16,7 % im Jejunus-Mesenterium und 16,7 % in der Wurzel des Mesenteriums.
Die klinischen Erscheinungsbilder des ACL sind in der Regel variabel und unspezifisch. Es kann klinisch unauffällig sein und zufällig bei einer Untersuchung oder Laparotomie wegen einer nicht verwandten Pathologie entdeckt werden, oder es kann eine Vielzahl von vagen abdominalen Symptomen wie abdominales Unwohlsein, Blähungen, Durchfall, Anorexie, Übelkeit und Erbrechen imitieren. In den symptomatischen Fällen kann die zystische Masse andere abdominale Zysten wie Ovarialzysten, Pankreaszysten, Duplikationszysten oder Adnextorsionen imitieren. In sehr wenigen Fällen kann es zu einem akuten Abdomen aufgrund von Zystenkomplikationen wie Ruptur, Blutung, Sekundärinfektion oder Darmverschluss aufgrund von Torsion, Volvulus oder externem Druck auf den nahe gelegenen Darm kommen. ACL kann auch als Appendizitis oder Meckel-Divertikulitis fehldiagnostiziert werden. Die meisten Fälle (92,3 %) in unserer Studie waren symptomatisch, was möglicherweise auf eine späte Präsentation zurückzuführen ist, mit Ausnahme eines Falles eines ilealen Lymphangioms, das zufällig während einer laparoskopischen Appendektomie entdeckt wurde.
Ultrasonographie, Computertomographie und Magnetresonanztomographie sind nützliche präoperative radiologische Hilfsmittel für die Diagnose und chirurgische Planung von ACL. Sie können helfen, die zystische Natur des Tumors, seine anatomische Lage und seine Beziehung zu den umliegenden Strukturen zu bestimmen, aber sie reichen nicht aus, um eine einzige präoperative Diagnose zu stellen, und die endgültige Diagnose wird durch Histopathologie und/oder Immunchemie bestätigt.
Obwohl das Lymphangiom eine gutartige Läsion ist, verhält es sich aggressiv und invasiv; es kann zu einer enormen Größe anwachsen und lebensbedrohliche Zystenkomplikationen wie Ruptur, Infektion, Blutung oder Darmverschluss entwickeln oder in benachbarte lebenswichtige Strukturen eindringen und eine vollständige Resektion des Tumors erschweren. Daher sollte die ACL so früh wie möglich vollständig entfernt werden, mit oder ohne den angrenzenden Teil des anhaftenden Darms, um die Komplikationen der Zyste zu vermeiden und das Risiko eines erneuten Auftretens zu verringern. Die Prognose ist ausgezeichnet, wenn die Zyste vollständig entfernt wird. Wenn eine vollständige Entfernung der Zyste nicht möglich ist, weil sie sehr groß ist, tief im Mesenterium liegt oder den Hauptast der Arterien oder die IVC infiltriert, besteht die andere Möglichkeit in einer Teilexzision der Zyste mit Marsupialisation des verbleibenden Teils in die Bauchhöhle. Bei etwa 10 % der Patienten ist diese Form der Therapie erforderlich. Bei einem (7,7 %) unserer Patienten war diese Behandlungsoption erforderlich, wobei die Zyste bei diesem Patienten erneut auftrat.
Die Rezidivrate reicht von 0 % bis 13,6 %, wobei der Durchschnitt bei 6,1 % liegt. Die meisten Rezidive treten bei Patienten mit retroperitonealen Zysten oder bei Patienten auf, die nur eine Teilentfernung hatten. Die Lage der Zyste hat keinen Einfluss auf die Rezidivrate, wenn sie resektabel ist, aber die Operation und der Krankenhausaufenthalt verlängern sich wie bei retroperitonealen und Mesenterialwurzel-Lymphangiomen. Die Bedeutung der chirurgischen Behandlung des ACL liegt in der Vermeidung potenzieller Zystenkomplikationen und der Verringerung der Rezidivhäufigkeit, während nicht-chirurgische Behandlungen mit Bleomycin und Steroiden oder Aspiration und Injektion von Sklerosierungsmitteln wie Doxycyclin aus denselben Gründen nicht als der Operation überlegen erwiesen sind.
Schlussfolgerung
Aus den obigen Ausführungen geht hervor, dass die präoperative Diagnose der ACL aufgrund ihrer variablen, irreführenden klinischen Präsentationen, der Seltenheit der Erkrankung und ihrer Ähnlichkeit mit vielen anderen intraabdominalen Zysten in der Regel schwierig ist. Obwohl US, CT und MRT hilfreiche bildgebende Verfahren sind, können sie nur eine suggestive Diagnose der Krankheit liefern; die endgültige Diagnose wird jedoch erst nach der histopathologischen Untersuchung des entfernten Präparats gestellt. Die vollständige chirurgische Entfernung ist die Behandlung der Wahl bei ACL, um Komplikationen bei der Zyste zu vermeiden und die Häufigkeit des Wiederauftretens zu verringern.
- Chen CW, Hsu SD, Lin CH, Cheng MF, Yu JC (2005) Cystic lymphangioma of the jejunal mesentery in an adult: a case report.World J Gastroenterol 11: 5084-5086.

- Wani I (2009) Mesenteric Lymphangioma in Adult A case series with a review of the Literature.Dig Dis Sci 54: 2758-2762.
- Elhalaby E (2001) Mesenteric and retroperitoneal cysts in children. Tanta Med J 29: 51-61.
- Bansal H, Jenaw RK, Mandia R (2010) Huge Mesenteric Lymphangioma – A Rare Cause of Acute Abdomen. Int J Health Res 3: 195-198.
- Aprea G,GuidaF,Canfora A,Ferronetti A,Giugliano A, et al. (2013) Mesenteric cystic lymphangioma in adult: a case series and review of the literature. BMC Surgery 13: A4.
- de Perrot M, Rostan O, Morel P, Le Coultre C (1998) Abdominal lymphangioma in adults and children. Br J Surg 85: 395-397.
- Chin S, Kikuyama S, Hashimoto T, Tomita T, Hasegawa T, et al. (1993) Lymphangioma of jejunal mesentery in an adult: a case report and the review of the Japanese literature.Keio J Med 42: 41-43.
- Takiff H, Calabria R, Yin L, Stabile BE (1985) Mesenterialzysten und intra-abdominale zystische Lymphangiome. Arch Surg120:1266-1269.
- Egawa S, Satoh T, Suyama K, Uchida T, Iwabuchi K, et al. (1996) Giant retroperitoneal cyst in an adult male. Int J Urol3: 304-306.
- Losanoff JE, Richman BW, El-Sherif A, Rider KD, Jones JW (2003) Mesenteric cystic lymphangioma. J Am Coll Surg196: 598-603.
- Na WT, Lee TH, Lee BS, Kim SH, Chae HB, et al. (2010) Clinical aspects of intraabdominal cystic lymphangioma in Korea. Korean J Gastroenterol56: 353-358.
- Maa J, Wa C, Jaigirdir A, Cho SJ, Corvera CU (2009) Giant mesenteric cystic lymphangioma presenting with abdominal pain and masquerading as a gynecologic malignancy. Rare Tumors 1: e48.
- Ramírez-Ortega MA, Villegas-Romero J, Márquez-Díaz A(2010) A cystic mesenteric lymphangioma presented at the colon sigmoid. Case report. Rev Med Inst Mex Seguro Soc 48: 557-562.
- Prabhakaran K, Patankar JZ, Loh DL, Ahamed F, Ali MA (2007)Cystic lymphangioma of the mesentery causing intestinal obstruction. Singapore Med J 48: e265-e267.
- Elukoti HN, Alcasoas S, Vernekar J, Hegde P, Pereira S (2015) Mesenteric Lymphangioma Presenting as Ileal Volvulus. J Clin Diagn Res 9: TJ05-TJ06.
- Makni A, Chebbi F, Fetirich F, Ksantini R, Bedioui H, et al. (2012) Surgical management of intra-abdominal cystic lymphangioma. Report of 20 cases. World J Surg 36:1037-1043.
- Catherine H, Meghan C, Steven L, Larry W, Nam N (2009) Mesenteric lymphatic malformation associated with acute appendicitis: a case report. J Med Case Report3: 9030.
- Levy AD, Cantisani V, Miettinen M (2004) Abdominal lymphangiomas Imaging features with pathologic correlation. AJR 182:1485-1491.
- Tsukada H, Takaori K, Ishiguro S, Tsuda T, Ota S, et al. (2002) Giant cystic lymphangioma of the small bowel mesentery: report of a case. Surg Today 32: 734-737.
- Trindade EN, Trindade MR, Boza JC, Von Diemen V, Ilgenfritz RB (2007) Laparoscopic excision of a retroperitoneal cystic lymphangioma in an elderly patient.Minerva Chirurgica 62: 145-147.
- Mabrut JY, Grandjean JP, Henry L, Chappuis JP, Partensky C, et al. (2002) Mesenteric and mesocolic cystic lymphangiomas- Diagnostic and therapeutic management. Ann Chir May 127: 343-349.
- Kurtz RJ, Heimann TM, Holt J, Beck AR (1986) Mesenteriale und retroperitoneale Zysten. Ann Surg 203: 109-112.
- Méndez-Gallart R, Bautista A, Estévez E, Rodríguez-Barca P (2011) Abdominal cystic lymphangiomas in pediatrics : surgical approach and outcomes. Acta Chir Belg 111: 374-377