| Ed Davis, Ph.D. |
Einführung
Lentiviren und Adeno-assoziierte Viren (AAV) haben sich als unschätzbar wertvoll erwiesen, wenn es darum geht, genetisches Material in Säugetierzellen einzuschleusen, entweder in Kulturen oder in ganze Tiere. Beide Systeme eignen sich hervorragend für viele Anwendungen in der Grundlagenforschung, z. B. für die Überexpression von Proteinen, die Herstellung von Antikörpern und das Ausschalten von Genen, und beide sind vielversprechend für die Gentherapie. Jedes virale System hat jedoch seine eigenen Vor- und Nachteile, die von der jeweiligen Anwendung abhängen. GeneCopoeia bietet umfangreiche Produktlinien sowohl für Lentiviren als auch für AAV an, die Ihnen leistungsstarke und flexible Optionen für die Einbringung von DNA in Zellen bieten. In dieser Technical Note beschreiben wir die Technologien, die hinter den GeneCopoeia Lentifect™ Lentivirus- und AAVPrime™ AAV-Produktlinien stehen, und erörtern die Vorzüge jeder Technologie für verschiedene Anwendungen, um Ihnen bei der Auswahl des Systems zu helfen, das Ihren Anforderungen am besten entspricht.
Warum Viren für den DNA-Transport verwenden?
Einer der gängigsten Wege, DNA in Zellen einzubringen, ist die plasmidbasierte Transfektion, bei der Zellen mit chemischen Verbindungen wie Kalziumphosphat oder mit lipidbasierten Reagenzien behandelt werden. Die Plasmid-Transfektion ist jedoch nicht immer wünschenswert oder praktisch. So lassen sich beispielsweise einige Zellen nur sehr schwer oder gar nicht transfizieren, während die meisten kultivierten Zellen eine Infektion (auch Transduktion genannt) durch Lentiviren oder AAV unterstützen. Zweitens kann die Plasmid-Transfektion nicht für die In-vivo-DNA-Übertragung verwendet werden, die virale Transduktion hingegen schon. Sowohl Lentiviren als auch AAV können für eine Vielzahl von Anwendungen eingesetzt werden, z. B. für die Proteinexpression aus offenen Leserahmen (ORFs), die Ausschaltung von Genen durch RNA-Interferenz (RNAi), die durch Kurzhaar-RNA (shRNA) vermittelt wird, Luziferase- und andere Reportergen-Tests sowie die Ausschaltung von Genen, die durch das CRISPR-Cas9-System (clustered, regularly-interspaced, short palindromic repeats) vermittelt wird. Viele dieser Anwendungen für virale Vektoren wurden erfolgreich in kultivierten immortalisierten Säugetierzelllinien, in primären Zellkulturen, in Tiermodellen und in der Gentherapie bei menschlichen Patienten durchgeführt.
Der Begriff „Lentivirus“ bezieht sich auf die Klasse der Retroviren, zu denen auch das humane Immundefizienzvirus (HIV) gehört, und tatsächlich stammen die meisten derzeit verwendeten lentiviralen Systeme von HIV ab (Übersicht in Mátrai, et al, 2010; Sakuma, et al., 2012). Lentiviren, die Transgene tragen, integrieren sich bei der Infektion in das Genom und ermöglichen so eine stabile Expression sowohl in sich teilenden als auch in sich nicht teilenden Zellen.
Lentivirale Systeme wurden über mehrere Generationen hinweg stark von HIV modifiziert, um sie sicher in der Handhabung und nützlich für Anwendungen zu machen. GeneCopoeia verwendet das lentivirale System der 3. Generation (Dull, et al. 1998), das vier separate Plasmide benötigt, um infektiöse Viruspartikel (Virionen) zu produzieren. Ein lentivirales Plasmid von GeneCopoeia enthält nur das zu exprimierende Gen von Interesse (GOI), ein Antibiotika-Selektionsgen und die Verpackungs-Signalsequenzen. Manchmal enthält der Klon auch ein fluoreszierendes Reportergen. Das GOI-enthaltende Plasmid mit dem selektierbaren Marker und dem Reportergen kann Inserts von bis zu 5-6 kb aufnehmen. (Abbildung 1), obwohl die viralen Titer dramatisch abfallen, wenn die Größe der Inserts etwa 4 kb überschreitet.
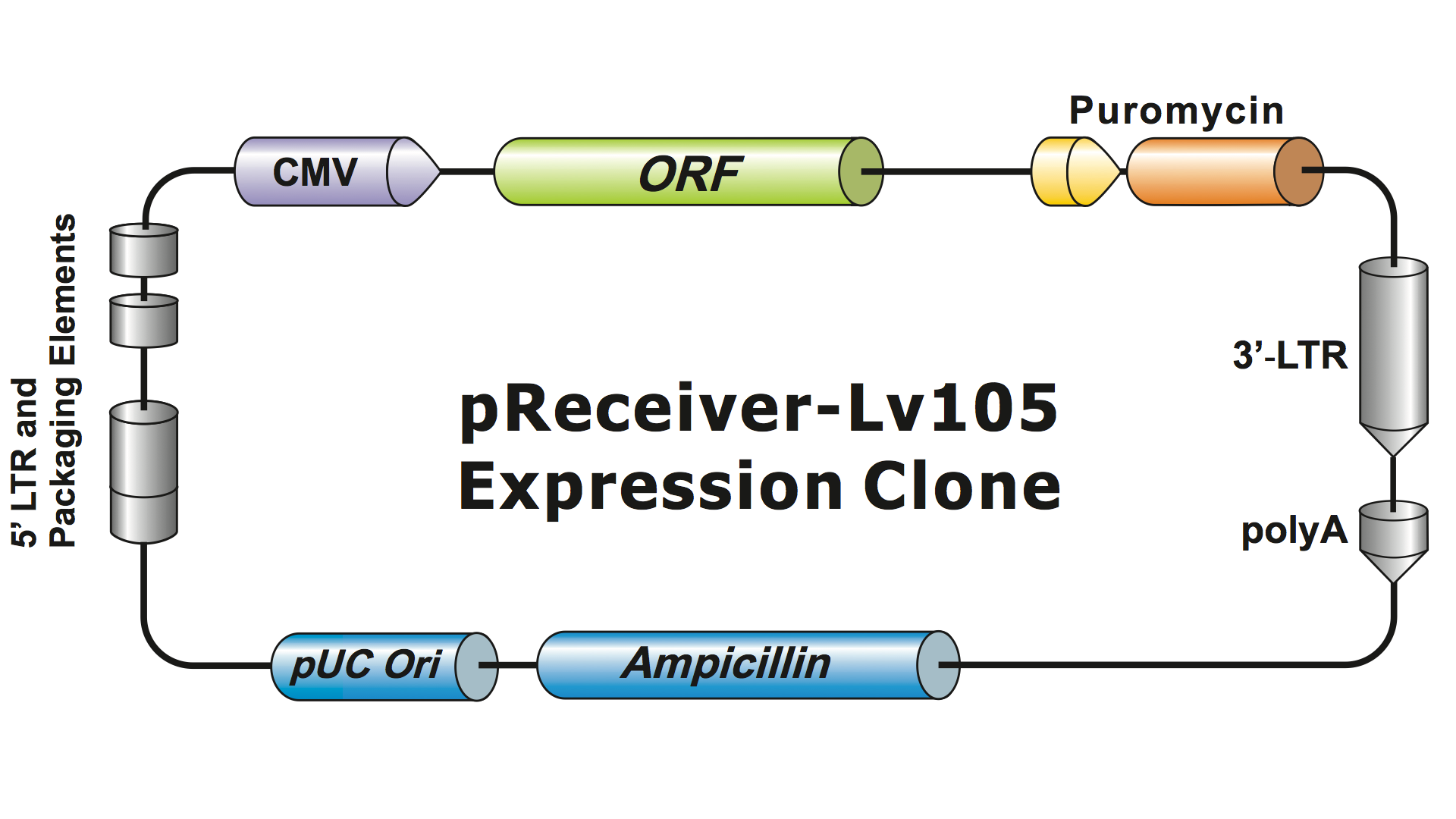 |
Abbildung 1. Beispiel eines lentiviralen GeneCopoeia-Expressionsklons |
Die zusätzlichen Plasmide exprimieren die retroviralen Elemente, die für die Verpackung und Integration benötigt werden (gag, pol, env, Rev). Wenn alle vier Plasmide in Verpackungszellen exprimiert werden, wird die GOI-RNA in Partikel eingebaut. Da die retroviralen Proteine nur während der Verpackung exprimiert werden, können infizierte Zellen kein infektiöses Virus produzieren. Darüber hinaus enthalten GeneCopoeias Lentifect™-Lentiviruspartikel eine Deletion in der U3-Region der LTRs, wodurch sie selbstinaktivierend (SIN) werden. Die SIN-Deletion verhindert die lentivirale Replikation in dem seltenen Fall, dass alle vier Plasmide rekombinieren und ein einziges aktives Virusplasmid bilden. Daher sind lentivirale Partikel sicher in der Handhabung und es besteht praktisch keine Möglichkeit, pathogene Viren zu erzeugen.
Zusätzlich zu den verbesserten Sicherheitsmodifikationen tragen die lentiviralen Partikel von GeneCopoeia das Glykoprotein des vesikulären Stomatitis-Virus G (VSV-G) anstelle des Wildtyp-HIV-env-Gens, wodurch sich der Gewebetropismus des Virus von CD4+ T-Zellen auf praktisch jeden Säugetierzelltyp ändert. Als solche sind Lentiviren ein weit verbreitetes System für Säugetierzellkulturen, Tiermodelle und Gentherapieanwendungen.
Da die lentiviralen Vektoren auf diese Weise modifiziert wurden, weisen die Lentifect™-Lentiviralsysteme von GeneCopoeia eine erhöhte Sicherheit auf und verfügen über die folgenden Merkmale, die sie für die DNA-Übertragung äußerst nützlich machen:
- Sie infizieren fast alle Säugetierzelltypen
- Sie können zur Übertragung relativ großer DNA-Sequenzen verwendet werden – bis zu einer Länge von etwa 5-6 kb
- Sie können zur Erzeugung stabiler Zelllinien oder zur Förderung einer stabilen Genexpression in Organen und Geweben in vivo verwendet werden, aufgrund der Integration des Transgens an zufälligen Stellen im Genom
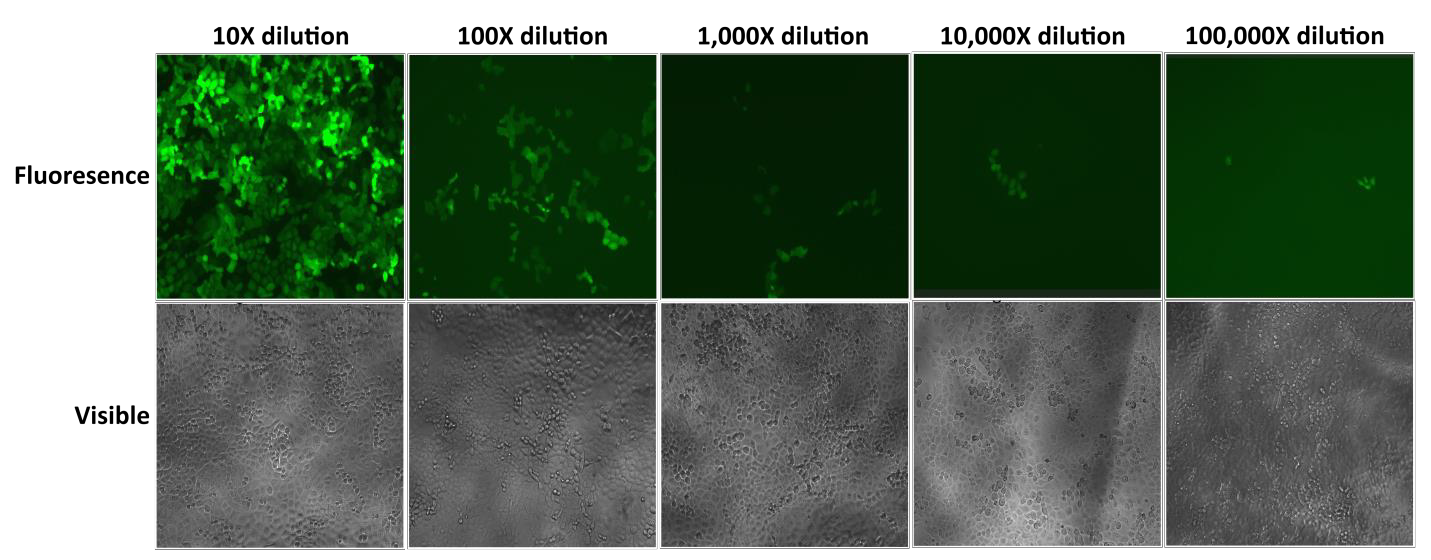
Die Lentifect™-Lentivirenpartikel von GeneCopoeia liefern hohe Titer, die es den Forschern ermöglichen, Gene von Interesse effizient zu exprimieren (Abbildung 2).
|
Abbildung 2. Test serieller Verdünnungen von Lentifect™ lentiviralen Partikeln. eGFP-Fluoreszenz wurde 72 Stunden nach der Transduktion mit einem Fluoreszenzmikroskop fotografiert. |
|
GeneCopoeia bietet eines der umfangreichsten Sortimente an lentiviralen Produkten in der Branche (Tabelle 1).
| Produkt/Dienstleistung | Beschreibung |
| Lentivirale Klone und Klonierungsvektoren | Vorgefertigte und kundenspezifische Klone, die ORFs, Promotoren, shRNAs, miRNA 3′ UTRs, Vorläufer und Inhibitoren, sgRNAs und mehr tragen. Verfügbar mit mehreren Promotoren, Tags und Reportern. Vektoren für das Do-it-yourself-Klonen von Sequenzen von Interesse. |
| Lentifect™ lentivirale Partikel | Fertige und kundenspezifisch verpackte, gebrauchsfertige lentivirale Partikel. Hergestellt aus den umfangreichen, genomweiten Klonsammlungen von GeneCopoeia oder aus vom Kunden eingereichten Klonen. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Komplettsystem von Reagenzien für die Do-it-yourself-Produktion von Lentiviralpartikeln. Enthält Verpackungsplasmide, Verpackungszelllinie, Partikelkonzentrationslösung und Titrationskit. |
Tabelle 1. GeneCopoeia’s Angebot an lentiviralen Produkten und Dienstleistungen.
AAV-basierte Systeme
Im Gegensatz zum RNA-Genom von Lentiviren hat AAV ein einzelsträngiges DNA-Genom (Samulski und Muzyczka, 2014). Außerdem stammt AAV nicht von einem Krankheitserreger ab, sondern ist eine Kontaminante des Adenovirus, der keine pathogenen Bedingungen zugeschrieben werden. Natürlich vorkommende AAV integrieren sich wie Lentiviren in das Genom, allerdings nur am AAVS1-Lokus auf Chromosom 19. Diese Stelle wird auch als „sicherer Hafen“ bezeichnet, da sie häufig für die Insertion von Transgenen verwendet wird, ohne Zellen zu schädigen (DeKelver, et al., 2010).
Wie Lentivirus wurde AAV im Hinblick auf Sicherheit und Verwendbarkeit modifiziert. AAV erfordert eine Koinfektion mit einem Helper-Virus. Das AAV-Genom ist 4,7 kb lang und enthält 2 Gene, Rep und Cap, die für die virale Replikation und Integration erforderlich sind. In AAVPrime™ sind Rep und Cap deletiert, so dass nur die 145 bp 5′ und 3′ inverted terminal repeats (ITRs) übrig bleiben. Die Deletion von Rep und Cap dient drei Zwecken: 1) Es beseitigt die Fähigkeit eines Helfervirus, AAV-infizierten Zellen die Produktion neuer AAV-Virionen zu ermöglichen; 2) es ermöglicht die Insertion von Genen mit einer Länge von bis zu 4 kb (obwohl der virale Titer bei Transgenen mit einer Länge von mehr als 3 kb abnimmt); und 3) es beseitigt praktisch die Fähigkeit von AAV zur Integration. Die geringe Größe von AAV stellt für einige Anwendungen eine Herausforderung dar. Für die CRISPR-Genom-Editierung verwenden Forscher beispielsweise die Cas9-Nuklease aus S. aureus, da sie etwa 30 % kürzer ist als die üblicherweise verwendete Cas9 aus S. pyogenes (Ran, et al., 2015).
Für die Verpackung wurden Rep und Cap auf ein anderes Plasmid verlagert und die Adenovirus-Helfergene auf ein drittes Plasmid platziert, wodurch das gesamte Verpackungssystem sicher und helfervirusfrei ist (Abbildung 3).
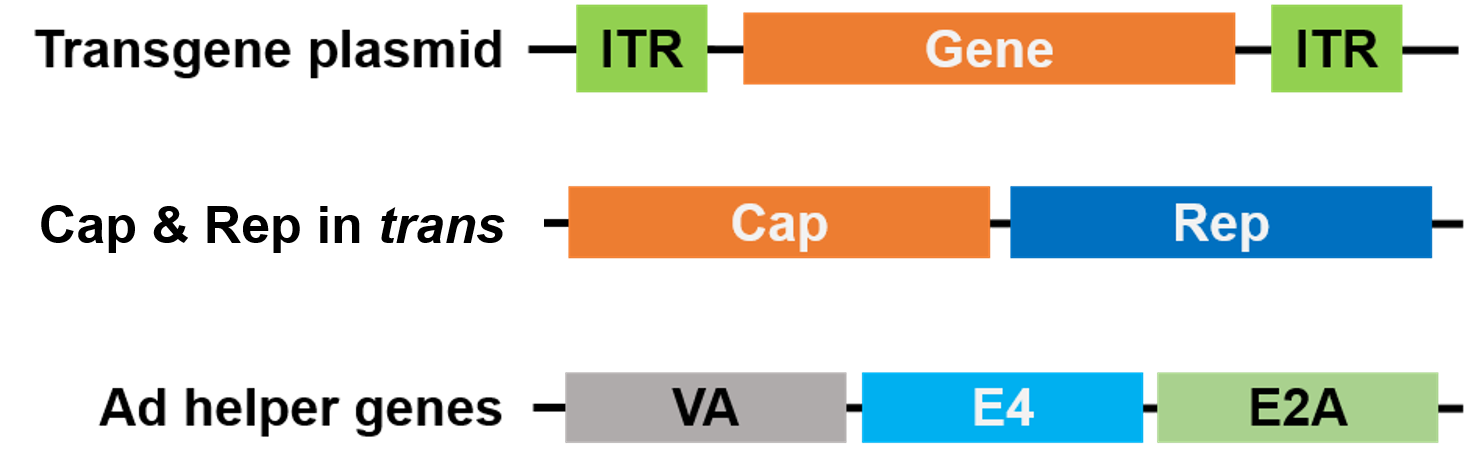 |
Abbildung 3. Helper-Virus-freies AAV. 3 Plasmide werden für die Verpackung verwendet. Das Gen von Interesse-Plasmid (oben) enthält die invertierten terminalen Repeats (ITRs). Ein zweites Plasmid (Mitte) trägt die AAV-Cap- und Rep-Gene, und das dritte Plasmid (unten) trägt die erforderlichen Gene aus dem Adenovirus (Ad) |
Außerdem gibt es AAV in verschiedenen Serotypen, die die Gewebespezifität der AAV-Infektion beeinflussen. Mehrere Serotypen ermöglichen es den Forschern, entweder a) ein breites Spektrum von Wirtszellen zu infizieren oder b) die Infektion auf ein oder wenige Gewebe zu beschränken. Die AAVPrime™-AAV-Partikel von GeneCopoeia sind in mehreren Serotypen erhältlich (Tabelle 2).
| Serotyp | Primäres Zielgewebe | Beschreibung |
| AAV-1 | Muskel | Best für Herzmuskel, Skelettmuskel, neuronales und gliales Gewebe. |
| AAV-2 | Muskel, Leber, Netzhaut | Am häufigsten verwendeter Serotyp. Am besten geeignet für Neuronen, Muskel, Leber und Gehirn. |
| AAV-3 | Megakaryozyten | Best für Megakaryozyten, Muskel, Leber, Lunge und Netzhaut. |
| AAV-4 | Retina | Am besten für Neuronen, Muskel, Gehirn und Netzhaut. |
| AAV-5 | Lunge | Best für Lunge, Neuronen, Synovialgelenk, Netzhaut und Bauchspeicheldrüse. |
| AAV-6 | Muskel, Lunge | Best für Lunge, Leber und Herz. |
| AAV-7 | Muskel, Netzhaut, Neuronen | Am besten für Muskel, Neuronen und Leber. |
| AAV-8 | Leber | Am besten für Muskel, Gehirn, Leber und Netzhaut. |
| AAV-9 | Vielfältig | Am besten für Muskel, Herz, Leber, Lunge und Gehirn. |
| AAV-10 | Pleura, ZNS | Kloniert von Cynomolgus, fast identisch mit AAVrh10 bis auf 12 Aminosäuren in VP1. Am besten geeignet für Lunge, Muskel, Herz, NCS und Leber. |
| AAV-DJ | Various | Eine Mischung aus 8 natürlich vorkommenden Serotypen. Transduziert effizient eine Vielzahl von Zelltypen in vitro. |
| AAV-DJ/8 | Various | Eine Variante von AAV-DJ mit einer Heparin-Bindungsdomäne (HBD) Mutation, die eine Infektion der Leber sowie anderer Gewebe in vivo ermöglicht. |
Tabelle 2. Liste der weit verbreiteten AAV-Serotypen
AAVPrime™ AAV-Partikel haben die folgenden Eigenschaften, die sie für die DNA-Übertragung sehr nützlich machen:
- Hohe Titer. Der Titer der gereinigten Partikel kann bis zu 10^14 GC/ml (Genomkopien/ml) betragen.
- Vielseitig. Mehrere Serotypen ermöglichen die Verwendung in einem breiten oder begrenzten Spektrum von Wirtszellen
- Geringe Toxizität. Integriert sich nicht in das Wirtsgenom.
- Geringe Immunogenität. Minimale Immunantwort des Wirts.
- Sicher. Wird mit keiner menschlichen Krankheit in Verbindung gebracht
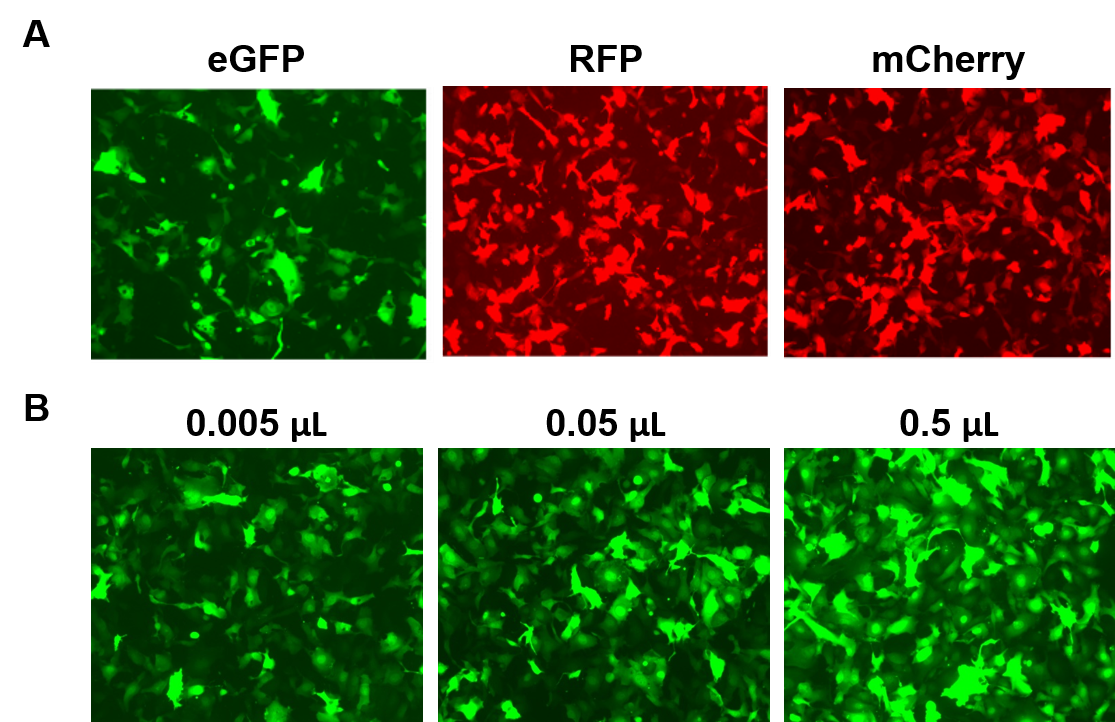
AAVPrime™-Partikel sind für menschliche und Maus-ORFs bis zu 3 kb, in mehreren Serotypen und Promotor-Optionen, entweder in Standardreinheit (nur für die in vitro-Verwendung) oder gereinigt (für die in vivo-Verwendung) erhältlich. Die Kunden können Plasmidklone, maßgeschneiderte Partikel für Gene von Interesse bestellen oder aus vorgefertigten Optionen wählen, die Gene wie fluoreszierende Reporter exprimieren (Abbildung 4).
|
Abbildung 4. Leistung der AAVPrime™-Partikel von GeneCopoeia. A. HT1080-Zellen in 24-Well-Platten, transduziert mit 0,5 µL AAV von Standardreinheit, das enhanced GFP (eGFP), rot fluoreszierendes Protein (RFP) und monomeres Cherry (mCherry) exprimiert. B. HT1080-Zellen in 24-Well-Platten wurden mit unterschiedlichen Mengen von gereinigtem AAV, das eGFP exprimiert, transduziert. Die Zellen wurden mit einem Fluoreszenzmikroskop sichtbar gemacht (Belichtungszeit: 400 ms). |
|
Was soll ich wählen: Lentivirus oder AAV?
Die Entscheidung zwischen Lentivirus und AAV hängt von vielen Faktoren ab. Zum Beispiel kann die Tatsache, dass Lentiviren in das Genom integriert werden, sowohl ein Vorteil als auch ein Nachteil sein, je nachdem, welche Anforderungen Sie haben. Die nachstehende Tabelle soll Ihnen bei der Entscheidung helfen:
| Größere Inserts | Stabile Integration | Keine Integration | Zell-/Gewebespezifität | in vivo Sicherheit | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Um mehr über die viralen Systeme von GeneCopoeia zu erfahren und um zu bestellen, besuchen Sie unsere Website (https://www.genecopoeia.com/product/lentiviral-system/)
Schlussfolgerungen
Wir bei GeneCopoeia sind bestrebt, Ihnen Produkte für die funktionelle Genomik und Zellbiologie in höchster Qualität und auf dem neuesten Stand der Technik anzubieten. Unser Angebot reicht von genomweiten Sets von Plasmid-DNA-Klonen für ORFs, Genpromotoren, miRNAs, shRNA und CRISPR über leistungsstarke Kits und Reagenzien bis hin zu Produkten für fluoreszierende Zellstruktursonden, Nukleinsäurequantifizierung und markierte Antikörper. Um mehr zu erfahren, besuchen Sie bitte unsere Website www.genecopoeia.com oder kontaktieren Sie uns unter [email protected].
DeKelver, et al. (2010). Funktionelle Genomik, Proteomik und regulatorische DNA-Analyse in isogenen Umgebungen unter Verwendung von Zinkfingernuklease-getriebener Transgenese in einen Safe-Harbor-Locus im menschlichen Genom. Genome Res 20, 1133.
Dull, et al. (1998). A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72, 8463.
Ran, et al. (2015). In vivo genome editing using Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Lentivirale Vektoren: basic to translational. Biochem. J. 443, 603.
Samulski und Muzyczka (2014). AAV-vermittelte Gentherapie für Forschung und therapeutische Zwecke. Annu. Rev. Virol. 1, 427.