La definición de Brønsted-Lowry de acidez y basicidad
Empezaremos nuestra discusión de la química ácido-base con un par de definiciones esenciales. La primera de ellas fue propuesta en 1923 por el químico danés Johannes Brønsted y el químico inglés Thomas Lowry, y ha llegado a conocerse como la definición Brønsted-Lowry de acidez y basicidad. Según la definición de Brønsted-Lowry, un ácido es una especie que actúa como donante de protones, mientras que una base es un aceptor de protones. En el capítulo anterior ya hemos comentado uno de los ejemplos más conocidos de reacción ácido-base de Brønsted-Lowry, entre el ácido clorhídrico y el ion hidróxido:
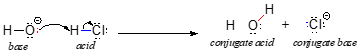
En esta reacción, se transfiere un protón del HCl (el ácido, o donante de protones) al ion hidróxido (la base, o aceptor de protones). Como aprendimos en el capítulo anterior, las flechas curvas representan el movimiento de electrones en este proceso de ruptura y formación de enlaces.
Después de que un ácido de Brønsted-Lowry dona un protón, lo que queda se llama base conjugada. Así, el ion cloruro es la base conjugada del ácido clorhídrico. A la inversa, cuando una base de Brønsted-Lowry acepta un protón se convierte en su forma ácida conjugada: el agua es así el ácido conjugado del ion hidróxido.
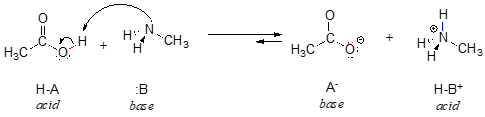
Aquí tenemos una reacción ácido-base orgánica, entre el ácido acético y la metilamina:
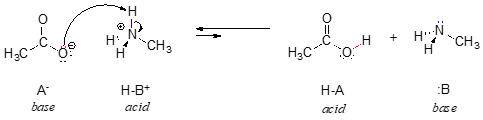
En el reverso de esta reacción, el ion acetato es la base y el ion metilamonio (metilamina protonada) es el ácido.
¿Qué hace que un compuesto sea ácido (susceptible de donar un protón) o básico (susceptible de aceptar un protón)? Responder a esta pregunta es una de nuestras principales tareas en este capítulo, y requerirá que pongamos en práctica gran parte de lo que aprendimos sobre la estructura orgánica en los dos primeros capítulos, así como las ideas sobre termodinámica que revisamos en el capítulo 6.
Por ahora, consideremos sólo una propiedad común de las bases: para actuar como base, una molécula debe tener un par reactivo de electrones. En todas las reacciones ácido-base que veremos en este capítulo, la especie básica tiene un átomo con un par solitario de electrones. Cuando la metilamina actúa como una base, por ejemplo, el par solitario de electrones en el átomo de nitrógeno se utiliza para formar un nuevo enlace a un protón.
Claramente, el ion metilamonio no puede actuar como una base – no tiene un par reactivo de electrones con el que aceptar un protón.
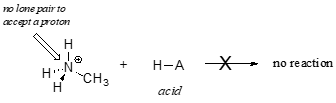
Más adelante, en el capítulo 14, estudiaremos las reacciones en las que un par de electrones en un enlace de un alqueno o anillo aromático actúan de forma básica – pero por ahora, nos concentraremos en la basicidad de los electrones no enlazantes (par solitario).
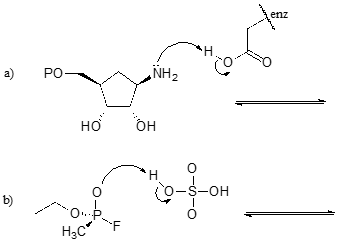
Ejercicio \(\PageIndex{1})
Completar las reacciones de abajo – en otras palabras, dibujar estructuras para los ácidos conjugados que faltan y bases conjugadas que resultan de las flechas curvas proporcionadas.