Definición de la constante de acidez
Sin duda sabe que algunos ácidos son más fuertes que otros. La acidez relativa de diferentes compuestos o grupos funcionales -en otras palabras, su capacidad relativa de donar un protón a una base común en condiciones idénticas- se cuantifica mediante un número llamado constante de acidez, abreviado \ (K_a\). La base común elegida para la comparación es el agua.
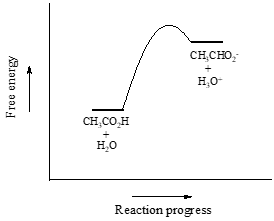
Consideraremos el ácido acético como nuestro primer ejemplo. Si hacemos una solución diluida de ácido acético en agua, se produce una reacción ácido-base entre el ácido (donante de protones) y el agua (aceptor de protones).

El ácido acético es un ácido débil, por lo que el equilibrio favorece a los reactivos sobre los productos – es termodinámicamente «ascendente». Esto se indica en la figura anterior por la longitud relativa de las flechas de reacción hacia delante y hacia atrás.
La constante de equilibrio \ {K_{eq}\} se define como:
{} = \frac{}{}]
Recuerda que se trata de una solución acuosa diluida: hemos añadido una pequeña cantidad de ácido acético a una gran cantidad de agua. Por lo tanto, en el curso de la reacción, la concentración de agua (aproximadamente 55,6 mol/L) cambia muy poco, y puede tratarse como una constante.
Si trasladamos el término constante de la concentración de agua al lado izquierdo de la expresión de la constante de equilibrio, obtenemos la expresión de \(K_a\), la constante ácida del ácido acético:
\a = \frac{}{}]
En términos más generales, la constante de disociación para un ácido dado HA o HB+ se expresa como:
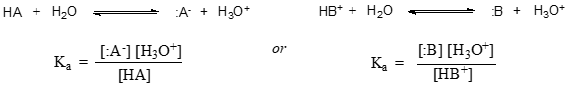
El valor de \(K_a\) para el ácido acético es \(1.75 \times 10^{-5}\️) – mucho menos que \️(1\️), lo que indica que hay mucho más ácido acético en solución que iones de acetato e hidronio.
Por el contrario, el ácido sulfúrico, con un \(K_a\) de aproximadamente \(10^9\), o el ácido clorhídrico, con un \(K_a\) de aproximadamente \(10^7\), ambos experimentan una disociación esencialmente completa en el agua: son ácidos muy fuertes.
Una cifra como \(1,75 \\N veces 10^{- 5}} no es muy fácil ni de decir, ni de recordar, ni de visualizar, por lo que los químicos suelen utilizar un término más cómodo para expresar la acidez relativa. El valor \(pK_a\) de un ácido es simplemente el logaritmo (base 10) de su valor \(K_a\).
Haciendo cuentas, encontramos que el \(pK_a\) del ácido acético es \(4,8\). El \(pK_a\) del ácido sulfúrico es -10, y el del ácido clorhídrico es -7. El uso de los valores de \(pK_a\) nos permite expresar la acidez relativa de los compuestos y grupos funcionales comunes en una escala numérica que va de -10 (para un ácido muy fuerte) a 50 (para un compuesto que no es ácido en absoluto). Cuanto más bajo sea el valor de \(pK_a\), más fuerte será el ácido.
Los grupos funcionales ionizables (que donan o aceptan protones) relevantes para la química orgánica biológica suelen tener valores de \(pK_a\) que oscilan entre 5 y 20 aproximadamente. Los más importantes se resumen a continuación, con valores \(pK_a\) muy aproximados para las formas de ácidos conjugados. También se incluyen como referencia más grupos ácidos con valores de \(pK_a) cercanos a cero.
Valores aproximados de \(pK_a)
| grupo | aproximado de \(pK_a) |
|---|---|
| Ión hidronio | 0 |
| Alcohol protonado | 0 |
| Carbonilo protonado | 0 |
| Ácidos carboxílicos | 5 |
| Iminas protonadas | 7 |
| Aminas protonadas | 10 |
| fenoles | 10 |
| tioles | 10 |
| alcoholes, agua | 15 |
| Ácidos de carbono (alfa) * | 20 |
*ácidos de carbono (alfa) se explicará en la sección 7.6A
Se recomienda encarecidamente memorizar ahora estos valores aproximados; luego, si necesita un valor más preciso, siempre podrá buscarlo en una tabla de \(pK_a\) más completa. El apéndice de este libro contiene una tabla más detallada de los valores típicos de \(pK_a), y hay tablas mucho más completas disponibles en recursos como el Handbook of Chemistry and Physics.
\(pK_a\) frente a \(pH\)
Es importante darse cuenta de que \(pK_a\) no es lo mismo que \(pH\): la primera es una propiedad inherente a un compuesto o grupo funcional, mientras que la segunda es una medida de la concentración de iones de hidronio en una solución acuosa determinada:
\\N]
Conocer los valores de \N(pK_a\N) no sólo nos permite comparar la fuerza de los ácidos, sino también la de las bases. La idea clave que hay que recordar es ésta: cuanto más fuerte es el ácido conjugado, más débil es la base conjugada. Podemos determinar que el ion hidróxido es una base más fuerte que el amoníaco (\(NH_3\)), porque el ion amonio (\(NH4^+\), \(pK_a = 9.2\)) es un ácido más fuerte que el agua (\(pK_a = 15,7\)).
Ejercicio \(\PageIndex{1})
¿Cuál es la base más fuerte, \(CH_3O^-\) o \(CH_3S^-\)? ¿Ión acetato o amoníaco? ¿Ion hidróxido o ion acetato?
Pongamos en práctica nuestra comprensión del concepto de \(pK_a) en el contexto de una molécula más compleja. Por ejemplo, ¿cuál es el \(pK_a\) del compuesto de abajo?

Necesitamos evaluar la acidez potencial de cuatro tipos diferentes de protones en la molécula, y encontrar el más ácido. Los protones aromáticos no son todos ácidos – su \ (pK_a\) es de aproximadamente 45. El grupo amina tampoco es ácido, su \ (pK_a) es de aproximadamente 35. (Recuerde que las aminas sin carga son básicas: son las aminas protonadas con carga positiva, con valores de \(pK_a\) en torno a 10, las que son débilmente ácidas). El protón del alcohol tiene un \(pK_a\) de alrededor de 15, y el protón del fenol tiene un \(pK_a\) de alrededor de 10: por lo tanto, el grupo más ácido en la molécula de arriba es el fenol. (Asegúrese de que puede reconocer la diferencia entre un fenol y un alcohol – recuerde, en un fenol el grupo \(OH\) está unido directamente al anillo aromático). Si esta molécula reaccionara con un equivalente molar de una base fuerte como el hidróxido de sodio, sería el protón del fenol el que se donaría para formar un anión fenolato.
Ejercicio \(\PageIndex{2})
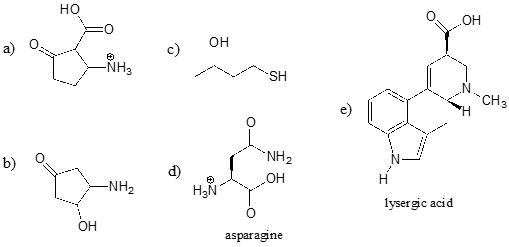
Identifique el grupo funcional más ácido de cada una de las moléculas que aparecen a continuación, y dé su \(pK_a\) aproximado.