| Ed Davis, Ph.D. |
Introducción
Lentivirus y virus adeno-asociados (AAV) han demostrado ser muy valiosos para introducir material genético en células de mamíferos, ya sea en cultivo o en animales enteros. Ambos sistemas son muy adecuados para muchas aplicaciones de investigación básica, como la sobreexpresión de proteínas, la producción de anticuerpos y la eliminación de genes, y ambos son prometedores para la terapia génica. Sin embargo, cada sistema viral tiene sus propias ventajas y desventajas, dependiendo de la aplicación. GeneCopoeia ofrece amplias líneas de productos tanto para lentivirus como para AAV, lo que le proporciona opciones potentes y flexibles para introducir el ADN en las células. En esta nota técnica, describimos las tecnologías en las que se basan las líneas de productos de lentivirus Lentifect™ y AAVPrime™ AAV de GeneCopoeia, y analizamos las ventajas de cada tecnología para diversas aplicaciones con el fin de ayudarle a elegir el sistema que mejor se adapte a sus necesidades.
¿Por qué utilizar virus para la administración de ADN?
Una de las formas más comunes de administrar ADN a las células es a través de la transfección basada en plásmidos, en la que las células se tratan con compuestos químicos como el fosfato de calcio, o con reactivos basados en lípidos. Sin embargo, la transfección de plásmidos no siempre es deseable o práctica. Por ejemplo, algunas células son muy difíciles o imposibles de transfectar, mientras que la mayoría de las células cultivadas admiten la infección (también conocida como transducción) mediante lentivirus o AAV. En segundo lugar, la transfección de plásmidos no puede utilizarse para la entrega de ADN in vivo, pero la transducción viral sí. Tanto los lentivirus como los AAV pueden utilizarse para una multitud de aplicaciones, como la expresión de proteínas a partir de marcos de lectura abiertos (ORF), la eliminación de genes por interferencia de ARN (ARNi) mediada por ARN de horquilla corta (ARNhc), la luciferasa y otros ensayos de genes informadores, y la eliminación de genes mediada por el sistema de repeticiones palindrómicas cortas agrupadas y regularmente espaciadas (CRISPR-Cas9). Muchas de estas aplicaciones de los vectores virales se han llevado a cabo con éxito en líneas celulares inmortalizadas de mamíferos, en cultivos celulares primarios, en modelos animales y en terapia génica en pacientes humanos.
El término «Lentivirus» se refiere a la clase de retrovirus que incluye el virus de la inmunodeficiencia humana (VIH) y, de hecho, la mayoría de los sistemas lentivirales que se utilizan actualmente derivan del VIH (revisado en Mátrai, et al., 2010; Sakuma, et al., 2012). Los lentivirus portadores de transgenes se integran en el genoma en el momento de la infección, por lo que permiten una expresión estable tanto en células que se dividen como en las que no lo hacen.
Los sistemas lentivirales han sido muy modificados a partir del VIH a lo largo de varias generaciones para hacerlos seguros de manejar y útiles para sus aplicaciones. GeneCopoeia utiliza el sistema lentiviral de tercera generación (Dull, et al. 1998), que requiere cuatro plásmidos separados para producir partículas virales infecciosas (viriones). Un plásmido lentiviral de GeneCopoeia sólo lleva el gen de interés (GOI) que se va a expresar, un gen de selección de antibióticos y las secuencias de señal de empaquetamiento. A veces, el clon también incluye un gen reportero fluorescente. El plásmido que contiene el GOI, con el marcador seleccionable y el gen informador, puede albergar inserciones de hasta unos 5-6 kb. (Figura 1), aunque los títulos virales disminuyen drásticamente cuando el tamaño de los insertos supera los 4 kb.
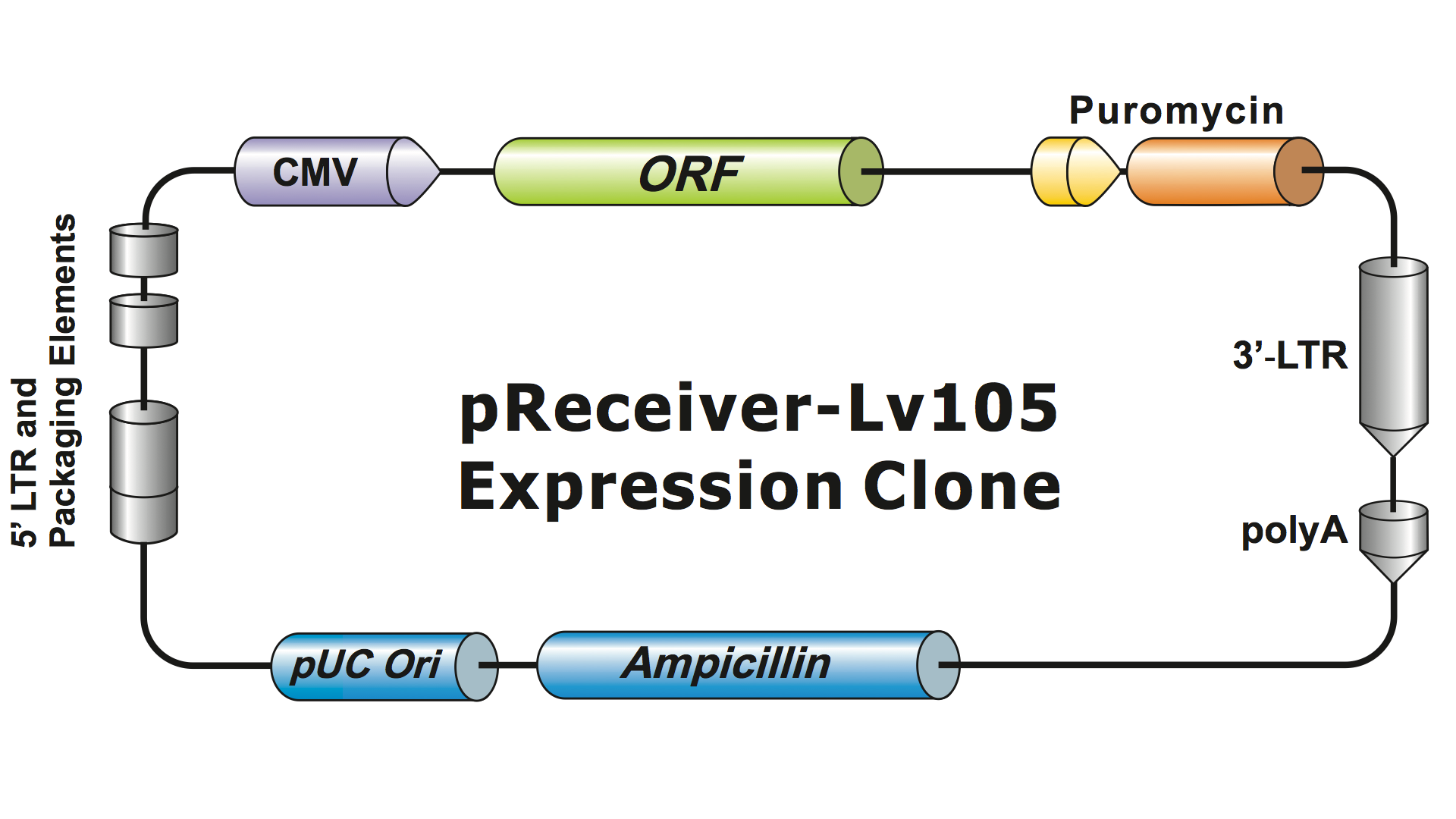 |
Figura 1. Ejemplo de clon de expresión lentiviral de GeneCopoeia |
Los plásmidos adicionales expresan los elementos retrovirales necesarios para el empaquetamiento y la integración (gag, pol, env, Rev). Cuando los cuatro plásmidos se expresan en las células de empaquetamiento, el ARN del GOI se incorpora a las partículas. Como las proteínas retrovirales se expresan sólo durante el empaquetamiento, las células infectadas no pueden producir virus infecciosos. Además, las partículas lentivirales Lentifect™ de GeneCopoeia contienen una deleción en la región U3 de las LTR, lo que las hace autoinactivables (SIN). La deleción SIN impide la replicación lentiviral en el raro caso de que los cuatro plásmidos se recombinen para crear un único plásmido viral activo. Por lo tanto, las partículas lentivirales son seguras de manipular, con prácticamente ninguna posibilidad de generar virus patógenos.
Además de las modificaciones de seguridad mejoradas, las partículas lentivirales Lentifect™ de GeneCopoeia llevan la glicoproteína del virus de la estomatitis vesicular G (VSV-G) en lugar del gen env del VIH de tipo salvaje, lo que cambia el tropismo tisular del virus de las células T CD4+ a prácticamente cualquier tipo de célula de mamífero. Como tal, los lentivirus son un sistema ampliamente utilizado para el cultivo de células de mamíferos, modelos animales y aplicaciones de terapia génica.
Debido a que los vectores lentivirales han sido modificados de estas maneras, los sistemas lentivirales Lentifect™ de GeneCopoeia tienen una seguridad mejorada, y tienen las siguientes características que los hacen altamente útiles para la entrega de ADN:
- Infectan casi todos los tipos de células de mamíferos
- Pueden utilizarse para liberar secuencias de ADN relativamente grandes -hasta unos 5-6 kb de longitud
- Pueden utilizarse para generar líneas celulares estables, o impulsar la expresión génica estable en órganos y tejidos in vivo, gracias a la integración del transgén en lugares aleatorios del genoma
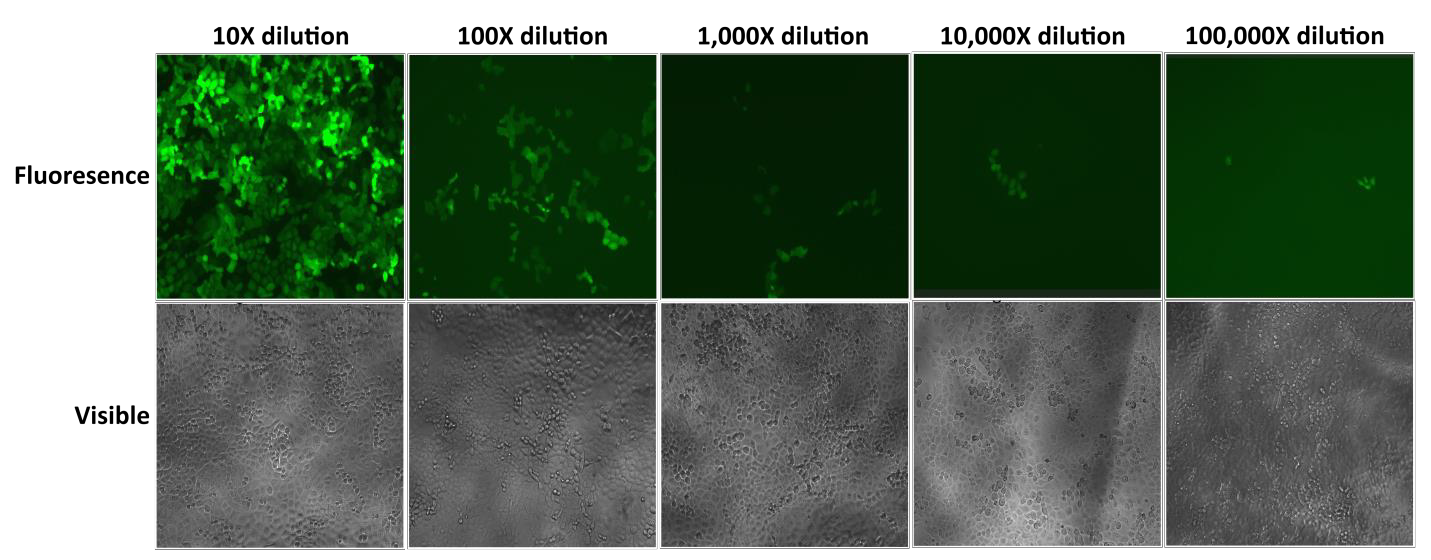
Las partículas lentivirales Lentifect™ de GeneCopoeia proporcionan títulos elevados, lo que permite a los investigadores expresar eficazmente los genes de interés (Figura 2).
|
Figura 2. Prueba de diluciones en serie de partículas lentivirales Lentifect™. La fluorescencia de la eGFP se fotografió con un microscopio de fluorescencia 72 horas después de la transducción. |
|
GeneCopoeia ofrece una de las líneas más extensas de productos lentivirales de la industria (Tabla 1).
| Producto/servicio | Descripción |
| Clones lentivirales y vectores de clonación | Clones prefabricados y personalizados que llevan ORFs, promotores, shRNAs, miRNA 3′ UTRs, precursores e inhibidores, sgRNAs y más. Disponibles con múltiples promotores, etiquetas y reporteros. Vectores para la clonación de secuencias de interés. |
| Partículas lentivirales Lentifect™ | Partículas lentivirales prefabricadas y envasadas a medida, listas para usar. Producidas a partir de las extensas colecciones de clones de todo el genoma de GeneCopoeia o de clones enviados por el cliente. |
| Reactivos de empaquetado lentiviral Lenti-Pac™ | Sistema completo de reactivos para la producción de partículas lentivirales «hágalo usted mismo». Incluye plásmidos de empaquetamiento, línea celular de empaquetamiento, solución de concentración de partículas y kit de valoración. |
Tabla 1. Línea de productos y servicios lentivirales de GeneCopoeia.
Sistemas basados en AAV
En contraste con el genoma de ARN de los lentivirus, el AAV tiene un genoma de ADN de una sola hebra (Samulski y Muzyczka, 2014). Además, el AAV no se deriva de un patógeno, sino que es un contaminante del adenovirus, sin que se le atribuyan condiciones patógenas. El AAV de origen natural se integra en el genoma como los lentivirus, pero sólo en el locus AAVS1 del cromosoma 19. Este sitio también se conoce como «Safe Harbor» (puerto seguro), porque se suele utilizar para la inserción de transgenes sin dañar las células (DeKelver, et al., 2010).
Al igual que el lentivirus, el AAV se ha modificado para que sea más seguro y utilizable. El AAV requiere la coinfección con un virus auxiliar. El genoma del AAV tiene una longitud de 4,7 kb y contiene 2 genes, Rep y Cap, que son necesarios para la replicación e integración viral. En AAVPrime™, Rep y Cap se eliminan, dejando sólo las repeticiones terminales invertidas (ITR) de 145 pb. La eliminación de Rep y Cap tiene tres propósitos: 1) elimina la capacidad de un virus ayudante para permitir que las células infectadas por el AAV produzcan nuevos viriones del AAV; 2) permite la inserción de genes de hasta aproximadamente 4 kb de longitud (aunque el título viral disminuye con transgenes de más de 3 kb); y 3) elimina prácticamente la capacidad de integración del AAV. El pequeño tamaño del AAV supone un reto para algunas aplicaciones. Por ejemplo, para la edición del genoma CRISPR, los investigadores utilizan la nucleasa Cas9 de S. aureus, porque es aproximadamente un 30% más corta que la Cas9 de S. pyogenes, más comúnmente utilizada (Ran, et al, 2015).
Para el empaquetamiento, Rep y Cap se han trasladado a un plásmido diferente, y los genes ayudantes de Adenovirus se colocan en un tercer plásmido, lo que hace que todo el sistema de empaquetamiento sea seguro y libre de virus ayudantes (Figura 3).
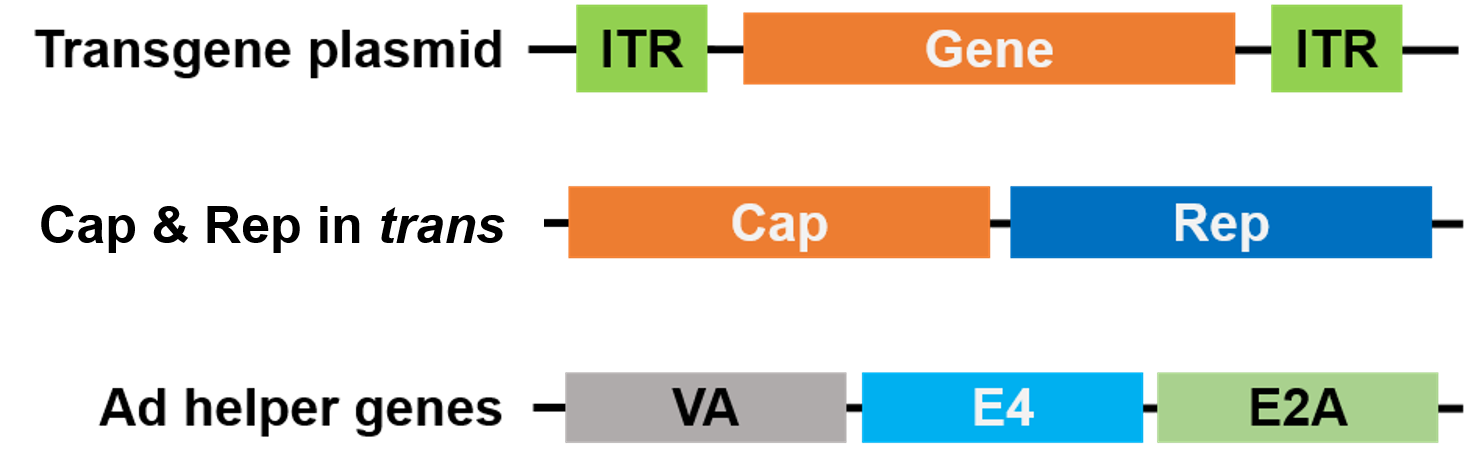 |
Figura 3. AAV sin virus ayudante. Se utilizan 3 plásmidos para el empaquetamiento. El plásmido del gen de interés (arriba) contiene las repeticiones terminales invertidas (ITRs). Un segundo plásmido (centro) lleva los genes Cap y Rep del AAV, y el tercer plásmido (abajo) lleva los genes requeridos del Adenovirus (Ad) |
Además, el AAV existe en diferentes serotipos, que afectan a la especificidad tisular de la infección del AAV. Los múltiples serotipos permiten a los investigadores a) infectar una amplia gama de células huésped; o b) limitar la infección a uno o unos pocos tejidos. Las partículas AAVPrime™ de GeneCopoeia están disponibles en múltiples serotipos (Tabla 2).
| Serotipo | Tejido objetivo primario | Descripción |
| AAV-1 | Músculo | Mejor para músculo cardíaco, músculo esquelético, tejido neuronal y glial. |
| AAV-2 | Músculo, hígado, retina | El serotipo más utilizado. El mejor para las neuronas, el músculo, el hígado y el cerebro. |
| AAV-3 | Megacariocitos | El mejor para los megacariocitos, el músculo, el hígado, el pulmón y la retina. |
| AAV-4 | Retina | Mejor para neuronas, músculo, cerebro y retina. |
| AAV-5 | Pulmón | Lo mejor para pulmón, neuronas, articulación sinovial, retina y páncreas. |
| AAV-6 | Músculo, pulmón | Lo mejor para pulmón, hígado y corazón. |
| AAV-7 | Músculo, Retina, Neuronas | Lo mejor para músculo, neuronas e hígado. |
| AAV-8 | Hígado | Lo mejor para músculo, cerebro, hígado y retina. |
| AAV-9 | Varios | Mejor para músculo, corazón, hígado, pulmón y cerebro. |
| AAV-10 | Pleura, SNC | Clonado de Cynomolgus, casi idéntico a AAVrh10 excepto por 12 aminoácidos en VP1. Mejor para pulmón, músculo, corazón, SNC e hígado. |
| AAV-DJ | Varios | Una mezcla de 8 serotipos de origen natural. Transduce eficazmente una amplia variedad de tipos de células in vitro. |
| AAV-DJ/8 | Varios | Una variante del AAV-DJ con una mutación del dominio de unión a la heparina (HBD), que permite la infección del hígado así como de otros tejidos in vivo. |
Tabla 2. Lista de serotipos de AAV ampliamente utilizados
Las partículas de AAV de AAVPrime™ tienen las siguientes características que las hacen muy útiles para la entrega de ADN:
- Títulos altos. El título de las partículas purificadas puede ser de hasta 10^14 GC/ml (copias del genoma/ml)
- Versátil. Múltiples serotipos permiten su uso en una amplia o limitada gama de células huésped
- Baja toxicidad. No se integra en el genoma del huésped.
- Baja inmunogenicidad. Respuesta inmunitaria mínima del huésped.
- Seguro. No se asocia a ninguna enfermedad humana
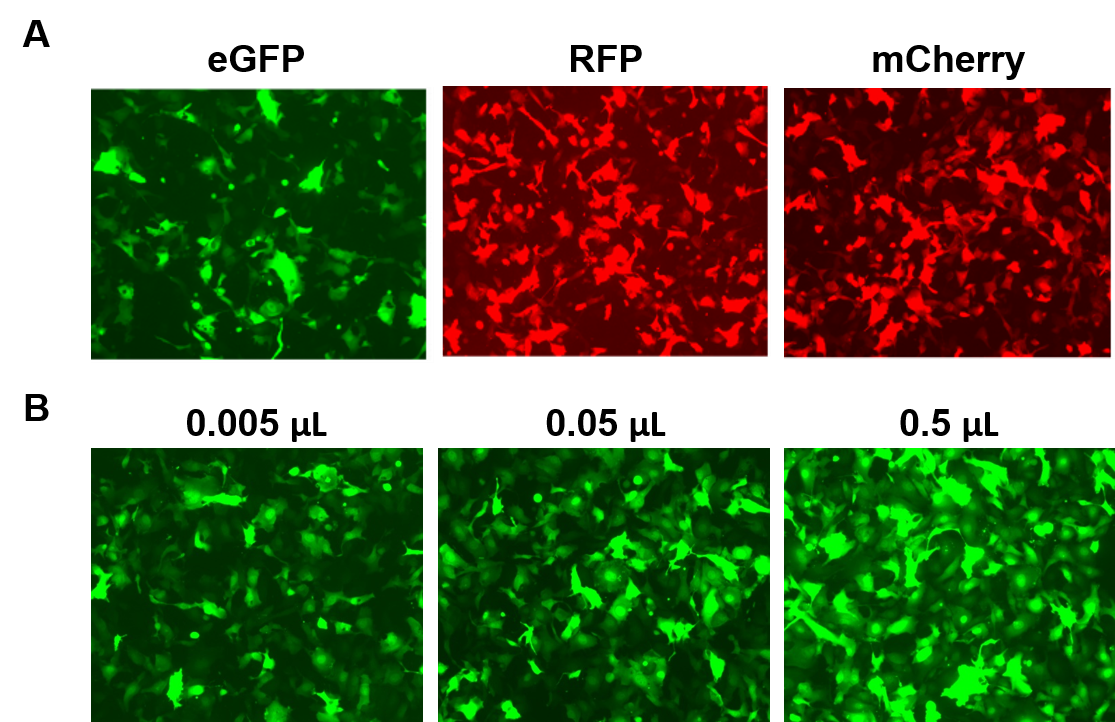
Las partículas AAVPrime™ están disponibles para ORFs humanos y de ratón de hasta 3 kb, en múltiples serotipos y opciones de promotores, en pureza estándar (sólo para uso in vitro) o purificada (para uso in vivo). Los clientes pueden pedir clones de plásmidos, partículas generadas a medida para los genes de interés, o elegir entre las opciones prefabricadas que expresan genes como reporteros fluorescentes (Figura 4).
|
Figura 4. Rendimiento de las partículas AAVPrime™ de GeneCopoeia. A. Células HT1080 en placas de 24 pocillos transducidas con 0,5 µl de AAV de pureza estándar que expresan GFP mejorada (eGFP), proteína roja fluorescente (RFP) y Cherry monomérico (mCherry). B. Se transducen células HT1080 en placas de 24 pocillos con cantidades variables de AAV purificado que expresa eGFP. Las células se visualizaron con un microscopio de fluorescencia (Tiempo de exposición: 400 ms). |
|
¿Qué debo elegir: ¿Lentivirus o AAV?
Elegir entre lentivirus y AAV depende de muchos factores. Por ejemplo, el hecho de que los lentivirus se integren en el genoma puede ser tanto una ventaja como una desventaja, dependiendo de cuáles sean sus necesidades. Consulte la siguiente tabla para ayudarle a decidir:
| Insertos más grandes | Integración estable | Sin integración | Especificidad de célula/tejido | Seguridad in vivo | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Para saber más sobre los sistemas virales de GeneCopoeia y hacer un pedido, visite nuestro sitio web (https://www.genecopoeia.com/product/lentiviral-system/)
Conclusiones
En GeneCopoeia, nos esforzamos por ofrecerle la más alta calidad, tecnología de vanguardia en productos para Genómica Funcional y Biología Celular. Ofrecemos una amplia gama de productos, desde conjuntos de clones de ADN plasmídico para ORFs, promotores de genes, miRNAs, shRNA y CRISPR, hasta potentes kits y reactivos, pasando por productos para sondas fluorescentes de estructura celular, cuantificación de ácidos nucleicos y anticuerpos marcados. Para obtener más información, visite nuestro sitio web, www.genecopoeia.com, o póngase en contacto con nosotros en [email protected].
DeKelver, et al. (2010). Genómica funcional, proteómica y análisis del ADN regulador en entornos isogénicos utilizando la transgénesis impulsada por nucleasas de dedos de zinc en un locus de puerto seguro en el genoma humano. Genome Res 20, 1133.
Dull, et al. (1998). A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72, 8463.
Ran, et al. (2015). Edición del genoma in vivo usando Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Lentiviral vectors: basic to translational. Biochem. J. 443, 603.
Samulski y Muzyczka (2014). Terapia génica mediada por AAV para fines de investigación y terapéuticos. Annu. Rev. Virol. 1, 427.