- Introducción
- Materiales y métodos
- Población del estudio
- Variables del estudio
- Resultados
- Distribución del grupo sanguíneo AB0/Rh en pacientes con CaP
- No hay diferencias significativas en las características clinicopatológicas entre los pacientes con PCa según los grupos sanguíneos AB0/Rh
- Sin valor pronóstico significativo del grupo sanguíneo para la supervivencia libre de BCR después de la RP
- Discusión
- Consentimiento informado
- Declaración ética
- Contribuciones de los autores
- Declaración de conflicto de intereses
Introducción
El cáncer de próstata (CaP) es el tumor maligno más frecuente en los países occidentales y la segunda causa de muerte relacionada con el cáncer en los varones (1). Los factores de riesgo más reconocidos para desarrollar un CaP son el aumento de la edad, el origen étnico y los antecedentes familiares (2). La predisposición familiar sugiere un componente genético heredado de la enfermedad (3), pero sólo representa una minoría (5-10%) de los casos de CaP. En consecuencia, aún se desconocen los factores ambientales y genéticos que predisponen a la mayoría de los pacientes (4, 5). El grupo sanguíneo AB0 es una característica hereditaria que se ha asociado con la incidencia y el pronóstico de varios tumores malignos (6-8). Se han propuesto varios mecanismos plausibles, como la inflamación, la vigilancia inmunitaria de las células malignas, la adhesión intercelular y la señalización de membrana, para explicar la asociación observada entre los grupos sanguíneos AB0 y el riesgo de cáncer.
Los antígenos del grupo sanguíneo AB0 (ABH) son glicoproteínas que se expresan en la superficie de los glóbulos rojos. Los antígenos fenotípicos A y B son carbohidratos terminales sintetizados por la adición de azúcares simples catalizada por una serie de glucosiltransferasas específicas. El fenotipo 0 se caracteriza por la ausencia de glicosiltransferasas A y B, de modo que sólo está presente una columna vertebral proteica, el antígeno H. Los antígenos de los glóbulos rojos tienen varias funciones, como la integridad estructural de la membrana, el transporte de moléculas a través de las membranas y la adhesión (9). Además de su expresión en los glóbulos rojos, los antígenos ABH también se expresan en diversas células epiteliales, como el urotelio, la mucosa gastrointestinal y los pulmones. Varios estudios demostraron cambios en el patrón de expresión de ABH en las células cancerosas según el grado del tumor y la progresión de la enfermedad, lo que sugiere una posible asociación entre el grupo sanguíneo AB0 y el riesgo de algunas neoplasias epiteliales (8, 10). Estudios recientes demostraron que los individuos del grupo sanguíneo A, AB o B tenían una mayor incidencia de cáncer de páncreas en comparación con los del grupo sanguíneo 0, mientras que el mayor riesgo entre se encontró relacionado con el grupo sanguíneo B (8). Del mismo modo, se informó de que el serotipo sanguíneo A estaba asociado a un mayor riesgo de cáncer gástrico, de mama y de ovario (11). Por otra parte, el grupo sanguíneo 0 se correlacionó con las mayores tasas de recurrencia y progresión tras la resección transuretral de la vejiga y, por tanto, se asoció con un peor pronóstico en pacientes con carcinoma urotelial de vejiga no invasivo (6).
Basado en la evidencia actual del papel predictivo del grupo sanguíneo en varias neoplasias, planteamos la hipótesis de que el tipo de grupo sanguíneo puede ser utilizado como un parámetro adicional, que facilita la evaluación de los riesgos y ayuda a estimar el pronóstico después de la cirugía en pacientes con CaP. En la literatura actual, sólo se dispone de pruebas clínicas limitadas en relación con el grupo sanguíneo y el CaP en general, que han demostrado resultados controvertidos (12-14). Además, en la actualidad, sólo existe un estudio centrado especialmente en el impacto de los grupos sanguíneos en el resultado de los pacientes tras la prostatectomía radical (PR) (13). Utilizando 555 pacientes con CaP sometidos a PR, los autores mostraron que el grupo sanguíneo AB0 era un predictor independiente de la recidiva bioquímica (RB) en el análisis multivariable, pero no en el análisis univariable.
Por lo tanto, el objetivo del presente estudio fue añadir más información al debate en curso mediante el análisis de la correlación del grupo sanguíneo AB0/Rh y su distribución dentro de los pacientes con PCa, la patología del tumor, la recurrencia y la mortalidad en pacientes con PCa localizado sometidos a RP mediante el uso de un gran conjunto de datos de un solo centro de 3.574 pacientes.
Materiales y métodos
Población del estudio
El estudio fue aprobado por la junta de revisión institucional. Un total de 3.582 pacientes con CaP clínicamente localizado que se sometieron a RP en nuestra institución entre 2009 y 2010 fueron seleccionados para la inclusión en el estudio. Se excluyeron aquellos con conjuntos de datos incompletos y seguimiento faltante (n = 8), dejando a 3.574 pacientes disponibles para el análisis.
La prostatectomía radical se realizó utilizando un enfoque retropúbico abierto (n = 3.220) o un enfoque laparoscópico asistido por robot (n = 354), como se describió anteriormente (15). La disección de los ganglios linfáticos se realizó en los pacientes de riesgo intermedio y alto de D’Amico, de acuerdo con las directrices de la Asociación Europea de Urología (EAU) para el CaP (16). Las muestras quirúrgicas se procesaron según los procedimientos histopatológicos estándar y fueron evaluadas por uropatólogos experimentados en un centro de gran volumen (>2.000 muestras de prostatectomía al año). Los tumores se clasificaron según el sistema de clasificación TNM del American Joint Committee on Cancer de 2007 y la clasificación histopatológica se asignó según el sistema Gleason (17).
Todos los participantes se sometieron a pruebas serológicas antes de la RP. La confirmación de laboratorio del grupo sanguíneo AB0 y Rh se obtuvo del Departamento de Medicina Transfusional del Hospital Universitario de Hamburgo-Eppendorf. Se utilizó como control la distribución de referencia AB0 de la población alemana (18).
Variables del estudio
Las variables del estudio incluyeron el grupo sanguíneo AB0/Rh, la edad, el antígeno prostático específico (PSA) preoperatorio, el volumen de la próstata (ecografía transrectal), la puntuación de Gleason (espécimen), el estadio pT, el estado pN, el margen quirúrgico, el BCR y la mortalidad tras la RP. El seguimiento de los pacientes consistió en pruebas de PSA cada 3-6 meses durante los primeros 2 años después de la RP, el BCR se definió como un nivel de PSA ≥0,2 ng/ml.
La relación entre el grupo sanguíneo AB0 y las variables clinicopatológicas se evaluó mediante pruebas de chi-cuadrado y pruebas t. En el análisis multivariable de regresión de Cox (pruebas de rango logarítmico), se evaluó el impacto del grupo sanguíneo, el PSA preoperatorio, la puntuación de Gleason, el estadio pT, el estado pN y el margen quirúrgico en la supervivencia libre de BCR, con el fin de evaluar los valores pronósticos de supervivencia. La probabilidad de supervivencia libre de BCR se comparó en los grupos 0, A, B y AB mediante el análisis de Kaplan-Meier y la prueba de rango logarítmico.
Todas las pruebas fueron de dos colas y los valores p <0,05 se consideraron estadísticamente significativos. Los análisis estadísticos se realizaron con el software JMP v9.0.2 (SAS Institute, Inc, Cary, NC, EE.UU.) y R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Resultados
Un total de 3.574 pacientes con CaP clínicamente localizado fueron elegibles para los análisis finales, la mediana de edad en el momento de la cirugía fue de 65 años (rango: 38-80) y la mediana de seguimiento fue de 36,9 meses (Tabla 1).

Tabla 1. Asociación del grupo sanguíneo AB0 y del factor Rhesus con las características clinicopatológicas de 3.574 pacientes tratados con prostatectomía radical.
Distribución del grupo sanguíneo AB0/Rh en pacientes con CaP
La distribución del grupo sanguíneo AB0 entre los pacientes con CaP antes de la PR fue la siguiente: 0 en 1.350 (38%), A en 1.605 (45%), B en 445 (12%) y AB en 174 (5%) pacientes, el 83% de los pacientes eran Rh positivos (Tabla 1). La distribución de referencia para la población alemana es la siguiente (18): 0 en el 41%; A en el 43%; B en el 11%; AB en el 5%; Rhesus positivo: 85%. Las distribuciones generales de los grupos sanguíneos AB0 y Rh en la cohorte del estudio fueron equivalentes a la distribución observada en la población masculina alemana.
No hay diferencias significativas en las características clinicopatológicas entre los pacientes con PCa según los grupos sanguíneos AB0/Rh
La mayoría de los pacientes tenían un PCa clínicamente localizado con un perfil de riesgo intermedio. La puntuación de Gleason más reportada fue 3 + 4 (66,9%) y el 63,3% de los pacientes tenían niveles de PSA preoperatorios dentro del rango de 4-10 ng/ml. Se detectaron tumores pT2 en el 68,7% y se lograron márgenes negativos en el 81,3% de los pacientes. La mediana del volumen prostático fue de 40 ml y se diagnosticó afectación ganglionar en 224 (6,3%) pacientes (Tabla 1). No hubo diferencias significativas en las características clinicopatológicas entre los pacientes con diferentes grupos sanguíneos AB0. Se encontraron porcentajes ligeramente mayores de estadio tumoral avanzado (≥pT3b) en los pacientes con grupo sanguíneo AB en comparación con los grupos sanguíneos 0, A y B (16,1, 12,6, 9,9 y 13,7%, respectivamente, p = 0,033). La población de pacientes con AB también mostró una proporción moderadamente mayor de factor Rh negativo (21,8%) en comparación con los otros grupos sanguíneos (16,9%, p = 0,01) (Tabla 1).
Sin valor pronóstico significativo del grupo sanguíneo para la supervivencia libre de BCR después de la RP
Según el análisis de regresión cox multivariable, el PSA preoperatorio, la puntuación de Gleason, el estadio pT, el estado pN y el margen quirúrgico se correlacionaron de forma significativa e independiente con la supervivencia libre de BCR (todos p < 0,05) (Tabla 2). Sin embargo, no pudimos observar ningún impacto del grupo sanguíneo AB0 en las tasas de BCR (Figura 1). Se evaluó además el valor pronóstico del grupo sanguíneo 0 en comparación con los grupos sanguíneos no 0, así como dentro de los grupos sanguíneos alternativos A/B/AB, con resultados no significativos (Tabla 2). Incluso si se realizó un subanálisis con pacientes con estado de margen positivo o negativo solamente, la influencia de AB0/Rh en el BCR siguió siendo insignificante (Figuras 2A,B). Además, el estado del factor Rhesus de los pacientes tampoco tuvo impacto en la supervivencia libre de BCR (p = 0,74).
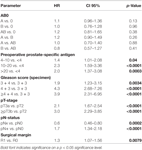
Tabla 2. Modelos multivariables de regresión cox de AB0 y factores pronósticos estándar para la supervivencia libre de recidiva bioquímica.
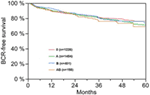
Figura 1. Supervivencia libre de recidiva bioquímica (BCR) tras prostatectomía radical estratificada por grupos sanguíneos AB0 (p = 0,572).
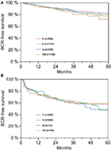
Figura 2. (A,B) Supervivencia libre de recidiva bioquímica (BCR) tras prostatectomía radical estratificada por grupos sanguíneos AB0 en pacientes con estado de margen quirúrgico negativo y positivo.
Discusión
Se ha informado con frecuencia de posibles asociaciones entre el grupo sanguíneo AB0 y el riesgo de algunas neoplasias epiteliales, como el cáncer de páncreas, colorrectal y gástrico (19, 20). Además, los grupos sanguíneos AB0/Rh están disponibles para la mayoría de los pacientes antes de la intervención quirúrgica, por lo que se sugieren como un marcador complementario ideal sin necesidad de pasos adicionales de procesamiento en el laboratorio.
Hace varias décadas, los estudios inmunohistoquímicos indicaron que las células de PCa derivadas de pacientes muestran diferentes patrones de expresión de ABH que las células de próstata normales/benignas (21). Dado que se ha informado de que tanto el grupo sanguíneo AB0 como su expresión de antígeno en el tejido están asociados con la incidencia, la progresión de la enfermedad y el resultado en varias neoplasias malignas (8, 22, 23), esta expresión alterada del antígeno ABH en el tejido de la próstata sugirió una posible influencia del grupo sanguíneo en la transformación maligna de las células de la próstata.
Un estudio reciente publicado por Markt y sus colegas (14) analizó la relación entre el grupo sanguíneo AB0 y el riesgo de albergar un PCa agresivo. Los autores analizaron un conjunto de datos de 2.774 pacientes con PCa agresivo y 4.443 pacientes sin PCa como controles. Con estos datos, no se pudo demostrar una correlación significativa entre el grupo sanguíneo AB0 o la «dosis» de alelos A o B y el riesgo de padecer un PCa agresivo. Aunque los autores también informaron de la mortalidad específica por cáncer y de la mortalidad general estratificada por grupos sanguíneos, el estudio no incluía información sobre el tratamiento del PCa. Además, sólo se incluyeron pacientes con tumores agresivos, lo que podría enmascarar el efecto potencial de los diferentes grupos sanguíneos.
Estos resultados están en consonancia con un estudio realizado por Kvist y sus colegas, que demostró que no había correlación entre el grupo sanguíneo AB0 y la supervivencia de los pacientes con PCa tratados con espera vigilante. Este estudio estaba limitado principalmente por el reducido número de casos (n = 279) (12). Curiosamente, el único estudio centrado en pacientes después de la RP, que incluía 555 pacientes japoneses, informó recientemente de que el grupo sanguíneo 0 se asociaba significativamente con un menor riesgo de RCB después de la RP en el análisis multivariable, pero no en el univariable (13). En el subanálisis de pacientes con un margen quirúrgico negativo, la tasa de ausencia de RBC a los 5 años en el grupo sanguíneo 0 fue significativamente mayor que en el grupo A (91,2 frente a 71,0%; p = 0,026). En esta cohorte de estudio, el 46,3% de los pacientes tenían un estado de margen positivo a pesar de un estadio clínico de T1c en el 74,2% de los pacientes. No se mencionó el estadio patológico (pT).
Nuestra cohorte retrospectiva de 3.574 pacientes con CaP clínicamente localizado es la mayor cohorte que se ha analizado hasta ahora para determinar un posible impacto de los grupos sanguíneos AB0 y Rh en las características del tumor y el resultado tras la RP. En el presente estudio, la mayoría de los pacientes tenían tumores pT2 (68,7%) y el 18,6% tenían un estado de margen positivo. Con estos datos, no pudimos mostrar ningún impacto significativo de los grupos sanguíneos AB0/Rh sobre las características clinicopatológicas (PSA preoperatorio, puntuación de Gleason, volumen de la próstata, estadio pT, estado pN y margen quirúrgico) y la supervivencia libre de BCR tras la RP curativa. Además, al realizar un subanálisis con pacientes con estado de margen positivo o negativo únicamente, la influencia del AB0/Rh en el BCR siguió siendo insignificante. Por lo tanto, no pudimos reproducir los resultados del estudio japonés (13). A diferencia de otras neoplasias como el cáncer de páncreas o de vejiga, el grupo sanguíneo AB0/Rh no aportó ningún valor pronóstico en el CaP.
Nuestro estudio tiene varias limitaciones importantes. La primera y más importante son las limitaciones inherentes a los análisis retrospectivos y la falta de un grupo de control. Además, nuestra cohorte de estudio contiene predominantemente PCa localizados con perfil de riesgo bajo a intermedio (puntuación de Gleason 3 + 4 en el 66,9%, PSA preoperatorio de 4-10 ng/ml en el 63,3%, pT2 en el 68,7% y márgenes negativos en el 81,3% de los pacientes) lo que permite la preselección de pacientes con pronóstico favorable. Además, la distribución global del AB es -en contraste con los otros grupos sanguíneos- generalmente poco abundante (4,9%). Algunas observaciones como la proporción moderadamente aumentada del factor Rh negativo (21,8%) en los pacientes con AB en comparación con los otros grupos sanguíneos (16,9%, p = 0,01) podrían ser posiblemente potenciadas debido a la rareza del tipo AB Rh negativo, lo que impide una detección estadísticamente significativa de una correlación dentro de este subgrupo. Por último, faltaba información sobre el genotipo del grupo sanguíneo respectivo.
Además de las características mencionadas, nunca se pueden descuidar los aspectos ambientales, geográficos y raciales al discutir las correlaciones del grupo sanguíneo AB0 con el cáncer. Las diferencias raciales y étnicas en los grupos sanguíneos así como en el PCa son bien conocidas (24, 25). En Europa, donde el CaP es la neoplasia maligna más común y la segunda causa de muerte relacionada con el cáncer en los hombres (1), los grupos sanguíneos más frecuentes son el A y el 0, aumentando al alelo B de oeste a este. Por el contrario, los países asiáticos con menor incidencia y bajo grado de PCa se caracterizan por una alta ocurrencia de tipos B y una relativa baja frecuencia de 0, así como una menor población con factor Rh negativo (26). En este sentido, nuestros resultados difieren del estudio actual en pacientes japoneses con un estado de margen positivo relativamente alto y BCR después de la RP curativa (13).
Se han propuesto varios mecanismos para explicar cómo el grupo sanguíneo influye en la incidencia y la progresión del cáncer; sin embargo, todavía no están claros. En el caso del cáncer de vejiga, se sugirió una aberración cromosómica, ya que el gen AB0 está localizado en el cromosoma 9q34, una zona que está frecuentemente alterada en el cáncer de vejiga (27). Dado que el gen AB0 codifica en realidad para las glucosiltransferasas, que catalizan la transferencia de azúcares al antígeno H (0), la aparición del cáncer de vejiga está potencialmente correlacionada con el grupo sanguíneo 0. Por el contrario, se ha informado de que los individuos con grupos sanguíneos no 0 (A, AB y B) tienen un riesgo elevado de desarrollar cáncer gástrico e indican un papel específico del grupo sanguíneo en el cáncer.
En lo que respecta al CaP, hay varios esfuerzos en marcha para dilucidar el papel del grupo sanguíneo en la supervivencia después de la terapia. Ya se informó de que los pacientes con el grupo sanguíneo no 0 deberían tener un mayor riesgo de tromboembolismo venoso después de la RP, lo que podría influir en el resultado (28). Incluso un estudio publicado recientemente demostró que los anticuerpos séricos contra el grupo sanguíneo A predicen la supervivencia con PROSTVAC-VF (una vacuna terapéutica contra el cáncer basada en poxvirus que se encuentra en ensayos clínicos de fase III para el tratamiento del CaP avanzado) y debería considerarse como un nuevo biomarcador potencialmente predictivo para PROSTVAC-VF (29). Aunque en nuestro estudio no observamos ninguna asociación clara entre el grupo sanguíneo AB0/Rh y la patología tumoral y el resultado, estas pruebas siguen sugiriendo un papel predictivo del grupo sanguíneo en la epidemiología y el resultado clínico del CaP, especialmente en vista de la respuesta a la terapia.
El presente estudio, con 3.574 pacientes, es el mayor que se ha realizado hasta ahora para analizar el impacto de los grupos sanguíneos AB0 o Rh en la patología y el resultado después de la RP y añade un conocimiento importante a la literatura.
En conclusión, nuestros datos sugieren que no hay una asociación relevante del grupo sanguíneo AB0/Rhesus con las características clínico-patológicas adversas del tumor o el resultado oncológico después de la cirugía, en contraste con varias otras enfermedades malignas. No obstante, está indicado realizar más investigaciones para evaluar una posible asociación entre el genotipo del grupo sanguíneo o su expresión de antígeno en el tejido del PCa y el pronóstico dentro de diferentes grupos terapéuticos, incluyendo el PCa de alto grado o avanzado, que no se reflejaron suficientemente en nuestro grupo de estudio.
Consentimiento informado
Se obtuvo el consentimiento informado de todos los participantes individuales incluidos en el estudio.
Declaración ética
Todos los procedimientos realizados en los estudios con participantes humanos se ajustaron a las normas éticas del comité de investigación institucional y/o nacional y a la declaración de Helsinki de 1964 y sus modificaciones posteriores o normas éticas comparables.
Contribuciones de los autores
SO, DT y TS: contribuciones sustanciales a la concepción o diseño del trabajo, redacción del trabajo, aprobación final de la versión a publicar. PM: contribuciones sustanciales a la concepción o diseño del trabajo, redacción del trabajo, aprobación final de la versión a publicar. FC: adquisición, análisis o interpretación de datos para el trabajo, revisión crítica del contenido intelectual importante, aprobación final de la versión que se publicará. PT: adquisición, análisis o interpretación de datos para el trabajo, revisión crítica por contenido intelectual importante, aprobación final de la versión a publicar. SP: adquisición, análisis o interpretación de datos para el trabajo, revisión crítica por contenido intelectual importante, aprobación final de la versión a publicar. JLH, JH y MG: adquisición, análisis o interpretación de datos para el trabajo, revisión crítica por contenido intelectual importante, aprobación final de la versión a publicar. Todos los autores aceptaron ser responsables de todos los aspectos del trabajo para garantizar que las cuestiones relacionadas con la exactitud o la integridad de cualquier parte del trabajo se investiguen y resuelvan adecuadamente.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
El editor encargado declaró una afiliación compartida, aunque ninguna otra colaboración, con varios de los autores (FC, SP, JH y DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Estadísticas del cáncer, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Risk factors for prostate cancer. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Etiología genética del cáncer de próstata hereditario. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Reported family history of cancer in the prostate, lung, colorectal, and ovarian cancer screening trial. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impacto del grupo sanguíneo ABO en los resultados en pacientes con cáncer primario de vejiga no músculo invasivo. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Muñoz X, Luján-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variación en el grupo sanguíneo ABO y loci FUT y riesgo de cáncer gástrico difuso e intestinal en una población europea. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Riesgo de cáncer de páncreas y alelos del grupo sanguíneo ABO: resultados del consorcio de cohortes de cáncer de páncreas. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. El gen que codifica el antígeno del grupo sanguíneo I: revisión de una I para un ojo. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. La expresión de los antígenos del grupo sanguíneo A, B y H en el tejido del carcinoma se correlaciona con un mal pronóstico de los pacientes con cáncer colorrectal. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. Grupo sanguíneo ABO e incidencia de cáncer de ovario epitelial. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Prognostic variables in patients with prostate cancer: influence of blood group ABO (H), the Rhesus system, age, differentiation, tumour stage and metastases. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Asociaciones entre los grupos sanguíneos ABO y la recurrencia bioquímica después de la prostatectomía radical. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. Alelos del grupo sanguíneo ABO y riesgo de cáncer de próstata: resultados del consorcio de cohortes de cáncer de mama y próstata (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) increases nerve-sparing frequency and reduces positive surgical margins in open and robot-assisted laparoscopic radical prostatectomy: experience after 11,069 consecutive patients. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Guidelines on Prostate Cancer 2015. Asociación Europea de Urología (2015).
Google Scholar
17. Gleason D, Mellinger G. Predicción del pronóstico del adenocarcinoma de próstata mediante la combinación de la clasificación histológica y la estadificación clínica. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. El grupo sanguíneo determina la incidencia del cáncer de páncreas en Alemania. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. Grupos sanguíneos ABO y cáncer. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. El sistema de grupos sanguíneos ABO y Lewis. Immunochemistry, genetics and relation to human disease. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Detección de antígenos del grupo sanguíneo en secciones congeladas de epitelio prostático. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Expresión de antígenos relacionados con ABH/Lewis como factores pronósticos en pacientes con cáncer de mama. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. The blood group ABO gene transcript is down-regulated in human bladder tumors and growth-stimulated urothelial cell lines. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Comparative studies of prostate cancer in Japan versus the United States. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Patrones basados en modelos en la mortalidad por cáncer de próstata a nivel mundial. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. Frecuencias de fenotipos ABO y Rh(D) de diferentes grupos raciales/étnicos en los Estados Unidos. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Genotypic and phenotypic characterization of the histoblood group ABO(H) in primary bladder tumors. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Cáncer de próstata: el tipo de sangre no O es un factor de riesgo de TEV después de la prostatectomía radical. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Los anticuerpos séricos contra el grupo sanguíneo A predicen la supervivencia en PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar