Introducción
Los receptores de serotonina (5-hidroxitriptamina, 5-HT) 2C (5-HT2CRs) están ampliamente distribuidos en el cerebro, y median los efectos reguladores de la 5-HT sobre la ansiedad, el sueño, la secreción hormonal, el comportamiento alimentario, la actividad locomotora, así como los procesos de aprendizaje y memoria (Bagdy, 1998; Chagraoui et al., 2016). La disfunción del 5-HT2CR se ha implicado en condiciones patológicas, como la ansiedad y la depresión (Chagraoui et al., 2016; Di Giovanni y De Deurwaerdere, 2016). Por otra parte, numerosos antidepresivos, ansiolíticos y antipsicóticos tienen afinidades a los 5-HT2CR, que pueden estar implicados en los efectos terapéuticos de estos fármacos (Bagdy et al., 2001; Chagraoui et al., 2016; Di Giovanni y De Deurwaerdere, 2016). Así, el 5-HT2CR es una prometedora diana farmacológica en el tratamiento de varios trastornos neuropsiquiátricos (Chagraoui et al, 2016; Di Giovanni y De Deurwaerdere, 2016).
Se ha descrito que la estimulación de los 5-HT2CR produce ansiedad y, a su vez, los antagonistas del 5-HT2CR subselectivos, como el SB-242084, ejercieron marcados efectos ansiolíticos (Dekeyne y otros, 2000; Bagdy y otros, 2001; Kantor y otros, 2005). Los antagonistas selectivos del 5-HT2CR RS-102221 y SB-242084 produjeron efectos antidepresivos de inicio rápido en ratones (Opal et al., 2014). Asimismo, el antagonismo del 5-HT2CR potenció los efectos ansiolíticos y antidepresivos de la fluoxetina, un inhibidor selectivo de la recaptación de serotonina (ISRS), y además redujo los efectos secundarios motores en ratones (Demireva et al., 2018). Es importante destacar que se ha sugerido que la interacción de los sistemas 5-HT y dopamina (DA) contribuye a estos efectos (De Deurwaerdere y Di Giovanni, 2017).
Se han descrito diversos parámetros en el electroencefalograma (EEG) tanto durante la vigilia como durante el sueño para proporcionar biomarcadores de depresión y de terapia antidepresiva individualizada (Steiger y Kimura, 2010). Las oscilaciones gamma son componentes de frecuencia relativamente alta (>30 Hz) del EEG, que proporcionan pistas importantes sobre la dinámica de la población neuronal (Buzsaki y Wang, 2012). Las oscilaciones gamma se han asociado con funciones sensoriales y cognitivas, así como con la plasticidad neuronal y la memoria en animales y humanos (Cardin, 2016). Por otra parte, la actividad gamma anormal ha sido implicada en varias condiciones psiquiátricas (Cardin, 2016). Sobre la base del creciente cuerpo de evidencia que sugiere la participación de la gamma en el patomecanismo de la depresión, las alteraciones en las oscilaciones gamma se han propuesto recientemente como un nuevo biomarcador (o endofenotipo) para la depresión mayor e incluso para el seguimiento de las terapias antidepresivas (Fitzgerald y Watson, 2018). Se ha demostrado que varios antidepresivos alteran la actividad gamma (Fitzgerald y Watson, 2018). Por ejemplo, se ha descubierto que el ISRS escitalopram disminuye la potencia gamma durante el sueño de movimiento ocular rápido (REMS) en el tratamiento agudo, mientras que el escitalopram crónico aumentó la potencia gamma durante las etapas de sueño de onda lenta (Papp et al., 2018). Sin embargo, sigue siendo una cuestión abierta si las alteraciones de la actividad gamma inducidas por los fármacos en diferentes etapas de vigilancia son indicadores o mediadores causales de la acción terapéutica, o signos de efectos secundarios (Fitzgerald y Watson, 2018).
Según nuestro conocimiento, hay un vacío en la literatura con respecto a los efectos de los antagonistas selectivos del 5-HT2CR en las oscilaciones gamma en humanos y en roedores. Por lo tanto, aquí investigamos cómo cambia la potencia gamma (30-60 Hz) en diferentes etapas de vigilancia (i) por la administración aguda del antagonista altamente selectivo del 5-HT2CR SB-242084, (ii) por la administración crónica del ampliamente utilizado ISRS escitalopram, (iii) y por su combinación.
Métodos
En los experimentos se utilizaron ratas Wistar macho, adquiridas en el centro local de animales (Universidad Semmelweis, Budapest, Hungría). Los animales se mantuvieron en condiciones ambientales controladas (21 ± 1°C, ciclo de luz-oscuridad de 12/12 h con las luces encendidas a las 10 AM), y se les proporcionó libre acceso a comida estándar para roedores y agua del grifo. Todas las condiciones de alojamiento y los experimentos con animales se llevaron a cabo de acuerdo con la Directiva de la UE 2010/63/UE y los «Principios del cuidado de los animales de laboratorio» de los Institutos Nacionales de la Salud (Publicaciones del NIH nº 85-23, revisadas en 1985), así como con las leyes nacionales específicas (el Reglamento gubernamental húngaro sobre estudios con animales 40/2013). Los experimentos fueron aprobados por el Comité Científico Ético Nacional de Experimentación Animal. Se hicieron todos los esfuerzos para minimizar el dolor y la incomodidad de los animales.
Se implantaron electrodos electroencefalográficos (EEG) y electromiográficos (EMG) bajo anestesia de halotano al 2%, como se describió anteriormente (Jakus et al., 2003). Las ratas pesaban entre 250 y 280 g en el momento de la cirugía. Para el EEG, se insertaron electrodos de tornillo de acero inoxidable por vía epidural sobre la corteza frontal izquierda (L: 2,0 mm, A: 2,0 mm hasta el bregma), la corteza parietal izquierda (L: 2,0 mm, A: 2:0 mm hasta el lambda) y sobre el cerebelo como electrodo de tierra. Para la EMG, se colocó un par de electrodos de EMG (electrodos de resorte de acero inoxidable cubiertos de goma de silicona, Plastics One Inc., Roanoke, VA, USA) en la musculatura del cuello. Tras la recuperación (7 días), las ratas fueron conectadas al sistema de EEG mediante un cable de registro y un pivote eléctrico fijado sobre las jaulas. Los animales permanecieron conectados durante todo el estudio.
Para el pretratamiento crónico, las ratas recibieron 10 mg/kg/día de solución de escitalopram-oxalato (ESC Gedeon Richter Plc., Hungría, disuelta en una solución de HCl 0,3 N en agua destilada) o vehículo (VEH; solución de HCl 0,3 N en agua destilada) a través de una minibomba osmótica (2ML4, ALZET, 2,5 μl/h, DURECT Corporation, USA) durante 21 días. El día 21, las ratas recibieron inyecciones intraperitoneales de 1 mg/kg de SB-242084 o vehículo en un volumen de 1 ml/kg de peso corporal. Las ratas se dividieron aleatoriamente en cuatro grupos como sigue VEH+veh (n = 6), VEH+SB (n = 6), ESC+veh (n = 6) y ESC+SB (n = 6).
Se registraron el EEG, el EMG y la actividad motora durante al menos 3 h después de las inyecciones, a partir del inicio de la luz. Las señales se amplificaron mediante filtros analógicos (Coulburn Lablinc System, EE.UU.; filtrado por debajo de 0,50 Hz y por encima de 100 Hz a 6 dB/octava) y se sometieron a conversión analógica a digital (MVRD-2200 V, Canopus, Japón) con una frecuencia de muestreo de 128 Hz. Los datos se almacenaron en un ordenador para su posterior procesamiento.
Las grabaciones poligráficas se puntuaron utilizando la función de puntuación automatizada del software Sleep Sign for Animal (Kissei Comtec America Inc., EE.UU.) para épocas de 4 s, seguido de una supervisión visual. Se distinguieron seis estadios de vigilancia basados en criterios convencionales (Kantor et al., 2004) de la siguiente manera (véase la figura suplementaria 1 para los trazos representativos). En la vigilia activa (AW), el EEG se caracteriza por una actividad de baja amplitud en las frecuencias beta (14-29 Hz) y alfa (10-13 Hz), además de una intensa actividad EMG y motora. En la vigilia pasiva (PW), el patrón del EEG es similar al de la AW, acompañado de una actividad EMG relativamente alta y una actividad motora mínima o nula. En el sueño ligero de ondas lentas (SWS-1), el EEG se caracteriza por ondas corticales lentas de gran amplitud (0,5-4 Hz) interrumpidas por husos (6-15 Hz), acompañadas de una actividad EMG reducida y sin actividad motora. En el sueño profundo de ondas lentas (SWS-2), el EEG está dominado por ondas corticales lentas continuas de gran amplitud con una actividad EMG reducida y sin actividad motora. En la fase intermedia del sueño (IS), que ocurre sobre todo antes o después del REMS, el EEG se caracteriza por una asociación de husos de alta amplitud y ondas theta (5-9 Hz). En la fase REMS, el EEG está dominado por una actividad de baja amplitud y alta frecuencia con ondas theta regulares, además del EMG silencioso y la actividad motora con contracción muscular ocasional (twitching). Se descartaron las épocas contaminadas con artefactos o que contenían transiciones entre etapas de vigilancia.
El análisis cuantitativo del EEG (qEEG) se calculó para épocas consecutivas de 4 s en el rango de frecuencias de 0,5-60 Hz mediante la transformación rápida de Fourier (ventana de Hanning, resolución de frecuencia de 0,25 Hz). Los intervalos adyacentes de 0,25 Hz se sumaron en intervalos de 1 Hz que están marcados por sus límites superiores. Los valores de potencia de las épocas en AW, PW, SWS-1, SWS-2, IS y REMS se promediaron por separado en las 3 h resumidas, o en la primera, segunda y tercera h respectivamente, después de los tratamientos para obtener valores de densidad de potencia para estas etapas de sueño-vigilia. En este informe, nos centramos en el rango de frecuencia de 30-60 Hz de los espectros de potencia del EEG. Los datos dentro de 49-51 Hz se excluyeron del análisis para evitar la contaminación del ruido de interferencia de 50 Hz de la red eléctrica. Todos los datos fueron transformados logarítmicamente antes del análisis.
Para el análisis del espectro de potencia, las comparaciones entre grupos se realizaron mediante ANOVA de dos vías sobre medidas repetidas con dos factores principales: tratamiento (no repetido) y bines de frecuencia gamma (repetido), seguido de la prueba post hoc de Bonferroni. Para investigar los efectos del tratamiento en cada h, se analizaron los datos resumidos de potencia de 30-60 Hz (excluyendo los de 49-51 Hz) mediante ANOVA de una vía, en relación con AW, PW, SWS-1, SWS-2, IS y REMS respectivamente. Tras la detección de un efecto principal significativo del tratamiento, se realizaron pruebas post hoc de Newman-Keuls. Se aceptó la significación estadística cuando p < 0,05.
En nuestro diseño experimental, las ratas de control (VEH+veh) fueron expuestas a los mismos procedimientos que las tratadas con fármacos. Así, la comparación de los grupos tratados con fármacos y el grupo de control tiene como objetivo minimizar la angustia causada por las inyecciones y la presencia de las minibombas, permitiendo estudiar los efectos de los fármacos. Para los gráficos espectrales, en favor de una mejor visibilidad (ya que los datos de potencia del EEG siguen una tendencia decreciente con el aumento de las frecuencias), normalizamos los valores de potencia de las ratas tratadas con fármacos a los valores espectrales de potencia medios de las de control (grupo VEH+veh), mostrando así datos relativos. Los datos absolutos se presentan en los gráficos de barras, como valores de potencia resumidos. Los datos se expresan como media ± SEM de seis animales por grupo.
Resultados
Los efectos de los fármacos (SB-242084 agudo, escitalopram crónico y su combinación) sobre el qEEG en el rango gamma de 30-60 Hz se evaluaron por separado para las seis fases de vigilancia promediando los datos de potencia en las primeras 3 h de la fase pasiva (Figura 1). El análisis reveló que todos los fármacos causaron alteraciones dependientes de la fase de vigilancia en este rango de frecuencias, con una tendencia a la elevación en cada fase, en comparación con el grupo VEH+veh.
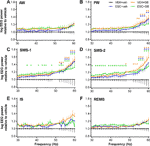
Figura 1 Cambios de potencia del EEG en el rango de frecuencias gamma (30-60 Hz) tras la administración de SB-242084 agudo (VEH+SB), escitalopram crónico (ESC+veh), y su combinación (ESC+SB) en las primeras 3 h de la fase pasiva. Se muestran los espectros de potencia en las siguientes seis fases de vigilancia: (A) vigilia activa (AW) y (B) vigilia pasiva (PW), (C) sueño ligero (SWS-1) y (D) sueño profundo de ondas lentas (SWS-2), (E) fase intermedia (IS), y (F) sueño de movimientos oculares rápidos (REMS). Los datos de potencia del EEG se presentan como media ± SEM, en relación con el grupo de control VEH+veh (n = 6 animales por grupo). *Resultados post hoc significativos en comparación con el control, p < 0,05.
Durante el AW, los resultados del ANOVA no mostraron alteraciones significativas (efecto del tratamiento: F3,20 = 1,917, p = 0,1594; interacción tratamiento x frecuencia: F81,540 = 1,218, p = 0,1081; Figura 1A). Sin embargo, durante el PW, se observó una línea de potencia moderadamente elevada en los grupos SB, y en las frecuencias más altas también en el grupo ESC+veh (efecto del tratamiento: F3,20 = 2,217, p = 0,1176; interacción significativa tratamiento x frecuencia: F81,540 = 2,519, p < 0,001; Figura 1B).
Los efectos más prominentes se observaron durante las etapas de sueño de ondas lentas, donde el SB-242084 agudo, el escitalopram crónico y también el tratamiento combinado causaron una elevación de la potencia. Esto fue apoyado por los resultados significativos del ANOVA en SWS-1 (efecto del tratamiento: F3,20 = 3,692, p = 0,0290; interacción significativa tratamiento x frecuencia: F81,540 = 2,693, p < 0,001; Figura 1C), y en SWS-2 (efecto significativo del tratamiento: F3,20 = 4,787, p = 0,0113; interacción significativa tratamiento x frecuencia: F81,540 = 1,911, p < 0,001; Figura 1D).
El aumento de la potencia gamma no fue significativo durante el IS (efecto del tratamiento: F3,20 = 2,349, p = 0,1031, interacción tratamiento x frecuencia: F81,540 = 1,241, p = 0,0878; Figura 1E). Por último, durante el REMS, ni el SB-242084 agudo ni el escitalopram crónico afectaron a la potencia del EEG en este rango de frecuencias (efecto del tratamiento: F3,19 = 2,515, p = 0,0891; interacción tratamiento x frecuencia: F81,513 = 1,226, p = 0,1014; Figura 1F). Observamos que sólo se utilizaron los datos de n = 5 animales en el grupo ESC+SB, ya que un animal no pasó ningún tiempo en REMS en este intervalo de tiempo.
Para las diferencias significativas post hoc de Bonferroni tras los resultados significativos de ANOVA de dos vías descritos anteriormente, véase la Figura 1 para cada etapa de vigilancia. No se observaron diferencias significativas post hoc en ninguna de las etapas con respecto a las comparaciones de VEH+SB frente a ESC+veh, VEH+SB frente a ESC+SB y ESC+veh frente a ESC+SB, respectivamente.
Se analizaron los efectos dependientes de la etapa de sueño-vigilia de los fármacos sobre la potencia gamma total por hora. El ANOVA de una vía reveló que, aunque en la primera h de SWS-1, el efecto del tratamiento no era aún significativo (F3,20 = 2,544, p = 0,0851), en la segunda (F3,20 = 3,331, p = 0,0403) y tercera h (F3,20 = 4,607, p = 0,0131) las elevaciones de potencia eran significativas. En SWS-2, el ANOVA mostró efectos significativos del tratamiento en cada h (F3,18 = 4,062, p = 0,0228; F3,20 = 5,348, p = 0,0072; F3,20 = 4,910, p = 0,0102, respectivamente). También se encontró un efecto significativo en la segunda h de IS (F3,20 = 3,452, p = 0,0360), pero no en la primera ni en la tercera h. Finalmente, no se encontró ningún efecto significativo del tratamiento en estas horas en AW, PW y REMS. Para los resultados significativos post hoc, véase la Figura 2 para cada etapa de vigilancia.
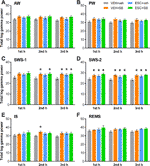
Figura 2 Potencia total del EEG en el rango de frecuencias gamma (30-60 Hz) tras la administración de SB-242084 agudo (VEH+SB), escitalopram crónico (ESC+veh), y su combinación (ESC+SB) en la primera, segunda y tercera hora de la fase pasiva, durante (A) la vigilia activa (AW) y (B) la vigilia pasiva (PW), (C) el sueño ligero (SWS-1) y (D) el sueño profundo de ondas lentas (SWS-2), (E) la fase intermedia (IS) y (F) el sueño de movimientos oculares rápidos (REMS). Los datos de potencia del EEG resumidos se presentan como media ± SEM (de n = 6 animales por grupo). *Resultados post hoc significativos en comparación con el grupo de control (VEH+veh), p < 0,05.
Discusión
Este es el primer estudio en el que se investigan los efectos agudos del antagonista selectivo del 5-HT2CR SB-242084 sobre la banda de frecuencias gamma de los espectros del EEG en diferentes etapas de vigilancia. Además, se probó con o sin pretratamiento crónico con ISRS. Aquí informamos de un aumento de la potencia de la banda gamma durante el SWS-2, el SWS-1 y el PW tras la administración aguda de SB-242084, (1 mg/kg, ip.), en ratas. Nuestros hallazgos sobre el pretratamiento adicional de 21 días con escitalopram (10 mg/kg/día, minibombas osmóticas) demuestran que el SB-242084 no modificó más la potencia gamma alterada por el tratamiento antidepresivo crónico. Además, los efectos agudos del SB-242084 y los efectos crónicos del escitalopram sobre la potencia gamma parecían muy similares en la mayoría de las fases de vigilancia. Sin embargo, los efectos de la combinación de estos dos tratamientos no se consideraron aditivos.
Las funciones cerebrales relacionadas con la actividad gamma se discutieron en la sección de introducción. Se han descrito oscilaciones gamma en múltiples áreas del cerebro, como el neocórtex, la corteza entorrinal, el hipocampo, el tálamo, la amígdala, el bulbo olfativo y el estriado. Su generación está ligada a la inhibición perisomática; sobre todo, a la actividad de las interneuronas positivas a la parvalbúmina a través de las sinapsis del ácido gamma-aminobutírico (GABA)A (Buzsaki y Wang, 2012). Se cree que las oscilaciones gamma desempeñan un papel importante en la depresión, lo que está respaldado por los hallazgos en humanos y animales. A saber, se midieron anormalidades gamma en pacientes deprimidos, y también en modelos animales de depresión, donde los cambios en gamma se asociaron con la recuperación terapéutica (Khalid et al., 2016; Noda et al., 2017; Fitzgerald y Watson, 2018).
Se ha demostrado que diversos tratamientos farmacológicos (dirigidos a los sistemas de serotonina, noradrenalina, dopamina y glutamato) y no farmacológicos de la depresión alteran la actividad gamma (Fitzgerald y Watson, 2018). Por ejemplo, se ha demostrado que el escitalopram, el antidepresivo ISRS ampliamente utilizado, que actúa sobre el sistema serotoninérgico, reduce la potencia gamma durante el REMS mediante un tratamiento agudo, mientras que su administración crónica aumentó la potencia gamma en las etapas de sueño de onda lenta, en ratas (Papp et al., 2018). Es importante destacar que los antidepresivos que actúan sobre el sistema noradrenérgico, como la reboxetina y la desipramina, aumentaron la potencia gamma (así como la theta) en el sistema septo-hipocampal tras un tratamiento agudo, mientras que el ISRS fluvoxamina no produjo tal efecto en el mismo estudio (Hajos et al., 2003a). Los supuestos antidepresivos de nueva generación, como la ketamina y su metabolito (2R,6R)-hidroxinorketamina, han demostrado que aumentan de forma prominente la potencia gamma cuando se aplican en dosis relevantes para la antidepresión. Estos efectos y también sus acciones similares a las de los antidepresivos se evitaron mediante el pretratamiento con un inhibidor del receptor del ácido propiónico α-amino-3-hidroxi-5-metil-4-isoxazol (AMPAR) (Zanos et al., 2016). Por último, Fitzgerald y Watson han propuesto recientemente que la señalización gamma puede proporcionar un biomarcador de los efectos antidepresivos de todas las clases de antidepresivos, ya que, según su hipótesis, todas las clases de antidepresivos pueden tener efectos finales comunes en el circuito límbico (Fitzgerald y Watson, 2019).
En este estudio, examinamos fármacos que actúan sobre el sistema 5-HT, a saber, un antagonista del 5-HT2CR y un ISRS con la acción principal de aumentar el nivel extracelular de 5-HT mediante la inhibición de su recaptación sináptica a través del transportador de 5-HT. Cada vez hay más pruebas de que el antagonismo del 5-HT2CR podría tener efectos beneficiosos en el tratamiento de la depresión y la ansiedad, aunque estos efectos de los antagonistas selectivos del 5-HT2CR aún no se han probado en estudios clínicos. En apoyo de la importancia de combinar los antagonistas del 5-HT2CR con los ISRS, la coadministración aguda de los antagonistas selectivos del 5-HT2CR SB-242084 o RS-102221 con el ISRS citalopram aumentó las elevaciones de los niveles de 5-HT inducidas por el citalopram en regiones implicadas en la fisiopatología de los trastornos depresivos, en un estudio de microdiálisis en ratas (Cremers et al., 2004). El pretratamiento con SB-242084 también revirtió el aumento de la expresión del miedo inducido por el citalopram en ratas (Burghardt y otros, 2007). Además, un trabajo reciente ha demostrado que el tratamiento agudo con SB-242084 después del tratamiento crónico (21 días) con fluoxetina redujo los comportamientos similares a la ansiedad y la depresión, y mejoró los efectos secundarios inducidos por los ISRS en ratones (Demireva et al, 2018).
En el presente estudio, se eligió la dosis de 1 mg/kg de SB-242084, basándose en anteriores estudios conductuales (Kennett et al., 1997; Martin et al., 2002; Opal et al., 2014) y de sueño y/o EEG (Popa et al., 2005; Sorman et al., 2011; Bogathy et al., 2019) en roedores. Es importante destacar que Kantor et al. han demostrado que, aunque las dosis de 0,3 y 1,0 mg/kg del fármaco produjeron efectos ansiolíticos similares, solo la dosis más alta afectó de forma destacada a la arquitectura del sueño-vigilia (efecto promotor de la vigilia con reducción del SWS-2), en ratas Sprague-Dawley (Kantor et al., 2005). Se ha encontrado un efecto reductor del REMS con una dosis de 1 mg/kg en ratas Wistar, y también se han observado elevaciones de la potencia theta durante el AW y el REMS tras este tratamiento (Kostyalik et al., 2014).
El efecto del SB-242084 y del escitalopram sobre la actividad gamma se analizó por separado en las etapas de vigilancia, ya que las funciones cerebrales y la actividad oscilatoria asociada, así como los niveles de neurotransmisores, muestran diferencias características entre las etapas. El papel de las oscilaciones gamma en funciones vinculadas a la vigilia como la atención focalizada, la cognición y el procesamiento sensorial está bien documentado (Cardin, 2016), sin embargo, su importancia funcional durante el sueño es menos conocida. Durante el REMS, se ha sugerido un papel de las oscilaciones gamma (más allá de las theta) en la consolidación de la memoria (Montgomery et al., 2008). Un artículo reciente ha propuesto que el aumento de la potencia gamma en el microestado REMS fásico en ciertas áreas está asociado con el procesamiento emocional, en los seres humanos (Simor et al., 2019). Durante el no REMS, las oscilaciones gamma podrían estar asociadas a los incrementos fásicos de la actividad neuronal durante las oscilaciones lentas (Valderrama et al., 2012). Un estudio de microelectrodos en monos y humanos ha enfatizado aún más el papel de las oscilaciones gamma (y beta) durante la no-REMS, a saber, una alta coherencia de oscilación sugiere una contribución una contribución de gamma a la consolidación de la memoria a la consolidación de la memoria durante la no-REMS (Quyen et al., 2016).
Descubrimos que una sola dosis de SB-242084 elevaba la potencia gamma durante el SWS-2, el SWS-1 y, en menor medida, el PW, pero no durante el REMS, el IS y el AW.
Las neuronas 5-HT se disparan más activamente durante la vigilia, su actividad disminuye durante el sueño de ondas lentas y se silencia durante el REMS. Por ello, el sistema 5-HT se ha considerado un modulador clave del comportamiento sueño-vigilia (Monti, 2011) y de las oscilaciones cerebrales, aunque los mecanismos celulares y los receptores implicados en estos procesos son complejos y poco conocidos (Puig y Gener, 2015). Se ha encontrado que el 5-HT per se afecta la actividad gamma en la corteza prefrontal de la rata a través de los 5-HT1ARs y 5-HT2ARs, pero no de los 5-HT2CRs, resultando en una disminución general de la amplitud en ratas anestesiadas (Puig et al., 2010). Además, cada vez hay más evidencias que apoyan la importancia del sistema DA en la sincronización de las interneuronas de espiación rápida, generando/regulando así las oscilaciones gamma (Furth et al., 2013).
5-HT2CR es presumiblemente el subtipo de receptor 5-HT con la distribución más extendida en el cerebro. Se ha descrito en interneuronas GABAérgicas en numerosas regiones, y también se expresa en neuronas DA. Sin embargo, este subtipo de receptor no se expresa en las neuronas 5-HT y noradrenérgicas (NA). El papel de los 5-HT2CR en la modulación de los sistemas monoaminérgicos, e intrigantemente, de los DA ha sido subrayado por varios estudios preclínicos (Di Giovanni y De Deurwaerdere, 2016; De Deurwaerdere y Di Giovanni, 2017). La estimulación local de los 5-HT2CR en áreas cerebrales específicas producía ansiedad de forma dependiente de la región y, a su vez, los antagonistas de los 5-HT2CR subtipo como el SB-242084 ejercían marcadas acciones ansiolíticas (Bagdy et al., 2001; Di Giovanni y De Deurwaerdere, 2016). Varios ansiolíticos y antidepresivos poseen propiedades antagonistas del 5-HT2CR, por ejemplo, numerosos antidepresivos tricíclicos, mianserina, mirtazapina, trazodona, nefazodona, fluoxetina y agomelatina (Martin et al., 2014). Por otra parte, los antagonistas selectivos del 5-HT2CR se han sugerido como posibles antidepresivos de inicio rápido sobre la base de estudios preclínicos (Opal et al., 2014).
Se han publicado unos pocos estudios sobre los efectos cualitativos (que afectan a la arquitectura del sueño-vigilia) y cuantitativos (que afectan a los espectros de potencia, es decir, a las oscilaciones) del sueño-vigilia de los antagonistas del 5-HT2CR, y del SB-242084 en particular. Kantor et al. han investigado los efectos dependientes de la dosis del SB-242084 sobre la ansiedad, la vigilancia y los espectros del EEG por debajo de 30 Hz en ratas. Han encontrado un aumento de la potencia theta en la vigilia (lo que sugiere un posible efecto de mejora cognitiva, ya que la actividad theta está asociada a los procesos de aprendizaje y memoria) incluso a una dosis de 0,1 mg/kg. En cambio, el fármaco aumentó la vigilia y suprimió el SWS-2 en las primeras horas de la fase pasiva sólo con una dosis de 1 mg/kg. En cuanto a las bandas de frecuencia delta, alfa o beta durante la vigilia, REMS, SWS-1 o SWS-2, no se ha informado de ninguna alteración significativa en este trabajo (Kantor et al., 2005). Kostyalik et al. han descrito que el SB-242084 elevó la duración del PW y suprimió el REMS, efecto que fue atenuado por el pretratamiento crónico con ESC, en ratas. En lo que respecta al qEEG, han encontrado un aumento de la potencia theta durante el AW y también durante el REMS que no se modificó más por el pretratamiento crónico con escitalopram (Kostyalik et al., 2014). El efecto potenciador de theta del antagonista del 5-HT2CR y, por tanto, el papel del 5-HT2CR en la regulación de la actividad theta han sido apoyados por Hajos et al. (2003b).
Los efectos del escitalopram y otros ISRS en la arquitectura del sueño-vigilia y en los parámetros del EEG en humanos y roedores están más ampliamente estudiados (Wilson y Argyropoulos, 2005; Vas et al., 2013; Fitzgerald y Watson, 2019). Recientemente, hemos informado de alteraciones de la potencia gamma tras la administración aguda (reducción durante el REMS) y crónica (elevación durante el SWS-1 y el SWS-2) en ratas (Papp et al., 2018).
Interesantemente, los efectos agudos del SB-242084 fueron similares a los causados por el escitalopram crónico, con otras palabras, el antagonismo selectivo sobre el 5-HT2CR produjo efectos similares sobre la actividad gamma que el bloqueo crónico del transportador de 5-HT y los efectos adicionales que ejerce el escitalopram. En ese caso, suponemos que los efectos del 5-HT, es decir, la desensibilización del 5-HT1AR (y posiblemente también del 5-HT2AR) pueden explicar el aumento de la potencia gamma en esas etapas, como hemos propuesto en nuestro trabajo anterior (Papp et al., 2018).
Para explicar nuestros hallazgos, debemos tener en cuenta que los 5-HT2CR pueden modular la actividad neuronal del 5-HT, del NA y, de manera importante, del DA (Di Giovanni y De Deurwaerdere, 2016). Se ha informado que la actividad constitutiva de los 5-HT2CRs ejerce un control inhibitorio sobre la actividad de las neuronas DA, que fue revertida por la administración sistémica de antagonistas de los 5-HT2CRs. El SB-242084 y el SB-206553 aumentaron significativamente la liberación basal de DA en las áreas inervadas de DA del cerebro de rata. Sin embargo, la liberación de DA provocada por el SB-242084 fue pequeña y alcanzó un máximo en comparación con el SB-206553 (De Deurwaerdere et al., 2004). Curiosamente, los ISRS también han sido implicados en la regulación de la señalización DAérgica (lo que podría indicar una posible característica común de los dos fármacos investigados), aunque los datos disponibles en la literatura son ambiguos. Mientras que se ha informado de que el escitalopram agudo aumenta la tasa de disparo y el estallido de las neuronas en el área tegmental ventral (Schilstrom et al., 2011), otro estudio ha demostrado que una administración de escitalopram durante 2 semanas disminuyó la tasa de disparo y el estallido de estas neuronas, en ratas anestesiadas (Dremencov et al., 2009).
Los hallazgos de este estudio deben interpretarse en el contexto de algunas limitaciones. El SB-242084 se administró en una sola dosis, y no probamos si el efecto potenciador de la gamificación del fármaco es dependiente de la dosis. Además, nuestro análisis se limitó a un máximo de 60 Hz debido al límite de Nyquist determinado por la tasa de muestreo nominal, por lo que se requieren más trabajos para investigar frecuencias gamma más rápidas, así como oscilaciones de alta frecuencia (HFO) y ondulaciones.
En conjunto, nuestros hallazgos muestran efectos similares entre el SB-242084 agudo y el escitalopram crónico sobre la actividad gamma, lo que apoya las evidencias preclínicas (y clínicas indirectas) de que el tratamiento agudo o a corto plazo con antagonistas del 5-HT2CR puede tener efectos antidepresivos. Por tanto, nuestro trabajo podría aportar más pruebas de que los antagonistas del 5-HT2CR pueden ser beneficiosos en el tratamiento de la depresión y/o la ansiedad. Si las alteraciones de la actividad gamma son marcadores de la acción terapéutica del fármaco o mediadores del efecto terapéutico, sigue siendo una cuestión no resuelta que necesita más estudios.
Declaración de disponibilidad de datos
Los conjuntos de datos generados y analizados durante el presente estudio no están disponibles públicamente debido al análisis en curso para su futura publicación, pero están disponibles a través del autor correspondiente previa solicitud razonable.
Declaración ética
Todas las condiciones de alojamiento y los experimentos con animales se llevaron a cabo de acuerdo con la Directiva de la UE 2010/63/UE y los «Principios del cuidado de los animales de laboratorio» de los Institutos Nacionales de la Salud (Publicaciones del NIH nº 85-23, revisadas en 1985), así como las leyes nacionales específicas (el Reglamento gubernamental húngaro sobre estudios con animales 40/2013). Los experimentos fueron aprobados por el Comité Científico Ético Nacional de Experimentación Animal, y permitidos por el gobierno (Dirección de Seguridad de la Cadena Alimentaria y Salud Animal de la Oficina Central de Agricultura, Permiso Nº 22.1/1375/7/2010).
Contribuciones de los autores
GB y TK diseñaron los experimentos. DK, SV, y PP realizaron los procedimientos experimentales. GB, DK, SV, y NP contribuyeron al análisis de datos. NP, SK, SV, y GB interpretaron los resultados. NP, SK y GB redactaron el primer borrador del manuscrito. Todos los autores han leído y aprobado el manuscrito final.
Financiación
Este trabajo fue apoyado por la Agencia Nacional de Desarrollo (KTIA_NAP_13-1-2013-0001) Programa de Investigación del Cerebro Húngaro (Grant No. KTIA_13_NAP-A-II/14), NAP 2.0 (Subvención nº 2017-1.2.1-NKP-2017-00002); Programa de Excelencia Temática ITM/NKFIH, Universidad Semmelweis; y la subvención SE-Neurología FIKP del EMMI.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Damos las gracias a Zita Kátai y Emese Bogáthy por su ayuda en los experimentos y/o en el análisis de los datos.
Material complementario
El material complementario de este artículo puede encontrarse en línea en: https://www.frontiersin.org/articles/10.3389/fphar.2019.01636/full#supplementary-material
Bagdy, G., Graf, M., Anheuer, Z. E., Modos, E. A., Kantor, S. (2001). Anxiety-like effects induced by acute fluoxetine, sertraline or m-CPP treatment are reversed by pretreatment with the 5-HT2C receptor antagonist SB-242084 but not the 5-HT1A receptor antagonist WAY-100635. Int. J. Neuropsicofarmacol. 4 (4), 399-408. doi: 10.1017/S1461145701002632
PubMed Abstract | CrossRef Full Text | Google Scholar
Bagdy, G. (1998). Serotonina, ansiedad y hormonas del estrés. Focus on 5-HT receptor subtypes, species and gender differences. Ann. N. Y. Acad. Sci. 851, 357-363. doi: 10.1111/j.1749-6632.1998.tb09009.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogathy, E., Papp, N., Tothfalusi, L., Vas, S., Bagdy, G. (2019). Efecto aditivo del bloqueo de los receptores 5-HT2C y CB1 en la regulación del ciclo de sueño-vigilia. BMC Neurosci. 20 (1), 14. doi: 10.1186/s12868-019-0495-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Burghardt, N. S., Bush, D. E., McEwen, B. S., LeDoux, J. E. (2007). Los inhibidores selectivos de la recaptación de serotonina aguda aumentan la expresión del miedo condicionado: bloqueo con un antagonista del receptor 5-HT(2C). Biol. Psychiatry 62 (10), 1111-1118. doi: 10.1016/j.biopsych.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., Wang, X. J. (2012). Mecanismos de las oscilaciones gamma. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
PubMed Abstract | CrossRef Full Text | Google Scholar
Cardin, J. A. (2016). Instantáneas del cerebro en acción: operaciones del circuito local a través de la lente de las oscilaciones gamma. J. Neurosci. 36 (41), 10496-10504. doi: 10.1523/JNEUROSCI.1021-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Chagraoui, A., Thibaut, F., Skiba, M., Thuillez, C., Bourin, M. (2016). Receptores 5-HT2C en los trastornos psiquiátricos: una revisión. Prog. Neuropsychopharmacol. Biol. Psychiatry 66, 120-135. doi: 10.1016/j.pnpbp.2015.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Cremers, T. I., Giorgetti, M., Bosker, F. J., Hogg, S., Arnt, J., Mork, A., et al. (2004). La inactivación de los receptores 5-HT(2C) potencia las consecuencias del bloqueo de la recaptación de serotonina. Neuropsychopharmacology 29 (10), 1782-1789. doi: 10.1038/sj.npp.1300474
PubMed Abstract | CrossRef Full Text | Google Scholar
Deurwaerdere, P., Di Giovanni, G. (2017). Modulación serotoninérgica de la actividad de los sistemas dopaminérgicos mesencefálicos: implicaciones terapéuticas. Prog. Neurobiol. 151, 175-236. doi: 10.1016/j.pneurobio.2016.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
De Deurwaerdere, P., Navailles, S., Berg, K. A., Clarke, W. P., Spampinato, U. (2004). La actividad constitutiva del receptor de serotonina2C inhibe la liberación de dopamina in vivo en el estriado y el núcleo accumbens de la rata. J. Neurosci. 24 (13), 3235-3241. doi: 10.1523/JNEUROSCI.0112-04.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Dekeyne, A., Denorme, B., Monneyron, S., Millan, M. J. (2000). Citalopram reduce la interacción social en ratas mediante la activación de los receptores de serotonina (5-HT)(2C). Neuropharmacology 39 (6), 1114-1117. doi: 10.1016/s0028-3908(99)00268-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Demireva, E. Y., Suri, D., Morelli, E., Mahadevia, D., Chuhma, N., Teixeira, C. M., et al. (2018). El bloqueo del receptor 5-HT2C revierte la disfunción de los ganglios basales asociada a los ISRS y potencia la eficacia terapéutica. Mol. Psychiatry. doi: 10.1038/s41380-018-0227-x
CrossRef Full Text | Google Scholar
Di Giovanni, G., Deurwaerdere, P. (2016). Nuevas oportunidades terapéuticas para los ligandos del receptor 5-HT2C en los trastornos neuropsiquiátricos. Pharmacol. Ther. 157, 125-162. doi: 10.1016/j.pharmthera.2015.11.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Dremencov, E., El Mansari, M., Blier, P. (2009). Effects of sustained serotonin reuptake inhibition on the firing of dopamine neurons in the rat ventral tegmental area. J. Psychiatry Neurosci. 34 (3), 223-229.
PubMed Abstract | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2018). Oscilaciones gamma como biomarcador de la depresión mayor: un tema emergente. Transl. Psychiatry 8 (1), 177. doi: 10.1038/s41398-018-0239-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2019). Registros electrofisiológicos in vivo de los efectos de los fármacos antidepresivos. Exp. Brain Res. 237 (7), 1593-1614. doi: 10.1007/s00221-019-05556-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Furth, K. E., Mastwal, S., Wang, K. H., Buonanno, A., Vullhorst, D. (2013). Dopamina, función cognitiva y oscilaciones gamma: papel de los receptores D4. Front. Cell Neurosci. 7, 102. doi: 10.3389/fncel.2013.00102
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Robinson, D. D., Yu, J. H., Hajos-Korcsok, E. (2003a). Norepinephrine but not serotonin reuptake inhibitors enhance theta and gamma activity of the septo-hippocampal system. Neuropsychopharmacology 28 (5), 857-864. doi: 10.1038/sj.npp.1300116
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Weaver, R. J. (2003b). Regulación de la actividad septo-hipocampal por receptores de 5-hidroxitriptamina(2C). J. Pharmacol. Exp. Ther. 306 (2), 605-615. doi: 10.1124/jpet.103.051169
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakus, R., Graf, M., Juhasz, G., Gerber, K., Levay, G., Halasz, P., et al. (2003). Los receptores 5-HT2C inhiben y los receptores 5-HT1A activan la generación de descargas de onda de pico en un modelo genético de rata de epilepsia de ausencia. Exp. Neurol. 184 (2), 964-972. doi: 10.1016/S0014-4886(03)00352-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Balogh, B., Benko, A., Bagdy, G. (2004). Aumento de la vigilia, la actividad motora y la disminución de la actividad theta después del bloqueo del receptor 5-HT2B por el antagonista selectivo de subtipo SB-215505. Br. J. Pharmacol. 142 (8), 1332-1342. doi: 10.1038/sj.bjp.0705887
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Molnar, E., Gyongyosi, N., Toth, A., Detari, L., et al. (2005). A pesar de un potencial ansiolítico similar, el antagonista del receptor 2C de la 5-hidroxitriptamina SB-242084 indolina] y el clordiazepóxido produjeron efectos diferenciales en los espectros de potencia del electroencefalograma. J. Pharmacol. Exp. Ther. 315 (2), 921-930. doi: 10.1124/jpet.105.086413
PubMed Abstract | CrossRef Full Text | Google Scholar
Kennett, G. A., Wood, M. D., Bright, F., Trail, B., Riley, G., Holland, V., et al. (1997). SB 242084, a selective and brain penetrant 5-HT2C receptor antagonist. Neuropharmacology 36 (4-5), 609-620. doi: 10.1016/s0028-3908(97)00038-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Khalid, A., Kim, B. S., Seo, B. A., Lee, S. T., Jung, K. H., Chu, K., et al. (2016). La oscilación gamma en las redes cerebrales funcionales está involucrada en la remisión espontánea de la conducta depresiva inducida por el estrés de restricción crónica en ratones. BMC Neurosci. 17, 4. doi: 10.1186/s12868-016-0239-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyalik, D., Katai, Z., Vas, S., Pap, D., Petschner, P., Molnar, E., et al. (2014). El tratamiento crónico con escitalopram causó una adaptación disociativa en los efectos inducidos por el antagonista del receptor de serotonina (5-HT) en el sueño REM, la vigilia y la actividad de las ondas theta. Exp. Brain Res. 232 (3), 935-946. doi: 10.1007/s00221-013-3806-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, J. R., Ballard, T. M., Higgins, G. A. (2002). Influencia del antagonista del receptor 5-HT2C, SB-242084, en pruebas de ansiedad. Pharmacol. Biochem. Behav. 71 (4), 615-625. doi: 10.1016/s0091-3057(01)00713-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, C. B., Hamon, M., Lanfumey, L., Mongeau, R. (2014). Controversias sobre el papel de los receptores 5-HT(2C) en los mecanismos de acción de los fármacos antidepresivos. Neurosci. Biobehav. Rev. 42, 208-223. doi: 10.1016/j.neubiorev.2014.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Montgomery, S. M., Sirota, A., Buzsaki, G. (2008). Coordinación theta y gamma de las redes del hipocampo durante la vigilia y el sueño de movimiento ocular rápido. J. Neurosci. 28 (26), 6731-6741. doi: 10.1523/JNEUROSCI.1227-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Monti, J. M. (2011). Control de la serotonina en la conducta de sueño-vigilia. Sleep Med. Rev. 15 (4), 269-281. doi: 10.1016/j.smrv.2010.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Noda, Y., Zomorrodi, R., Saeki, T., Rajji, T. K., Blumberger, D. M., Daskalakis, Z. J., et al. (2017). Potencia gamma del EEG en estado de reposo y mejora del acoplamiento theta-gamma tras la EMTr dorsolateral izquierda de alta frecuencia en pacientes con depresión. Clin. Neurophysiol. 128 (3), 424-432. doi: 10.1016/j.clinph.2016.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Opal, M. D., Klenotich, S. C., Morais, M., Bessa, J., Winkle, J., Doukas, D., et al. (2014). Los antagonistas de los receptores de serotonina 2C inducen efectos antidepresivos de inicio rápido. Mol. Psychiatry 19 (10), 1106-1114. doi: 10.1038/mp.2013.144
PubMed Abstract | CrossRef Full Text | Google Scholar
Papp, N., Vas, S., Bogathy, E., Katai, Z., Kostyalik, D., Bagdy, G. (2018). El escitalopram agudo y crónico alteran las oscilaciones gamma del EEG de manera diferente: relevancia para los efectos terapéuticos. Eur. J. Pharm. Sci. 121, 347-355. doi: 10.1016/j.ejps.2018.06.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Popa, D., Lena, C., Fabre, V., Prenat, C., Gingrich, J., Escourrou, P., et al. (2005). Contribution of 5-HT2 receptor subtypes to sleep-wakefulness and respiratory control, and functional adaptations in knock-out mice lacking 5-HT2A receptors. J. Neurosci. 25 (49), 11231-11238. doi: 10.1523/JNEUROSCI.1724-05.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Gener, T. (2015). Modulación por serotonina de los ritmos prefronto-hipocampales en la salud y la enfermedad. ACS Chem. Neurosci. 6 (7), 1017-1025. doi: 10.1021/cn500350e
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Watakabe, A., Ushimaru, M., Yamamori, T., Kawaguchi, Y. (2010). La serotonina modula la actividad sincrónica y de interneuronas de espiación rápida en la corteza prefrontal de rata a través de los receptores 5-HT1A y 5-HT2A. J. Neurosci. 30 (6), 2211-2222. doi: 10.1523/JNEUROSCI.3335-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Quyen, M. L. V., Muller, L. E., Telenczuk, B., Halgren, E., Cash, S., Hatsopoulos, N. G., et al. (2016). Oscilaciones de alta frecuencia en el neocórtex humano y del mono durante el ciclo de vigilia-sueño. Proc. Natl. Acad. Sci. U. S. A. 113 (33), 9363-9368. doi: 10.1073/pnas.1523583113
PubMed Abstract | CrossRef Full Text | Google Scholar
Schilstrom, B., Konradsson-Geuken, A., Ivanov, V., Gertow, J., Feltmann, K., Marcus, M. M., et al. (2011). Efectos de S-citalopram, citalopram y R-citalopram en los patrones de disparo de las neuronas de dopamina en el área tegmental ventral, la transmisión mediada por el receptor de N-metil-D-aspartato en la corteza prefrontal medial y la función cognitiva en la rata. Synapse 65 (5), 357-367. doi: 10.1002/syn.20853
PubMed Abstract | CrossRef Full Text | Google Scholar
Simor, P., van Der Wijk, G., Gombos, F., Kovacs, I. (2019). La paradoja del sueño de movimiento ocular rápido a la luz de la actividad oscilatoria y la sincronización cortical durante los microestados fásicos y tónicos. Neuroimage 202, 116066. doi: 10.1016/j.neuroimage.2019.116066
PubMed Abstract | CrossRef Full Text | Google Scholar
Sorman, E., Wang, D., Hajos, M., Kocsis, B. (2011). Control del ritmo theta del hipocampo por la serotonina: papel de los receptores 5-HT2c. Neuropharmacology 61 (3), 489-494. doi: 10.1016/j.neuropharm.2011.01.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiger, A., Kimura, M. (2010). El EEG de vigilia y del sueño proporciona biomarcadores en la depresión. J. Psychiatr. Res. 44 (4), 242-252. doi: 10.1016/j.jpsychires.2009.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Valderrama, M., Crepon, B., Botella-Soler, V., Martinerie, J., Hasboun, D., Alvarado-Rojas, C., et al. (2012). Human gamma oscillations during slow wave sleep. PloS One 7 (4), e33477. doi: 10.1371/journal.pone.0033477
PubMed Abstract | CrossRef Full Text | Google Scholar
Vas, S., Katai, Z., Kostyalik, D., Pap, D., Molnar, E., Petschner, P., et al. (2013). Adaptación diferencial de la latencia del sueño REM, la etapa intermedia y los efectos de potencia theta de escitalopram después del tratamiento crónico. J. Neural Transm. (Viena) 120 (1), 169-176. doi: 10.1007/s00702-012-0847-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilson, S., Argyropoulos, S. (2005). Antidepresivos y sueño: una revisión cualitativa de la literatura. Drugs 65 (7), 927-947. doi: 10.2165/00003495-200565070-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanos, P., Moaddel, R., Morris, P. J., Georgiou, P., Fischell, J., Elmer, G. I., et al. (2016). Acciones antidepresivas independientes de la inhibición NMDAR de los metabolitos de la ketamina. Nature 533 (7604), 481-486. doi: 10.1038/nature17998
PubMed Abstract | CrossRef Full Text | Google Scholar