Introducción
La artritis reumatoide (AR) es una enfermedad autoinmune, de naturaleza poligénica, caracterizada por una poliartritis con manifestaciones sistémicas y una mayor y grave morbilidad.1,2 La AR afecta a entre el 0,5% y el 1% de la población, provocando una disminución de la calidad de vida, una importante discapacidad física y un coste económico considerable.3-6 La expresión clínica de la enfermedad es variada, desde formas leves autolimitadas hasta una evolución muy agresiva y rápida que culmina con la destrucción de la articulación afectada y la consiguiente discapacidad.7
Los estudios genéticos han confirmado la existencia de un sustrato genético, en parte relacionado con ciertos genes que codifican proteínas implicadas en las respuestas de las células T.1 Estos hallazgos refuerzan la importancia del papel atribuido a las células T en el inicio y la perpetuación de la respuesta inmunitaria anormal en esta enfermedad.8
La patogénesis de la AR es compleja e implica a diferentes poblaciones celulares relacionadas con la respuesta inmunitaria innata y adaptativa. En la patogénesis participan células residentes en la sinovia, como los sinoviocitos fibroblásticos B o los macrófagos de la íntima, y células inflamatorias de la sangre como los linfocitos T, los linfocitos B y los monocitos9. Todos ellos contribuyen a la transformación agresiva del fenotipo sinoviocitario B y al desarrollo de un intenso infiltrado inflamatorio con el resultado final de la destrucción del cartílago y del hueso subcondral10,11 (Fig. 1).
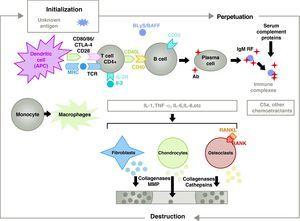
Fisiopatología de la artritis reumatoide. Organización fisiopatológica general de la artritis reumatoide. AC, anticuerpo; BAFF, factor activador de células B; BLyS, estimulador de linfocitos B; CD, cúmulo de diferenciación; CPA, célula presentadora de antígenos; CPH, MHC; CTLA4, antígeno asociado a linfocitos 4 T fracción citotóxica C5a complemento 5a, FR, factor reumatoide; Ig, inmunoglobulina; IL, interleucina; MMP, metaloproteinasas de matriz; RANK, receptor activador del factor nuclear B kappa; RANKL, receptor activador del ligando del factor nuclear B kappa; RCT, receptor de células T; TNF, factor de necrosis tumoral.
El tratamiento actual de la AR se basa en la administración de fármacos antirreumáticos modificadores de la enfermedad (DMARD) utilizados solos o en combinación.12 Estos fármacos ralentizan la destrucción articular, es decir, son capaces de modificar el curso natural de la enfermedad.4,13 Sin embargo, el porcentaje de pacientes con una respuesta clínica satisfactoria es bajo y suele requerir la adición de un fármaco biológico en un alto porcentaje de pacientes.9,13-15
En los últimos años se han identificado nuevas moléculas y dianas terapéuticas cuyo bloqueo podría reducir o eliminar la respuesta inflamatoria crónica. Una de estas nuevas moléculas es abatacept. Abatacept es una construcción proteica totalmente humanizada, formada por el dominio extracelular del antígeno 4 asociado a los linfocitos T citotóxicos humanos (CTL4) y un fragmento modificado genéticamente de la región Fc de la inmunoglobulina G1 (IgG1) humana, que inhibe las células T de coestimulación que actúan en el verdadero núcleo de la respuesta inmunitaria y, por tanto, en el inicio de la enfermedad.
Activación de las células T
La activación inmunológica efectiva de las células T requiere la participación de dos grupos de receptores de membrana en las células presentadoras de antígeno (APC)14 (Figs. 1 y 2). El primero es el vehículo utilizado por las APC para proporcionar el antígeno específico previamente procesado a la célula T. A pesar del enorme esfuerzo dedicado a esta investigación, seguimos sin poder identificar los antígenos artrógenos que desencadenan la AR.8 La presentación por parte de las CCA de un antígeno contra el que se monta una respuesta inmunitaria específica se organiza a través de un complejo trimolecular que comprende: moléculas del complejo mayor de histocompatibilidad (CMH) presentes en la CCA, el antígeno contra el que se desarrolla la respuesta inmunitaria y un receptor de membrana en la célula T (TCR) específico para ese antígeno15 (señal o vía de señalización de la respuesta inmunitaria 1).
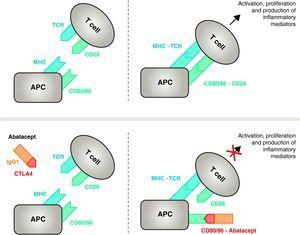
Mecanismo de acción de abatacept. El fragmento de abatacept que comprende el dominio extracelular de CTLA4 se une a los receptores CD80/CD86, impidiendo o desplazando su interacción con el receptor CD28. De este modo, bloquea selectivamente la unión específica de CD80/CD86 al receptor CD28, lo que supone, fisiopatológicamente, un bloqueo de la segunda señal de activación inmunitaria y, por tanto, de la activación de las células T CPA, célula presentadora de antígeno; MHC, complejo mayor de histocompatibilidad; TCR, receptor de células T.
Para inhibir la activación completa, las células T requieren un segundo conjunto de receptores de comunicación intercelular entre las APC y las células T que se produce a través de las vías costimuladoras y constituye la llamada respuesta inmunitaria de 2 señales.14 Aunque existen varias vías de coestimulación, una de ellas es esencial, la unión de los receptores CD80 (B7-1)/CD86 (B7-2) de la membrana de la CPA con el receptor CD28 de las células T.10,16 La activación simultánea de ambos desencadena una intensa señalización intracelular en las células T, esencial para la activación completa, la proliferación, la supervivencia y la producción de citoquinas 8. A las 24-48h de la activación de los linfocitos T, la misma señalización intracelular inicia un mecanismo regulador que pretende desactivar la propia respuesta. Esto induce la expresión de CTLA411 en la membrana celular de los linfocitos con la misión de competir con CD28 debido a su mayor afinidad de unión a CD80/CD86.17,18
La activación de ambos subconjuntos de células T, CD4+ y CD8+ depende del receptor coestimulador CD28. Las células T CD4+ son células T auxiliares. Reconocen los péptidos presentados por las moléculas MHC de clase II presentes en la APC. Estos antígenos se originan en la vía exógena que procesa patógenos como las bacterias. Muchas enfermedades autoinmunes están asociadas a una respuesta patológica de las células T CD4+. Por su parte, las células T CD8+ son linfocitos citotóxicos (CTL). Las células T CD8+ reconocen antígenos, principalmente virales y tumorales, presentados por moléculas de clase I MHC. Tras su activación, las células CD8+ median en la destrucción de la célula diana mediante la producción de perforina, granzimas e interferón (IFN)-g. Ambos subtipos de células T se activan mediante la coestimulación con CD2815, aunque la activación de las células T CD8+ depende menos de esta vía de coestimulación. De hecho, mientras que todas las células CD4+ expresan CD28 en su membrana, esto sólo ocurre en aproximadamente el 50% de las CD8+.19 Además, se ha demostrado que las células CD4+ muestran una mayor respuesta a la unión de CD2820. Por otra parte, el promotor de CD28 no es un requisito absoluto para la activación de los CTL.21 Todo ello supondría un doble beneficio terapéutico en la práctica clínica. Por un lado, abatacept actúa preferentemente sobre la célula diana en la patogénesis de la enfermedad. Por otra parte, la menor acción sobre la actividad de los linfocitos CD8+ garantizaría un mejor perfil de seguridad en términos de complicaciones virales y tumorales.
La activación de los linfocitos T CD4+ es el punto de partida de una cascada proinflamatoria con producción de grandes cantidades de citoquinas y proliferación celular que, si se perpetúa y mantiene, como en la AR, conduce a una inflamación crónica muy activa, capaz de destruir los tejidos en los que se desencadena, principalmente las articulaciones en el caso de la AR8 (Fig. 1). La sinovia comienza a proliferar debido a las células infiltradas procedentes de la sangre, entre las que se encuentran los propios linfocitos T y sus subtipos, así como los linfocitos B. Los monocitos se diferencian en macrófagos y osteoclastos y también activan los condrocitos articulares. En este entorno se producen grandes cantidades de citoquinas proinflamatorias como la interleucina (IL)-1, la IL-6 y el factor de necrosis tumoral (TNF) y muchas otras. Las células B también producen autoanticuerpos, como el factor reumatoide o los anticuerpos contra el péptido citrulinado. Todos ellos conducen a la destrucción no sólo de la membrana sino también del hueso y el cartílago subyacentes.22
Biotecnología en el tratamiento de la artritis reumatoide
Debido a las investigaciones mencionadas, se ha desarrollado y comercializado la fabricación biotecnológica de diversas moléculas destinadas a bloquear objetivos específicos. La primera generación se caracterizó por la aparición de fármacos neutralizadores del TNF: etanercept, infliximab y adalimumab y anakinra, que inhiben la acción de la IL-1. Posteriormente, han surgido nuevas moléculas, como abatacept, para modular la coestimulación de la respuesta inmunitaria, certolizumab y golimumab para bloquear el TNF, rituximab contra el receptor CD20 de los linfocitos B, y tocilizumab que bloquea la IL-6.7,23-26
A pesar del enorme salto en términos de eficacia terapéutica debido a la introducción de estos fármacos, un porcentaje sustancial de pacientes, estimado entre el 25% y el 40%, no responden a los fármacos o biológicos actualmente comercializados o se ven afectados por la aparición de acontecimientos adversos.27-32 La necesidad de mejorar esta situación sigue siendo un estímulo en la búsqueda y desarrollo de nuevas moléculas dirigidas a regular diferentes dianas terapéuticas que puedan mejorar la eficacia terapéutica, como es el caso de abatacept, que modula selectivamente la activación de las células T.33
El abatacept es una construcción proteica que se produce mediante tecnología de ADN recombinante en células de ovario de hámster.34,35 Esta molécula fue diseñada para interferir en la regulación de las vías costimuladoras de las células T, que desempeñan un papel importante en la patogénesis de diversas enfermedades autoinmunes, infecciones, rechazo de órganos trasplantados e inmunidad tumoral.36
Abatacept se utiliza en combinación con metotrexato en pacientes con AR que han tenido una respuesta inadecuada o intolerancia a otros DMARDs, incluyendo metotrexato (MTX) o un inhibidor del TNF-alfa. En la artritis idiopática juvenil poliarticular está indicado en pacientes de 6 años o más que han tenido una respuesta inadecuada a otros DMARDs, incluyendo al menos un fármaco neutralizador del TNF.35
Mecanismo de acción de Abatacept
Abatacept es un modulador selectivo de la señal costimuladora CD80/86-CD28, y como se ha comentado anteriormente es esencial para la activación de las células T Abatacept inhibe la activación de las células T, bloqueando selectivamente la unión específica del receptor CD80/CD86 en APC a CD28 en la célula T (Fig. 2).22,37 La estrategia farmacológica busca inhibir la respuesta inmune/inflamatoria acelerada, característica de la enfermedad, y restaurar la homeostasis normal del sistema inmune. De hecho, la competencia entre el CD28 endógeno y el CTLA4 por la unión al CD80/86 es el mecanismo fisiológico utilizado para regular y, en su caso, concluir una respuesta inmunitaria normal. Abatacept, al bloquear la unión de CD80/86 a CD28, inhibe la transmisión de una segunda señal de la respuesta inmunitaria, que produce indirectamente una señal negativa sobre la activación de las células T. Además, abatacept tiene probablemente un mayor efecto al impedir la formación de una señal costimuladora en las células T, inactivando las que ya están activas, que no están unidas a CTLA4
Fármaco de apoyo para el uso
1. Por qué se incluye el abatacept en el grupo de fármacos inmunomoduladores? Básicamente, porque produce depleción celular, especialmente de células T debido a la acción farmacológica que ejerce al no bloquear selectivamente una citoquina concreta, evitando la supresión radical de vías esenciales para el correcto funcionamiento de la respuesta inmune.8
2. ¿Cómo impide la unión de la región Fc de la molécula a su receptor? La región Fc de abatacept está modificada genéticamente, de modo que no se une a los receptores CD16 y CD32, y lo hace muy débilmente al receptor CD64. Este diseño evita las respuestas celulares mediadas por el receptor Fc, como la citotoxicidad celular dependiente de anticuerpos (ADCC) y la citotoxicidad dependiente del complemento (CDC).18 Ambas se asocian a la lisis celular, con posibles efectos adversos que pueden observarse en tratamientos prolongados38. Por lo tanto, el fragmento modificado de IgG1 parece ser activo, evitando así los efectos adversos derivados de la ADCC.39
3. Efecto antiinflamatorio de abatacept. Abatacept reduce significativamente muchos de los mediadores inflamatorios en los pacientes con AR, restaurándolos a la normalidad, hecho demostrado en varios ensayos clínicos utilizados al investigar el fármaco.
En un estudio de fase II-b, de un año de duración y controlado con placebo en pacientes con AR y respuesta inadecuada al MTX, se tomaron muestras y se midieron los niveles séricos de marcadores seleccionados en los días previos a la infusión para estudiar el efecto de abatacept sobre los mediadores y las citoquinas proinflamatorias. Un grupo de pacientes recibió MTX y abatacept 10mg/kg, según el programa habitual. El grupo de control, por su parte, fue tratado con MTX y placebo. Un año después del tratamiento, los marcadores en el grupo de abatacept de 10mg/kg se habían normalizado, mientras que permanecían elevados en el grupo de placebo (TNF: 7,4 vs 10,3pg/ml; FR: 159 vs 225U/l, sIL-2R: vs 1228,3 1697,1pg/ml IL-6: 7,3 vs 19,9pg/ml).40
4. Inmunogenicidad. Según los datos del fármaco, sólo 187 de 3877 (4,8%) pacientes con AR tratados hasta 8 años con abatacept desarrollaron anticuerpos contra el fármaco durante el tratamiento.41 Los anticuerpos contra abatacept se evaluaron en pacientes después de suspender el fármaco (>42 días después de la última dosis), y en 103 de 1888 (5,5%) fueron seropositivos. Por el contrario, en otro estudio de 2000 pacientes abatacept, se midieron los anticuerpos y se concluyó que abatacept tiene una baja inmunogenicidad.42,43
5. Abatacept y la tuberculosis. El TNF participa en la respuesta inflamatoria y la inmunopatología de la tuberculosis (TB). Los estudios in vitro demuestran que el TNF aumenta la actividad fagocítica y micobactericida de los macrófagos, mientras que in vivo están implicados en la formación inicial y el posterior mantenimiento de los granulomas, algo que controla el crecimiento de las micobacterias y limita su propagación. En un modelo crónico de reactivación de la tuberculosis latente en ratones, se estudió la evolución de la infección en ratones tratados con abatacept en comparación con otro grupo tratado con un anti-TNF monoclonal murino.42 Cuatro meses después de infectar a ratones C57BL/6 con Mycobacterium tuberculosis y, una vez confirmado que tenían una infección tuberculosa latente, los ratones fueron tratados durante 16 semanas con una de las dos intervenciones experimentales. Transcurrido este tiempo, todos los ratones tratados con anti-TNF murieron de tuberculosis diseminada con una supervivencia media de 44 días. Por el contrario, ninguno de los ratones tratados con abatacept murió.
Mientras que la concentración de IFN-g en suero no cambió en el grupo de abatacept, se elevó en los ratones con anti-TNF. Este aumento se atribuyó a la mayor infiltración de CD4+ y CD8+ causada por la dispersión generalizada de las colonias bacterianas.
Así, mientras que los ratones tratados con la terapia anti-TNF mostraron una mortalidad del 100%, abatacept no alteró la capacidad de los ratones para organizar una respuesta inflamatoria capaz de controlar la propagación de la tuberculosis. Sin embargo, aún no hay suficientes datos clínicos para confirmar estos hallazgos en humanos.
6. Efecto antirresortivo de abatacept en el remodelado óseo. La actividad de los osteoclastos está aumentada en la AR, tanto en la articulación, causando erosiones óseas, como a nivel sistémico, alcanzando niveles asociados a la osteoporosis generalizada.44,45
De hecho, se ha demostrado un aumento del ligando receptor activador del factor nuclear NF-kB (RANKL) en la membrana sinovial.45,46 Abatacept inhibe de forma dependiente de la dosis la formación de osteoclastos murinos y la actividad osteoclastógena evaluada in vitro. Esto se estudió en osteoclastos murinos cultivados en placas de dentina, en las que se midió el número de fosas de resorción después de 6 días de añadir diferentes dosis de abatacept.47
El fármaco disminuyó significativamente el área de resorción ósea. Estos datos sugieren que abatacept es una molécula que se une directamente a las células precursoras de osteoclastos, inhibiendo su diferenciación. Este mecanismo podría explicar el efecto antierosivo del fármaco en pacientes con AR. De hecho, los pacientes tratados con abatacept mostraron una tendencia a la disminución de los niveles de RANK y de su ligando RANKL en la sinovia, todo ello asociado a un aumento de la osteoprotegerina.48 Aunque el mecanismo exacto subyacente a esta observación no está claro, estos hallazgos se correlacionan bien con la mejoría radiológica observada en los pacientes tratados con abatacept.
7. Efectos de abatacept en otras células inmunitarias. Aunque la APC es la célula diana que se une a abatacept y los macrófagos también expresan receptores CD80/86 en su superficie, hay pocos estudios que investiguen la acción del fármaco sobre la actividad de estas células. De hecho, un reciente estudio in vitro ha demostrado que los macrófagos presentaban una marcada expresión de receptores CD80/86 y que el tratamiento con abatacept reducía sustancialmente la producción de citoquinas49. Estos resultados sugieren que el mecanismo de acción del fármaco podría extenderse a la regulación del linaje de los macrófagos, células clave en la patogénesis de la enfermedad.
Abatacept también suprime la migración folicular de las células T específicas de antígeno y, en consecuencia, la colaboración entre las células T y las células B foliculares en el ganglio linfático. Este hallazgo se ha observado in situ en los ganglios linfáticos de ratones BALB/c50. Tras la transfusión de dichos ratones con células T preestimuladas específicas de antígeno, una inmunización posterior de los ratones mostró la proliferación de células T y la migración a la zona de los linfocitos B. En los ratones tratados con abatacept, se bloqueó la proliferación y migración de células T, limitando su presencia en la mayoría de los casos en el paracórtex de los ganglios linfáticos. Así pues, el tratamiento prolongado con abatacept reduce la proliferación, la movilidad y la distribución de los linfocitos de memoria de autoantígenos intraganglionares, lo que podría conducir a la disminución de los autoanticuerpos.
Conclusiones sobre el mecanismo de acción de Abatacept
Abatacept es una construcción proteica totalmente humanizada, que consiste en el dominio extracelular del antígeno 4 asociado a linfocitos T citotóxicos humanos (CTL4) y un fragmento genéticamente modificado de la región Fc de la IgG1, diseñado para interferir en la regulación de la coestimulación de los linfocitos T El fármaco inhibe la activación de los linfocitos T bloqueando selectivamente la unión específica de CD80/CD86 al receptor CD28 y, por tanto, inhibiendo la proliferación de los linfocitos T y la respuesta inmunitaria de los linfocitos B Esta acción farmacológica se traduce en una disminución de los niveles de mediadores inflamatorios en pacientes con AR y en una respuesta clínica segura y eficaz.
Conflicto de intereses
El Dr. Gabriel Herrero-Beaumont ha recibido becas de investigación de Bristol-Myers-Squibb. El Dr. Santos Castañeda ha recibido becas de formación e investigación de Abbott, MSD y Pfizer.