La forma de los tres orbitales 3p. De izquierda a derecha: 3py, 3pz y 3px. Para cada uno, las zonas amarillas son donde las funciones de onda tienen valores positivos y las zonas blancas denotan valores negativos.
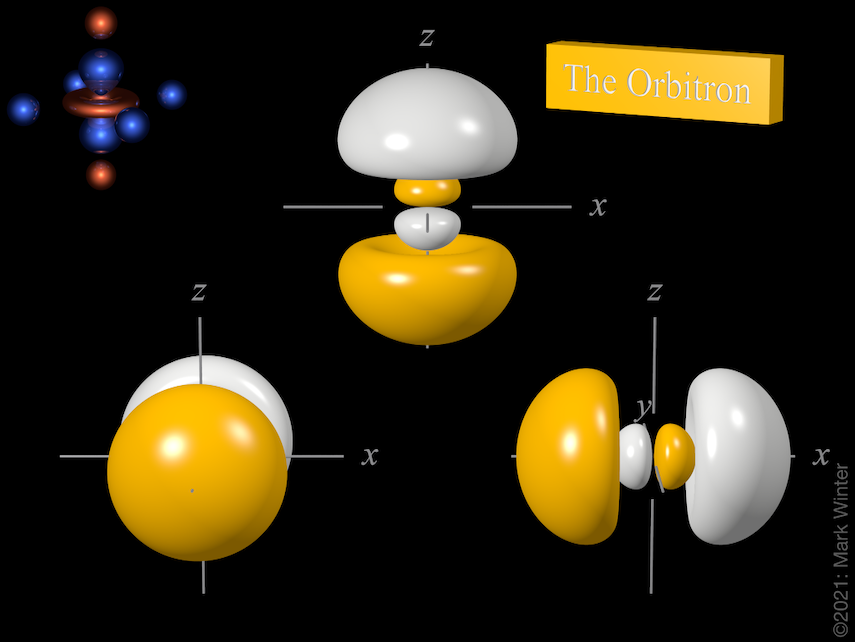
Los tres orbitales 3p. Utilice los iconos anterior y siguiente para ver otras vistas
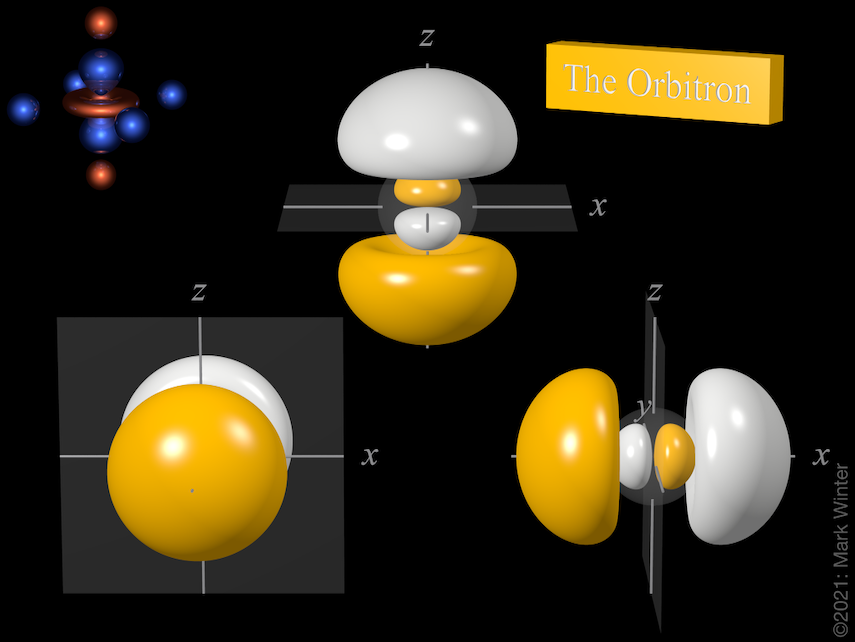
Los tres orbitales 3p incluyendo los nodos orbitales. Usa los iconos anterior y siguiente para ver otras vistas
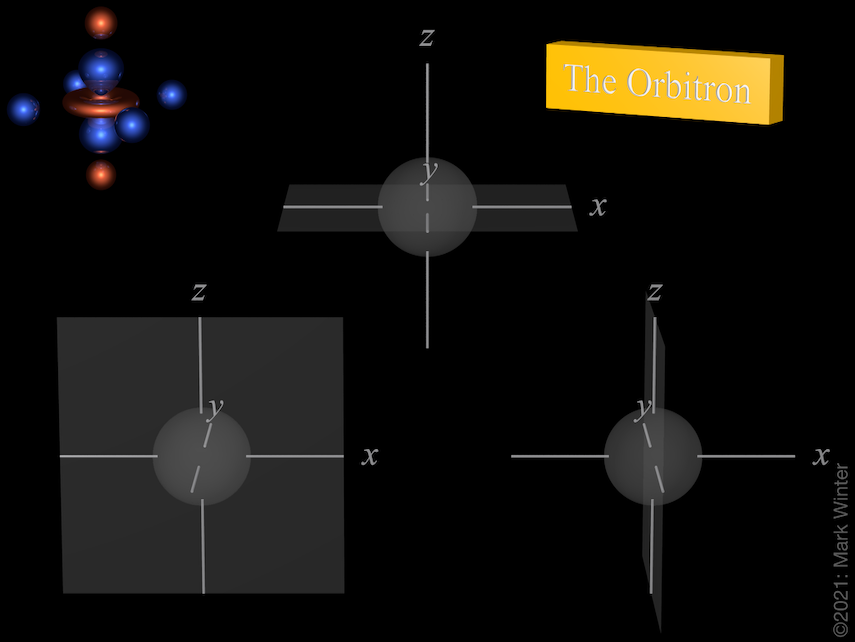
Los nodos de los tres orbitales 3p. Utiliza los iconos anterior y siguiente para ver otras vistas
Anterior
Para cualquier átomo, hay tres orbitales 3p. Estos orbitales tienen la misma forma pero están alineados de forma diferente en el espacio. Los tres orbitales 3p utilizados normalmente se etiquetan como 3px, 3py y 3pz ya que las funciones están «alineadas» a lo largo de los ejes x, y y z respectivamente.
Cada orbital 3p tiene cuatro lóbulos. Hay un nodo plano normal al eje del orbital (por lo que el orbital 3px tiene un plano nodal yz, por ejemplo). Además del nodo plano, también hay un nodo esférico que divide los pequeños lóbulos interiores. Los orbitales p superiores (4p, 5p, 6p y 7p) son aún más complejos, ya que tienen más nodos esféricos.
El origen del nodo plano queda claro al inspeccionar las ecuaciones de onda que, por ejemplo, incluyen un término x en el caso del orbital 4px. Cuando x = 0, entonces hay un nodo, y éste por definición es el plano yz.
El origen del nodo esférico queda claro al inspeccionar las ecuaciones de onda que, por ejemplo, incluyen términos (4 – ρ). Cuando (4 – ρ) = 0, entonces hay un nodo. Dado que para cualquier orbital 3p ρ = 2Zr/3 (Z = carga nuclear efectiva, r = radio en unidades atómicas), entonces los nodos están en el radio para el que (4 – 2Zr/3) = 0, es decir, r = 6/Z unidades atómicas.
El OrbitronTM, una galería de orbitales en la WWW: https://winter.group.shef.ac.uk/orbitron/