La définition Brønsted-Lowry de l’acidité et de la basicité
Nous allons commencer notre discussion sur la chimie acido-basique avec quelques définitions essentielles. La première d’entre elles a été proposée en 1923 par le chimiste danois Johannes Brønsted et le chimiste anglais Thomas Lowry, et est connue sous le nom de définition Brønsted-Lowry de l’acidité et de la basicité. Un acide, selon la définition de Brønsted-Lowry, est une espèce qui agit comme un donneur de protons, tandis qu’une base est un accepteur de protons. Nous avons déjà abordé dans le chapitre précédent l’un des exemples les plus familiers de réaction acide-base de Brønsted-Lowry, entre l’acide chlorhydrique et l’ion hydroxyde :
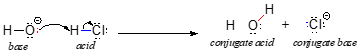
Dans cette réaction, un proton est transféré de HCl (l’acide, ou donneur de proton) à l’ion hydroxyde (la base, ou accepteur de proton). Comme nous l’avons appris dans le chapitre précédent, les flèches courbes représentent le mouvement des électrons dans ce processus de rupture et de formation de liaisons.
Après qu’un acide de Brønsted-Lowry ait donné un proton, ce qui reste est appelé la base conjuguée. L’ion chlorure est ainsi la base conjuguée de l’acide chlorhydrique. Inversement, lorsqu’une base de Brønsted-Lowry accepte un proton, elle se transforme en sa forme acide conjuguée : l’eau est ainsi l’acide conjugué de l’ion hydroxyde.
Voici une réaction acide-base organique, entre l’acide acétique et la méthylamine :
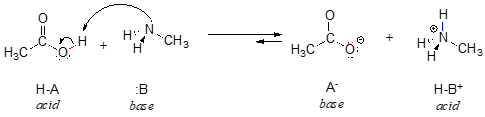
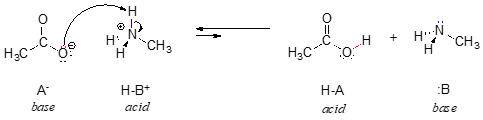
Dans l’inverse de cette réaction, l’ion acétate est la base et l’ion méthylammonium (méthylamine protonée) est l’acide.
Qu’est-ce qui rend un composé acide (susceptible de donner un proton) ou basique (susceptible d’accepter un proton) ? Répondre à cette question est l’une de nos principales tâches dans ce chapitre, et nous demandera de mettre à profit une grande partie de ce que nous avons appris sur la structure organique dans les deux premiers chapitres, ainsi que les idées sur la thermodynamique que nous avons passées en revue au chapitre 6.
Pour l’instant, considérons simplement une propriété commune des bases : pour agir comme une base, une molécule doit avoir une paire réactive d’électrons. Dans toutes les réactions acide-base que nous verrons dans ce chapitre, l’espèce basique possède un atome avec une paire d’électrons solitaires. Lorsque la méthylamine agit comme une base, par exemple, la paire d’électrons solitaires sur l’atome d’azote est utilisée pour former une nouvelle liaison avec un proton.
Il est clair que l’ion méthylammonium ne peut pas agir comme une base – il n’a pas de paire d’électrons réactifs avec lesquels accepter un proton.
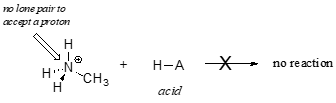
Plus tard, au chapitre 14, nous étudierons les réactions dans lesquelles une paire d’électrons dans une liaison d’un alcène ou d’un cycle aromatique agit de manière basique – mais pour l’instant, nous nous concentrerons sur la basicité des électrons non liants (paire solitaire).
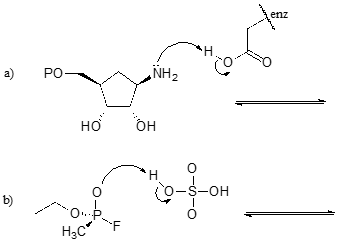
Exercice \(\PageIndex{1}\)
Complétez les réactions ci-dessous – en d’autres termes, dessinez les structures des acides conjugués et des bases conjuguées manquantes qui résultent des flèches courbes fournies.