| Ed Davis, Ph.D. |
Introduction
Lentivirus et virus adéno-associé (AAV) se sont révélés inestimables pour introduire du matériel génétique dans les cellules de mammifères, que ce soit en culture ou chez des animaux entiers. Ces deux systèmes se prêtent parfaitement à de nombreuses applications de recherche fondamentale, telles que la surexpression de protéines, la production d’anticorps et l’élimination de gènes, et sont tous deux prometteurs pour la thérapie génique. Cependant, chaque système viral présente des avantages et des inconvénients qui lui sont propres, en fonction de l’application. GeneCopoeia propose des lignes de produits étendues pour les lentivirus et les AAV, vous offrant ainsi des options puissantes et flexibles pour délivrer de l’ADN dans les cellules. Dans cette note technique, nous décrivons les technologies derrière les gammes de produits Lentifect™ lentivirus et AAVPrime™ AAV de GeneCopoeia, et discutons des mérites de chaque technologie pour diverses applications afin de vous aider à choisir le système le mieux adapté à vos besoins.
Pourquoi utiliser des virus pour la délivrance d’ADN ?
L’une des façons les plus courantes de délivrer de l’ADN aux cellules est la transfection à base de plasmide, dans laquelle les cellules sont traitées avec des composés chimiques comme le phosphate de calcium, ou avec des réactifs à base de lipides. Cependant, la transfection plasmidique n’est pas toujours souhaitable ou pratique. Par exemple, certaines cellules sont très difficiles ou impossibles à transfecter, alors que la plupart des cellules cultivées supportent l’infection (également appelée transduction) par un lentivirus ou un AAV. Deuxièmement, la transfection plasmidique ne peut pas être utilisée pour l’administration d’ADN in vivo, alors que la transduction virale le peut. Le lentivirus et l’AAV peuvent tous deux être utilisés pour une multitude d’applications, telles que l’expression de protéines à partir de cadres de lecture ouverts (ORF), l’élimination de gènes par interférence ARN (ARNi) médiée par l’ARN à épingle à cheveux courte (shRNA), la luciférase et d’autres tests de gènes rapporteurs, et l’élimination de gènes médiée par le système CRISPR-Cas9 (clustered, regularly-interspaced, short palindromic repeats-Cas9). Beaucoup de ces applications pour les vecteurs viraux ont été réalisées avec succès dans des lignées de cellules de mammifères immortalisées en culture, dans des cultures de cellules primaires, dans des modèles animaux et dans la thérapie génique sur des patients humains.
Systèmes lentiviraux
Le terme « Lentivirus » fait référence à la classe de rétrovirus qui inclut le virus de l’immunodéficience humaine (VIH) et, en fait, la plupart des systèmes lentiviraux actuellement utilisés sont dérivés du VIH (revu dans Mátrai, et al…, 2010 ; Sakuma, et al., 2012). Les lentivirus porteurs de transgènes s’intègrent dans le génome lors de l’infection, et permettent ainsi une expression stable dans les cellules qui se divisent et celles qui ne se divisent pas.
Les systèmes lentiviraux ont été fortement modifiés à partir du VIH sur plusieurs générations pour les rendre sûrs à manipuler et utiles pour les applications. GeneCopoeia utilise le système lentiviral de 3ème génération (Dull, et al. 1998), qui nécessite quatre plasmides distincts pour produire des particules virales infectieuses (virions). Un plasmide lentiviral GeneCopoeia ne porte que le gène d’intérêt (GOI) à exprimer, un gène de sélection antibiotique et les séquences de signal d’emballage. Parfois, le clone comprendra également un gène rapporteur fluorescent. Le plasmide contenant le gène d’intérêt, avec le marqueur de sélection et le gène rapporteur, peut accueillir des insertions allant jusqu’à environ 5-6 kb. (Figure 1), bien que les titres viraux chutent considérablement lorsque la taille des inserts dépasse environ 4 kb.
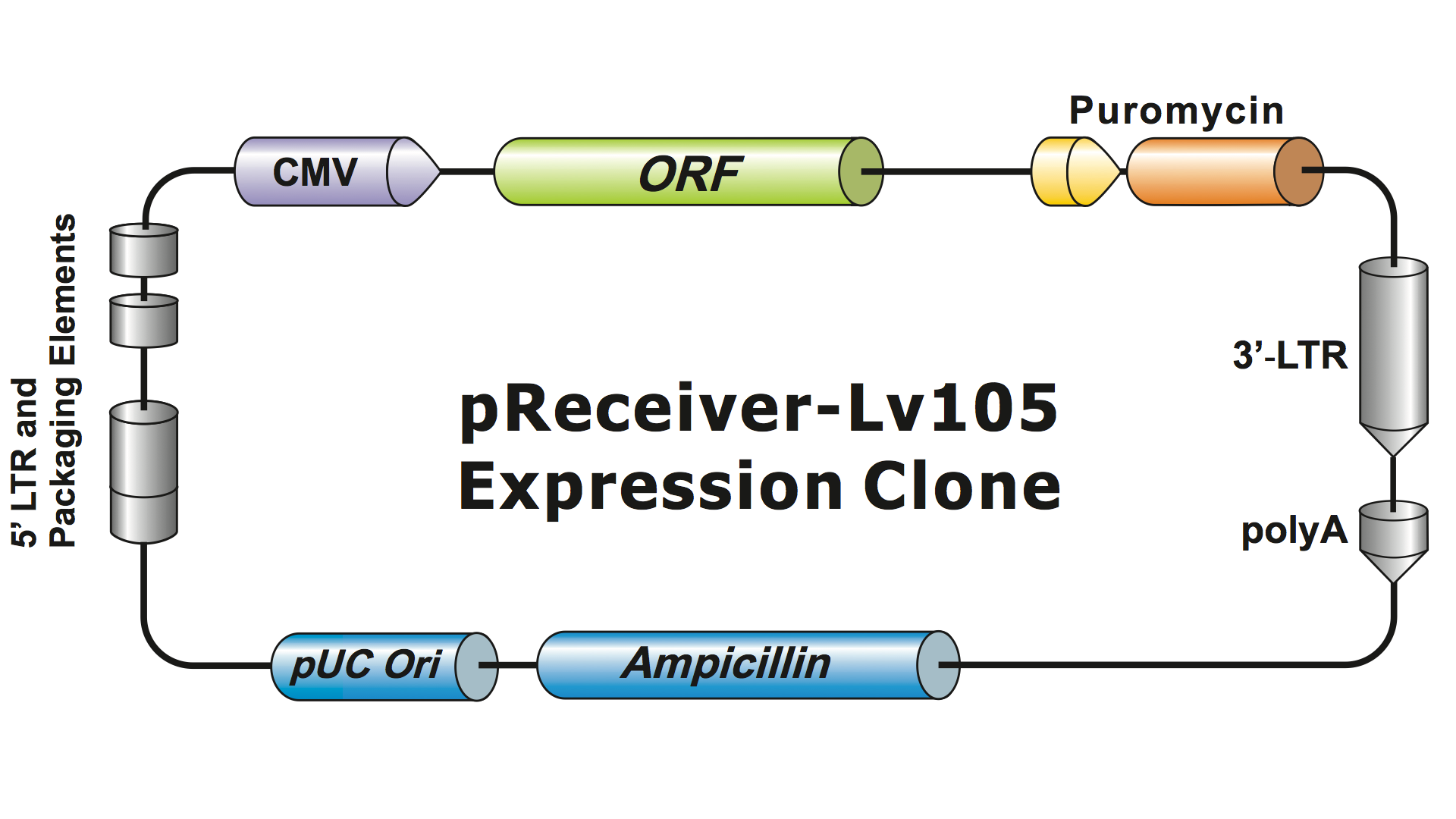 |
Figure 1. Exemple de clone d’expression lentiviral GeneCopoeia |
Les plasmides supplémentaires expriment les éléments rétroviraux nécessaires à l’empaquetage et à l’intégration (gag, pol, env, Rev). Lorsque les quatre plasmides sont exprimés dans des cellules d’empaquetage, l’ARN du GOI est incorporé dans les particules. Comme les protéines rétrovirales ne sont exprimées que pendant l’encapsidation, les cellules infectées ne peuvent pas produire de virus infectieux. En outre, les particules lentivirales Lentifect™ de GeneCopoeia contiennent une délétion dans la région U3 des LTR, ce qui les rend auto-inactives (SIN). La délétion SIN empêche la réplication lentivirale dans le cas rare où les quatre plasmides se recombinent pour créer un seul plasmide viral actif. Par conséquent, les particules lentivirales sont sûres à manipuler, avec pratiquement aucune chance de générer un virus pathogène.
En plus des modifications de sécurité améliorées, les particules lentivirales Lentifect™ de GeneCopoeia portent la glycoprotéine du virus de la stomatite vésiculaire G (VSV-G) à la place du gène env du VIH de type sauvage, ce qui change le tropisme tissulaire du virus des cellules T CD4+ à pratiquement tout type de cellules de mammifères. En tant que tels, les lentivirus sont un système largement utilisé pour la culture de cellules de mammifères, les modèles animaux et les applications de thérapie génique.
Parce que les vecteurs lentiviraux ont été modifiés de ces manières, les systèmes lentiviraux Lentifect™ de GeneCopoeia ont une sécurité renforcée, et présentent les caractéristiques suivantes qui les rendent très utiles pour la délivrance d’ADN :
- Ils infectent presque tous les types de cellules de mammifères
- Ils peuvent être utilisés pour délivrer des séquences d’ADN relativement grandes – jusqu’à environ 5-6 kb de longueur
- Ils peuvent être utilisés pour générer des lignées cellulaires stables, ou conduire une expression génétique stable dans les organes et les tissus in vivo, en raison de l’intégration du transgène à des endroits aléatoires du génome
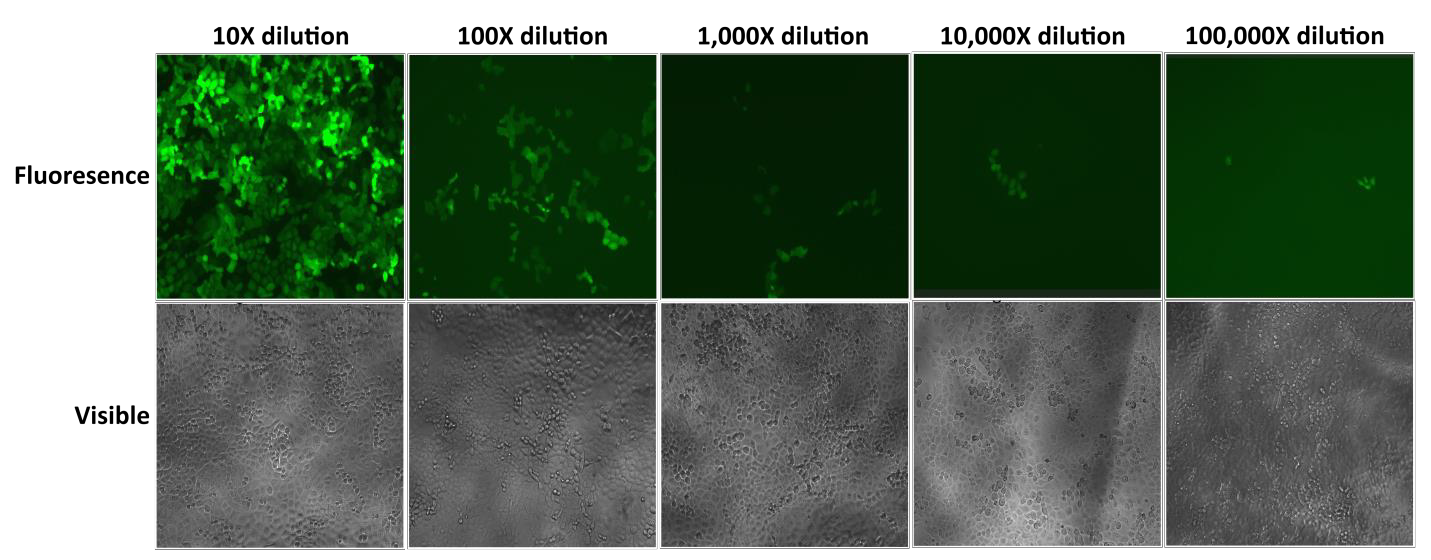
Les particules lentivirales Lentifect™ de GeneCopoeia fournissent des titres élevés, permettant aux chercheurs d’exprimer efficacement des gènes d’intérêt (Figure 2).
|
Figure 2. Test de dilutions sérielles de particules lentivirales Lentifect™. La fluorescence eGFP a été photographiée avec un microscope à fluorescence 72 heures après la transduction. |
|
GeneCopoeia offre l’une des plus vastes gammes de produits lentiviraux de l’industrie (tableau 1).
| Produit/service | Description |
| Clones lentiviraux et vecteurs de clonage | Clones préfabriqués et personnalisés portant des ORF, des promoteurs, des shRNA, des miRNA 3′ UTR, des précurseurs et des inhibiteurs, des sgRNA, et plus encore. Disponibles avec plusieurs promoteurs, marqueurs et rapporteurs. Vecteurs pour le clonage par soi-même de séquences d’intérêt. |
| Particules lentivirales Lentifect™ | Particules lentivirales prêtes à l’emploi et emballées sur mesure. Produites à partir des vastes collections de clones à l’échelle du génome de GeneCopoeia ou à partir de clones soumis par les clients. |
| Lenti-Pac™ Réactifs de conditionnement lentiviral | Système complet de réactifs pour la production de particules lentivirales à faire soi-même. Comprend des plasmides de conditionnement, une lignée cellulaire de conditionnement, une solution de concentration de particules et un kit de titrage. |
Tableau 1. Gamme de produits et services lentiviraux de GeneCopoeia.
Systèmes basés sur l’AAV
Contrairement au génome ARN des lentivirus, l’AAV a un génome ADN simple brin (Samulski et Muzyczka, 2014). De plus, l’AAV n’est pas dérivé d’un agent pathogène ; il s’agit plutôt d’un contaminant de l’adénovirus, sans qu’aucune condition pathogène ne lui soit attribuée. Les AAV naturels s’intègrent dans le génome comme les lentivirus, mais uniquement au locus AAVS1 sur le chromosome 19. Ce site est également connu sous le nom de « Safe Harbor », car il est couramment utilisé pour l’insertion de transgènes sans endommager les cellules (DeKelver, et al., 2010).
Comme le lentivirus, l’AAV a été modifié pour la sécurité et la facilité d’utilisation. L’AAV nécessite une co-infection avec un virus auxiliaire. Le génome de l’AAV est long de 4,7 kb et contient 2 gènes, Rep et Cap, qui sont nécessaires pour la réplication et l’intégration virale. Dans AAVPrime™, Rep et Cap sont supprimés, ne laissant que les répétitions terminales inversées (ITR) 5′ et 3′ de 145 pb. La suppression de Rep et Cap a trois objectifs : 1) Elle élimine la capacité d’un virus auxiliaire à permettre aux cellules infectées par l’AAV de produire de nouveaux virions AAV ; 2) Elle permet l’insertion de gènes d’une longueur allant jusqu’à environ 4 kb (bien que le titre viral diminue avec des transgènes de plus de 3 kb) ; et 3) Elle élimine pratiquement la capacité de l’AAV à s’intégrer. La petite taille de l’AAV présente des difficultés pour certaines applications. Par exemple, pour l’édition du génome CRISPR, les chercheurs utilisent la nucléase Cas9 de S. aureus, car elle est environ 30% plus courte que la Cas9 de S. pyogenes, plus couramment utilisée (Ran, et al…, 2015).
Pour l’emballage, Rep et Cap ont été déplacés vers un plasmide différent, et les gènes d’aide de l’Adénovirus sont placés sur un troisième plasmide, ce qui rend l’ensemble du système d’emballage sûr et sans virus d’aide (Figure 3).
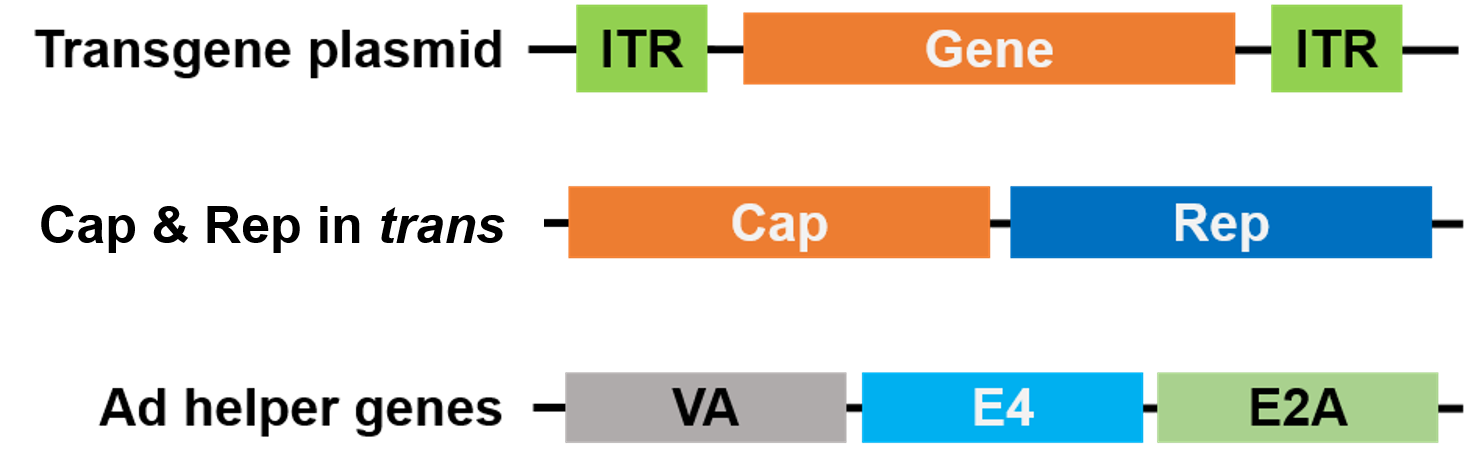 |
Figure 3. AAV sans virus Helper. 3 plasmides sont utilisés pour le conditionnement. Le plasmide du gène d’intérêt (en haut) contient les répétitions terminales inversées (ITR). Un 2e plasmide (au milieu) porte les gènes Cap et Rep de l’AAV, et le 3e plasmide (en bas) porte les gènes requis de l’Adénovirus (Ad) |
De plus, l’AAV existe en différents sérotypes, qui affectent la spécificité tissulaire de l’infection par l’AAV. Les sérotypes multiples permettent aux chercheurs soit a) d’infecter une large gamme de cellules hôtes ; soit b) de limiter l’infection à un ou quelques tissus. Les particules AAV AAVPrime™ de GeneCopoeia sont disponibles en plusieurs sérotypes (tableau 2).
| Sérotype | Tissus cible primaire | Description |
| AAV-1 | Muscle | Mieux pour le muscle cardiaque, le muscle squelettique, le tissu neuronal et glial. |
| AAV-2 | Muscle, foie, rétine | Sérotype le plus couramment utilisé. Le meilleur pour les neurones, les muscles, le foie et le cerveau. |
| AAV-3 | Mégacaryocytes | Le meilleur pour les mégacaryocytes, les muscles, le foie, les poumons et la rétine. |
| AAV-4 | Retina | Le meilleur pour les neurones, les muscles, le cerveau et la rétine. |
| AAV-5 | Poumon | Meilleur pour le poumon, les neurones, la synovie, la rétine et le pancréas. |
| AAV-6 | Muscle, poumon | Meilleur pour le poumon, le foie et le cœur. |
| AAV-7 | Muscle, rétine, neurones | Mieux pour les muscles, les neurones et le foie. |
| AAV-8 | Liver | Mieux pour les muscles, le cerveau, le foie et la rétine. |
| AAV-9 | Divers | Meilleur pour les muscles, le cœur, le foie, les poumons et le cerveau. |
| AAV-10 | Pleura, CNS | Cloné à partir de Cynomolgus, presque identique à AAVrh10 sauf pour 12 acides aminés dans VP1. Meilleur pour le poumon, le muscle, le cœur, le SNC et le foie. |
| AAV-DJ | Varié | Mélange de 8 sérotypes naturels. Transduit efficacement une grande variété de types de cellules in vitro. |
| AAV-DJ/8 | Varié | Variant de l’AAV-DJ avec une mutation du domaine de liaison à l’héparine (HBD), qui permet l’infection du foie ainsi que d’autres tissus in vivo. |
Tableau 2. Liste des sérotypes d’AAV largement utilisés
Les particules d’AAV AAVPrime™ présentent les caractéristiques suivantes qui les rendent très utiles pour la délivrance d’ADN :
- Titres élevés. Le titre des particules purifiées peut atteindre 10^14 GC/ml (copies de génome/ml)
- Polyvalent. Les multiples sérotypes permettent une utilisation dans une gamme large ou limitée de cellules hôtes
- Faible toxicité. Ne s’intègre pas dans le génome de l’hôte.
- Faible immunogénicité. Réponse immunitaire minimale de l’hôte.
- Sûr. Non associé à aucune maladie humaine
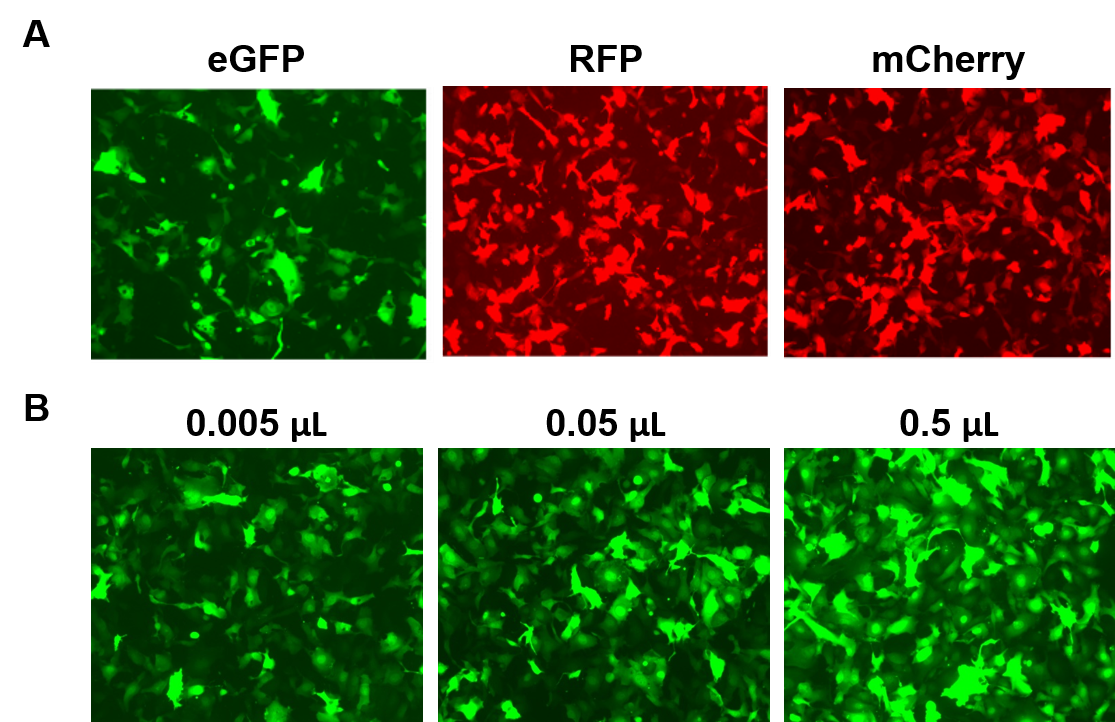
Les particules AAVPrime™ sont disponibles pour les ORF humains et de souris jusqu’à 3 kb, dans de multiples sérotypes et options de promoteur, en pureté standard (pour une utilisation in vitro uniquement) ou purifiée (pour une utilisation in vivo). Les clients peuvent commander des clones de plasmides, des particules générées sur mesure pour les gènes d’intérêt, ou choisir parmi des options préfabriquées exprimant des gènes tels que des reporters fluorescents (Figure 4).
|
Figure 4. Performances des particules AAVPrime™ de GeneCopoeia. A. Cellules HT1080 dans des plaques à 24 puits transduites avec 0,5 µL d’AAV de pureté standard exprimant la GFP améliorée (eGFP), la protéine fluorescente rouge (RFP) et le Cherry monomère (mCherry). B. Des cellules HT1080 dans des plaques à 24 puits ont été transduites avec des quantités variables d’AAV purifié exprimant la eGFP. Les cellules ont été visualisées avec un microscope à fluorescence (Temps d’exposition : 400 ms). |
|
Quoi choisir : Lentivirus ou AAV?
Le choix entre lentivirus et AAV dépend de nombreux facteurs. Par exemple, le fait que les lentivirus s’intègrent au génome peut être à la fois un avantage et un inconvénient, en fonction de vos besoins. Consultez le tableau ci-dessous pour vous aider à décider :
| Plus grands inserts | Intégration stable | Pas d’intégration | . intégration | Spécificité cellules/tissus | Sécurité in vivo | |
| Lentivirus | ✔︎ | ✔︎ | ||||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Pour en savoir plus sur les systèmes viraux de GeneCopoeia et pour commander, visitez notre site Web (https://www.genecopoeia.com/product/lentiviral-system/)
Conclusions
A GeneCopoeia, nous nous efforçons de vous fournir des produits de la plus haute qualité, à la pointe de la technologie, pour la génomique fonctionnelle et la biologie cellulaire. Nous proposons une large gamme de produits, depuis les ensembles de clones d’ADN plasmidique pour les ORF, les promoteurs de gènes, les miRNA, les shRNA et CRISPR, jusqu’aux kits et réactifs puissants, en passant par les produits pour les sondes fluorescentes de structure cellulaire, la quantification des acides nucléiques et les anticorps marqués. Pour en savoir plus, visitez notre site Web, www.genecopoeia.com, ou contactez-nous à [email protected].
DeKelver, et al. (2010). Génomique fonctionnelle, protéomique et analyse de l’ADN régulateur dans des contextes isogéniques en utilisant la transgénèse pilotée par la nucléase à doigt de zinc dans un locus sûr du génome humain. Genome Res 20, 1133.
Dull, et al. (1998). Un vecteur lentivirus de troisième génération avec un système de conditionnement conditionnel. J. Virol. 72, 8463.
Ran, et al. (2015). Édition du génome in vivo à l’aide de Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Vecteurs lentiviraux : de la base au translationnel. Biochem. J. 443, 603.
Samulski et Muzyczka (2014). Thérapie génique médiée par AAV pour la recherche et à des fins thérapeutiques. Annu. Rev. Virol. 1, 427.