Compte tenu de la relative simplicité structurelle et de la répétitivité de l’ADN, il s’ensuivrait que les protéines qui s’y lient spécifiquement pourraient avoir des motifs de domaines de liaison à l’ADN communs mais avec des chaînes latérales d’acides aminés spécifiques permettant des interactions de liaison spécifiques.
- hélice-tour-hélice : présente dans les protéines de liaison à l’ADN procaryotes.
Figure : hélice-tour-hélice
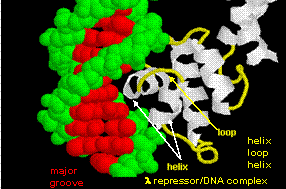
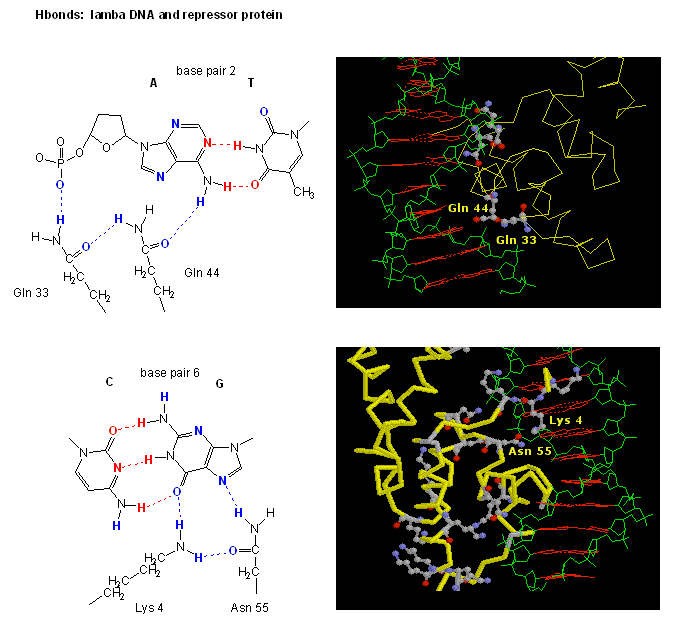
Les figures montrent deux protéines de ce type, le répresseur cro du bactériophage 434 et le répresseur lambda du bactériophage lambda. (Les bactériophages sont des virus qui infectent les bactéries.) Remarquez comment la spécificité est obtenue, en partie, par la formation de liaisons H spécifiques entre la protéine et le grand sillon de l’ADN opérateur.
Figure : Complexe répresseur/ADN Lambda
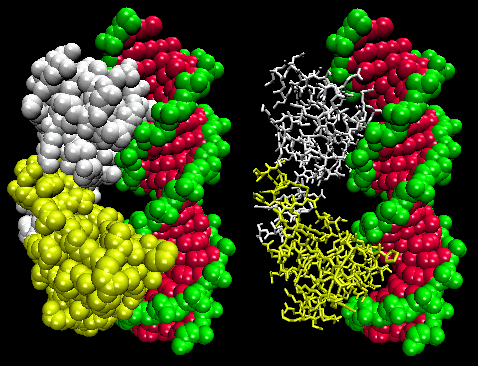
Figure : Interactions de liaison H entre le répresseurλ et l’ADN
![]() Jmol : Mise à jour du complexe répresseur Lambda/ADN Jmol14 (Java) | JSMol (HTML5)
Jmol : Mise à jour du complexe répresseur Lambda/ADN Jmol14 (Java) | JSMol (HTML5)
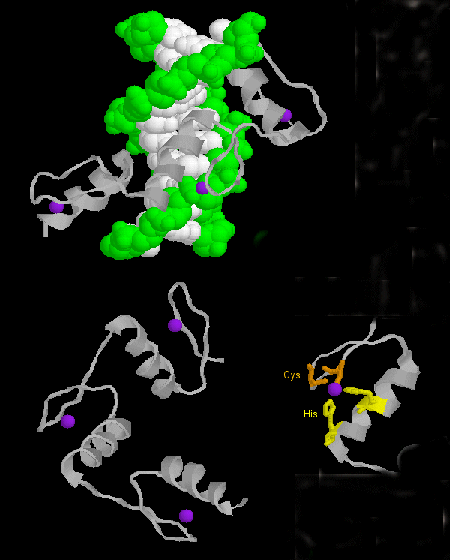
- Doigt de zinc : (eucaryotes) Ces protéines ont un motif de séquence commun de X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4- dans lequel X est un acide aminé quelconque. Zn2+ est coordonné de manière tétraédrique avec les chaînes latérales Cys et His, qui se trouvent respectivement sur l’un des deux brins bêta antiparallèles et sur une hélice alpha. Le doigt de zinc, stabilisé par le zinc, se lie au sillon majeur de l’ADN. ]
Figure : doigt de zinc
![]() Jmol : Complexe Zif268:ADN mis à jour Jmol14 (Java) | JSMol (HTML5)
Jmol : Complexe Zif268:ADN mis à jour Jmol14 (Java) | JSMol (HTML5)
Les protéines à doigt de zinc, dont 900 sont codées dans le génome humain (y compris la protéine de liaison aux isolateurs eucaryotes CTCF décrite ci-dessus) peuvent être mobilisées pour réparer réellement des mutations spécifiques dans les cellules, ce qui, si cela est effectué dans un pourcentage suffisamment élevé de cellules mutantes, pourrait guérir des maladies génétiques spécifiques telles que certaines formes de la maladie d’immunodéficience combinée sévère. Dans cette nouvelle technique (Urnov et al, 2005), de multiples domaines de liaison du doigt Zn (l’un des domaines naturels ou des formes mutantes produites en laboratoire), chacun spécifique d’une certaine séquence de nucléotides, sont liés à une endonucléase non spécifique, dérivée de l’enzyme FokI. La nucléase est active sous forme dimérique, de sorte que le complexe actif nécessite deux domaines endonucléases, chacun lié à quatre domaines de doigts Zn différents, pour s’assembler au site cible. La spécificité de la liaison est obtenue par sélection par les domaines à doigt Zn. Une encoche est alors pratiquée sur l’ADN par la nucléase et les mécanismes de réparation de la cellule hôte s’ensuivent. Ce processus implique la séparation des brins, la recombinaison homologue de la région entaillée avec de l’ADN complémentaire dans la cellule et la réparation de l’entaille. Si un excès d’ADN de type sauvage (non muté) est ajouté aux cellules et utilisé comme matrice, le mécanisme normal de réparation de l’ADN fixerait la mutation. Urnov et al ont montré que jusqu’à 20% des cellules cultivées contenant une mutation peuvent être réparées en laboratoire. Si ces cellules obtiennent un avantage sélectif de croissance, les cellules mutées seraient éventuellement remplacées par des cellules de type sauvage.
- récepteurs des hormones stéroïdiennes : (eucaryotes) Contrairement à la plupart des hormones, qui se lient à des récepteurs de surface cellulaire, les hormones stéroïdes (dérivés du cholestérol) traversent la membrane cellulaire et se lient à des récepteurs cytoplasmiques par l’intermédiaire d’un domaine de liaison hormonal. Cela modifie la forme du récepteur qui se lie ensuite à un site spécifique sur l’ADN (élément de réponse aux hormones) par l’intermédiaire d’un domaine de liaison à l’ADN. Dans une structure analogue au doigt de zinc, Zn 2+ est coordonné de manière tétraédrique à 4 Cys, dans une structure de type globulaire qui se lie en tant que dimère à deux séquences d’ADN identiques, mais inversées (palindrome) dans le sillon principal. (Exemples de palindromes : Able était je avant de voir Elbe ; Dennis et Edna dînent, dis-je, alors qu’Enid et Edna ont péché.
Considérez le récepteur des glucocorticoïdes (GR) comme un exemple spécifique. Il se lie à l’ADN sous la forme d’un dimère. Les deux domaines de liaison à l’ADN du dimère s’associent à deux sillons majeurs adjacents de l’ADN dans la séquence de liaison du GR (GBS), une courte séquence d’ADN au sein du promoteur. Meijsing et al. ont découvert que non seulement la GBS agit comme un site de liaison pour le GR, permettant la transcription des gènes, mais qu’elle affecte également la conformation du récepteur, entraînant la régulation de la transcription des gènes d’une autre manière. Le groupe a construit des « gènes rapporteurs » de luciférase, dont le GBS est lié au gène de la protéine luciférase, qui exprimeraient la protéine luciférase (qui est fluorescente) s’ils étaient transcrits, avec le GBS. Ils ont constaté que l’activité transcriptionnelle relative n’était pas corrélée à l’affinité de liaison relative du GR au GBS. Les GBS beaucoup plus actifs que les autres se lient de manière comparable à ceux de moindre activité, tandis que les GBS ayant une activité transcriptionnelle similaire se lient avec des affinités différentes. Cela montre que le GBS confère une fonction unique au GR qui lui est associé (c’est-à-dire que la transcription n’est pas simplement affectée par la liaison ou non du GR au GBS). Un �lever arm� du récepteur s’est avéré subir des changements conformationnels lorsqu’il est lié à l’ADN, avec des changements spécifiques à la séquence à laquelle il est lié. Une protéine mutante, GR-γ, a été rendue identique à la protéine sauvage, GR-α, sauf dans le bras de levier s’est avérée avoir une activité transcriptionnelle différente même si elles se liaient au même site sur l’ADN, montrant que le bras de levier et sa conformation affectent la transcription.
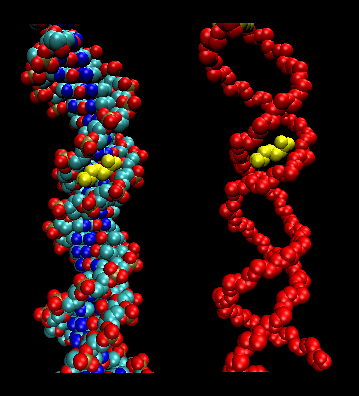
- leucine fermetures éclair (ou ciseaux) : (eucaryotes) Ces protéines contiennent des tronçons de 35 acides aminés dans lesquels Leu se trouve de manière répétée à 7 intervalles d’acides aminés. Ces régions de la protéine forment des hélices amphiphiles, avec Leu sur une face, un Leu après deux tours d’hélice. Deux de ces protéines peuvent former un dimère, stabilisé par la liaison de ces hélices amphiphiles non polaires et riches en leucine l’une à l’autre, formant une bobine enroulée, comme dans la protéine musculaire myosine. La fermeture éclair à leucine représente le domaine de liaison de la protéine. Le domaine de liaison à l’ADN se trouve dans les 30 premiers acides aminés N-terminaux, qui sont basiques et forment une hélice alpha lorsque la protéine se lie à l’ADN. La fermeture éclair de leucine a alors pour fonction de réunir deux protéines de liaison à l’ADN, ce qui permet aux hélices de base N-terminales d’interagir avec le grand sillon de l’ADN de manière spécifique à la base. La valine et l’isoleucine, ainsi que la leucine, se trouvent souvent dans des tronçons d’acides aminés qui peuvent interagir pour former d’autres types de bobines enroulées.
Figure : fermetures éclair de leucine (réalisées avec VMD)
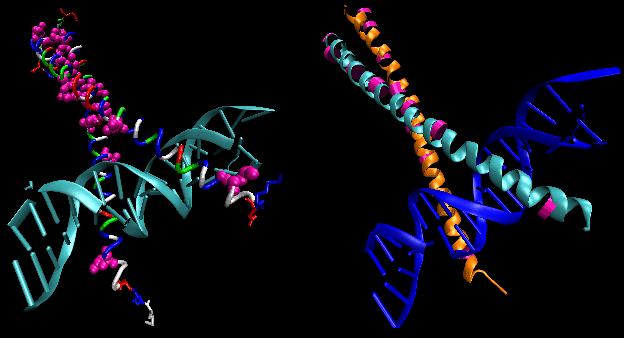
![]() Jmol : Mise à jour de la fermeture éclair à leucine Jmol14 (Java) | JSMol (HTML5)
Jmol : Mise à jour de la fermeture éclair à leucine Jmol14 (Java) | JSMol (HTML5)
Tout comme les nucléases à doigts de zinc ont été utilisées pour induire la réparation de mutations, une autre étude du génome du rat a utilisé des ZFNs spécialement conçus pour provoquer des ruptures dans l’ADN-ds qui contiennent des mutations provenant d’un mécanisme de réparation de l’ADN inexact (par NHEJ) et qui contiennent donc des mutations spécifiques (Geurts, et al. 2009). Ce processus, �knockout du gène,� empêche la production de la protéine normalement transcrite par le gène cible. Des ZFN à cinq et six doigts ont été utilisés pour atteindre un haut niveau de spécificité dans la liaison ciblée au gène pour trois protéines différentes : la protéine fluorescente verte (GFP), l’immunoglobuline M (IgM) et Rab38. Le knockout a réussi chez 12% des rats testés ; ces animaux ne présentaient aucune protéine de type sauvage et aucune expression. Les ZFN étaient suffisamment spécifiques pour qu’aucune mutation ne soit observée sur l’un des 20 sites non ciblés prédits. Cette étude soutient la viabilité du contrôle de la transcription et de l’expression pour le traitement des maladies et l’importance de la liaison spécifique.
Nous avons vu que deux facteurs principaux contribuent à la reconnaissance spécifique de l’ADN par les protéines ; la formation de liaisons hydrogène avec des donneurs et accepteurs nucléotidiques spécifiques dans le sillon majeur, et les déformations dépendantes de la séquence de l’hélice d’ADN vers des formes modifiées avec une affinité accrue des ligands protéiques. Par exemple, la protéine de liaison Tata (TBP) peut interagir avec un sillon mineur élargi dans la boîte TATA. De nouvelles découvertes soutiennent qu’en plus les protéines sont capables d’utiliser des informations dans les sillons mineurs qui sont devenus « rétrécis » en fonction de la séquence de nucléotides.
Les pistes d’ADN enrichies en A peuvent conduire à des conformations de torsion qui provoquent la liaison hydrogène entre paires de bases dans les sillons majeurs, résultats dans le rétrécissement des sillons mineurs. De grandes quantités de paires de bases AT sont concentrées dans les sillons mineurs étroits (largeur <5,0 �) et les paires de bases CG se trouvent plus fréquemment dans les sillons mineurs larges.
Comment le rétrécissement des sillons mineurs affecte-t-il la reconnaissance de l’ADN ? Les sillons mineurs étroits augmentent le potentiel électrostatique négatif de l’ADN, ce qui en fait un site plus spécifique et reconnaissable. Les phosphates du squelette de l’ADN sont plus proches du milieu du sillon lorsqu’il est étroit, corrélant ainsi les sillons mineurs étroits à un potentiel électrostatique plus négatif.
Les parties des protéines interagissant avec le sillon mineur contiennent de l’arginine dont la chaîne latérale peut être logée dans le sillon mineur plus étroit et plus négatif. Les arginines peuvent se lier et dans certains cas s’insérer comme de courts motifs de séquence qui renforcent la spécificité de la reconnaissance de la forme de l’ADN. Arg est préféré à Lys car les rayons effectifs de la charge dans Arg sont plus grands que ceux du porteur de charge dans Lys. Cela entraîne une diminution de l’énergie de désolvatation pour Arg, ce qui favorise sa liaison au sillon majeur rétréci. Cette découverte montre que « le rôle de la forme de l’ADN doit être pris en considération lors de l’annotation de l’ensemble du génome et de la prédiction des sites de liaison des facteurs de transcription ».
Figure : Arg dans la liaison de la transposase T3c dans le bosquet mineur rétréci du transposon T3c
- Modèle de glissement pour les interactions protéine/ADN
Contributeurs et attributions
- Professeur Henry Jakubowski (College of St. Benedict/St. John’s University)
.