Introduction
La sérotonine (5-hydroxytryptamine, 5-HT) 2C (5-HT2CRs) sont largement distribués dans le cerveau, et médient les effets régulateurs de la 5-HT sur l’anxiété, le sommeil, la sécrétion hormonale, le comportement alimentaire, l’activité locomotrice, ainsi que les processus d’apprentissage et de mémoire (Bagdy, 1998 ; Chagraoui et al., 2016). Le dysfonctionnement du 5-HT2CR a été impliqué dans des conditions pathologiques, comme l’anxiété et la dépression (Chagraoui et al, 2016 ; Di Giovanni et De Deurwaerdere, 2016). D’autre part, de nombreux antidépresseurs, anxiolytiques et antipsychotiques ont des affinités avec les 5-HT2CR, qui peuvent être impliquées dans les effets thérapeutiques de ces médicaments (Bagdy et al., 2001 ; Chagraoui et al., 2016 ; Di Giovanni et De Deurwaerdere, 2016). Ainsi, le 5-HT2CR est une cible pharmacologique prometteuse dans le traitement de plusieurs troubles neuropsychiatriques (Chagraoui et al, 2016 ; Di Giovanni et De Deurwaerdere, 2016).
La stimulation des 5-HT2CR a été décrite comme produisant de l’anxiété, et à son tour, les antagonistes sous-types des 5-HT2CR comme le SB-242084 ont exercé des effets anxiolytiques marqués (Dekeyne et al., 2000 ; Bagdy et al., 2001 ; Kantor et al., 2005). Les antagonistes sélectifs du 5-HT2CR RS-102221 et SB-242084 ont produit des effets de type antidépresseur à déclenchement rapide chez la souris (Opal et al., 2014). De même, l’antagonisme du 5-HT2CR a potentialisé les effets anxiolytiques et antidépresseurs de la fluoxétine, un inhibiteur sélectif de la recapture de la sérotonine (ISRS), de plus, il a réduit les effets secondaires moteurs chez les souris (Demireva et al., 2018). Il est important de noter que l’interaction des systèmes 5-HT et dopamine (DA) a été suggérée pour contribuer à ces effets (De Deurwaerdere et Di Giovanni, 2017).
Divers paramètres sur l’électroencéphalogramme (EEG) pendant la veille et le sommeil ont été décrits pour fournir des biomarqueurs de la dépression et de la thérapie antidépressive individualisée (Steiger et Kimura, 2010). Les oscillations gamma sont des composantes à relativement haute fréquence (>30 Hz) de l’EEG, qui fournissent des indices importants sur la dynamique des populations neuronales (Buzsaki et Wang, 2012). Les oscillations gamma ont été associées aux fonctions sensorielles et cognitives, ainsi qu’à la plasticité neuronale et à la mémoire chez les animaux et les humains (Cardin, 2016). D’autre part, une activité gamma anormale a été impliquée dans plusieurs conditions psychiatriques (Cardin, 2016). Sur la base du nombre croissant de preuves suggérant l’implication du gamma dans le pathomécanisme de la dépression, les altérations des oscillations gamma ont récemment été proposées comme un nouveau biomarqueur (ou endophénotype) pour la dépression majeure et même pour le suivi des thérapies antidépressives (Fitzgerald et Watson, 2018). Il a été démontré que plusieurs antidépresseurs modifient l’activité gamma (Fitzgerald et Watson, 2018). Par exemple, on a constaté que l’ISRS escitalopram diminuait la puissance gamma pendant le sommeil à mouvements oculaires rapides (REMS) lors d’un traitement aigu, tandis que l’escitalopram chronique augmentait la puissance gamma pendant les stades de sommeil lent (Papp et al., 2018). Cependant, la question reste ouverte de savoir si les altérations de l’activité gamma induites par les médicaments dans les différents stades de vigilance sont des indicateurs ou des médiateurs causaux de l’action thérapeutique, ou des signes d’effets secondaires (Fitzgerald et Watson, 2018).
Selon nos connaissances, il existe un vide dans la littérature concernant les effets des antagonistes sélectifs du 5-HT2CR sur les oscillations gamma chez l’homme et chez les rongeurs. Ainsi, nous étudions ici comment la puissance gamma (30-60 Hz) est modifiée dans différents stades de vigilance (i) par l’administration aiguë de l’antagoniste hautement sélectif du 5-HT2CR SB-242084, (ii) par l’administration chronique de l’escitalopram, un ISRS largement utilisé, (iii) et par leur combinaison.
Méthodes
Des rats Wistar mâles, achetés dans l’animalerie locale (Université Semmelweis, Budapest, Hongrie), ont été utilisés dans les expériences. Les animaux ont été maintenus dans des conditions environnementales contrôlées (21 ± 1°C, cycle lumière-obscurité de 12/12 h avec allumage des lumières à 10 heures), et ont eu un accès libre à de la nourriture standard pour rongeurs et à de l’eau du robinet. Toutes les conditions d’hébergement et les expériences sur les animaux ont été réalisées conformément à la directive européenne 2010/63/UE et aux « Principes de soins aux animaux de laboratoire » des Instituts nationaux de la santé (publications NIH n° 85-23, révisées en 1985), ainsi qu’aux lois nationales spécifiques (règlement gouvernemental hongrois sur les études animales 40/2013). Les expériences ont été approuvées par le Comité scientifique national d’éthique sur l’expérimentation animale. Tous les efforts ont été faits pour minimiser la douleur et l’inconfort des animaux.
Des électrodes électroencéphalographiques (EEG) et électromyographiques (EMG) ont été implantées sous anesthésie à l’halothane à 2%, comme décrit précédemment (Jakus et al., 2003). Les rats pesaient 250-280 g au moment de la chirurgie. Pour l’EEG, des électrodes à vis en acier inoxydable ont été insérées par voie épidurale sur le cortex frontal gauche (L : 2,0 mm, A : 2,0 mm au bregma), le cortex pariétal gauche (L : 2,0 mm, A : 2,0 mm au lambda), et sur le cervelet comme électrode de masse. Pour l’EMG, une paire d’électrodes EMG (électrodes à ressort en acier inoxydable recouvertes de caoutchouc de silicone, Plastics One Inc., Roanoke, VA, USA) a été placée dans la musculature du cou. Après récupération (7 jours), les rats ont été reliés au système EEG par un câble d’enregistrement et un pivot électrique fixé au-dessus des cages. Les animaux sont restés connectés pendant toute l’étude.
Pour le prétraitement chronique, les rats ont reçu 10 mg/kg/jour de solution d’escitalopram-oxalate (ESC Gedeon Richter Plc, Hongrie, dissous dans une solution de HCl 0,3 N dans de l’eau distillée) ou de véhicule (VEH ; solution de HCl 0,3 N dans de l’eau distillée) via une minipompe osmotique (2ML4, ALZET, 2,5 μl/h, DURECT Corporation, USA) pendant 21 jours. Le 21e jour, les rats ont reçu des injections intrapéritonéales de 1 mg/kg de SB-242084 ou de véhicule dans un volume de 1 ml/kg de poids corporel. Les rats ont été répartis aléatoirement en quatre groupes comme suit : VEH+veh (n = 6), VEH+SB (n = 6), ESC+veh (n = 6) et ESC+SB (n = 6).
L’EEG, l’EMG et l’activité motrice ont été enregistrés pendant au moins 3 h après les injections, à partir de l’apparition de la lumière. Les signaux ont été amplifiés par des filtres analogiques (Coulburn Lablinc System, USA ; filtrage au-dessous de 0,50 Hz et au-dessus de 100 Hz à 6 dB/octave) et soumis à une conversion analogique-numérique (MVRD-2200 V, Canopus, Japon) avec un taux d’échantillonnage de 128 Hz. Les données ont été stockées sur un ordinateur pour un traitement ultérieur.
Les enregistrements polygraphiques ont été notés à l’aide de la fonction de notation automatique du logiciel Sleep Sign for Animal (Kissei Comtec America Inc., USA) pour des époques de 4 s, suivies d’une supervision visuelle. Six stades de vigilance ont été distingués sur la base de critères conventionnels (Kantor et al., 2004) comme suit (voir la figure supplémentaire 1 pour des traces représentatives). En état de veille active (AW), l’EEG est caractérisé par une activité de faible amplitude aux fréquences bêta (14-29 Hz) et alpha (10-13 Hz), en plus d’une activité EMG et motrice intense. Dans le cas de l’éveil passif (PW), le schéma EEG est similaire à celui de l’AW, accompagné d’une activité EMG relativement élevée et d’une activité motrice minimale ou nulle. Dans le sommeil lent léger (SWS-1), l’EEG est caractérisé par des ondes corticales lentes de forte amplitude (0,5-4 Hz) interrompues par des fuseaux (6-15 Hz), accompagnées d’une activité EMG réduite et d’aucune activité motrice. Dans le sommeil lent profond (SWS-2), l’EEG est dominé par des ondes corticales lentes continues de forte amplitude, accompagnées d’une activité EMG réduite et d’aucune activité motrice. Dans le stade intermédiaire du sommeil (IS), qui se produit principalement avant ou après le sommeil paradoxal, l’EEG est caractérisé par une association de fuseaux de forte amplitude et d’ondes thêta (5-9 Hz). Dans le REMS, l’EEG est dominé par une activité de faible amplitude et de haute fréquence avec des ondes thêta régulières, en plus de l’EMG silencieux et de l’activité motrice avec une contraction musculaire occasionnelle (twitching). Les époques qui étaient contaminées par des artefacts ou qui contenaient des transitions entre les stades de vigilance ont été écartées.
L’analyse quantitative de l’EEG (qEEG) a été calculée pour des époques consécutives de 4 s dans la plage de fréquence de 0,5-60 Hz au moyen d’une transformation de Fourier rapide (fenêtre de Hanning, résolution de fréquence de 0,25 Hz). Les intervalles adjacents de 0,25 Hz ont été additionnés en intervalles de 1 Hz, marqués par leurs limites supérieures. La moyenne des valeurs de puissance des époques AW, PW, SWS-1, SWS-2, IS et REMS a été calculée séparément dans les 3 heures résumées, ou dans la première, la deuxième et la troisième heure respectivement, après les traitements afin d’obtenir des valeurs de densité de puissance pour ces stades de veille et de sommeil. Dans ce rapport, nous nous sommes concentrés sur la plage de fréquences 30-60 Hz du spectre de puissance de l’EEG. Les données comprises entre 49 et 51 Hz ont été exclues de l’analyse pour éviter la contamination par le bruit parasite de 50 Hz provenant du réseau électrique. Toutes les données ont été transformées en logarithme avant l’analyse.
Pour l’analyse du spectre de puissance, les comparaisons entre les groupes ont été effectuées par ANOVA à deux voies sur mesures répétées avec deux facteurs principaux : le traitement (non répété) et les tranches de fréquence gamma (répétées), suivi du test post hoc de Bonferroni. Pour étudier les effets du traitement dans chaque h, les données résumées de la puissance de 30-60 Hz (à l’exclusion de celles de 49-51 Hz) ont été analysées par une ANOVA à une voie, concernant respectivement AW, PW, SWS-1, SWS-2, IS et REMS. Après la détection d’un effet principal significatif du traitement, des tests post hoc de Newman-Keuls ont été effectués. La signification statistique a été acceptée lorsque p < 0,05.
Dans notre plan expérimental, les rats témoins (VEH+veh) ont été exposés aux mêmes procédures que ceux traités par le médicament. Ainsi, la comparaison entre les groupes traités par les médicaments et le groupe témoin vise à minimiser la détresse causée par les injections et la présence des minipompes, permettant ainsi d’étudier les effets des médicaments. Pour les graphiques spectraux, afin d’améliorer la visibilité (les données de puissance de l’EEG suivent une tendance décroissante avec l’augmentation des fréquences), nous avons normalisé les valeurs de puissance des rats traités par les médicaments aux valeurs spectrales moyennes de puissance des rats témoins (groupe VEH+veh), montrant ainsi des données relatives. Les données absolues sont présentées sur les graphiques à barres, sous forme de valeurs de puissance résumées. Les données sont exprimées en moyenne ± SEM de six animaux par groupe.
Résultats
Les effets des médicaments (SB-242084 aigu, escitalopram chronique et leur combinaison) sur le qEEG dans la gamme gamma 30-60 Hz ont été évalués séparément pour les six stades de vigilance en faisant la moyenne des données de puissance dans les 3 premières heures de la phase passive (figure 1). L’analyse a révélé que tous les médicaments ont provoqué des altérations dépendantes du stade de vigilance dans cette gamme de fréquences, avec une tendance à l’élévation dans chaque stade, par rapport au groupe VEH+veh.
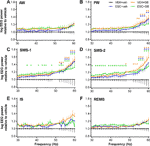
Figure 1 Modifications de la puissance de l’EEG dans la gamme de fréquences gamma (30-60 Hz) après l’administration de SB-242084 aiguë (VEH+SB), d’escitalopram chronique (ESC+veh) et de leur combinaison (ESC+SB) dans les 3 premières heures de la phase passive. Les spectres de puissance sont représentés dans les six phases de vigilance suivantes : (A) éveil actif (AW) et (B) éveil passif (PW), (C) sommeil léger (SWS-1) et (D) sommeil lent profond (SWS-2), (E) stade intermédiaire (IS), et (F) sommeil à mouvements oculaires rapides (REMS). Les données de puissance EEG sont présentées sous forme de moyenne ± SEM, par rapport au groupe témoin VEH+veh (n = 6 animaux par groupe). *Résultats post hoc significatifs par rapport au contrôle, p < 0,05.
Pendant le REMS, les résultats de l’ANOVA n’ont montré aucune altération significative (effet du traitement : F3,20 = 1,917, p = 0,1594 ; interaction traitement x fréquence : F81,540 = 1,218, p = 0,1081 ; figure 1A). Cependant, pendant le PW, une ligne de puissance modérément élevée a été observée dans les groupes SB, et aux fréquences les plus élevées également dans le groupe ESC+veh (effet du traitement : F3,20 = 2.217, p = 0.1176 ; interaction significative traitement x fréquence : F81,540 = 2,519, p < 0,001 ; figure 1B).
Les effets les plus importants ont été observés pendant les stades de sommeil à ondes lentes, où le SB-242084 aigu, l’escitalopram chronique et également le traitement combiné ont provoqué une augmentation de la puissance. Ceci a été confirmé par les résultats significatifs de l’ANOVA dans le SWS-1 (effet du traitement : F3,20 = 3,692, p = 0,0290 ; interaction significative traitement x fréquence : F81,540 = 2,693, p < 0,001 ; figure 1C), et dans SWS-2 (effet significatif du traitement : F3,20 = 4,787, p = 0,0113 ; interaction significative entre le traitement et la fréquence : F81,540 = 1,911, p < 0,001 ; figure 1D).
L’augmentation de la puissance gamma n’était pas significative pendant l’IS (effet du traitement : F3,20 = 2,349, p = 0,1031, interaction traitement x fréquence : F81,540 = 1,241, p = 0,0878 ; figure 1E). Enfin, pendant le REMS, ni le SB-242084 aigu ni l’escitalopram chronique n’ont affecté la puissance de l’EEG dans cette gamme de fréquences (effet du traitement : F3,19 = 2,515, p = 0,0891 ; interaction traitement x fréquence : F81,513 = 1,226, p = 0,1014 ; figure 1F). Nous notons que les données de seulement n = 5 animaux ont été utilisées dans le groupe ESC+SB, car un animal n’a pas passé de temps en REMS dans cet intervalle de temps.
Pour les différences post hoc significatives de Bonferroni suite aux résultats significatifs de l’ANOVA à deux voies décrits ci-dessus, voir la figure 1 pour chaque stade de vigilance. Aucune différence post hoc significative n’a été observée dans aucun des stades concernant les comparaisons de VEH+SB par rapport à ESC+veh, VEH+SB par rapport à ESC+SB, et ESC+veh par rapport à ESC+SB, respectivement.
Les effets des médicaments sur la puissance gamma totale en fonction du stade de vigilance ont été analysés heure par heure. L’ANOVA à sens unique a révélé que bien que dans la première h de SWS-1, l’effet du traitement n’était pas encore significatif (F3,20 = 2,544, p = 0,0851), dans la deuxième (F3,20 = 3,331, p = 0,0403) et la troisième h (F3,20 = 4,607, p = 0,0131), les élévations de puissance étaient significatives. Dans le cas de SWS-2, l’ANOVA a montré des effets significatifs du traitement à chaque h (F3,18 = 4,062, p = 0,0228 ; F3,20 = 5,348, p = 0,0072 ; F3,20 = 4,910, p = 0,0102, respectivement). De même, un effet significatif a été trouvé dans la deuxième heure de l’IS (F3,20 = 3,452, p = 0,0360), mais pas dans la première ou la troisième heure. Enfin, aucun effet significatif du traitement n’a été trouvé dans ces heures dans AW, PW et REMS. Pour les résultats significatifs post hoc, voir la figure 2 pour chaque stade de vigilance.
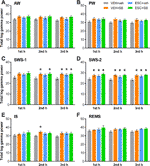
Figure 2 Puissance EEG totale dans la gamme de fréquences gamma (30-60 Hz) après l’administration de SB-242084 aiguë (VEH+SB), d’escitalopram chronique (ESC+veh) et de leur combinaison (ESC+SB) dans la première, deuxième et troisième heures de la phase passive, pendant (A) la veille active (AW) et (B) la veille passive (PW), (C) le sommeil léger (SWS-1) et (D) le sommeil lent profond (SWS-2), (E) le stade intermédiaire (IS) et (F) le sommeil à mouvements oculaires rapides (REMS). Les données résumées de la puissance EEG sont présentées sous forme de moyenne ± SEM (de n = 6 animaux par groupe). *Résultats post hoc significatifs par rapport au groupe témoin (VEH+veh), p < 0,05.
Discussion
Il s’agit de la première étude portant sur les effets aigus de l’antagoniste sélectif du 5-HT2CR SB-242084 sur la bande de fréquence gamma des spectres EEG dans différents stades de vigilance. En outre, il a été testé avec ou sans prétraitement chronique par des ISRS. Nous rapportons ici une augmentation de la puissance de la bande gamma pendant le SWS-2, le SWS-1 et le PW après l’administration aiguë de SB-242084 (1 mg/kg, ip.), chez le rat. Nos résultats concernant le prétraitement supplémentaire de 21 jours par l’escitalopram (10 mg/kg/jour, minipompes osmotiques) démontrent que le SB-242084 n’a pas modifié davantage la puissance gamma altérée par le traitement antidépresseur chronique. De plus, les effets aigus du SB-242084 et les effets chroniques de l’escitalopram sur la puissance gamma semblent très similaires dans la plupart des stades de vigilance. Cependant, les effets de la combinaison de ces deux traitements n’ont pas été considérés comme additifs.
Les fonctions cérébrales liées à l’activité gamma ont été abordées dans la section d’introduction. Les oscillations gamma ont été décrites dans de multiples zones du cerveau, comme le néocortex, le cortex entorhinal, l’hippocampe, le thalamus, l’amygdale, le bulbe olfactif et le striatum. Leur génération est liée à l’inhibition périsomatique ; surtout, à l’activité des interneurones positifs à la parvalbumine via les synapses d’acide gamma-aminobutyrique (GABA)A (Buzsaki et Wang, 2012). On pense que les oscillations gamma jouent un rôle important dans la dépression, ce que confirment les résultats obtenus chez l’homme et l’animal. En effet, des anomalies gamma ont été mesurées chez des patients déprimés, ainsi que dans des modèles animaux de dépression, où des changements dans le gamma ont été associés à une récupération thérapeutique (Khalid et al., 2016 ; Noda et al, 2017 ; Fitzgerald et Watson, 2018).
Divers traitements pharmacologiques (ciblant les systèmes de la sérotonine, de la noradrénaline, de la dopamine et du glutamate) et non pharmacologiques de la dépression se sont avérés modifier l’activité gamma (Fitzgerald et Watson, 2018). Par exemple, il a été démontré que l’escitalopram, l’antidépresseur ISRS largement utilisé, agissant sur le système sérotoninergique, réduit la puissance gamma pendant le REMS par un traitement aigu, alors que son administration chronique augmente la puissance gamma dans les stades de sommeil lent, chez le rat (Papp et al., 2018). Fait important, les antidépresseurs agissant sur le système noradrénergique, tels que la reboxétine et la désipramine, ont augmenté la puissance gamma (ainsi que thêta) dans le système septo-hippocampique après un traitement aigu, alors que l’ISRS fluvoxamine n’a pas produit un tel effet dans la même étude (Hajos et al., 2003a). Il a été démontré que les antidépresseurs présumés de la prochaine génération, tels que la kétamine et son métabolite, la (2R,6R)-hydroxynorkétamine, augmentent considérablement la puissance gamma lorsqu’ils sont appliqués à des doses adaptées aux antidépresseurs. Ces effets et également leurs actions de type antidépresseur ont été empêchés par un prétraitement avec un inhibiteur des récepteurs de l’acide α-amino-3-hydroxy-5-méthyl-4-isoxazole propionique (AMPAR) (Zanos et al., 2016). Enfin, Fitzgerald et Watson ont récemment proposé que la signalisation gamma puisse fournir un biomarqueur des effets antidépresseurs de toutes les classes d’antidépresseurs, car, selon leur hypothèse, toutes les classes d’antidépresseurs peuvent avoir des effets finaux communs sur les circuits limbiques (Fitzgerald et Watson, 2019).
Dans cette étude, nous avons examiné des médicaments agissant sur le système 5-HT, à savoir un antagoniste du 5-HT2CR et un ISRS dont l’action principale est d’augmenter le niveau extracellulaire de 5-HT en inhibant sa recapture synaptique via le 5-HT-transporteur. Un nombre croissant de données suggère que l’antagonisme du 5-HT2CR pourrait avoir des effets bénéfiques dans le traitement de la dépression et de l’anxiété, bien que ces effets des antagonistes sélectifs du 5-HT2CR n’aient pas encore été testés dans des études cliniques. La pertinence de l’association d’antagonistes du 5-HT2CR et d’ISRS a été confirmée par une étude de microdialyse chez le rat, au cours de laquelle la co-administration aiguë des antagonistes sélectifs du 5-HT2CR SB-242084 ou RS-102221 et de l’ISRS citalopram a augmenté les élévations des niveaux de 5-HT induites par le citalopram dans des régions impliquées dans la physiopathologie des troubles dépressifs (Cremers et al., 2004). Le prétraitement par le SB-242084 a également inversé l’augmentation de l’expression de la peur induite par le citalopram chez le rat (Burghardt et al., 2007). En outre, un article récent a montré qu’un traitement aigu au SB-242084 après un traitement chronique (21 jours) à la fluoxétine réduisait les comportements de type anxiété et dépression, et améliorait les effets secondaires induits par les ISRS chez les souris (Demireva et al, 2018).
Dans la présente étude, la dose de 1 mg/kg de SB-242084 a été choisie, sur la base d’anciennes études comportementales (Kennett et al., 1997 ; Martin et al., 2002 ; Opal et al., 2014) et de sommeil et/ou d’EEG (Popa et al., 2005 ; Sorman et al., 2011 ; Bogathy et al., 2019) chez les rongeurs. Il est important de noter que Kantor et al. ont démontré que, bien que des doses de 0,3 et 1,0 mg/kg du médicament aient produit des effets anxiolytiques similaires, seule la dose la plus élevée a affecté l’architecture veille-sommeil de manière importante (effet favorisant l’éveil avec réduction du SWS-2), chez des rats Sprague-Dawley (Kantor et al., 2005). Un effet réducteur des REMS ont été trouvés à la dose de 1 mg/kg chez des rats Wistar, et des élévations de la puissance thêta pendant l’AW et les REMS ont également été observées après ce traitement (Kostyalik et al., 2014).
L’effet du SB-242084 et de l’escitalopram sur l’activité gamma a été analysé séparément dans les stades de vigilance, puisque les fonctions cérébrales et l’activité oscillatoire associée, ainsi que les niveaux de neurotransmetteurs montrent des différences caractéristiques entre les stades. Le rôle des oscillations gamma dans les fonctions liées à l’éveil telles que l’attention focalisée, la cognition et le traitement sensoriel est bien documenté (Cardin, 2016), cependant, leur importance fonctionnelle pendant le sommeil est moins comprise. Pendant le sommeil paradoxal, un rôle des oscillations gamma (au-delà des thêta) dans la consolidation de la mémoire a été suggéré (Montgomery et al., 2008). Un article récent a proposé que l’augmentation de la puissance gamma dans le micro-état REMS phasique dans certaines zones est associée au traitement émotionnel, chez les humains (Simor et al., 2019). Pendant le non-REMS, les oscillations gamma pourraient être associées à des augmentations phasiques de l’activité neuronale pendant les oscillations lentes (Valderrama et al., 2012). Une étude par microélectrodes chez les singes et les humains a encore souligné le rôle des oscillations gamma (et bêta) pendant le non-REMS, à savoir, une cohérence élevée des oscillations suggère une contribution une contribution du gamma à la consolidation de la mémoire à la consolidation de la mémoire pendant le non-REMS (Quyen et al, 2016).
Nous avons constaté qu’une dose unique de SB-242084 élevait la puissance gamma pendant le SWS-2, le SWS-1, et- dans une moindre mesure- le PW, mais pas pendant le REMS, le IS, et le AW.
Les neurones 5-HT tirent le plus activement pendant l’éveil, leur activité diminue pendant le sommeil lent, et se tait pendant le REMS. Le système 5-HT a donc été considéré comme un modulateur clé du comportement veille-sommeil (Monti, 2011) et des oscillations cérébrales, bien que les mécanismes cellulaires et les récepteurs impliqués dans ces processus soient complexes et mal compris (Puig et Gener, 2015). On a constaté que la 5-HT en soi affecte l’activité gamma dans le cortex préfrontal du rat par l’intermédiaire des 5-HT1AR et des 5-HT2AR, mais pas des 5-HT2CR, ce qui entraîne une diminution globale de l’amplitude chez les rats anesthésiés (Puig et al., 2010). En outre, de plus en plus de preuves soutiennent l’importance du système DA dans la synchronisation des interneurones à stimulation rapide, générant ainsi/régulant les oscillations gamma (Furth et al., 2013).
Le 5-HT2CR est vraisemblablement le sous-type de récepteur 5-HT ayant la distribution la plus étendue dans le cerveau. Il a été décrit sur les interneurones GABAergiques dans de nombreuses régions, et est également exprimé par les neurones DA. Cependant, ce sous-type de récepteur n’est pas exprimé par les neurones 5-HT et noradrénergiques (NA). Plusieurs études précliniques (Di Giovanni et De Deurwaerdere, 2016 ; De Deurwaerdere et Di Giovanni, 2017) ont souligné le rôle des récepteurs 5-HT2 dans la modulation des systèmes monoaminergiques et, de façon intrigante, des systèmes DA. La stimulation locale des 5-HT2CR dans des zones cérébrales spécifiques produit de l’anxiété de manière région-dépendante, et à leur tour, les antagonistes sous-type-sélectifs des 5-HT2CR comme le SB-242084 exercent des actions anxiolytiques marquées (Bagdy et al., 2001 ; Di Giovanni et De Deurwaerdere, 2016). Plusieurs anxiolytiques et antidépresseurs possèdent des propriétés antagonistes du 5-HT2CR, par exemple, de nombreux antidépresseurs tricycliques, la miansérine, la mirtazapine, la trazodone, la néfazodone, la fluoxétine et l’agomélatine (Martin et al., 2014). D’autre part, les antagonistes sélectifs du 5-HT2CR ont été suggérés comme des antidépresseurs putatifs à action rapide sur la base d’études précliniques (Opal et al., 2014).
Quelques études ont été publiées concernant les effets qualitatifs (affectant l’architecture du sommeil et de l’éveil) et quantitatifs (affectant les spectres de puissance, c’est-à-dire les oscillations) sur le sommeil et l’éveil des antagonistes du 5-HT2CR, et du SB-242084 en particulier. Kantor et al. ont étudié les effets dose-dépendants du SB-242084 sur l’anxiété, la vigilance et les spectres EEG inférieurs à 30 Hz chez le rat. Ils ont constaté une augmentation de la puissance thêta à l’éveil (ce qui suggère un possible effet d’amélioration cognitive, l’activité thêta étant associée aux processus d’apprentissage et de mémoire), même à la dose de 0,1 mg/kg. En revanche, le médicament a augmenté le réveil et supprimé le SWS-2 dans la première heure de la phase passive uniquement à la dose de 1 mg/kg. En ce qui concerne les bandes de fréquence delta, alpha ou bêta pendant l’éveil, le REMS, le SWS-1 ou le SWS-2, aucune altération significative n’a été signalée dans cet article (Kantor et al., 2005). Kostyalik et al. ont décrit que le SB-242084 augmentait la durée du PW et supprimait le REMS, effet qui était atténué par un prétraitement chronique par l’ESC, chez les rats. En ce qui concerne le qEEG, ils ont constaté une augmentation de la puissance thêta pendant l’AW et également pendant le REMS, qui n’était pas modifiée par un prétraitement chronique à l’escitalopram (Kostyalik et al., 2014). L’effet d’augmentation de la puissance thêta de l’antagoniste du 5-HT2CR et donc le rôle du 5-HT2CR dans la régulation de l’activité thêta ont été soutenus par Hajos et al. (2003b).
Les effets de l’escitalopram et d’autres ISRS sur l’architecture veille-sommeil et les paramètres EEG chez l’homme et les rongeurs sont plus largement étudiés (Wilson et Argyropoulos, 2005 ; Vas et al., 2013 ; Fitzgerald et Watson, 2019). Récemment, nous avons signalé des altérations de la puissance gamma après une administration aiguë (réduction pendant le REMS) et chronique (élévation pendant le SWS-1 et le SWS-2) à des rats (Papp et al., 2018).
Il est intéressant de noter que les effets aigus du SB-242084 étaient similaires à ceux provoqués par l’escitalopram chronique, autrement dit, l’antagonisme sélectif sur le 5-HT2CR a produit des effets similaires sur l’activité gamma que le blocage chronique du transporteur de 5-HT et les effets supplémentaires qu’exerce l’escitalopram. Dans ce cas, nous présumons que les effets du 5-HT, à savoir la désensibilisation du 5-HT1AR (et peut-être aussi du 5-HT2AR) peuvent expliquer l’augmentation de la puissance gamma dans ces stades, comme nous l’avons proposé dans notre article précédent (Papp et al., 2018).
Pour expliquer nos résultats, nous devons prendre en considération le fait que les 5-HT2CR peuvent moduler l’activité des neurones 5-HT, NA et, surtout, DA (Di Giovanni et Deurwaerdere, 2016). Il a été rapporté que l’activité constitutive des 5-HT2CRs exerce un contrôle inhibiteur sur l’activité des neurones DA, qui a été inversé par l’administration systémique d’antagonistes des 5-HT2CRs. Le SB-242084 et le SB-206553 ont augmenté de manière significative la libération basale de DA dans les zones innervées par la DA du cerveau de rat. Cependant, la libération de DA provoquée par le SB-242084 était faible et atteignait un maximum par rapport au SB-206553 (De Deurwaerdere et al., 2004). Il est intéressant de noter que les ISRS ont également été impliqués dans la régulation de la signalisation DAergique (ce qui pourrait indiquer une possible caractéristique commune des deux médicaments étudiés), bien que les données disponibles dans la littérature soient ambiguës. Alors qu’il a été rapporté que l’escitalopram en phase aiguë augmentait le taux d’excitation et l’éclatement des neurones dans l’aire tegmentale ventrale (Schilstrom et al., 2011), une autre étude a démontré qu’une administration d’escitalopram pendant 2 semaines diminuait le taux d’excitation et l’éclatement de ces neurones, chez des rats anesthésiés (Dremencov et al., 2009).
Les résultats de cette étude doivent être interprétés dans le contexte de certaines limitations. Le SB-242084 a été administré en une seule dose, et nous n’avons pas testé si l’effet de renforcement gamma du médicament est dose-dépendant. En outre, notre analyse a été limitée à un maximum de 60 Hz en raison de la limite de Nyquist déterminée par le taux d’échantillonnage nominal, donc des travaux supplémentaires sont nécessaires pour étudier les fréquences gamma plus rapides, ainsi que les oscillations à haute fréquence (HFO) et les ondulations.
Ensemble, nos résultats montrent des effets similaires entre le SB-242084 aigu et l’escitalopram chronique sur l’activité gamma, ce qui soutient les preuves précliniques (et cliniques indirectes) qu’un traitement aigu ou à court terme avec des antagonistes du 5-HT2CR peut avoir des effets antidépresseurs. Ainsi, notre travail pourrait fournir des preuves supplémentaires que les antagonistes du 5-HT2CR peuvent être bénéfiques dans le traitement de la dépression et/ou de l’anxiété. Si les altérations de l’activité gamma sont des marqueurs de l’action thérapeutique des médicaments ou des médiateurs de l’effet thérapeutique, reste une question non résolue qui nécessite des études supplémentaires.
Data Availability Statement
Les ensembles de données générés et analysés au cours de la présente étude ne sont pas accessibles au public en raison de l’analyse en cours pour une publication future, mais sont disponibles auprès de l’auteur correspondant sur demande raisonnable.
Déclaration d’éthique
Toutes les conditions de logement et les expériences sur les animaux ont été réalisées conformément à la directive européenne 2010/63/UE et aux « principes de soins des animaux de laboratoire » des Instituts nationaux de la santé (publications NIH n° 85-23, révisées en 1985), ainsi qu’aux lois nationales spécifiques (le règlement gouvernemental hongrois sur les études animales 40/2013). Les expériences ont été approuvées par le Comité scientifique national d’éthique sur l’expérimentation animale, et autorisées par le gouvernement (Direction de la sécurité de la chaîne alimentaire et de la santé animale de l’Office agricole central, permis n° 22.1/1375/7/2010).
Contributions des auteurs
GB et TK ont conçu les expériences. DK, SV, et PP ont réalisé les procédures expérimentales. GB, DK, SV et NP ont contribué à l’analyse des données. NP, SK, SV et GB ont interprété les résultats. NP, SK et GB ont rédigé la première version du manuscrit. Tous les auteurs ont lu et approuvé le manuscrit final.
Funding
Ce travail a été soutenu par l’Agence nationale de développement (KTIA_NAP_13-1-2013-0001) Programme hongrois de recherche sur le cerveau (subvention n °. KTIA_13_NAP-A-II/14), NAP 2.0 (subvention n° 2017-1.2.1-NKP-2017-00002) ; le programme d’excellence thématique IMT/NKFIH, Université Semmelweis ; et la subvention SE-Neurologie FIKP de l’EMMI.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Zita Kátai et Emese Bogáthy pour leur aide dans les expériences et/ou l’analyse des données.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fphar.2019.01636/full#supplementary-material
Bagdy, G., Graf, M., Anheuer, Z. E., Modos, E. A., Kantor, S. (2001). Les effets de type anxiété induits par un traitement aigu à la fluoxétine, à la sertraline ou au m-CPP sont inversés par un prétraitement avec l’antagoniste des récepteurs 5-HT2C SB-242084 mais pas avec l’antagoniste des récepteurs 5-HT1A WAY-100635. Int. J. Neuropsychopharmacol. 4 (4), 399-408. doi : 10.1017/S1461145701002632
PubMed Abstract | CrossRef Full Text | Google Scholar
Bagdy, G. (1998). Sérotonine, anxiété et hormones de stress. Focus sur les sous-types de récepteurs 5-HT, les différences entre les espèces et les sexes. Ann. N. Y. Acad. Sci. 851, 357-363. doi : 10.1111/j.1749-6632.1998.tb09009.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogathy, E., Papp, N., Tothfalusi, L., Vas, S., Bagdy, G. (2019). Effet additif du blocage des récepteurs 5-HT2C et CB1 sur la régulation du cycle veille-sommeil. BMC Neurosci. 20 (1), 14. doi : 10.1186/s12868-019-0495-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Burghardt, N. S., Bush, D. E., McEwen, B. S., LeDoux, J. E. (2007). Les inhibiteurs sélectifs de la recapture de la sérotonine en phase aiguë augmentent l’expression de la peur conditionnée : blocage avec un antagoniste des récepteurs 5-HT(2C). Biol. Psychiatry 62 (10), 1111-1118. doi : 10.1016/j.biopsych.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., Wang, X. J. (2012). Mécanismes des oscillations gamma. Annu. Rev. Neurosci. 35, 203-225. doi : 10.1146/annurev-neuro-062111-150444
PubMed Abstract | CrossRef Full Text | Google Scholar
Cardin, J. A. (2016). Instantanés du cerveau en action : les opérations des circuits locaux à travers la lentille des oscillations gamma. J. Neurosci. 36 (41), 10496-10504. doi : 10.1523/JNEUROSCI.1021-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Chagraoui, A., Thibaut, F., Skiba, M., Thuillez, C., Bourin, M. (2016). Les récepteurs 5-HT2C dans les troubles psychiatriques : une revue. Prog. Neuropsychopharmacol. Biol. Psychiatry 66, 120-135. doi : 10.1016/j.pnpbp.2015.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Cremers, T. I., Giorgetti, M., Bosker, F. J., Hogg, S., Arnt, J., Mork, A., et al. (2004). L’inactivation des récepteurs 5-HT(2C) potentialise les conséquences du blocage du recaptage de la sérotonine. Neuropsychopharmacologie 29 (10), 1782-1789. doi : 10.1038/sj.npp.1300474
PubMed Abstract | CrossRef Full Text | Google Scholar
De Deurwaerdere, P., Di Giovanni, G. (2017). Modulation sérotonergique de l’activité des systèmes dopaminergiques mésencéphaliques : implications thérapeutiques. Prog. Neurobiol. 151, 175-236. doi : 10.1016/j.pneurobio.2016.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
De Deurwaerdere, P., Navailles, S., Berg, K. A., Clarke, W. P., Spampinato, U. (2004). L’activité constitutive du récepteur de la sérotonine2C inhibe la libération de dopamine in vivo dans le striatum et le noyau accumbens du rat. J. Neurosci. 24 (13), 3235-3241. doi : 10.1523/JNEUROSCI.0112-04.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Dekeyne, A., Denorme, B., Monneyron, S., Millan, M. J. (2000). Le citalopram réduit l’interaction sociale chez le rat par activation des récepteurs de la sérotonine (5-HT)(2C). Neuropharmacology 39 (6), 1114-1117. doi : 10.1016/s0028-3908(99)00268-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Demireva, E. Y., Suri, D., Morelli, E., Mahadevia, D., Chuhma, N., Teixeira, C. M., et al. (2018). Le blocage des récepteurs 5-HT2C inverse le dysfonctionnement des ganglions de la base associé aux ISRS et potentialise l’efficacité thérapeutique. Mol. Psychiatry. doi : 10.1038/s41380-018-0227-x
CrossRef Full Text | Google Scholar
Di Giovanni, G., De Deurwaerdere, P. (2016). Nouvelles opportunités thérapeutiques pour les ligands des récepteurs 5-HT2C dans les troubles neuropsychiatriques. Pharmacol. Ther. 157, 125-162. doi : 10.1016/j.pharmthera.2015.11.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Dremencov, E., El Mansari, M., Blier, P. (2009). Effets de l’inhibition soutenue de la recapture de la sérotonine sur le tir des neurones dopaminergiques dans l’aire tegmentale ventrale du rat. J. Psychiatry Neurosci. 34 (3), 223-229.
PubMed Abstract | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2018). Les oscillations gamma comme biomarqueur de la dépression majeure : un sujet émergent. Transl. Psychiatry 8 (1), 177. doi : 10.1038/s41398-018-0239-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2019). Enregistrements électrophysiologiques in vivo des effets des médicaments antidépresseurs. Exp. Brain Res. 237 (7), 1593-1614. doi : 10.1007/s00221-019-05556-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Furth, K. E., Mastwal, S., Wang, K. H., Buonanno, A., Vullhorst, D. (2013). Dopamine, fonction cognitive et oscillations gamma : rôle des récepteurs D4. Front. Cell Neurosci. 7, 102. doi : 10.3389/fncel.2013.00102
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Robinson, D. D., Yu, J. H., Hajos-Korcsok, E. (2003a). Norepinephrine but not serotonin reuptake inhibitors enhance theta and gamma activity of the septo-hippocampal system. Neuropsychopharmacologie 28 (5), 857-864. doi : 10.1038/sj.npp.1300116
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Weaver, R. J. (2003b). Régulation de l’activité septo-hippocampique par les récepteurs de la 5-hydroxytryptamine(2C). J. Pharmacol. Exp. Ther. 306 (2), 605-615. doi : 10.1124/jpet.103.051169
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakus, R., Graf, M., Juhasz, G., Gerber, K., Levay, G., Halasz, P., et al. (2003). Les récepteurs 5-HT2C inhibent et les récepteurs 5-HT1A activent la génération de décharges de pointes-ondes dans un modèle génétique de rat d’épilepsie d’absence. Exp. Neurol. 184 (2), 964-972. doi : 10.1016/S0014-4886(03)00352-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Balogh, B., Benko, A., Bagdy, G. (2004). Augmentation de l’éveil, de l’activité motrice et diminution de l’activité thêta après blocage du récepteur 5-HT2B par l’antagoniste sous-type-sélectif SB-215505. Br. J. Pharmacol. 142 (8), 1332-1342. doi : 10.1038/sj.bjp.0705887
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Molnar, E., Gyongyosi, N., Toth, A., Detari, L., et al. (2005). Malgré un potentiel anxiolytique similaire, l’antagoniste des récepteurs 2C de la 5-hydroxytryptamine [SB-242084 indoline] et le chlordiazépoxide ont produit des effets différentiels sur les spectres de puissance des électroencéphalogrammes. J. Pharmacol. Exp. Ther. 315 (2), 921-930. doi : 10.1124/jpet.105.086413
PubMed Abstract | CrossRef Full Text | Google Scholar
Kennett, G. A., Wood, M. D., Bright, F., Trail, B., Riley, G., Holland, V., et al. (1997). SB 242084, un antagoniste sélectif et pénétrant dans le cerveau des récepteurs 5-HT2C. Neuropharmacology 36 (4-5), 609-620. doi : 10.1016/s0028-3908(97)00038-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Khalid, A., Kim, B. S., Seo, B. A., Lee, S. T., Jung, K. H., Chu, K., et al. (2016). L’oscillation gamma dans les réseaux cérébraux fonctionnels est impliquée dans la rémission spontanée du comportement dépressif induit par un stress de contention chronique chez la souris. BMC Neurosci. 17, 4. doi : 10.1186/s12868-016-0239-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyalik, D., Katai, Z., Vas, S., Pap, D., Petschner, P., Molnar, E., et al. (2014). Le traitement chronique à l’escitalopram a provoqué une adaptation dissociative des effets induits par l’antagoniste des récepteurs de la sérotonine (5-HT) 2C dans le sommeil paradoxal, le réveil et l’activité des ondes thêta. Exp. Brain Res. 232 (3), 935-946. doi : 10.1007/s00221-013-3806-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, J. R., Ballard, T. M., Higgins, G. A. (2002). Influence de l’antagoniste des récepteurs 5-HT2C, SB-242084, dans les tests d’anxiété. Pharmacol. Biochem. Behav. 71 (4), 615-625. doi : 10.1016/s0091-3057(01)00713-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, C. B., Hamon, M., Lanfumey, L., Mongeau, R. (2014). Controverses sur le rôle des récepteurs 5-HT(2C) dans les mécanismes d’action des antidépresseurs. Neurosci. Biobehav. Rev. 42, 208-223. doi : 10.1016/j.neubiorev.2014.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Montgomery, S. M., Sirota, A., Buzsaki, G. (2008). Coordination thêta et gamma des réseaux hippocampiques pendant l’éveil et le sommeil à mouvements oculaires rapides. J. Neurosci. 28 (26), 6731-6741. doi : 10.1523/JNEUROSCI.1227-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Monti, J. M. (2011). Le contrôle par la sérotonine du comportement veille-sommeil. Sleep Med. Rev. 15 (4), 269-281. doi : 10.1016/j.smrv.2010.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Noda, Y., Zomorrodi, R., Saeki, T., Rajji, T. K., Blumberger, D. M., Daskalakis, Z. J., et al. (2017). Puissance gamma de l’EEG à l’état de repos et amélioration du couplage thêta-gamma après une SMTr haute fréquence préfrontale dorsolatérale gauche chez des patients souffrant de dépression. Clin. Neurophysiol. 128 (3), 424-432. doi : 10.1016/j.clinph.2016.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Opal, M. D., Klenotich, S. C., Morais, M., Bessa, J., Winkle, J., Doukas, D., et al. (2014). Les antagonistes des récepteurs de la sérotonine 2C induisent des effets antidépresseurs à déclenchement rapide. Mol. Psychiatry 19 (10), 1106-1114. doi : 10.1038/mp.2013.144
PubMed Abstract | CrossRef Full Text | Google Scholar
Papp, N., Vas, S., Bogathy, E., Katai, Z., Kostyalik, D., Bagdy, G. (2018). L’escitalopram aigu et chronique modifie différemment les oscillations gamma de l’EEG : pertinence pour les effets thérapeutiques. Eur. J. Pharm. Sci. 121, 347-355. doi : 10.1016/j.ejps.2018.06.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Popa, D., Lena, C., Fabre, V., Prenat, C., Gingrich, J., Escourrou, P., et al. (2005). Contribution des sous-types de récepteurs 5-HT2 au contrôle du sommeil et de l’éveil et au contrôle respiratoire, et adaptations fonctionnelles chez les souris knock-out dépourvues de récepteurs 5-HT2A. J. Neurosci. 25 (49), 11231-11238. doi : 10.1523/JNEUROSCI.1724-05.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Gener, T. (2015). Modulation par la sérotonine des rythmes préfronto-hippocampiques dans la santé et la maladie. ACS Chem. Neurosci. 6 (7), 1017-1025. doi : 10.1021/cn500350e
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Watakabe, A., Ushimaru, M., Yamamori, T., Kawaguchi, Y. (2010). La sérotonine module l’activité des interneurones à stimulation rapide et l’activité synchrone dans le cortex préfrontal du rat par l’intermédiaire des récepteurs 5-HT1A et 5-HT2A. J. Neurosci. 30 (6), 2211-2222. doi : 10.1523/JNEUROSCI.3335-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Quyen, M. L. V., Muller, L. E., Telenczuk, B., Halgren, E., Cash, S., Hatsopoulos, N. G., et al. (2016). Oscillations à haute fréquence dans le néocortex humain et du singe pendant le cycle veille-sommeil. Proc. Natl. Acad. Sci. U. S. A. 113 (33), 9363-9368. doi : 10.1073/pnas.1523583113
PubMed Abstract | CrossRef Full Text | Google Scholar
Schilstrom, B., Konradsson-Geuken, A., Ivanov, V., Gertow, J., Feltmann, K., Marcus, M. M., et al. (2011). Effets du S-citalopram, du citalopram et du R-citalopram sur les schémas de tir des neurones dopaminergiques dans l’aire tegmentale ventrale, la transmission médiée par les récepteurs du N-méthyl-D-aspartate dans le cortex préfrontal médian et la fonction cognitive chez le rat. Synapse 65 (5), 357-367. doi : 10.1002/syn.20853
PubMed Abstract | CrossRef Full Text | Google Scholar
Simor, P., van Der Wijk, G., Gombos, F., Kovacs, I. (2019). Le paradoxe du sommeil par mouvement oculaire rapide à la lumière de l’activité oscillatoire et de la synchronisation corticale pendant les micro-états phasiques et toniques. Neuroimage 202, 116066. doi : 10.1016/j.neuroimage.2019.116066
PubMed Abstract | CrossRef Full Text | Google Scholar
Sorman, E., Wang, D., Hajos, M., Kocsis, B. (2011). Contrôle du rythme thêta hippocampique par la sérotonine : rôle des récepteurs 5-HT2c. Neuropharmacology 61 (3), 489-494. doi : 10.1016/j.neuropharm.2011.01.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiger, A., Kimura, M. (2010). L’EEG de veille et de sommeil fournit des biomarqueurs dans la dépression. J. Psychiatr. Res. 44 (4), 242-252. doi : 10.1016/j.jpsychires.2009.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Valderrama, M., Crepon, B., Botella-Soler, V., Martinerie, J., Hasboun, D., Alvarado-Rojas, C., et al. (2012). Oscillations gamma humaines pendant le sommeil lent. PloS One 7 (4), e33477. doi : 10.1371/journal.pone.0033477
PubMed Abstract | CrossRef Full Text | Google Scholar
Vas, S., Katai, Z., Kostyalik, D., Pap, D., Molnar, E., Petschner, P., et al. (2013). Adaptation différentielle des effets de la latence du sommeil paradoxal, du stade intermédiaire et de la puissance thêta de l’escitalopram après un traitement chronique. J. Neural Transm. (Vienne) 120 (1), 169-176. doi : 10.1007/s00702-012-0847-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilson, S., Argyropoulos, S. (2005). Les antidépresseurs et le sommeil : une revue qualitative de la littérature. Drugs 65 (7), 927-947. doi : 10.2165/00003495-200565070-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanos, P., Moaddel, R., Morris, P. J., Georgiou, P., Fischell, J., Elmer, G. I., et al. (2016). Actions antidépressives indépendantes de l’inhibition de NMDAR des métabolites de la kétamine. Nature 533 (7604), 481-486. doi : 10.1038/nature17998
PubMed Abstract | CrossRef Full Text | Google Scholar
.