- Introduction
- Matériaux et méthodes
- Matériaux et produits chimiques
- Préparation de la lignée cellulaire
- Préparation du poisson zèbre
- Test de viabilité cellulaire et observation morphologique
- Analyse de l’apoptose par coloration DAPI et cytométrie en flux
- Essai de xénogreffe sur l’animal
- Analyse par PCR en temps réel (qPCR)
- Analyse par Western Blot (WB)
- Analyse statistique
- Résultats
- Effet anti-prolifératif du TF
- Effet pro-apoptotique de TF
- Effet in vivo de la TF sur les zébrafins xénogreffés
- Action moléculaire de TF sur les expressions d’ARNm dans les cellules A375
- Action moléculaire de la TB sur les expressions des protéines dans les cellules A375
- Discussion
- Conclusion
- Data Availability Statement
- Déclaration d’éthique
- Contributions des auteurs
- Funding
- Conflit d’intérêts
- Abréviations
Introduction
Le mélanome est un type mortel de cancer de la peau, avec un potentiel métastatique élevé et une intraitabilité (Yang et al., 2018). Les patients atteints de mélanome à un stade avancé sont toujours non résécables et ont un plus mauvais pronostic (Leonardi et al., 2018). La chimiothérapie est un pilier du traitement clinique du mélanome, mais les efficacités des chimiothérapies sont limitées en raison de leurs effets secondaires sur les tissus sains (Oliveira Pinho et al., 2019). Récemment, plusieurs immunothérapies, notamment les inhibiteurs des récepteurs CTLA-4 ou PD-1, ont été développées comme nouvelles options pour le traitement du mélanome, mais leurs efficacités ne sont pas fiables et leurs effets secondaires sont encore non négligeables (Rodríguez-Cerdeira et al., 2017). Il est donc urgent d’élaborer de nouvelles stratégies présentant une efficacité et une sécurité satisfaisantes. La médecine traditionnelle chinoise (MTC) est une approche complémentaire et est appliquée cliniquement depuis des milliers d’années, possédant une efficacité certaine et moins d’effets secondaires. Selon la théorie de la MTC, le cancer est associé à l’accumulation dans le corps de flegme, de toxines ou d’inflammation, et les herbes anti-flegme, anti-toxiques ou anti-inflammatoires peuvent posséder des effets anticancéreux (Wang et Cheng, 2019). Cette théorie a été soutenue par de nombreux cas. Par exemple, la curcumine dans Rhizoma Curcumae longae a exercé des effets cytotoxiques en induisant l’apoptose et en inhibant l’angiogenèse des cellules de mélanome (Mirzaei et al., 2016), et la vitexine dans Vitex negundo a supprimé la croissance des cellules de mélanome en induisant des dommages à l’ADN et en augmentant les niveaux de ROS (Liu et al., 2018). Par conséquent, les composants végétaux de la MTC ont un grand potentiel pour le traitement des cancers, tels que le mélanome.
Le thé est l’une des boissons les plus répandues dans le monde. Il est connu non seulement pour sa saveur particulière mais aussi pour ses bienfaits sur la santé. En raison de la différence de processus, le thé a trois types principaux, y compris le thé vert non fermenté, le thé oolong partiellement fermenté et le thé noir entièrement fermenté ou thé pu-erh (Kuo et al., 2005). Les feuilles de thé ont été caractérisées comme une herbe MTC avec des propriétés anti-phlegme et anti-toxiques, indiquant son potentiel anti-cancer. Des études modernes ont rapporté que la boisson au thé est efficace pour prévenir et traiter les cancers (Jin et al., 2018). Récemment, on a découvert que les polyphénols du thé possèdent une activité anticancéreuse, dont l’effet est supérieur à celui de la boisson au thé (Mao et al., 2019). La théaflavine (TF) est un tel composant polyphénol produit par l’oxydation des catéchines des feuilles de thé pendant la fermentation, agissant comme un pigment principal pour la couleur, la saveur et la bioactivité du thé (Roberts et al., 1957). Il est capable d’induire l’apoptose dans une variété de lignées cellulaires cancéreuses, telles que les lignées cellulaires de carcinome mammaire humain (MCF-7, MDA-MB-231, T47D, et ZR-75-1), les lignées cellulaires de carcinome du côlon (HCT-15 et HT-29), et les lignées cellulaires de carcinome hépatique (HCCLM3 et Huh-7), indiquant un potentiel anticancéreux (Adhikary et al., 2009 ; Lahiry et al., 2010 ; Li et al., 2012 ; Shao et al., 2016). Néanmoins, peu d’attention a été accordée à son effet sur le mélanome jusqu’à présent.
Au vu des effets pro-apoptotiques rapportés de TF sur de nombreuses lignées cellulaires cancéreuses (Lahiry et al., 2008), nous avons émis l’hypothèse que TF exerce des effets pro-apoptotiques sur les cellules de mélanome. Pour vérifier cette hypothèse, nous avons réalisé des expériences in vitro afin d’évaluer l’effet pro-apoptotique cytotoxique de la TF sur les cellules de mélanome humain et mené des expériences in vivo en utilisant un modèle de xénogreffe sur des larves de poisson zébré afin de déterminer son effet inhibiteur sur les tumeurs. En outre, le mécanisme de TF a également été exploré.
Matériaux et méthodes
Matériaux et produits chimiques
La théaflavine (TF, >95% de pureté) a été fournie par Theabio Co, Ltd (Hangzhou, Chine) (numéro de lot : 20181211061). Le milieu Dulbecco′s modified Eagle′s (DMEM) contenant du glucose élevé (4,5 g/l) a été obtenu auprès des laboratoires HyClone (UT, États-Unis). Le sérum bovin fœtal (FBS) a été obtenu auprès de Cell Max (Beijing, Chine). La trypsine (0,25%) a été obtenue auprès de Gibco (NY, USA). Le bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium (MTT) et le diméthylsulfoxyde (DMSO) ont été obtenus auprès de Sigma (St. Louis, MO, USA). Annexin-V : Le kit de détection de l’apoptose FITC a été obtenu auprès de BD Biosciences (CA, USA). La solution de coloration 4′-6-diamidino-2-phénylindole (DAPI) a été obtenue auprès de Thermo Fisher Scientific (MA, USA). Les anticorps primaires ont été obtenus auprès de Cell Signaling Technology (MA, USA). Le réactif Trizol et le kit de réaction en chaîne par polymérase en temps réel (PCR en temps réel) ont été obtenus auprès de TaKaRa (Dalian, Chine).
Préparation de la lignée cellulaire
Le fibroblaste de la peau HFF-1 humain et la lignée cellulaire de mélanome A375 ont été obtenus auprès de la banque cellulaire de Shanghai de l’Académie chinoise des sciences (Shanghai, Chine), et la lignée cellulaire de mélanome A875 humain a été obtenue auprès de la banque cellulaire de Kunming de l’Académie chinoise des sciences (Kunming, Chine). Ces lignées cellulaires ont été cultivées dans un milieu DMEM contenant 10% de FBS à 37°C dans un incubateur humidifié à 5% de CO2. Le milieu a été changé quotidiennement, et les cellules ont été traitées avec TF dans leur phase de croissance logarithmique.
Préparation du poisson zèbre
La souche AB de poisson zèbre de type sauvage a été obtenue auprès du Centre de ressources du poisson zèbre de Chine, Institut d’hydrobiologie, Académie des sciences de Chine (Wuhan, Chine) et accréditée par l’Association pour l’évaluation et l’accréditation des soins aux animaux de laboratoire internationale (SYXK 2012-0171). Les larves de poisson zébré à 2 dpf (jours après la fécondation) ont été produites par accouplement naturel par paires et hébergées dans une installation d’aquaculture à lumière contrôlée avec une photopériode standard de 14:10 h jour/nuit et nourries avec des crevettes de saumure vivantes deux fois par jour et des flocons d’alevins une fois par jour.
Test de viabilité cellulaire et observation morphologique
Des tests MTT ont été réalisés pour déterminer les effets inhibiteurs de la TF sur les lignées cellulaires de mélanome, comme décrit précédemment (Zhou et al, 2017). Les cellules ont été ensemencées dans des plaques 96 puits à 6×103 cellules/puits dans 200 μl de milieu pour une adhérence de 24h, puis traitées avec TF à des concentrations de 0, 50, 100, 150, 200, 250, 300 et 400 μg/ml pendant 24, 48 et 72 h. Ensuite, 20 μl de solution de MTT (5,0 mg/ml) ont été ajoutés à chaque puits et incubés à 37°C pendant 4h. Du DMSO (150 μl) a été ajouté dans chaque puits et la valeur de densité optique (valeur OD) a été mesurée à 490 nm avec le lecteur de microplaques Biorad (CA, USA). Taux d’inhibition (%) = × 100 %. Les concentrations inhibitrices à 50 % (CI50) pour 24, 48 et 72 heures ont été calculées par analyse de régression. Par conséquent, 120, 240 et 360 μg/ml (232,3, 464,7 et 697,0 μM) ont été désignés comme des doses faibles, moyennes et élevées de TF. Ensuite, les lignées cellulaires HFF-1, A375 et A875 ont été ensemencées dans des plaques à 96 puits comme ci-dessus, et traitées avec la dose moyenne de TF à 24 h. La morphologie cellulaire des cellules A375 a été observée au microscope à fluorescence Carl Zeiss (Göttingen, Allemagne).
Analyse de l’apoptose par coloration DAPI et cytométrie en flux
L’apoptose cellulaire a été déterminée par coloration DAPI et cytométrie en flux basée sur la coloration annexin-V/PI. Pour la coloration DAPI, les cellules A375 ont été ensemencées dans des plaques à 96 puits et traitées avec TF à des concentrations faibles, moyennes et élevées pendant 24 h, puis fixées avec du paraformaldéhyde à 4 % dans du PBS pendant 30 min à température ambiante et colorées avec du DAPI pendant 10 min dans l’obscurité. Après trois lavages, les cellules ont été observées à l’aide de cinq lamelles couvre-objet sous le microscope à fluorescence Carl Zeiss (Göttingen, Allemagne) et les cellules apoptotiques ont été comptées. La cytométrie en flux a été réalisée selon les instructions du fabricant′. Brièvement, les cellules A375 ont été ensemencées dans des plaques 6 puits à 3×105 cellules/puits pendant 24 h et traitées avec TF à des concentrations faibles, moyennes et élevées pendant 48 h supplémentaires. Ensuite, les cellules ont été lavées deux fois et marquées avec une solution d’annexine V-fluorescéine-isothiocyanate et PI dans un tampon de liaison. L’intensité de la fluorescence des cellules a été détectée par cytométrie de flux BD C6 (CA, USA). L’analyse a été répétée et les taux de cellules apoptotiques précoces et apoptotiques tardives (%) ont été calculés.
Essai de xénogreffe sur l’animal
Pour déterminer la gamme de doses de TF, totalement 300 larves de poisson zébré à 3 dpf ont été utilisées et cultivées au hasard dans des plaques à 6 puits avec 30 poissons chacune. La TF a été dissoute dans chaque puits à 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1 000 et 2 000 μg/ml, respectivement, pendant 24 h. Ensuite, les poissons de chaque groupe ont été observés sous un microscope stéréoscopique pour enregistrer la mortalité et les événements indésirables. Comme décrit par notre étude précédente, la dose sans effet indésirable observé (NOAEL) de TF a été estimée, et 1/9 NOAEL, 1/3 NOAEL et NOAEL ont été appliqués comme doses faibles, moyennes et élevées pour l’expérience suivante (Jin et al, 2018).
Pour établir le modèle de xénogreffe, les cellules A375 ont été colorées avec CM-Dil (fluorescence rouge) à une dilution de 1:1 000 et microinjectées dans le sac vitellin de larves de poisson zébré (2 dpf) à une dose de 200 cellules/poisson. Après une croissance tumorale de 24 h, tous les poissons ont été observés sous un microscope à fluorescence (AZ100, Nikon, Tokyo, Japon) pour la vérification du modèle. Les poissons porteurs d’A375 ont été regroupés en 5 groupes (30 poissons chacun) et traités avec 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL et NOAEL de TF, ainsi qu’avec 15 μg/ml (50 μM) de cisplatine, respectivement, pendant 24 h. L’intensité de fluorescence (IF) de la masse cellulaire A375 des poissons zébrés a été détectée et le taux d’inhibition a été calculé comme suit : taux d’inhibition (%) = × 100 %.
Analyse par PCR en temps réel (qPCR)
Pour révéler les actions moléculaires de TF sur les cellules A375, la qPCR a été employée sur un système de PCR en temps réel ABI QuantStudio™ 7 Flex (Applied Biosystems, CA, USA). L’ARN total des cellules A375 a été extrait à l’aide du réactif Trizol et synthétisé en ADNc par transcription inverse. Le système de réaction qPCR comportait un volume de 20,0 μl : 10 μl de SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl d’amorce directe de PCR, 0,8 μl d’amorce inverse de PCR, 2,0 μl d’ADNc matrice, 0,4 μl de colorant de référence ROX et 6,0 μl de ddH2O. Les conditions de réaction de la qPCR ont été fixées à 95°C pour une dénaturation initiale de 30 s, 40 cycles de 95°C pour 5 s de dénaturation, 60°C pour 34 s de recuit et 72°C pour 40 s d’extension. A la fin de chaque réaction, une analyse de la courbe de fusion a été réalisée. La β-ACTINE a été utilisée comme gène de référence et la méthode 2-ΔΔCT a été appliquée pour analyser l’expression relative de chaque gène (tableau 1).

Tableau 1 Séquences d’amorces utilisées pour l’analyse qPCR.
Analyse par Western Blot (WB)
L’expression protéique des cellules A375 avec un traitement par TF à 0 μg/ml et 120 μg/ml (232,3 μM) a été analysée par analyse WB. Les protéines totales ont été extraites à l’aide d’un tampon de lyse (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1 % Triton, 0,1 % SDS, 5 μg/ml leupeptine et 1 mM PMSF) pendant 30 min sur glace avec congélation et décongélation répétées. Les protéines ciblées ont été séparées par électrophorèse sur gel de polyacrylamide au dodécylsulfate de sodium dénaturant (SDS-PAGE) (8~12%), puis transférées sur une membrane en fluorure de polyvinylidène (PVDF) (Millipore, MA, USA). La membrane a été bloquée avec du lait écrémé à 5% pendant 2 heures, puis incubée pendant une nuit à 4°C avec les anticorps contre : ACTIN, ASK1, ATM, ATM phosphorylé (p-ATM), ATR, ATR phosphorylé (p-ATR), caspase 3 clivée (c-CASP3), caspase 8 clivée (c-CASP8), CHK1, CHK2, CHK1 et CHK2 phosphorylés (p-CHK1 et p-CHK2), JNK, JNK phosphorylé (p-JNK), C-JUN, C-JUN phosphorylé (p-C-JUN), PARP (poly ADP-ribose polymérase) clivé, P53, et P53 phosphorylé (p-P53). Après incubation avec l’anticorps secondaire, ces protéines ont été visualisées avec un kit de chimiluminescence améliorée (Amersham Pharmacia Biotech, Little Chalfort, UK) et détectées à l’aide d’un analyseur de chimiluminescence.
Analyse statistique
Les données ont été exprimées en valeurs moyennes ± SD et soumises à une ANOVA à sens unique, suivie d’une comparaison de la différence la moins significative (LSD) de Fisher. Toutes les analyses ont été effectuées à l’aide d’une version actualisée du logiciel DPS (Tang et Zhang, 2013).
Résultats
Effet anti-prolifératif du TF
Comme le montre la figure 1A, le TF à 50 μg/ml (96.8 μM) a significativement inhibé la viabilité des cellules A375, et les taux d’inhibition ont augmenté avec l’augmentation des concentrations de TF de 50 à 400 μg/ml (96,8 à 744,4 μM) (chaque P < 0,01 par rapport au niveau normal), indiquant une manière concentration-dépendante. Les taux d’inhibition ont également augmenté avec le traitement TF de 24 à 72 h, avec des IC50 de 218,9 à 84,9 μg/ml (423,8 à 164,4 μM), respectivement. Ensuite, nous avons appliqué 120, 240 et 360 μg/ml (232,3, 464,7 et 697,0 μM) comme doses de TF-L, TF-M et TF-H, respectivement. Comme le montre la figure 1B, TF-M a manifestement inhibé la viabilité des cellules A375 et A875, mais a exercé peu d’effet sur les cellules HFF-1. Comme le montre la figure 1C, la morphologie des cellules A375 a été manifestement altérée et le nombre de cellules vivantes a diminué avec le traitement par TF à des concentrations croissantes.

Figure 1 Viabilité cellulaire des cellules A375 avec traitement par TF à 24, 48 et 72 h (A), viabilité cellulaire des cellules HFF-1, A375 et A875 avec traitement par TF à 24 h (B), et morphologie des cellules A375 avec traitement par théaflavine (TF) à 24 h (C). Les données sont des moyennes ± SD (n = 5). Par le biais de comparaisons multiples de la différence la moins significative (LSD) de Fisher, les données (moyenne ± SD) avec la même lettre minuscule (b vs. bc ; bc vs. cd ; c vs. c ; cd vs. d ; d vs. d) n’indiquent aucune différence significative entre elles, tandis que les données avec des lettres différentes (a vs. b vs. c vs. b vs. e vs. f vs. g) indiquent une différence significative entre elles. Barre d’échelle = 200 μm.
Effet pro-apoptotique de TF
La coloration DAPI et la cytométrie en flux ont été réalisées pour évaluer l’effet pro-apoptotique de TF sur les cellules A375. Le résultat de la coloration DAPI a montré une morphologie apoptotique, y compris la forme rétrécie, la caryopyknose et la fragmentation nucléaire, dans les cellules A375 avec le traitement TF de 120 à 360 μg/ml (232,3 à 697,0 μM) (figure 2A). Le nombre de cellules apoptotiques a augmenté de manière significative avec le traitement TF à 240 et 360 μg/ml (464,7 et 697,0 μM) (chaque P < 0,01 vs NC) (Figure 2C). Le résultat de la cytométrie de flux a montré l’apoptose précoce et l’apoptose tardive des cellules A375 induites par la TB (Figure 2B). Le nombre de cellules apoptotiques précoces et tardives a augmenté avec le traitement par TF de 120 à 360 μg/ml (232,3 à 697,0 μM) (figure 2B), et leurs proportions étaient significativement plus élevées avec le traitement par TF à 360 μg/ml (697,0 μM) (P < 0,01 et P < 0,05 par rapport au niveau normal) (figures 2D, E). Les résultats ont indiqué que TF a induit l’apoptose des cellules A375 de manière concentration-dépendante.
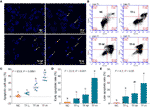
Figure 2 Observation de coloration DAPI (A) et analyse par cytométrie en flux (B) sur les cellules A375 avec le traitement à la théaflavine (TF). Analyse statistique du taux de cellules apoptotiques (C), analyse statistique du taux d’apoptose précoce (D) et analyse statistique du taux d’apoptose tardive (E). Au moyen de comparaisons multiples de la différence la moins significative (LSD) de Fisher, les données (moyenne ± SD) avec la même lettre minuscule (a vs ab ; ab vs b ; b vs b ; c vs c) n’indiquent aucune différence significative entre elles, tandis que les données avec des lettres différentes (a vs b vs c) indiquent une différence significative entre elles. Barre d’échelle = 100 μm.
Effet in vivo de la TF sur les zébrafins xénogreffés
Les courbes de mortalité et d’événements indésirables des zébrafins avec le traitement par la TF ont été présentées dans la figure 3A. La mort des poissons a été causée par la TF à 31,25 μg/ml (60,5 μM), et aucun poisson n’a survécu avec la TF à 125 μg/ml (242,0 μM), ce qui indique que la dose maximale non létale de TF est inférieure à 31,25 μg/ml (60,5 μM). Les effets indésirables, notamment le retournement anormal du corps et l’œdème, ont été observés avec le traitement par TF à partir de 3,47 μg/ml (6,7 μM) jusqu’à ses doses les plus élevées, indiquant la NOAEL de TF inférieure à 3,47 μg/ml (6,7 μM). Après des tests répétés, la NOAEL a finalement été estimée à 2,0 μg/ml (3,9 μM). Ainsi, 0,22, 0,67 et 2,0 μg/ml (0,4, 1,3 et 3,9 μM) ont été utilisés comme doses faibles, moyennes et élevées de TF pour l’expérience suivante.
Comme le montre la figure 3B, un modèle de xénogreffe de cellules A375 a été établi dans des larves de zebrafish et les intensités de fluorescence de la masse cellulaire dans les poissons ont été testées. Après 24 h de traitement, TF de 0,22 à 2,0 μg/ml (0,4, 1,3 et 3,9 μM) a manifestement inhibé la croissance de la tumeur A375, avec des taux d’inhibition de 1,0 à 46,4 %. Les effets inhibiteurs du TF à 0,67 et 2,0 μg/ml (1,3 et 3,9 μM) étaient significatifs, s’ils étaient comparés au groupe modèle (P < 0,01), et l’effet du TF à 2,0 μg/ml (3,9 μM) était même supérieur à celui du cisplatine à sa NOAEL (50 μM).
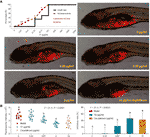
Figure 3 Mortalité et effets indésirables des larves de zebrafish induits par la théaflavine (TF) et observation de larves de zebrafish xénotransplantées avec des cellules A375 avec traitement de TF ou de cisplatine (A) ainsi que l’intensité de fluorescence et les taux inhibiteurs de TF (B). La zone fluorescente en rouge représente la masse des cellules A375. Au moyen de comparaisons multiples LSD, les données (moyenne ± SD) avec la même lettre minuscule (a vs. a ; c vs. c) n’indiquent pas de différence significative entre elles, tandis que les données avec des lettres différentes (a vs. b vs. c) indiquent une différence significative entre elles.
Action moléculaire de TF sur les expressions d’ARNm dans les cellules A375
Les expressions relatives d’ARNm des gènes ciblés par TF ont été testées par dosage qPCR. Comme montré dans la Fig. 4, les expressions de BAX, de BIM, de C-MYC, de P21, de P53, et de PUMA ont été significativement augmentées par TF (chaque P < 0.01 contre le niveau de NC), excepté celui de BAX avec le traitement de TF à sa basse concentration. Bien que l’expression de BCL-2 ait été régulée par la TF, les ratios de BAX/BCL-2 étaient significativement plus élevés avec le traitement par TF à ses concentrations moyennes à élevées que celui du niveau NC (P < 0,01), indiquant le rôle majeur de BAX dans l’action de la TF.
Action moléculaire de la TB sur les expressions des protéines dans les cellules A375
La TF a été appliquée pour déterminer l’expression et la phosphorylation des protéines ciblées par la TF. Comme le montre la figure 5, les expressions de ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8 et c-CASP3 ont été significativement régulées à la hausse par la TF à 120 μg/ml (232,3 μM) (chaque P < 0,01 par rapport au niveau NC). En outre, les actions de TF sur ATR, p-ATR, CHK2, P53, C-JUN (43 kd) et p-C-JUN (Ser 73) étaient insignifiantes (chacune P > 0,05 vs le niveau NC).
Discussion
Bien que les activités anticancéreuses de TF aient été bien documentées (Sur et Panda, 2017 ; Takemoto et Takemoto, 2018 ; Sajadimajd et al, 2020), les connaissances sur son efficacité sur le mélanome sont encore peu nombreuses. Pour combler cette lacune, la présente étude a mené des expériences in vitro et in vivo pour étudier les effets et le mécanisme de TF contre les cellules de mélanome. Pour la première fois, nous avons démontré les effets cytotoxiques pro-apoptotiques et inhibiteurs de tumeurs de TF sur les cellules de mélanome A375. Son mécanisme a été suggéré comme étant associé aux voies P53 et JNK. L’innovation de cette étude est la mise en évidence de l’efficacité anti-mélanome de TF, alors que les rapports précédents ne portaient que sur les effets de TF′ sur d’autres tumeurs (Lin, 2002 ; Sur et Panda, 2017). En outre, il s’agit également du premier rapport sur l’action moléculaire de TF sur la voie JNK, alors que le mécanisme associé à la voie P53 de l’effet pro-apoptotique de TF′s sur les cellules de carcinome a été précédemment rapporté (Lahiry et al., 2008).
Récemment, les modèles de xénogreffe de tumeurs utilisant des larves de zebrafish ont attiré une attention croissante pour les études anticancéreuses, en raison des avantages des larves de zebrafish par rapport aux autres modèles animaux : (1) l’absence de rejet immunitaire contre les cellules humaines permet un taux de réussite plus élevé pour la xénotransplantation ; (2) la transparence du corps permet une observation visible in vivo de la croissance tumorale et de la toxicité des médicaments ; et (3) la génération à grande échelle et l’organogenèse rapide permettent des périodes expérimentales plus courtes (Langheinrich, 2003 ; Pardo-Martin et al., 2010 ; Konantz et al., 2012). Dans cette étude, TF a exercé un effet inhibiteur dose-dépendant sur la masse tumorale A375 chez les larves de zebrafish (figure 3B), avec un taux inhibiteur de 46,4 % à sa NOAEL (3,9 μM). Le taux d’inhibition était plus élevé que celui du cisplatine, ce qui indique que TF était plus efficace que le cisplatine dans leur gamme de doses sûres respectives. De plus, le taux d’inhibition était plus élevé que celui d’un autre pigment du thé (l’abrownine) (Jin et al., 2018), ce qui suggère que TF est le composant le plus efficace du thé. Cependant, la gamme de doses efficaces in vivo (1,3 à 3,9 μM) de TF est beaucoup plus faible que sa gamme de doses efficaces in vitro (96,8 à 774,4 μM). Cette différence peut s’expliquer par le fait que, après administration orale, les dérivés métabolisés du TF ont un effet plus important que celui du TF. Cela indique que l’application orale peut être plus efficace que les autres voies pour le TF.
Selon la règle de conversion des doses, les doses efficaces (1,3 et 3,9 μM) de TF chez les larves de poisson zébré peuvent être estimées à 0,03 à 0,09 mg/kg chez l’homme (Zhang et al., 2003). Cela suggère que l’administration orale de TF à une gamme de doses aussi faible peut être efficace pour traiter les patients atteints de mélanome, ce qui indique un bon rapport coût-efficacité de ce composé. À notre connaissance, il n’existe que quelques rapports concernant l’application clinique de la TF. Un essai en double aveugle, randomisé, contrôlé par placebo et en groupes parallèles a appliqué un extrait de thé vert enrichi en TF pour traiter des patients souffrant d’hypercholestérolémie légère à modérée pendant 12 semaines (Maron et al., 2003). Dans cet essai, la dose quotidienne de TF était de 75 mg dans l’extrait de thé vert, ce qui a permis de réduire de manière significative le cholestérol total, le LDL-C et les triglycérides chez les adultes hypercholestérolémiques sans observer d’effets indésirables importants (Maron et al., 2003). Dans cette étude, la gamme de doses efficaces de TF était beaucoup plus faible que celle rapportée, ce qui suggère un plus grand potentiel de TF pour le traitement du mélanome en clinique. Cependant, bien que la gamme de doses efficaces de TF soit faible, son seuil de dose létale pour les larves de poisson zèbre était également faible (<60,5 μM) et était inférieur à celui des autres pigments de thé (figure 3A) (Jin et al., 2018), ce qui laisse une inquiétude quant à la toxicité potentielle de TF pour les êtres humains. De manière intéressante, nous avons constaté que TF exerçait peu d’effet sur la lignée cellulaire normale (fibroblaste cutané HFF-1) (Figure 1B), suggérant une faisabilité clinique pour son utilisation externe qui peut éviter la toxicité potentielle de son utilisation interne.
Notre expérience mécanistique a montré que TF activait ATM, CHK1/2, P53, CASP8/3 dans la voie P53 et activait également ASK1, JNK et C-JUN dans la voie JNK, s’associant à l’apoptose des cellules A375. L’apoptose a été déterminée par la coloration DAPI et l’analyse cytométrique de flux au niveau cellulaire (Figure 2) et médiée par la surexpression des gènes pro-apoptotiques (P53, BAX, BIM et PUMA) et l’activation des protéines liées à l’apoptose (caspases et PARP) au niveau moléculaire (Figures 4 et 5). P53 (TP53) code pour une phosphoprotéine nucléaire se liant à l’ADN et ayant une activité de suppression de tumeur, qui agit comme un facteur de transcription au centre d’un réseau de contrôle de l’apoptose en réponse à des stress cellulaires (Martin et al., 2002). Il active l’apoptose en stimulant la transcription des gènes de la famille Bcl-2, tels que BAX, BIM et PUMA (Levine et Oren, 2009). BAX et BIM codent pour des membres pro-apoptotiques qui provoquent l’apoptose et la mort cellulaire en activant la cascade des caspases en réponse à des stimuli apoptotiques (Rossé et al., 1998 ; Youle et Strasser, 2008). PUMA, en tant que modulateur de l’apoptose régulé par P53, code une protéine contenant le domaine BH3 qui se localise aux mitochondries, interagit avec Bax et Bak, et active la cascade des caspases par clivage de CASP3 (Nakano et Vousden, 2001 ; Letai, 2009). Dans cette étude, CASP8 et CASP3 ont été clivés en réponse à l’activation de P53. CASP8 est une caspase d’initiation dans la cascade apoptotique, qui active CASP3 pour la fragmentation apoptotique d’ADN, résultant en clivage ultérieur de PARP (c-PARP) pour exécuter le processus apoptotique (Jänicke et autres, 1998 ; Stennicke et autres, 1998 ; Boulares et autres, 1999). La PARP est responsable de la réparation de l’ADN et de la viabilité cellulaire en réponse à un stress exogène (Satoh et Lindahl, 1992). Elle peut être clivée par CASP3 et facilite ainsi le désassemblage cellulaire dans l’apoptose (Oliver et al., 1998). Ainsi, la quantité de PARP clivée (c-PARP) peut être utilisée comme marqueur de l’apoptose cellulaire.
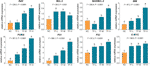
Figure 4 Expression relative de l’ARNm des gènes ciblés par la théaflavine (TF) dans les cellules A375 après 24 h de traitement. Par le biais de comparaisons multiples de la différence la moins significative (LSD) de Fisher, les données (moyenne ± SD) avec la même lettre minuscule (a vs. a ; b vs. b ; c vs. c) n’indiquent aucune différence significative entre elles, tandis que les données avec des lettres différentes (a vs. b vs. c vs. d) indiquent une différence significative entre elles.
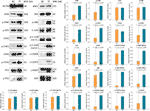
Figure 5 Expression et phosphorylation des protéines ciblées par la théaflavine (TF) dans les cellules A375 après 24 h de traitement. Les données (moyenne ± SD) avec des lettres minuscules différentes sont significativement différentes les unes des autres lors des comparaisons multiples de la différence la moins significative (LSD) de Fisher.
Dans nos études précédentes, nous avons signalé que l’induction de dommages à l’ADN était associée au mécanisme pro-apoptotique médié par la voie P53 de la théabrownine (Wu et al., 2016 ; Jin et al., 2018). Cependant, bien que la TF et la théabrownine aient toutes deux activé la voie P53 et induit l’apoptose des cellules tumorales, nous n’avons pas trouvé d’induction de dommages à l’ADN avec le traitement par la TF dans cette étude. Par ailleurs, nous avons constaté l’activation de la cascade ASK1-JNK-C-JUN, qui fonctionne également comme une voie apoptotique. Dans ce module de signalisation, ASK1 (apoptosis signal-regulating kinase 1) est une protéine kinase activée par un mitogène qui joue un rôle clé dans l’apoptose induite par les cytokines et le stress en déclenchant une voie dépendante des mitochondries (Matsuzawa et Ichijo, 2001 ; Zhang et al., 2003). Il active la signalisation JNK en aval en réponse à différents types de stress, ce qui entraîne l’apoptose des cellules par l’activation de C-JUN et la surexpression ultérieure de gènes pro-apoptotiques (Tobiume et al., 2001). Les chimiothérapies, telles que le cisplatine, le docétaxel et le paclitaxel, induisent l’apoptose des cellules de mélanome par la voie JNK, indépendamment de la voie P53 (Mandic et al., 2001 ; Mhaidat et al., 2008 ; Selimovic et al., 2008). Cela indique que le TF pourrait avoir un avantage par rapport à ces médicaments en raison de son mécanisme d’action à double voie, ce qui a été démontré de manière préliminaire par les effets inhibiteurs de tumeurs plus élevés du TF que ceux du cisplatine dans cette étude. Cependant, cette étude présente certaines limites, comme suit : (1) les actions des voies P53 et JNK dans le mécanisme proposé de médiation à double voie de la TF n’ont pas été vérifiées ; (2) l’interaction entre les voies P53 et JNK n’a pas été étudiée, et on ne sait pas quelle voie joue le rôle principal ; et (3) la gamme de doses in vitro et la gamme de doses in vivo sont assez différentes, la raison en a été expliquée mais nécessite des preuves expérimentales. Pour résoudre ces problèmes, des études supplémentaires sont nécessaires à l’avenir. Par exemple, des siRNA ou des inhibiteurs de P53 et de JNK devraient être utilisés pour vérifier les actions de ces voies et pour explorer l’interaction entre elles, et les métabolites sériques du TF devraient être analysés chimiquement et étudiés pharmacologiquement pour tester notre hypothèse selon laquelle les dérivés métabolisés du TF ont un effet supérieur à celui du TF. En outre, étant donné qu’il n’existe pas de rapports cliniques sur le TF pour le traitement du cancer, l’efficacité thérapeutique et les avantages du TF sur les patients atteints de cancer devraient être étudiés plus en détail.
Conclusion
Puisque le potentiel anticancéreux du TF a été bien documenté, il reste incertain si le TF est efficace dans le traitement du mélanome. Dans cette étude, en utilisant une lignée cellulaire de mélanome et un modèle de xénogreffe de poisson zèbre, nous avons trouvé des effets cytotoxiques pro-apoptotiques et inhibiteurs de tumeurs de TF sur les cellules de mélanome et révélé son mécanisme en association avec les activations des voies P53 et JNK. Il s’agit de la première étude décrivant les effets et le mécanisme de la TF contre les cellules de mélanome. Comme le mécanisme de la TF ne dépend pas uniquement de la voie P53, on peut s’attendre à ce que la TF soit efficace dans le traitement des lignées cellulaires mutées par la voie P53. D’autres études sont justifiées pour vérifier cette déduction. Dans l’ensemble, cette étude fournit des preuves de l’efficacité de TF contre le mélanome, ce qui contribue au développement d’agents dérivés de TF pour la thérapie du mélanome.
Data Availability Statement
Les données brutes soutenant les conclusions de cet article sont disponibles auprès de l’auteur correspondant sur demande raisonnable.
Déclaration d’éthique
L’étude sur les animaux a été examinée et approuvée par le Comité d’éthique de l’Université médicale chinoise de Zhejiang.
Contributions des auteurs
LeZ a effectué le travail principal de cet article. BY a réalisé les expériences cellulaires et moléculaires. LiZ et SM ont contribué à la rédaction de ce manuscrit. WD a fourni des idées et un soutien financier à ce travail. YX a mené l’expérience sur le poisson zèbre. LS a conçu ce travail et rédigé le manuscrit. TE a amélioré la conception et la rédaction du manuscrit. Tous les auteurs ont contribué à l’article et ont approuvé la version soumise.
Funding
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (subventions n° 81774331, 81873049 et 81973873), la Fondation provinciale des sciences naturelles de Chine du Zhejiang (subvention n° LY18H270004), le Projet provincial des sciences et technologies de la médecine traditionnelle chinoise de Chine du Zhejiang (subvention n° LY18H270004). 2016ZZ011), la discipline caractéristique de supériorité de l’Université clé de construction de la province du Zhejiang (pharmacologie chinoise traditionnelle) et la Fondation d’ouverture de la Chine (subvention n° ZYX2018006).
Conflit d’intérêts
YX a été employé par la société Hunter Biotechnology, Inc.
Les autres auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Abréviations
DAPI, 4′-6-diamidino-2-phénylindole ; DMEM, milieu Eagle′s modifié de Dulbecco ; DMSO, diméthylsulfoxyde ; dpf, jours post-fécondation ; FBS, sérum bovin fœtal ; FI, intensité de fluorescence ; LSD, différence la moins significative de Fisher ; NOAEL, dose sans effet nocif observé ; MTT, bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium ; PARP, poly ADP-ribose polymérase ; SDS-PAGE, électrophorèse sur gel de polyacrylamide au dodécylsulfate de sodium dénaturant ; MTC, théaflavine ; TF, médecine traditionnelle chinoise.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Les théaflavines retardent la migration des cellules cancéreuses du sein humain en inhibant NF-kappaB par l’intermédiaire de la diaphonie p53-ROS. FEBS Lett. 584 (1), 7-14. doi : 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. (1999). Role of poly(ADP-ribose) polymerase (PARP) cleavage in apoptosis. Caspase 3-resistant PARP mutant increases rates of apoptosis in transfected cells. J. Biol. Chem. 274 (33), 22932-22940. doi : 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). La Caspase-3 est requise pour la fragmentation de l’ADN et les changements morphologiques associés à l’apoptose. J. Biol. Chem. 273 (16), 9357-9360. doi : 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). La théabrownine déclenche des dommages à l’ADN pour supprimer les cellules d’ostéosarcome humain U2OS en activant la voie de signalisation p53. J. Cell. Mol. Med. 22 (9), 4423-4436. doi : 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebrafish xenografts comme un outil pour les études in vivo sur le cancer humain. Ann. New Y. Acad. Sci. 1266, 124-137. doi : 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Comparative studies on the hypolipidemic and growth suppressive effects of oolong, black, pu-erh, and green tea leaves in rats. J. Agric. Food Chem. 53 (2), 480-489. doi : 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Contribution de la transactivation de Bax médiée par p53 dans l’apoptose des cellules de carcinome épithélial mammaire induite par la théaflavine. Apoptosis 13 (6), 771-781. doi : 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Les théaflavines ciblent les voies Fas/caspase-8 et Akt/pBad pour induire l’apoptose dans les cellules cancéreuses du sein humain mutées en p53. Carcinogenèse 31 (2), 259-268. doi : 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Le poisson zèbre : un nouveau modèle sur le catwalk pharmaceutique. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi : 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Le mélanome cutané : De la pathogenèse à la thérapie (revue). Int. J. Oncol. 52 (4), 1071-1080. doi : 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma frappe Bax. J. Cell Biol. 185 (2), 189-191. doi : 10.1083/jcb.200903134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). Les 30 premières années de p53 : de plus en plus complexe. Nat. Rev. Cancer 9 (10), 749-758. doi : 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Les théaflavines inhibent l’ATP synthase et la chaîne respiratoire sans augmenter la production de superoxyde. J. Nutr. Biochem. 23 (8), 953-960. doi : 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Chimioprévention du cancer par les polyphénols du thé par la modulation des voies de transduction du signal. Arch. Pharmacal. Res. 25 (5), 561-571. doi : 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Le composé Vitexin 1, une nouvelle extraction d’une herbe chinoise, supprime la croissance des cellules de mélanome par des dommages à l’ADN en augmentant les niveaux de ROS. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi : 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Le cisplatine induit la conformation proapoptotique de Bak d’une manière deltaMEKK1-dépendante. Mol. Cell. Biol. 21 (11), 3684-3691. doi : 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Le thé et ses composants préviennent le cancer : Une revue du mécanisme lié à l’oxydoréduction. Int. J. Mol. Sci. 20 (21), 5249. doi : 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Cholesterol-lowering effect of a theaflavin-enriched green tea extract : a randomized controlled trial. Arch. Intern Med. 163 (12), 1448-1453. doi : 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Intégration des données de mutation et analyse structurelle de la protéine suppresseur de tumeur TP53. Hum. Mutat. 19 (2), 149-164. doi : 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Mécanismes moléculaires de la décision entre la vie et la mort : régulation de l’apoptose par l’apoptosis signal-regulating kinase 1. J. Biochem. 130 (1), 1-8. doi : 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Implication du stress du réticulum endoplasmique dans l’apoptose JNK-dépendante du mélanome humain induite par le docétaxel. Apoptosis Int. J. Programme. Cell Death 13 (12), 1505-1512. doi : 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumin : Un nouveau candidat pour la thérapie du mélanome ? Int. J. Cancer 139 (8), 1683-1695. doi : 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, un nouveau gène proapoptotique, est induit par p53. Mol. Cell 7 (3), 683-694. doi : 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Stratégies nanotechnologiques émergentes pour la chimiothérapie systémique contre le mélanome. Nanomater. (Bâle) 9 (10), 1455. doi : 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Importance de la poly(ADP-ribose) polymérase et de son clivage dans l’apoptose. Lesson from an uncleavable mutant. J. Biol. Chem. 273 (50), 33533-33539. doi : 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). High-throughput in vivo vertebrate screening. Nat. Methods 7 (8), 634-636. doi : 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). Les substances phénoliques du thé manufacturé. I. Fractionnement et chromatographie sur papier des substances hydrosolubles. J. Sci. Food Agric. 8, 72-80. doi : 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Progrès de l’immunothérapie pour le mélanome : une revue complète. Mediators Inflammation 2017, 3264217. doi : 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prolonge la survie cellulaire après la libération du cytochrome c induite par Bax. Nature 391 (6666), 496-499. doi : 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Avancées sur les polyphénols naturels comme agents anticancéreux pour le cancer de la peau. Pharmacol. Res. 151, 104584. doi : 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Rôle de la formation de poly(ADP-ribose) dans la réparation de l’ADN. Nature 356 (6367), 356-358. doi : 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Taxol-induced mitochondrial stress in melanoma cells is mediated by activation of c-Jun N-terminal kinase (JNK) and p38 pathways via uncoupling protein 2. Cell. Signal. 20 (2), 311-322. doi : 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Les théaflavines suppriment la croissance tumorale et les métastases via le blocage de la voie STAT3 dans le carcinome hépatocellulaire. Oncotarg. Ther. 9, 4265-4275. doi : 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). La pro-caspase-3 est une cible physiologique majeure de la caspase-8. J. Biol. Chem. 273 (42), 27084-27090. doi : 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Aspects moléculaires des efficacités chimiopréventives et thérapeutiques du cancer du thé et des polyphénols du thé. Nutrition 43-44, 8-15. doi : 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Synthèse des théaflavines et de leurs fonctions. Mol. (Bâle Suisse) 23 (4), 918. doi : 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Logiciel Data Processing System (DPS) avec conception expérimentale, analyse statistique et exploration de données développé pour une utilisation dans la recherche entomologique. Insect Sci. 20 (2), 254-260. doi : 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 est nécessaire pour des activations soutenues de JNK/p38 MAP kinases et l’apoptose. EMBO Rep. 2 (3), 222-228. doi : 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analyses sur la théorie de la pathogenèse de la toxine cancéreuse et la théorie « consolider la résistance du corps et nettoyer la source ». China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Effet anti-prolifératif et d’induction d’apoptose de l’abrownine contre les cellules A549 d’adénocarcinome pulmonaire non à petites cellules. Front. Pharmacol. 7, 465. doi : 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). Une revue épidémiologique du régime alimentaire et du mélanome malin cutané. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi : 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). La famille des protéines BCL-2 : des activités opposées qui médient la mort cellulaire. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi : 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Le poisson zèbre : un modèle animal pour les études toxicologiques. Curr. Protoc. Toxicol. Chapitre 1:Unité1.7. doi : 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). La théabrownine inhibe la progression du cycle cellulaire et la croissance tumorale du carcinome pulmonaire par un mécanisme lié à c-myc. Front. Pharmacol. 8, 75. doi : 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar
.