- Introduction
- Matériels et méthodes
- Population étudiée
- Variables de l’étude
- Résultats
- Distribution du groupe sanguin AB0/Rh chez les patients atteints de PCa
- Pas de différences significatives dans les caractéristiques clinicopathologiques parmi les patients atteints de PCa selon les groupes sanguins AB0/Rh
- Aucune valeur pronostique significative du groupe sanguin pour la survie sans BCR après RP
- Discussion
- Consentement éclairé
- Déclaration éthique
- Contributions des auteurs
- Déclaration de conflit d’intérêts
Introduction
Le cancer de la prostate (CPa) est la tumeur maligne la plus fréquente dans les pays occidentaux et la deuxième cause de décès liés au cancer chez les hommes (1). Les facteurs de risque les plus reconnus pour développer un PCa sont l’âge croissant, l’origine ethnique et les antécédents familiaux (2). La prédisposition familiale suggère l’existence d’une composante génétique héréditaire de la maladie (3), mais ne représente qu’une minorité (5-10%) des cas de CPa. Par conséquent, les facteurs environnementaux et génétiques prédisposant la plupart des patients sont encore inconnus (4, 5). Le groupe sanguin AB0 est une caractéristique héréditaire qui a été associée à l’incidence et au pronostic de plusieurs tumeurs malignes (6-8). Plusieurs mécanismes plausibles, dont l’inflammation, la surveillance immunitaire des cellules malignes, l’adhésion intercellulaire et la signalisation membranaire, ont été proposés pour expliquer l’association observée entre les groupes sanguins AB0 et le risque de cancer.
Les antigènes du groupe sanguin AB0 (ABH) sont des glycoprotéines exprimées à la surface des globules rouges. Les antigènes phénotypiques A et B sont des glucides terminaux synthétisés par l’addition de sucres simples catalysée par une série de glycosyltransférases spécifiques. Le phénotype 0 se caractérise par l’absence de glycosyltransférases A et B, de sorte que seul un squelette protéique, l’antigène H, est présent. Les antigènes des globules rouges ont diverses fonctions, notamment l’intégrité structurelle des membranes, le transport des molécules à travers les membranes et l’adhésion (9). Outre leur expression sur les globules rouges, les antigènes ABH sont également exprimés dans une variété de cellules épithéliales, notamment l’urothélium, la muqueuse gastro-intestinale et les poumons. Plusieurs études ont démontré des changements dans le profil d’expression d’ABH dans les cellules cancéreuses en fonction du grade de la tumeur et de la progression de la maladie, suggérant une association possible entre le groupe sanguin AB0 et le risque de certaines malignités épithéliales (8, 10). Des études récentes ont montré que les personnes appartenant au groupe sanguin A, AB ou B présentaient une incidence accrue de cancer du pancréas par rapport à celles du groupe sanguin 0, le risque le plus élevé étant lié au groupe sanguin B (8). De même, on a signalé que le sérotype sanguin A était associé à un risque plus élevé de cancer gastrique, du sein et de l’ovaire (11). D’autre part, le groupe sanguin 0 a été corrélé aux taux de récidive et de progression les plus élevés après une résection transurétrale de la vessie et donc associé à un pronostic plus défavorable chez les patients atteints de carcinome urothélial de la vessie non invasif sur le plan musculaire (6).
Sur la base des preuves actuelles du rôle prédictif du groupe sanguin dans plusieurs tumeurs malignes, nous avons émis l’hypothèse que le type de groupe sanguin peut être utilisé comme un paramètre supplémentaire, qui facilite l’évaluation des risques et aide à estimer le pronostic après la chirurgie chez les patients atteints de PCa. Dans la littérature actuelle, il n’existe que peu de preuves cliniques concernant le groupe sanguin et le cancer du sein en général, ce qui a donné lieu à des résultats controversés (12-14). De plus, il n’existe actuellement qu’une seule étude portant sur l’impact des groupes sanguins sur le résultat des patients après une prostatectomie radicale (RP) (13). En utilisant 555 patients atteints de PCa subissant une RP, les auteurs ont montré que le groupe sanguin AB0 était un prédicteur indépendant de la récidive biochimique (BCR) dans l’analyse multivariable mais pas dans l’analyse univariable.
C’est pourquoi l’objectif de la présente étude était d’ajouter des informations supplémentaires au débat en cours en analysant la corrélation du groupe sanguin AB0/Rh et sa distribution chez les patients atteints de PCa, la pathologie tumorale, la récidive et la mortalité chez les patients atteints de PCa localisé subissant une RP en utilisant un grand ensemble de données d’un seul centre de 3 574 patients.
Matériels et méthodes
Population étudiée
L’étude a été approuvée par le comité d’examen institutionnel. Un total de 3 582 patients présentant un PCa cliniquement localisé et ayant subi une RP dans notre institution entre 2009 et 2010 ont été sélectionnés pour être inclus dans l’étude. Ceux dont les données étaient incomplètes et le suivi manquant ont été exclus (n = 8), ce qui laisse 3 574 patients disponibles pour l’analyse.
La prostatectomie radicale a été réalisée par une approche rétropubienne ouverte (n = 3 220) ou une approche laparoscopique assistée par robot (n = 354), comme décrit précédemment (15). La dissection des ganglions lymphatiques a été réalisée chez les patients à risque intermédiaire et à haut risque de D’Amico, conformément aux directives de l’Association européenne d’urologie (EAU) pour le PCa (16). Les spécimens chirurgicaux ont été traités selon les procédures histopathologiques standard et évalués par des uropathologistes expérimentés dans un centre à fort volume (>2 000 spécimens de prostatectomie par an). Les tumeurs ont été classées selon le système TNM 2007 de l’American Joint Committee on Cancer et le classement histopathologique a été attribué selon le système Gleason (17).
Tous les participants ont subi un test sérologique avant la RP. La confirmation en laboratoire du groupe sanguin AB0 et Rh a été obtenue auprès du département de médecine transfusionnelle de l’hôpital universitaire de Hambourg-Eppendorf. La distribution de référence AB0 de la population allemande a été utilisée comme contrôle (18).
Variables de l’étude
Les variables de l’étude comprenaient le groupe sanguin AB0/Rh, l’âge, l’antigène spécifique de la prostate (PSA) préopératoire, le volume de la prostate (échographie transrectale), le score de Gleason (spécimen), le stade pT, le statut pN, la marge chirurgicale, le BCR et la mortalité après RP. Le suivi des patients consistait en un dosage de l’APS tous les 3 à 6 mois pendant les 2 premières années après la RP, la RCB était définie comme un taux d’APS ≥0,2 ng/ml.
La relation entre le groupe sanguin AB0 et les variables clinicopathologiques a été évaluée à l’aide de tests du chi carré et de tests t. Dans l’analyse multivariable de régression de Cox (tests log-rank), l’impact du groupe sanguin, du PSA préopératoire, du score de Gleason, du stade pT, du statut pN et de la marge chirurgicale sur la survie sans BCR a été évalué afin d’évaluer les valeurs pronostiques de la survie. La probabilité de survie sans BCR a été comparée dans les groupes 0, A, B et AB à l’aide de l’analyse de Kaplan-Meier et du test log-rank.
Tous les tests étaient bilatéraux et les valeurs p <0,05 ont été considérées comme statistiquement significatives. Les analyses statistiques ont été effectuées avec le logiciel JMP v9.0.2 (SAS Institute, Inc, Cary, NC, USA) et R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Résultats
Un total de 3 574 patients présentant un PCa cliniquement localisé ont été éligibles pour les analyses finales, l’âge médian au moment de la chirurgie était de 65 ans (plage : 38-80) et le suivi médian était de 36,9 mois (tableau 1).

Tableau 1. Association du groupe sanguin AB0 et du facteur Rhésus avec les caractéristiques clinicopathologiques de 3 574 patients traités par prostatectomie radicale.
Distribution du groupe sanguin AB0/Rh chez les patients atteints de PCa
La distribution du groupe sanguin AB0 chez les patients atteints de PCa avant la RP était la suivante : 0 chez 1 350 (38%), A chez 1 605 (45%), B chez 445 (12%) et AB chez 174 (5%) patients, 83% des patients étaient Rh positif (tableau 1). La distribution de référence pour la population allemande est donnée comme suit (18) : 0 dans 41% ; A dans 43% ; B dans 11% ; AB dans 5% ; Rhésus positif : 85%. Les distributions globales des groupes sanguins AB0 ainsi que Rh dans la cohorte étudiée étaient équivalentes à la distribution observée dans la population masculine allemande.
Pas de différences significatives dans les caractéristiques clinicopathologiques parmi les patients atteints de PCa selon les groupes sanguins AB0/Rh
La majorité des patients avaient un PCa cliniquement localisé avec un profil de risque intermédiaire. Le score de Gleason le plus souvent rapporté était de 3 + 4 (66,9 %) et 63,3 % des patients avaient un taux de PSA préopératoire compris entre 4 et 10 ng/ml. Des tumeurs pT2 ont été détectées chez 68,7 % des patients et des marges négatives ont été obtenues chez 81,3 % des patients. Le volume médian de la prostate était de 40 ml et une atteinte des ganglions lymphatiques a été diagnostiquée chez 224 (6,3 %) patients (tableau 1). Il n’y avait pas de différences significatives dans les caractéristiques clinicopathologiques entre les patients de différents groupes sanguins AB0. Des pourcentages légèrement plus élevés de stade tumoral avancé (≥pT3b) ont été constatés chez les patients du groupe sanguin AB par rapport aux groupes sanguins 0, A et B (16,1, 12,6, 9,9 et 13,7 %, respectivement, p = 0,033). La population de patients avec AB a également montré un ratio modérément accru de facteur Rh négatif (21,8%) par rapport aux autres groupes sanguins (16,9%, p = 0,01) (tableau 1).
Aucune valeur pronostique significative du groupe sanguin pour la survie sans BCR après RP
Selon l’analyse de régression multivariable de Cox, le PSA préopératoire, le score de Gleason, le stade pT, le statut pN et la marge chirurgicale étaient significativement et indépendamment corrélés à la survie sans BCR (tous les p < 0,05) (tableau 2). Cependant, nous n’avons pas pu observer d’impact du groupe sanguin AB0 sur les taux de RCB (Figure 1). Nous avons également évalué la valeur pronostique du groupe sanguin 0 par rapport aux groupes sanguins non-0 ainsi qu’au sein des groupes sanguins alternatifs A/B/AB, avec des résultats non significatifs (tableau 2). Même en effectuant une sous-analyse avec les patients ayant un statut de marge positif ou négatif uniquement, l’influence du groupe AB0/Rh sur le RCB est restée non significative (Figures 2A,B). De plus, le statut du facteur Rhésus des patients n’avait également aucun impact sur la survie sans RCB (p = 0,74).
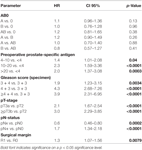
Tableau 2. Modèles de régression cox multivariable de l’AB0 et des facteurs pronostiques standard pour la survie sans récidive biochimique.
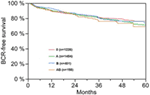
Figure 1. Survie sans récidive biochimique (BCR) après prostatectomie radicale stratifiée par groupes sanguins AB0 (p = 0,572).
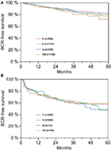
Figure 2. (A,B) Survie sans récidive biochimique (BCR) après prostatectomie radicale stratifiée par les groupes sanguins AB0 chez les patients ayant un statut de marge chirurgicale négatif et positif.
Discussion
Des associations possibles entre le groupe sanguin AB0 et le risque de certaines malignités épithéliales, y compris le cancer du pancréas, le cancer colorectal et le cancer gastrique ont été fréquemment rapportées (19, 20). En outre, les groupes sanguins AB0/Rh sont disponibles pour la plupart des patients avant l’intervention chirurgicale, ce qui en fait un marqueur complémentaire idéal sans aucune étape supplémentaire de traitement en laboratoire.
Il y a plusieurs décennies, des études immunohistochimiques ont indiqué que les cellules de PCa dérivées de patients présentent des schémas d’expression ABH différents de ceux des cellules de prostate normales/bénignes (21). Puisqu’il a été rapporté que le groupe sanguin AB0 et l’expression de son antigène sur les tissus sont associés à l’incidence, à la progression de la maladie et à l’issue de plusieurs tumeurs malignes (8, 22, 23), une telle expression altérée de l’antigène ABH dans le tissu prostatique a suggéré une influence possible du groupe sanguin sur la transformation maligne des cellules prostatiques.
Une étude récente publiée par Markt et ses collègues (14) a analysé la relation entre le groupe sanguin AB0 et le risque d’héberger un PCa agressif. Les auteurs ont analysé un ensemble de données comprenant 2 774 patients atteints de PCa agressif et 4 443 patients sans PCa comme témoins. Ces données n’ont pas permis de mettre en évidence une corrélation significative entre le groupe sanguin AB0 ou la » dose » d’allèles A ou B et le risque de PCa agressif. Bien que les auteurs aient également fait état de la mortalité spécifique au cancer et de la mortalité globale stratifiées par groupes sanguins, l’étude ne comportait pas d’informations sur le traitement du CPa. De plus, seuls les patients atteints de tumeurs agressives ont été inclus, ce qui pourrait masquer l’effet potentiel des différents groupes sanguins.
Ces résultats sont en accord avec une étude menée par Kvist et ses collègues, qui n’a démontré aucune corrélation entre le groupe sanguin AB0 et la survie des patients atteints de PCa gérés avec une attente vigilante. Cette étude était principalement limitée par le petit nombre de cas (n = 279) (12). Il est intéressant de noter que la seule étude portant sur les patients ayant subi une RP et incluant 555 patients japonais a récemment rapporté que le groupe sanguin 0 était significativement associé à une diminution du risque de RCB après RP dans une analyse multivariable mais non univariable (13). Dans la sous-analyse des patients dont la marge chirurgicale était négative, le taux d’absence de RCB à 5 ans dans le groupe sanguin 0 était significativement plus élevé que dans le groupe A (91,2 vs 71,0 % ; p = 0,026). Dans cette cohorte d’étude, 46,3% des patients avaient une marge positive malgré un stade clinique de T1c chez 74,2% des patients. Le stade pathologique (pT) n’était pas mentionné.
Notre cohorte rétrospective de 3 574 patients atteints de PCa cliniquement localisé est la plus grande cohorte analysée à ce jour pour déterminer un impact possible des groupes sanguins AB0 et Rh sur les caractéristiques de la tumeur et le résultat après RP. Dans la présente étude, la majorité des patients avaient des tumeurs pT2 (68,7%) et 18,6% avaient un statut de marge positif. En utilisant ces données, nous n’avons pas pu montrer d’impact significatif des groupes sanguins AB0/Rh sur les caractéristiques clinicopathologiques (PSA préopératoire, score de Gleason, volume prostatique, stade pT, statut pN et marge chirurgicale) et la survie sans BCR après RP curative. De plus, en effectuant une sous-analyse avec les patients ayant un statut de marge positif ou négatif uniquement, l’influence de AB0/Rh sur la RCB est restée insignifiante. Par conséquent, nous n’avons pas pu reproduire les résultats de l’étude japonaise (13). Contrairement à d’autres tumeurs malignes telles que le cancer du pancréas ou de la vessie, le groupe sanguin AB0/Rh n’a pas eu de valeur pronostique dans le cancer du sein.
Notre étude présente plusieurs limites importantes. Tout d’abord, les limites inhérentes aux analyses rétrospectives et l’absence d’un groupe de contrôle. En outre, notre cohorte d’étude contient principalement des PCa localisés avec un profil de risque faible à intermédiaire (score de Gleason 3 + 4 dans 66,9%, PSA préopératoire de 4-10 ng/ml dans 63,3%, pT2 dans 68,7% et marges négatives dans 81,3% des patients) permettant une présélection des patients avec un pronostic favorable. Par ailleurs, la distribution globale du groupe AB est, contrairement aux autres groupes sanguins, généralement peu abondante (4,9%). Certaines observations telles que le ratio modérément accru de facteur Rh négatif (21,8 %) chez les patients AB par rapport aux autres groupes sanguins (16,9 %, p = 0,01) pourraient être éventuellement renforcées en raison de la rareté du type AB Rh négatif, ce qui empêche la détection statiquement significative d’une corrélation au sein de ce sous-groupe. Enfin, les informations sur le génotype du groupe sanguin respectif manquaient.
En plus des caractéristiques mentionnées ci-dessus, les préoccupations environnementales, géographiques et raciales ne peuvent jamais être négligées dans la discussion des corrélations entre le groupe sanguin AB0 et le cancer. Les différences raciales et ethniques dans les groupes sanguins ainsi que dans le PCa sont bien connues (24, 25). En Europe, où le cancer du poumon est la tumeur maligne la plus fréquente et la deuxième cause de décès par cancer chez l’homme (1), les groupes sanguins les plus fréquents sont les groupes A et 0, qui passent à l’allèle B d’ouest en est. En revanche, les pays asiatiques où l’incidence et le grade du PCa sont les plus faibles sont caractérisés par une forte occurrence des types B et une fréquence relativement faible de 0, ainsi que par une population plus réduite avec un facteur Rh négatif (26). A cet égard, nos résultats diffèrent de l’étude actuelle chez les patients japonais avec un statut de marge positive relativement élevé et un BCR après RP curative (13).
Plusieurs mécanismes ont été proposés pour expliquer comment le groupe sanguin influence l’incidence et la progression du cancer ; cependant, ils restent encore peu clairs. Dans le cas du cancer de la vessie, une aberration chromosomique a été suggérée, car le gène AB0 est situé sur le chromosome 9q34, une zone qui est fréquemment altérée dans le cancer de la vessie (27). Comme le gène AB0 code en fait pour des glycosyltransférases, qui catalysent le transfert de sucres à l’antigène H (0), la survenue d’un cancer de la vessie est potentiellement corrélée au groupe sanguin 0. A l’inverse, il a été rapporté que les individus avec des groupes sanguins non 0 (A, AB et B) ont un risque élevé de développer un cancer gastrique et indiquent un rôle spécifique au cancer du groupe sanguin.
En ce qui concerne le PCa, plusieurs efforts sont en cours pour élucider le rôle du groupe sanguin dans la survie après la thérapie. Il a déjà été signalé que les patients de groupe sanguin non-0 devraient présenter un risque accru de thromboembolie veineuse après une RP, ce qui pourrait avoir une influence sur le résultat (28). Même une étude publiée récemment a démontré que les anticorps sériques du groupe sanguin A prédisent la survie sous PROSTVAC-VF (un vaccin thérapeutique anticancéreux à base de poxvirus en phase III des essais cliniques pour le traitement du PCa avancé) et devraient être considérés comme un nouveau biomarqueur potentiellement prédictif pour PROSTVAC-VF (29). Bien que nous n’ayons pas observé d’association claire entre le groupe sanguin AB0/Rh et la pathologie et le résultat de la tumeur dans notre étude, ces preuves suggèrent toujours un rôle prédictif du groupe sanguin dans l’épidémiologie et le résultat clinique du PCa, en particulier en vue de la réponse au traitement.
La présente étude avec 3 574 patients est la plus importante à ce jour analysant l’impact des groupes sanguins AB0 ou Rh sur la pathologie et le résultat après RP et ajoute des connaissances importantes à la littérature.
En conclusion, nos données suggèrent qu’il n’y a pas d’association pertinente du groupe sanguin AB0/Rhésus avec des caractéristiques tumorales clinicopathologiques défavorables ou le résultat oncologique après la chirurgie, contrairement à plusieurs autres malignités. Néanmoins, des recherches supplémentaires sont indiquées pour évaluer une association possible entre le génotype du groupe sanguin ou son expression antigénique sur le tissu du PCa et le pronostic au sein de différents groupes de thérapie, y compris le PCa de haut grade ou avancé, qui n’étaient pas suffisamment reflétés dans notre groupe d’étude.
Consentement éclairé
Le consentement éclairé a été obtenu de tous les participants individuels inclus dans l’étude.
Déclaration éthique
Toutes les procédures effectuées dans les études impliquant des participants humains étaient conformes aux normes éthiques du comité de recherche institutionnel et/ou national et à la déclaration d’Helsinki de 1964 et ses amendements ultérieurs ou à des normes éthiques comparables.
Contributions des auteurs
SO, DT et TS : contributions substantielles à la conception ou au design du travail, rédaction du travail, approbation finale de la version à publier. PM : contributions substantielles à la conception ou au design du travail, rédaction du travail, approbation finale de la version à publier. FC : acquisition, analyse ou interprétation des données pour le travail, révision critique du contenu intellectuel important, approbation finale de la version à publier. PT : acquisition, analyse ou interprétation des données pour le travail, révision critique pour le contenu intellectuel important, approbation finale de la version à publier. SP : acquisition, analyse ou interprétation des données pour le travail, révision critique pour le contenu intellectuel important, approbation finale de la version à publier. JLH, JH, et MG : acquisition, analyse ou interprétation des données pour le travail, révision critique pour le contenu intellectuel important, approbation finale de la version à publier. Tous les auteurs ont accepté d’être responsables de tous les aspects du travail en veillant à ce que les questions liées à l’exactitude ou à l’intégrité de toute partie du travail soient examinées et résolues de manière appropriée.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Le rédacteur de traitement a déclaré une affiliation partagée, mais aucune autre collaboration, avec plusieurs des auteurs (FC, SP, JH et DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Statistiques sur le cancer, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Facteurs de risque du cancer de la prostate. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Étiologie génétique du cancer héréditaire de la prostate. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Reported family history of cancer in the prostate, lung, colorectal, and ovarian cancer screening trial. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impact du groupe sanguin ABO sur les résultats chez les patients atteints d’un cancer primaire non-musculaire invasif de la vessie. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034.
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Risque de cancer du pancréas et allèles du groupe sanguin ABO : résultats du consortium de la cohorte du cancer du pancréas. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. Le gène codant pour l’antigène du groupe sanguin I : examen d’un I pour un œil. Immunohématologie (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. L’expression des antigènes de groupe sanguin A, B et H dans les tissus de carcinome est en corrélation avec un mauvais pronostic pour les patients atteints de cancer colorectal. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. Groupe sanguin ABO et incidence du cancer épithélial de l’ovaire. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Variables pronostiques chez les patients atteints de cancer de la prostate : influence du groupe sanguin ABO (H), du système Rhésus, de l’âge, de la différenciation, du stade tumoral et des métastases. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associations entre les groupes sanguins ABO et la récidive biochimique après une prostatectomie radicale. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. Allèles du groupe sanguin ABO et risque de cancer de la prostate : résultats du consortium de la cohorte du cancer du sein et de la prostate (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. L’examen en coupe congelée de la structure neurovasculaire adjacente (NeuroSAFE) augmente la fréquence de la préservation des nerfs et réduit les marges chirurgicales positives dans la prostatectomie radicale laparoscopique ouverte et assistée par robot : expérience après 11 069 patients consécutifs. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Lignes directrices sur le cancer de la prostate 2015. Association européenne d’urologie (2015).
Google Scholar
17. Gleason D, Mellinger G. Prédiction du pronostic de l’adénocarcinome prostatique par le classement histologique et la stadification clinique combinés. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blood group determinates incidence for pancreatic cancer in Germany. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. Les groupes sanguins ABO et le cancer. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. Le système des groupes sanguins ABO et Lewis. Immunochimie, génétique et relation avec les maladies humaines. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Détection des antigènes de groupe sanguin dans les sections congelées de l’épithélium prostatique. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Expression of ABH/Lewis-related antigens as prognostic factors in patients with breast cancer. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. La transcription du gène du groupe sanguin ABO est régulée à la baisse dans les tumeurs de la vessie humaine et les lignées de cellules urothéliales stimulées par la croissance. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Comparative studies of prostate cancer in Japan versus the United States. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Modèles basés sur des modèles dans la mortalité par cancer de la prostate dans le monde entier. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. Fréquences des phénotypes ABO et Rh(D) de différents groupes raciaux/ethniques aux États-Unis. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Caractérisation génotypique et phénotypique du groupe sanguin ABO(H) dans les tumeurs primaires de la vessie. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Cancer de la prostate : le groupe sanguin non O est un facteur de risque de TEV après une prostatectomie radicale. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Les anticorps sériques du groupe sanguin A prédisent la survie sous PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar
.