le principal constituant fonctionnel du globule rouge, servant de protéine de transport de l’oxygène ; c’est un type d’hémoprotéine dans lequel chaque molécule est un tétramère composé de quatre monomères maintenus ensemble par des liaisons faibles. Il s’agit d’un type d’hémoprotéine dans lequel chaque molécule est un tétramère composé de quatre monomères maintenus ensemble par des liaisons faibles. Symbole Hb.
L’atome de fer a une valence libre et peut lier une molécule d’oxygène. Ainsi, chaque molécule d’hémoglobine peut lier une molécule d’oxygène. La liaison de l’oxygène par un monomère augmente l’affinité pour l’oxygène des autres dans le tétramère. Cela fait de l’hémoglobine une protéine de transport plus efficace qu’une protéine monomère telle que la myoglobine.
L’hémoglobine oxygénée (oxyhémoglobine) est de couleur rouge vif ; l’hémoglobine non liée à l’oxygène (désoxyhémoglobine) est plus foncée. Cela explique la couleur rouge vif du sang artériel, dans lequel l’hémoglobine est saturée d’oxygène à environ 97 %. Le sang veineux est plus foncé car il n’est saturé qu’à 20 ou 70 %, selon la quantité d’oxygène utilisée par les tissus. L’affinité de l’hémoglobine pour le monoxyde de carbone est 210 fois plus forte que son affinité pour l’oxygène. Le complexe formé (carboxyhémoglobine) ne peut pas transporter l’oxygène. Ainsi, l’intoxication au monoxyde de carbone entraîne une hypoxie et une asphyxie.
Une autre forme d’hémoglobine qui ne peut pas transporter l’oxygène est la méthémoglobine, dans laquelle l’atome de fer est oxydé à l’état d’oxydation +3. Pendant les 120 jours de vie d’un globule rouge, l’hémoglobine est lentement oxydée en méthémoglobine. Au moins quatre systèmes enzymatiques différents peuvent reconvertir la méthémoglobine en hémoglobine. Lorsque ceux-ci sont défectueux ou surchargés, il peut en résulter une méthémoglobinémie, avec des taux élevés de méthémoglobine provoquant dyspnée et cyanose.
Une fonction secondaire de l’hémoglobine est de faire partie du système tampon du sang. Les résidus d’histidine dans les chaînes de globine agissent comme des bases faibles pour minimiser le changement du pH sanguin qui se produit lorsque l’oxygène est absorbé et le dioxyde de carbone libéré dans les poumons et lorsque l’oxygène est délivré et le dioxyde de carbone absorbé dans les tissus.
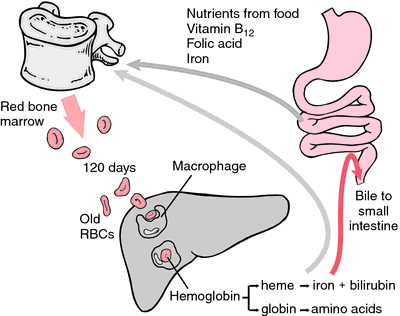
Lorsque les érythrocytes s’usent ou sont endommagés, ils sont ingérés par les macrophages du système réticulo-endothélial. Le cycle porphyrine de l’hème est converti en bilirubine, un pigment biliaire, qui est excrété par le foie. Le fer est transporté vers la moelle osseuse pour être incorporé dans l’hémoglobine des érythrocytes nouvellement formés.
La concentration en hémoglobine du sang varie avec l’hématocrite. Les valeurs normales de la concentration d’hémoglobine dans le sang sont de 13,5 à 18,0 g/100 ml chez l’homme et de 12,0 à 16,0 g/100 ml chez la femme. La concentration moyenne normale d’hémoglobine corpusculaire, qui est la concentration à l’intérieur des globules rouges, est de 32 à 36 g/100 ml.
De nombreuses hémoglobines anormales issues de mutations ont été découvertes. Certaines ont une affinité altérée pour l’oxygène, d’autres sont instables, et dans certaines l’atome de fer est oxydé, ce qui entraîne une méthémoglobinémie congénitale. Certaines mutations entraînent une réduction du taux de synthèse de l’hémoglobine. Toutes ces affections sont appelées hémoglobinopathies.
L’hémoglobinopathie la plus courante est la drépanocytose, causée par une mutation remplaçant le sixième acide aminé de la chaîne β, normalement l’acide glutamique, par la valine. La variante de l’hémoglobine α2βS2 est connue sous le nom d’Hb S. Les mutations entraînant une synthèse réduite de l’une des chaînes sont appelées thalassémies. Elles peuvent résulter de la délétion du gène d’une chaîne ou d’une mutation dans le gène régulateur qui contrôle la synthèse de la chaîne.
.