La forme des trois orbitales 3p. De gauche à droite : 3py, 3pz, et 3px. Pour chacune, les zones jaunes correspondent aux endroits où les fonctions d’onde ont des valeurs positives et les zones blanches désignent les valeurs négatives.
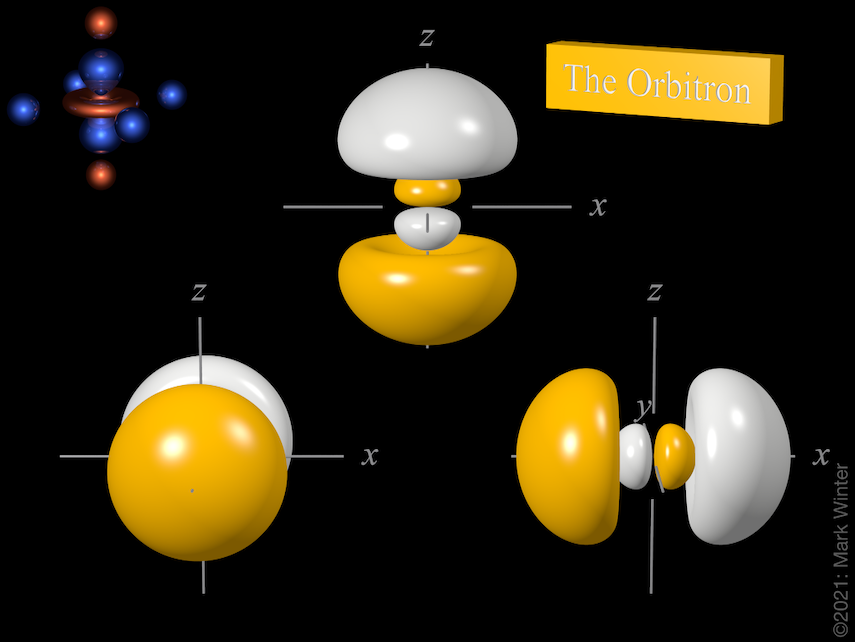
Les trois orbitales 3p. Utilisez les icônes précédent et suivant pour voir d’autres vues
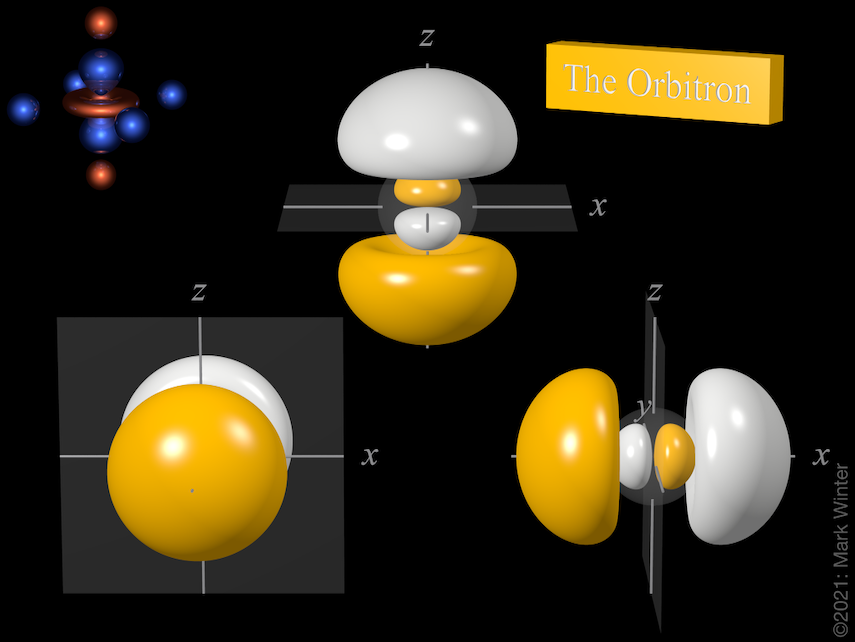
Les trois orbitales 3p incluant les nœuds orbitaux. Utilisez les icônes précédent et suivant pour voir d’autres vues
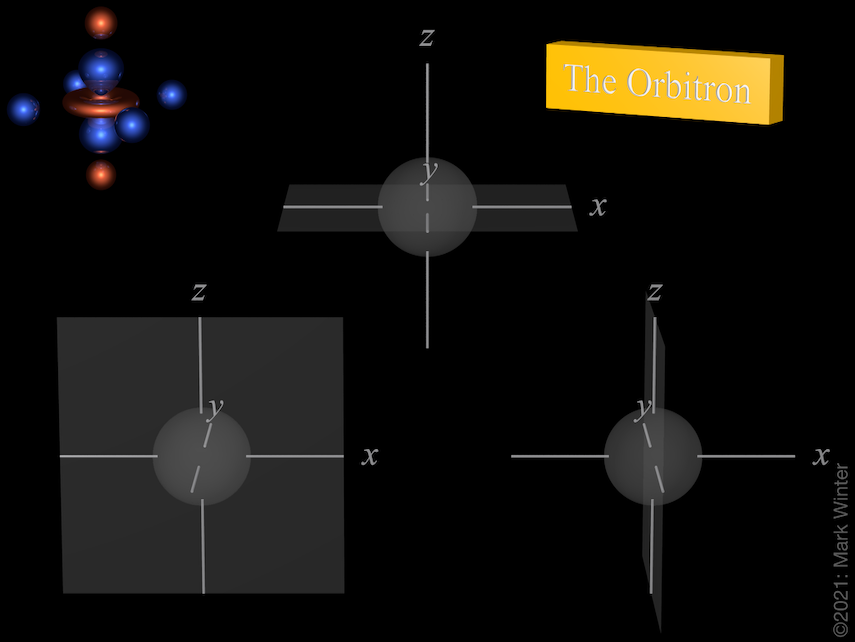
Nœuds des trois orbitales 3p. Utilisez les icônes précédent et suivant pour voir d’autres vues
Précédent
Pour tout atome, il existe trois orbitales 3p. Ces orbitales ont la même forme mais sont alignées différemment dans l’espace. Les trois orbitales 3p normalement utilisées sont étiquetées 3px, 3py, et 3pz puisque les fonctions sont « alignées » le long des axes x, y, et z respectivement.
Chaque orbitale 3p a quatre lobes. Il y a un nœud planaire normal à l’axe de l’orbitale (donc l’orbitale 3px a un plan nodal yz, par exemple). Outre le nœud planaire, il existe également un nœud sphérique qui sépare les petits lobes internes. Les orbitales p supérieures (4p, 5p, 6p et 7p) sont encore plus complexes car elles ont plus de nœuds sphériques.
L’origine du nœud planaire devient claire en inspectant les équations d’onde qui, par exemple, incluent un terme x dans le cas de l’orbitale 4px. Lorsque x = 0, alors il y a un nœud, et c’est par définition le plan yz.
L’origine du nœud sphérique devient claire en inspectant les équations d’onde qui, par exemple, incluent des termes (4 – ρ). Lorsque (4 – ρ) = 0, alors il y a un nœud. Puisque pour toute orbitale 3p ρ = 2Zr/3 (Z = charge nucléaire effective, r = rayon en unités atomiques), alors les nœuds sont au rayon pour lequel (4 – 2Zr/3) = 0, c’est-à-dire r = 6/Z unités atomiques.
L’OrbitronTM, une galerie d’orbitales sur le WWW : https://winter.group.shef.ac.uk/orbitron/