Introduction
La fermeture primaire de la paroi abdominale après une transplantation isolée d’intestin grêle ou d’organe multiviscéral reste l’un des défis les plus importants à résoudre dans ce domaine. La grande majorité de ces patients présentent des complications liées à la fermeture de la paroi, qui peuvent être attribuées à la distension intestinale due au syndrome d’ischémie-reperfusion, à l’œdème intestinal associé et à l’inélasticité de la cavité abdominale, dont le volume est généralement réduit après des antécédents d’opérations multiples et d’infections associées, la pose d’une stomie et une incidence élevée de fistules antérieures.1,2 Ces circonstances augmentent le risque de syndrome de compartiment, qui peut entraîner une ischémie ou une nécrose de la greffe.3 Par conséquent, environ 20 à 50 % des receveurs de ce type de greffe auront besoin d’une technique chirurgicale alternative à la fermeture primaire conventionnelle de la paroi abdominale.4-6 En général, étant donné la perte de structure de la paroi chez ces receveurs, ils sont considérés comme de mauvais candidats pour la chirurgie reconstructive, telle que la séparation des composants ou les lambeaux musculo-cutanés.
Ce problème peut être résolu ou traité soit en réduisant la taille de la greffe, soit en augmentant la capacité du receveur. La tendance générale à choisir des donneurs de poids plus faible, avec un ratio compris entre 1,1 et 0,757 ou même à réduire la taille des greffons8,9 facilite la fermeture sans tension dans de nombreux cas.1 Les techniques de fermeture de paroi utilisant un treillis conventionnel (résorbable ou non) ou un treillis biologique10 ont présenté des résultats décevants, probablement dus à une combinaison de tension dans la fermeture et aux effets de fortes doses de médicaments immunosuppresseurs. L’utilisation de la fermeture abdominale par étapes, préconisée par le groupe de Birmingham avec 23 cas combinant des prothèses en nylon synthétique (Silastic@) et une thérapie par pression négative, pourrait être une alternative.11 La fermeture cutanée isolée est parfois possible, bien que la couche musculaire inférieure ne présente pas autant d’élasticité. Des interventions ont même été proposées avec une série d’opérations utilisant des expanseurs, qui ne semblent pas très recommandables en raison des taux élevés de complications (infection, hernie, fistule, sérome/hématome, obstruction intestinale, extrusion de la maille, etc.).12,13
Le recours à la transplantation de la paroi abdominale totale ou partielle provenant du même donneur que la greffe intestinale ou multiviscérale, développé par Levi et al. depuis 2003,3 peut être une alternative intéressante dans ce contexte puisqu’elle présente des avantages évidents en termes d’obtention d’une fermeture sans tension avec un greffon en normoposition et bien vascularisé, d’évitement des complications infectieuses du maillage pouvant conduire à un rejet (présentation sous forme d’éruption maculopapuleuse),14 le tout réalisé en une seule chirurgie.2 Les expériences initiales de 15 et 17 patients ont montré de bons résultats2,15.
État actuel des greffes de paroi abdominale dans la transplantation d’organesGreffe d’épaisseur partielleFascia non vascularisé
Il existe deux techniques d’extraction de base décrites dans la littérature :
- –
Technique de Miami3 : elle consiste en l’ablation complète de la paroi abdominale comme s’il s’agissait d’une greffe complète, en bloc, pour séparer ultérieurement le lamina antérieur du fascia du rectus.
- –
Technique de Mount-Sinai/Favaloro16 : une incision transversale est réalisée dans le tissu sous-cutané et la peau, réséquant en bloc le feuillet antérieur du fascia du rectus antérieur par une incision sous-costale bilatérale avec péritoine.
Dans les deux cas, le greffon devient indépendant du reste du lambeau à la fin de l’extraction, après perfusion, qui n’est pas synchrone avec le reste des organes extraits. Le greffon est placé dans une solution de conservation, et les tissus et muscles en excès sont retirés sur la paillasse.
Dans notre hôpital, les deux artères iliaques externes du donneur sont canulées, et le lambeau complet du greffon est perfusé ; par la suite, une technique d’extraction très similaire à la méthode de Miami est réalisée. L’objectif est d’obtenir un greffon complet du donneur (figure 1) pour décider ultérieurement du type de greffe et de fermeture de la paroi requis par le receveur (en fonction des examens d’imagerie préopératoires, notamment de la tomographie volumétrique, qui doit être confirmée par l’état des tissus au moment de l’implantation).
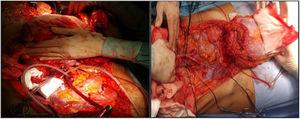
Cannulation des artères iliaques externes (il n’est pas nécessaire de canuler les veines) et préparation du greffon pour l’extraction.
Bien que la plupart des séries réalisent la perfusion du greffon de paroi avec la solution de préservation Wisconsin, dans notre hôpital, nous pensons que l’utilisation de la solution Celsior est supérieure en raison de sa plus faible viscosité, bien qu’il n’y ait pas suffisamment de preuves dans la littérature à cet égard.17
Par la suite, sur le banc, le type de greffe est décidé en fonction des besoins du receveur, et les tissus inutiles sont retirés (figure 2). Dans le cas d’un fascia non vascularisé, l’excision du tissu graisseux et musculaire est importante car, sans support circulatoire, il serait très susceptible de développer une nécrose et de devenir une source d’infection.
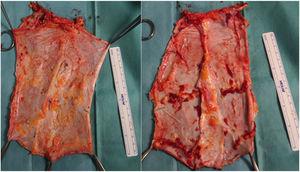
Exemples de greffes de fascia non vascularisées.
Fascia vascularisé
Ceci est indiqué dans les cas d’implants hépatiques isolés et ceux associés à des greffes intestinales. L’extraction du foie serait réalisée en association avec le ligament falciforme et le feuillet postérieur de la gaine des droits, ce qui maintiendrait un certain degré de débit de l’artère du ligament falciforme (généralement du foie gauche) et un drainage par la veine ombilicale, avec une vascularisation partielle du péritoine et du feuillet postérieur de la gaine des droits (figure 3). L’artère du ligament falciforme apparaît dans 67% des autopsies, mais seulement dans 2%-24% des angiographies.18 Elle semble être une option très intéressante chez les donneurs et receveurs pédiatriques, car chez les adultes elle est oblitérée. Apparemment, ce greffon présente une plus grande résistance à l’infection que le fascia non vascularisé et une meilleure intégration avec les tissus environnants. Le groupe de Chicago19 a dû accéder jusqu’à 3 fois à la cavité d’un receveur, observant une bonne viabilité du lamina (malgré cela, le patient est décédé 51 jours plus tard à cause d’une infection fongique). Dans les cas de l’Université Duke20, il a été utilisé comme une sorte de maille de renforcement pour la fermeture, sans complications apparentes dans les deux cas (tableau 1).
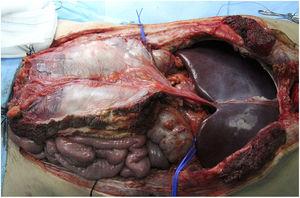
Exemple d’extraction de fascia vascularisé dans notre hôpital ; en fin de compte, son utilisation n’a pas été nécessaire.
Expérience internationale en matière de transplantation de la paroi abdominale.
| Hôpital | Type d’anastomose vasculaire | N de cas | Complications |
|---|---|---|---|
| Tx épaisseur totale de la paroi | |||
| Miami4 (2003) | Macro-vasculaire iliaque-.iliaque | 12 (6 IT ; 4 MOT ; 2 MMOT) | Thrombose (2)Fermeture secondaire (2)Infections (7) |
| Oxford2 (2008-2014) | Microvasculaire épigastrique-iliaque | 17 cas (12 IT ; 5 MMOT) | Infections (6)GVHD (2)Rejet aigu (5) |
| Bolonia21 (2005) | Microvasculaire épigastric-iliaque | 3 cas (3 IT) | Syndrome lymphoprolifératif (1) |
| Chennai (Vayda et al. Résultats non publiés) (2015) | Microvasculaire épigastrique-iliaque | 1 cas (1 IT) | |
| Indiana (Viana et al. Résultats non publiés) (2013) | Macrovasculaire iliaque- iliaque | 1 cas (1 IT) | |
| Groningue23 (2016) | Microvasculaire épigastrique-iliaque | 1 cas (1 IT) | |
| Tx fascia vascularisé | |||
| Oxford2. (2007) | 1 cas (1 IT) | ||
| Chicago19 (2010) | 5 cas (1 LKT, 4 TH) | Sepis (1)Fermeture secondaire (2) | |
| Universidad Duke20 (2012) | 2 cas (2 MOT) | ||
| Tx nonvascularisée du fascia | |||
| Miami24 (2009) | 13 cas (6 MOT, 4 TH, 2 MMOT, 1 LIT) | Infections (7)Retrait (2) | |
| Oxford2 (2007) | 1 cas (1 IT) | ||
| Argentine16 (2007) | 19 cas (13 IT, 4 MOT, 2 LIT) | Pertes de greffons (3)Infection (7/17) | |
| Mont Sinaï24 (2009) | 1 cas (IT) | Septiche (1) | |
| Berlín25 (2012) | 5 cas (5 MOT) associés VAC | ||
| Hôpital 12 de Octubre (2018) | 2 cas (1 IT, 1 MOT) | Sépis (1) | |
GVHD : maladie du greffon contre l’hôte ; LT : transplantation hépatique ; LIT : transplantation hépatique et intestinale ; LKT : transplantation hépatique et rénale ; IT : transplantation intestinale ; MOT : transplantation d’organes multiples ; MMOT : transplantation d’organes multiples modifiée ; Tx : transplantation.
Greffe de la paroi abdominale de pleine épaisseur
Cette alternative semble la plus physiologique d’un point de vue anatomique. Historiquement, c’est le premier type de transplantation de paroi qui a été réalisé, ce qui est surprenant, étant donné que c’est la technique la plus complexe, tant pour l’extraction que pour l’implantation. L’extraction se fait en 2 temps, au début et à la fin de l’extraction des organes multiples. Dès le début de l’extraction, une incision du lambeau de pleine épaisseur est réalisée « à domicile », laissant le lambeau musculo-cutané mobilisé et relié au donneur par les vaisseaux épigastriques inférieurs. Une fois l’extraction multi-organes effectuée, l’aorte est canulée et le greffon de paroi est perfusé avant l’extraction et la mise en glace avec solution de conservation (Fig. 4). Dans notre hôpital, la canulation sélective des deux artères iliaques externes est préférée (ligature distale du canal inguinal-artère fémorale-et dans l’origine de l’artère iliaque externe) et indépendante du processus de perfusion du reste des organes à extraire.
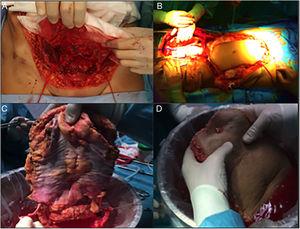
Phases de l’extraction complète du greffon : (A) Dissection des vaisseaux épigastriques inférieurs ; (B) Préparation des canules avec le lambeau « à domicile » ; (C) Dissection au banc de l’arcade vasculaire épigastrique inférieure ; (D) Confirmation de la perfusion.
Idéalement, c’est la solution pour les patients manquant de paroi abdominale et même de peau pour la fermeture. Elle permettrait donc d’éviter de réduire le greffon ou de limiter le pool de donneurs en fonction du rapport de poids greffon/receveur de 0,75. Compte tenu du poids des receveurs adultes dans notre environnement, la concurrence pour les donneurs pédiatriques est fréquente, donc la possibilité d’élargir la gamme de poids garantit une plus grande largeur et qualité des organes disponibles.
La reconstruction de la greffe de paroi est effectuée de différentes manières, en fonction de la structure vasculaire et anatomique de la paroi du receveur. Une anastomose est généralement utilisée entre un patch de l’artère iliaque externe et l’artère épigastrique inférieure du donneur avec la bifurcation des artères iliaques du receveur en raison de son plus grand diamètre. Le groupe de Bolonia22 utilise une anastomose directe entre les vaisseaux épigastriques inférieurs du donneur et du receveur, sauf dans un des 3 cas où l’artère circonflexe iliaque superficielle a été utilisée en raison d’une blessure de l’artère épigastrique inférieure du receveur.
La détection éventuelle d’un rejet d’organe intestinal ou multiviscéral par des biopsies de paroi a été proposée, bien que celles-ci puissent ne pas être aussi sensibles ou spécifiques que les biopsies intestinales (aucun rejet n’a été détecté dans le cas de Bolonia, alors qu’il existait dans l’intestin) ; cependant, elles pourraient avoir une grande valeur de recherche22.
Notre expérience
Nous présentons les cas de 2 patients chez qui il était impossible de réaliser une fermeture primaire de la paroi abdominale ou une chirurgie de réparation en raison de plusieurs interventions chirurgicales avant la transplantation.
Cas 1
La patiente est une femme de 50 ans qui avait été adressée à notre hôpital en raison d’un syndrome de l’intestin court secondaire à de multiples résections (6 interventions) pour ischémie mésentérique. Après 3 ans en tant que candidate à la transplantation intestinale et en raison de la nutrition parentérale, elle a développé une maladie hépatique chronique et un déclin de la fonction rénale, faisant d’elle une candidate à la transplantation multiviscérale. La patiente présentait un défaut très important de la paroi abdominale mesurant 10cm de diamètre transversal×15cm de longueur, avec la diminution conséquente de la taille de l’abdomen.
Une transplantation d’organes multiples a été réalisée selon la technique standard. Au moment de la fermeture de la paroi, le défaut de la paroi abdominale était insurmontable, associé à une importante peau redondante, ce qui a permis une fermeture avec le feuillet antérieur non vascularisé du fascia du rectus du donneur, sans nécessiter la greffe abdominale complète. La patiente a présenté de multiples complications infectieuses qui ont conduit à son décès (pneumonie et collections abdominales), sans relation apparente avec la paroi abdominale sur les examens d’imagerie réalisés ou l’autopsie. Aucune réintervention abdominale n’a été nécessaire après la transplantation.
Cas 2
Une femme de 60 ans a été adressée à notre hôpital en raison d’une tumeur desmoïde avec infiltration de la paroi abdominale. Elle avait subi 2 laparotomies précédentes qui avaient confirmé l’impossibilité de la réséquer en raison d’une implication étendue de l’artère mésentérique supérieure. Deux ans après avoir été inscrit sur la liste d’attente, une transplantation d’intestin isolé a été réalisée selon la technique standard. Au moment de la fermeture, et en raison du syndrome de post-reperfusion du greffon, le défaut de la paroi abdominale était impossible à fermer (défaut de 16cm de long×20cm de large). Une greffe non vascularisée de la lamelle antérieure de la gaine du muscle droit a été réalisée, ce qui a permis une fermeture cutanée primaire (Fig. 5). La période postopératoire s’est déroulée sans incident, à l’exception d’un épisode de rejet léger, qui a nécessité l’ajout d’évérolimus au régime immunosuppresseur avec corticostéroïdes et tacrolimus. Lors de la tomodensitométrie de suivi, une excellente intégration du lambeau de fascia a été observée (tomodensitométrie normale, sans défaut de paroi ou bombement observé), sans collection ni signe d’infection.
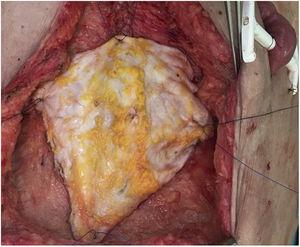
Positionnement définitif du greffon de fascia non vascularisé.
Discussion
La transplantation de la paroi abdominale a été consolidée comme une alternative valide pour la fermeture de la paroi chez les patients recevant une autre transplantation d’organe abdominal. Dans jusqu’à 40 % des cas, la fermeture de la paroi abdominale compliquera la transplantation multiviscérale ou intestinale, et cette question doit donc être résolue.26 Les résultats à long terme, notamment pour les greffons vascularisés, laissent présager un bon avenir, au point d’avoir démontré une piloérection et un certain degré de contraction musculaire autonome chez certains greffons.27
Le choix d’un type de greffon ou d’un autre repose sur la nécessité de réparer la paroi abdominale du receveur. En fonction de la taille du défaut, l’utilisation du greffon qui complique le moins l’implantation est priorisée. Dans de nombreux cas, le défaut est musculo-aponévrotique et ne nécessite pas la pleine épaisseur supplémentaire requise par l’ajout d’une double anastomose vasculaire. L’alternative du fascia vascularisé est limitée aux patients pédiatriques qui nécessitent au moins une transplantation hépatique.
Bien que les greffons non vascularisés présentent une incidence plus élevée de complications, notamment infectieuses, ils semblent être une alternative raisonnable, en particulier chez les patients plus âgés présentant un degré plus élevé d’athérosclérose qui entrave un support vasculaire adéquat ou entraîne un risque supplémentaire lors de la création d’anastomoses24. Cette charge athérosclérotique doit être mesurée chez les receveurs adultes par tomodensitométrie avec contraste artériel lors du calcul du rapport risque-bénéfice.
Chez les receveurs pédiatriques, les alternatives vascularisées gagnent probablement en importance. Des avantages tels qu’un diagnostic potentiel de rejet, ou au moins un prélèvement moins invasif avec moins de complications potentielles, en font une alternative très attrayante pour la fermeture de la paroi abdominale chez les patients ayant subi de multiples réinterventions28 et, au départ, un meilleur statut vasculaire.
La résistance et l’intégration dans les tissus des différents types de greffe de la paroi abdominale sont frappantes, montrant que ces techniques sont des alternatives de fermeture de la paroi très solides, notamment en cas de réopérations. Dans les séries publiées,22 elles démontrent une résistance significative, avec une absence remarquable d’adhérences des intestins au greffon de paroi.16 Dans notre série avec des greffons non vascularisés, la présence d’une fibrose macroscopique à l’autopsie d’un patient et sur les tests d’imagerie de l’autre a démontré une bonne intégration sans la nécessité d’un support vasculaire.
De nouvelles classifications telles que celle proposée par le groupe de Light et al. 29 pourraient être utiles dans la planification préopératoire des besoins en greffons, ainsi que pour pouvoir comparer les différents greffons au-delà de leur support vasculaire.
Le fait que les greffes multiviscérales et intestinales représentent un très faible pourcentage du total influence la faible utilisation de la transplantation de la paroi abdominale et a probablement fortement limité sa diffusion. Cependant, la possibilité d’utiliser ce type de greffe chez les transplantés hépatiques dont la paroi abdominale est hostile pourrait élargir l’indication. Ceci est particulièrement vrai étant donné l’incidence des complications avec les mailles en polypropylène (et le fait que les mailles ne peuvent pas entrer en contact avec les viscères) et les mauvais résultats avec les mailles en polytétrafluoroéthylène expansé en termes de réopération et d’infection. Les alternatives avec des mailles biologiques utilisées dans notre hôpital30 n’ont présenté que des résultats acceptables chez les receveurs pédiatriques avec un petit défaut de paroi, et à un coût économique très élevé, ce qui explique pourquoi elles ne sont plus utilisées chez les receveurs adultes.
L’utilisation d’une telle greffe sans greffe associée d’autres viscères semble au moins controversée étant donné les besoins d’immunosuppression, et les alternatives avec des mailles et des composés sont plus viables chez les patients non immunosupprimés.
Conclusion
Les greffes de paroi abdominale sont une alternative valable chez les patients en cours de transplantation avec des lésions antérieures de la paroi abdominale (entravant la réparation en raison de la perte de couches musculaires) ou des tailles de donneur/greffon mal assorties avec la nécessité de réduire la greffe.
Conflit d’intérêts
Les auteurs n’ont pas de conflit d’intérêts à déclarer.