- Introduction
- Materiaalit ja menetelmät
- Tulokset ja keskustelu
- Termodynaaminen argumentti
- Mitkä asetogeneesireaktiot ovat termodynaamisesti suotuisia?
- Mitkä asetogeneesireaktiot ovat todennäköisimpiä tutkituissa olosuhteissa?
- Mitkä asetogeneesireaktiot todennäköisesti tapahtuvat paikan päällä?
- Mitattuihin pitoisuuksiin perustuvat asetogeneesireaktioiden in situ -energiantuotot
- H2:ta sisältävien asetogeneesireaktioiden energiantuotot verrattuna kilpaileviin sulfaattipelkistys- ja metanogeneesireaktioihin
- Asetogeenien aineenvaihduntastrategiat
- Niche-erilaistuminen substraatin käytön perusteella
- Espesialisti vs. generalisti -argumentit
- Biosynteesin energeettiset kustannukset asetogeenien keskuudessa
- Johtopäätös
- Irintaristiriitoja koskeva lausunto
- Kiitokset
Introduction
Aiemmat tutkimukset anoksisissa sedimenteissä ovat osoittaneet, että orgaanista ainetta remineralisoivien terminaalimikrobien välillä on redox-vyöhykejako suhteessa elektroniakseptorien saatavuuteen (esim. Froelich et al., 1979; Canfield et al., 1993). Organismit, jotka käyttävät elektroniakseptoria, jolla on suurin Gibbsin vapaan energian tuotto, hallitsevat ryhmiä, jotka käyttävät energeettisesti epäedullisempia elektroniakseptoreita (esim. Cappenberg, 1974; Lovley ja Goodwin, 1988; Hoehler et al., 1998). Suuremmat energiantuotot tukevat nopeampaa kasvua ja johtavat epäedullisempia elektroniakseptoreita käyttävien ryhmien kilpailulliseen syrjäytymiseen (Cord-Ruwisch et al., 1988). Energiasubstraatteja, joilla on korkea liikevaihtonopeus, esimerkiksi vetyä (H2) ja asetaattia, voidaan jopa vetää termodynaamisiin kynnyspitoisuuksiin, jolloin vain läsnä oleva energeettisesti edullisin elektroniakseptori tuottaa riittävästi energiaa protonitranslokaatioon solukalvon läpi, ATP:n muodostumiseen ja kasvuun (Hoehler et al., 2001; Hoehler, 2004). Biologista redox-vyöhykejakoa tukevia todisteita on saatu makean veden ja meren rannikkosedimenttien sekä laboratoriossa tehtyjen kemostaatti- ja kokoviljelykokeiden perusteella.
Redox-vyöhykejaon käsitteen mukaisesti denitrifikaation, mangaanin ja raudan pelkistymisen sekä sulfaatin pelkistymisen prosessien pitäisi sulkea pois energeettisesti epäedullisemmat reaktiot, joihin liittyy hiilidioksidin pelkistyminen tai disproportionaatio, aina kun käytettävissä olevat nitraatti-, mangaani(IV)-, rauta(III)- ja sulfaattivarastot eivät ole nopeusrajoittavia (esim, Froelich et al., 1979; Canfield et al., 1993). Makean veden ja rannikon merisedimenteissä suotuisimpien hapettimien ehtyminen tapahtuu usein matalalla käymis- ja hydrolyysireaktioiden tuottamien elektroninluovuttajien ylimäärän vuoksi (Capone ja Kiene, 1988). Tämä luo kapeikon metaania tuottaville arkeoille (metanogeeneille) ja asetaattia syntetisoiville mikrobeille (asetogeeneille), ryhmille, jotka pystyvät keräämään energiaa hiilidioksidin pelkistymisestä alla olevissa kerroksissa (esim. Phelps ja Zeikus, 1984; Avery et al., 2002; Ferry ja Lessner, 2008; Liu ja Conrad, 2011). Sen sijaan oligotrofisemmissa offshore-merisedimenteissä, jotka peittävät suurimman osan maapallon pinnasta, orgaaninen aines ja siten elektroninluovuttajien saatavuus ovat tyypillisesti rajoittavia. Nitraatin, hapettuneiden metallien, sulfaatin ja/tai jopa diohapen (O2) ehtyminen tapahtuu vasta kymmeniä metrejä merenpohjan alapuolella – jos ollenkaan (esim. D’Hondt et al., 2004; D’Hondt et al., 2009). Näin ollen metanogeeneja ja asetogeeneja ei pitäisi esiintyä tai niiden pitäisi parhaimmillaankin elää marginaalisesti – lepotilassa tai selviytyä pieninä määrinä ei-kilpailukykyisillä energiasubstraateilla, joita muut ryhmät eivät käytä, kuten metyloituneilla C1-yhdisteillä tai metoksyloiduilla aromaattisilla yhdisteillä (Franklin et al., 1988; Lever et al., 2010). Näin ollen syvälle hautautuneista merisedimenteistä saadut viimeaikaiset todisteet, jotka osoittavat biogeenisen metaanin merkittävää kertymistä sulfaatti- ja metallien pelkistävien populaatioiden läsnä ollessa, vaikuttavat yllättäviltä (Wang et al., 2008). Lisäksi vaikka sulfaattipelkistäjät ja metanogeenit saavat enemmän energiaa kuin asetogeenit yhteisistä energiasubstraateista, on yhä enemmän näyttöä siitä, että asetogeeneillä on määrällisesti merkittävä rooli orgaanisen hiilen kiertokulussa meren ja maan syvän biosfäärin syvällä biosfäärissä (Heuer et al., 2006, 2009; Griebler ja Lueders, 2008; Pedersen et al., 2008; Lever et al., 2010).
Seuraavissa kappaleissa tarkastelen mahdollisia syitä siihen, miksi asetogeneesi esiintyy rinnakkain muiden, energeettisesti edullisempina pidettyjen polkujen kanssa syvällä maan alla. Analyyseissäni (1) lasken konservatiivisesti laajalle levinneiden asetogeneesireaktioiden energiantuotot maanalaisessa syvyydessä, (2) tarkastelen substraattigeneralismin mahdollisuuksia menestyksekkäänä strategiana äärimmäisessä energiarajoituksessa ja (3) tarkastelen biosynteesin kustannuksia ja mahdollisia tapoja, joilla asetogeenit voivat vähentää biosynteesiin kuluvaa energiaa.
Materiaalit ja menetelmät
Potentiaaliset energiantuotot laskettiin yhteensä 14 asetogeeniselle substraatille ja 20 asetogeneesireaktiolle (taulukko 1). Kriteereinä näiden substraattien valinnassa olivat (1) niiden laaja käyttö asetogeeneissä, (2) näiden tai niihin liittyvien substraattien aiemmin osoitettu kvantitatiivinen merkitys aineenvaihdunnan välituotteina anaerobisissa sedimenteissä, (3) niiden edustavuus laajasta valikoimasta asetogeenien käyttämiä substraattityyppejä ja (4) aiemmin julkaistut termodynaamiset ominaisuudet (taulukko 2). Reaktiot sisälsivät epäorgaanisia substraatteja (H2-CO2, CO), monokarboksyylihappoja (formiaatti, laktaatti), dikarboksyylihappoja (glykolaatti, oksalaatti), alkoholeja (metanoli, etanoli), ketoneja (pyruvaatti), hiilihydraatteja (glukoosi, sellobioosi), metyylihalogenideja (metyylikloridia, CH3Cl; tunnetaan myös nimellä kloorimetaani) ja metoksyloidut aromaattiset yhdisteet (syringaatti, vanilaatti).

Taulukko 1. Yleiskatsaus tässä tutkimuksessa tutkituista asetogeneesireaktioista (mukaillen Drake et al., 2006).
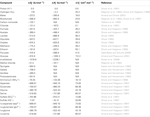
TAULUKKO 2. Vesipitoisten eduktien ja tuotteiden termodynaamiset tiedot vakio-olosuhteissa (N/A = ei saatavilla olevia julkaistuja arvoja).
Koska useimpien näiden yhdisteiden pitoisuustietoja syvältä merenpohjan alta on niukasti/ei ole, käytin varovaisia pitoisuusarvioita. Tämä tarkoittaa, että laskelmissa käytetyt eduktiopitoisuudet olivat näille tai vastaaville substraateille sedimentti- tai meriympäristössä aiemmin määritetyn spektrin alapäässä, kun taas tuotepitoisuudet olivat lähellä aiemmin mitatun pitoisuusspektrin yläpäätä (Meyer-Reil, 1978; Ansbaek ja Blackburn, 1979; Sørensen ym, 1981; Kaiser ja Hanselmann, 1982; King et al., 1982, 1983; Smith ja Oremland, 1983; Smith et al., 1985; Edenborn ja Litchfield, 1987; King, 1988, 2007; Lovley ja Goodwin, 1988; Martens, 1990; Liu ja Suflita, 1993; Hoehler ym, 1998; Chidhaisong et al., 1999; Ballschmiter, 2003; Dhillon et al., 2005; Finke et al., 2006; Chapelle ja Bradley, 2007; Heuer et al., 2009; Lever et al., 2010). Näin ollen liuenneille kaasumaisille energiasubstraateille (CO, CH3Cl; H2 ks. seuraava lause) käytettiin 0,1 nM:n pitoisuutta, kun taas kaikille muille energiasubstraateille oletettiin 100 nM. Merenpohjan alapuolelta saatujen H2-pitoisuustietojen tarkkuuteen liittyvien suurten epävarmuustekijöiden kompensoimiseksi, koska vety on tärkeä (yhteis)substraatti useissa asetogeneesireaktioissa (taulukko 1) ja koska aiemmin on julkaistu todisteita, jotka viittaavat asetogeneesiin hiilidioksidin pelkistymisen kautta H2:n avulla syvällä maanpinnan alla (Heuer et al., 2009), käytettiin kahta vetypitoisuutta, 0,1 nM ja 1 μM. Näihin pitoisuuksiin sisältyy vaihteluväli, joka mitattiin monissa orgaanisesti rikkaissa ja ultraoligotrofisissa maanalaisissa paikoissa valtameren porausohjelman (ODP) jaksoilla 201 ja 204, IODP:n tutkimusretkikunnan 329 ja Meteor-retkikunnan M76 aikana Benguelan nousuvesialueella (Shipboard Scientific Party, 2003; Lorenson et al., 2006; Expedition 329 Scientists, 2011; Lin et al., 2011). Asetogeneesireaktioissa, joissa H2 on kanssasubstraattina, 1 μM H2:n ei pitäisi olla rajoittava tekijä. Metabolisten tuotteiden osalta oletin 1 mM:n pitoisuuden asetaattia, 100 nM:n pitoisuuden gallaattia ja protokatekuaattia sekä tyypilliset meriveden protonien (10-8 M) ja kloridin (0,56 M; Pilson, 1998) pitoisuudet. Bikarbonaattipitoisuuksina käytettiin 2 mM (tyypillinen merivesipitoisuus), kun bikarbonaatti oli edukti, ja 200 mM, kun bikarbonaatti oli tuote. Sulfaatin pelkistysreaktioissa käytin 10 mM:n sulfaattipitoisuuksia ja 1 mM:n sulfidipitoisuuksia. Metanogeneesireaktioissa oletin metaanipitoisuuksiksi 1 mM. Kaikissa laskelmissa käytetty pH oli 8,0.
H2-CO2:sta, formiaatti-H2:sta ja formiaatista tapahtuvien asetogeneesireaktioiden in situ -energiantuottojen laskennassa käytin julkaistuja tietoja, jotka saatiin päiväntasaajan Tyynellämerellä ja Perun marginaalilla suoritetun ODP-jalkautuksen (ODP Leg 201 to the Equatorial Pacific and Peru Margin) aikana (Shipboard Scientific Party, 2003). pH:n lisäksi käytettiin mitattuja H2-, liuenneen epäorgaanisen hiilen (DIC), formiaatin ja asetaatin pitoisuuksia. In situ -lämpötila laskettiin kunkin paikan mitatusta lämpögradientista. In situ -paine laskettiin veden ja sedimentin syvyydestä olettaen, että veden keskimääräinen tiheys on 1,029 g cm-3, ja käyttämällä paikkakohtaisten sedimenttiosayksiköiden keskimääräisiä sedimentin irtotiheysarvoja (Shipboard Scientific Party, 2003). Mitatut aminohappopitoisuudet (glutamaatti, aspartaatti, seriini, glysiini) ODP Leg 201:n sedimenttisydämissä saatiin Mittereriltä (2006).
Gibbsin vapaat energiat reaktiota kohti laskettiin vakio-olosuhteille (25 °C, 1 atm) sekä lämpötilan ja paineen ääriarvoille, jotka kattavat suurimman osan maapallon maanalaisista sedimenteistä (Stumm ja Morgan, 1981). -1,9 °C, joka on useimpien merivesien jäätymislämpötila, edustaa alempaa lämpötilarajaa, joka todennäköisesti esiintyy syvällä biosfäärissä, kun taas 122 °C on ylempi lämpötilaraja, jota tunnettu elämä sietää (Takai et al., 2008). Painealue 1-1000 atm ulottuu matalista rannikkosedimenteistä suurimpaan osaan avomeren pinnanalaisista sedimenteistä. Aktiivisuudet approksimoitiin pitoisuuksista käyttämällä bikarbonaatin mitattua aktiivisuuskerrointa γ (0,532) anionisille asetogeneesin substraateille/tuotteille (formiaatti, asetaatti, laktaatti, oksalaatti, glykolaatti, syringaatti, vanilaatti) sekä metaanin mitattua aktiivisuuskerrointa (1,24) kaasuille (H2, CO) ja alkoholeille (metanoli, etanoli; molemmat Milleron ja Schreiberin julkaisuista, 1982). Veden, hiilihydraattien (glukoosi, sellobioosi) ja aminohappojen (aspartaatti, glutamaatti, glysiini, seriini) aktiivisuuskertoimiksi asetettiin 1,0. Sulfaatille (0,104) ja sulfidille (0,410; Millero ja Schreiber, 1982) käytettiin julkaistuja aktiivisuuskertoimia.
Gibbs-energiat substraattia kohti laskettiin Gibbs-energioista reaktiota kohti jakamalla jälkimmäiset substraattien määrällä reaktiota kohti. Kunkin substraatin termodynaamiset kynnyspitoisuudet laskettiin asettamalla  arvioiduksi biologiseksi energiakvantiksi (BEQ) -10 kJ mol-1 ja ratkaisemalla yhtälö substraattikonsentraatiolle, kun kaikki muut edukti- ja tuotekonsentraatiot pysyivät samoina ja edellä esitetyllä tavalla.
arvioiduksi biologiseksi energiakvantiksi (BEQ) -10 kJ mol-1 ja ratkaisemalla yhtälö substraattikonsentraatiolle, kun kaikki muut edukti- ja tuotekonsentraatiot pysyivät samoina ja edellä esitetyllä tavalla.
Tulokset ja keskustelu
Termodynaaminen argumentti
Voidaksemme arvioida mikrobien aineenvaihduntareaktioiden (taulukko 1) energeettistä toteuttamiskelpoisuutta syvissä merenpohjan alapuolisissa sedimenteissä on hyödyllistä laskea konservatiivisesti niiden energiantuotto olosuhteissa, jotka muistuttavat in situ esiintyviä. Tässä jaksossa tarkastelen erilaisten asetogeneesireaktioiden energeettistä potentiaalia esiintyä syvissä merenpohjan alapuolisissa sedimenteissä tarkastelemalla (1) Gibbsin vapaan energian saantoja reaktiota kohti  (2) Gibbsin vapaan energian saantoja substraattia kohti
(2) Gibbsin vapaan energian saantoja substraattia kohti  (3) substraattien termodynaamisia kynnyskonsentraatioita, joiden avulla asetogeneesireaktiot ovat termodynaamisesti edullisia, (4) niiden reaktioiden in situ -energiantuotot, joiden eduktio- ja tuotepitoisuudet on kvantifioitu merenpohjan alapuolisissa sedimenteissä, ja (5) H2:tä sisältävien erilaisten lito- ja organotrofisten asetogeneesireaktioiden energiantuotot vetymolekyyliä (H2) kohti verrattuna kilpaileviin vetytrofisiin sulfaatin pelkistymis- ja metanogeneesireaktioihin.
(3) substraattien termodynaamisia kynnyskonsentraatioita, joiden avulla asetogeneesireaktiot ovat termodynaamisesti edullisia, (4) niiden reaktioiden in situ -energiantuotot, joiden eduktio- ja tuotepitoisuudet on kvantifioitu merenpohjan alapuolisissa sedimenteissä, ja (5) H2:tä sisältävien erilaisten lito- ja organotrofisten asetogeneesireaktioiden energiantuotot vetymolekyyliä (H2) kohti verrattuna kilpaileviin vetytrofisiin sulfaatin pelkistymis- ja metanogeneesireaktioihin.
Mitkä asetogeneesireaktiot ovat termodynaamisesti suotuisia?
Lasketut Gibbsin vapaat energiat osoittavat, että useimmat asetogeneesireaktiot ovat termodynaamisesti suotuisia syvissä merenpohjanalaisissa sedimenteissä – energiantuotot ylittävät BEQ-arvon  laajalla lämpötilojen, paineiden ja vetykonsentraatioiden vaihteluvälialueella (Taulukko 3). Korkeimmat energia-arvot
laajalla lämpötilojen, paineiden ja vetykonsentraatioiden vaihteluvälialueella (Taulukko 3). Korkeimmat energia-arvot  ovat hiilihydraateilla, pyruvaatilla, metyylikloridilla, metoksyloituneilla aromaattisilla yhdisteillä ja laktaatilla. Myös muut substraatit, kuten glykolaatti, oksalaatti, metanoli ja etanoli, tuottavat BEQ:n ylittäviä energiamääriä. Sitä vastoin klassinen autotrofinen (”homoasetogeeninen”) reaktio H2-CO2:sta ja reaktiot formiaatista ovat endergonisia 0,1 nM:n H2-pitoisuuksissa (taulukko 3) ja tuottavat energiaa vain 1 μM:n H2-pitoisuuksissa ja alhaisissa tai keskilämpötiloissa (taulukko 3). Energiaa tuottavien substraattien osalta, joita voidaan käyttää H2:n kanssa tai ilman H2:tä, eli hiilimonoksidin, laktaatin, metanolin ja syringaatin osalta reaktiot, joihin ei liity H2:tä, tuottavat enemmän energiaa 0,1 nM:n lämpötilassa kuin reaktiot, joihin liittyy H2:tä; hiilimonoksidin ja laktaatin tapauksessa tämä ero on ratkaiseva, koska reaktiot, joihin ei liity vetyä, tuottavat paljon energiaa, kun taas H2:n kanssa tapahtuvat reaktiot ovat endergonisia (taulukko 3). Kohdassa = 1 μM tämä muuttuu, eli joidenkin vedyn kanssa tapahtuvien reaktioiden energiantuotot ovat eksergonisia ja tuottavat enemmän energiaa kuin BEQ (taulukko 3); yhdessä tapauksessa (laktaatti, -1,9 °C) vapaan energian tuotot jopa ylittävät pelkän laktaatista tapahtuvan asetogeneesin tuotot matalissa ja keskilämpötiloissa (ks. myös Tulokset ja keskustelu taulukossa 4 seuraavassa jaksossa).
ovat hiilihydraateilla, pyruvaatilla, metyylikloridilla, metoksyloituneilla aromaattisilla yhdisteillä ja laktaatilla. Myös muut substraatit, kuten glykolaatti, oksalaatti, metanoli ja etanoli, tuottavat BEQ:n ylittäviä energiamääriä. Sitä vastoin klassinen autotrofinen (”homoasetogeeninen”) reaktio H2-CO2:sta ja reaktiot formiaatista ovat endergonisia 0,1 nM:n H2-pitoisuuksissa (taulukko 3) ja tuottavat energiaa vain 1 μM:n H2-pitoisuuksissa ja alhaisissa tai keskilämpötiloissa (taulukko 3). Energiaa tuottavien substraattien osalta, joita voidaan käyttää H2:n kanssa tai ilman H2:tä, eli hiilimonoksidin, laktaatin, metanolin ja syringaatin osalta reaktiot, joihin ei liity H2:tä, tuottavat enemmän energiaa 0,1 nM:n lämpötilassa kuin reaktiot, joihin liittyy H2:tä; hiilimonoksidin ja laktaatin tapauksessa tämä ero on ratkaiseva, koska reaktiot, joihin ei liity vetyä, tuottavat paljon energiaa, kun taas H2:n kanssa tapahtuvat reaktiot ovat endergonisia (taulukko 3). Kohdassa = 1 μM tämä muuttuu, eli joidenkin vedyn kanssa tapahtuvien reaktioiden energiantuotot ovat eksergonisia ja tuottavat enemmän energiaa kuin BEQ (taulukko 3); yhdessä tapauksessa (laktaatti, -1,9 °C) vapaan energian tuotot jopa ylittävät pelkän laktaatista tapahtuvan asetogeneesin tuotot matalissa ja keskilämpötiloissa (ks. myös Tulokset ja keskustelu taulukossa 4 seuraavassa jaksossa).
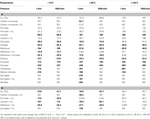
TAULUKKO 3. Eri asetogeneesireaktioiden Gibbsin vapaan energian tuotot laajalla lämpötila-, paine- ja H2-pitoisuusalueella.
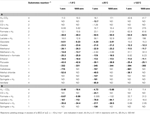
Taulukko 4. Eri asetogeneesireaktioiden Gibbsin vapaan energian tuotot. Gibbsin vapaan energian saannot substraattia kohti eri asetogeneesireaktioille laajalla alueella lämpötiloissa (°C), paineissa (atm) ja H2-pitoisuuksissa.
Lämpötilalla on lasketuilla alueilla paljon suurempi vaikutus asetogeneesireaktioiden vapaan energian saantoihin kuin paineella. Paineen muuttuessa 1:stä 1000 atm:iin suurin vaikutus on H2:n sisältävissä reaktioissa, jolloin laktaatti + H2:n muutos on suurin (5,2 kJ mol-1); kaikkien H2:tä sisältämättömien reaktioiden osalta ero  1:n ja 1000 atm:n paineen välillä on ≤2 kJ mol-1. Vertailun vuoksi voidaan todeta, että lämpötilan muutoksesta -1,9 °C:sta +122 °C:een johtuva ero
1:n ja 1000 atm:n paineen välillä on ≤2 kJ mol-1. Vertailun vuoksi voidaan todeta, että lämpötilan muutoksesta -1,9 °C:sta +122 °C:een johtuva ero  :ssa on aina suurempi kuin paineen muutoksesta 1:stä 1000 atm:iin johtuva ero
:ssa on aina suurempi kuin paineen muutoksesta 1:stä 1000 atm:iin johtuva ero  :ssa. H2-CO2:sta, formiaatti-H2:sta, laktaatti-H2:sta ja sellobioosista muodostuvissa reaktioissa
:ssa. H2-CO2:sta, formiaatti-H2:sta, laktaatti-H2:sta ja sellobioosista muodostuvissa reaktioissa  -arvojen muutos siirryttäessä -1,9 °C:sta +122 °C:een ylittää jopa reaktion 100 kJ mol-1.
-arvojen muutos siirryttäessä -1,9 °C:sta +122 °C:een ylittää jopa reaktion 100 kJ mol-1.
Lämpötilavaikutusten suuruus näyttää noudattavan trendejä. Ensinnäkin niistä kuudesta H2:ta tai formiaattia sisältävästä reaktiosta, joille lämpötilavaikutukset voitiin laskea, yksikään ei ole termodynaamisesti suotuisa 122 °C:ssa. Tämä sekä H2:n tai formiaatin sisältämien asetogeneesireaktioiden vapaan energian saantojen huomattava yleinen lasku lämpötilan vaikutuksesta viittaavat siihen, että nämä reaktiot ovat voimakkaasti valikoituneet pois lämpötiloissa, jotka lähestyvät elämän tunnettua ylärajaa – paitsi jos H2:n tai formiaatin pitoisuudet korkeissa lämpötiloissa ovat paljon korkeammat kuin tässä oletetaan. Toiseksi näyttää olevan systemaattinen ero siinä, miten lämpötila vaikuttaa energiantuottoon. Kaikissa C1-C3-substraateissa, lukuun ottamatta pelkän laktaatin reaktioita, vapaan energian saannot pienenevät lämpötilan kasvaessa; pelkän laktaatin reaktioissa ne kasvavat hieman lämpötilan kasvaessa. Sitä vastoin hiilihydraateista glukoosi (C6) ja sellobioosi (C12) muodostuvien asetogeneesireaktioiden vapaan energian tuotot kasvavat voimakkaasti lämpötilan vaikutuksesta. Perustuen näihin laskelmiin sisältyvien substraattien vähäiseen määrään ja siihen, että ainoat kaksi mukana olevaa suurta substraattia ovat hiilihydraatteja, on ennenaikaista väittää, että suurempia hiilisubstraatteja pitäisi kuluttaa mieluummin korkeissa lämpötiloissa. Kuitenkin se, että tiettyjen substraattien tai asetogeneesireaktioiden energiantuotto kasvaa, kun taas toisten laskee lämpötilan vaikutuksesta, viittaa siihen, että lämpötila vaikuttaa merkittävästi siihen, mitä substraatteja kulutetaan ja mitä energiantuottoa tuottavia reaktioita asetogeenit suorittavat syvän biosfäärin alueella.
Mitkä asetogeneesireaktiot ovat todennäköisimpiä tutkituissa olosuhteissa?
Aineenvaihdunnallisen reaktion Gibbsin vapaan energian tuotto ilmaisee sen, voiko kyseistä reaktiota käyttää energialähteenä tietyssä ympäristössä. Substraattirajoitusolosuhteissa, jollaiset ovat todennäköisiä syvän biosfäärin olosuhteissa, voidaan kuitenkin olettaa, että mikrobien kuluttajavalintoja – olettaen, että ne noudattavat optimaalista ravinnonhankintakäyttäytymistä – ohjaa energiantuotto substraattimoolia kohti – kunhan kokonaisreaktio tuottaa enemmän energiaa kuin BEQ. Niiden substraattien osalta, jotka voidaan metaboloida useiden reaktioiden kautta, joista jokainen tuottaa enemmän energiaa kuin BEQ, esim. metanoli -1,9 °C:ssa (taulukko 3), voitaisiin odottaa, että kuluttajat suosivat reaktioita, joiden energiantuotto substraattia kohti on suurin. Lisäksi on mahdollista, että vaikka organismit ovat energiavajeessa, ne suosivat tiettyjä substraatteja muiden sijaan substraattimolekyyliä kohti lasketun energiasisällön perusteella. Jotta voitaisiin tutkia mahdollisia seurauksia optimaalisesta ravinnonhankintakäyttäytymisestä, jota ohjaavat substraattikohtaiset energiantuotot, laskettiin jälkimmäiset (taulukko 4).
Vertailtaessa eri substraatteja substraattikohtaisella tasolla Gibbsin vapaan energian tuotot pysyvät korkeina  sellobioosille, glukoosille (kaikki T- ja P-arvot), laktaatille + H2:lle (vain = 1 μM:ssä, -1,9:ssä ja 25 °C:ssa; kaikki muuttumattomina taulukkoon 3 nähden), samoin kuin syringaattilääkkeelle (taulukko 4). Jos näitä substraatteja on saatavilla syvällä biosfäärissä ja jos asetogeenit tekevät valintoja substraattimolekyylikohtaisen energiamäärän perusteella, näitä substraatteja pitäisi käyttää mieluummin kuin muita tutkittuja substraatteja. Muita hyviä substraatteja voivat olla – energiantuoton laskevassa järjestyksessä – vanilaatti, metyylikloridi, laktaatti, pyruviitti, metanoli ja oksalaatti. Klassinen H2-CO2:sta lähtevä lito-autotrofinen reaktio sekä formiaatista ja glykolaatista lähtevät reaktiot ovat vähiten energiaa tuottavia substraattitasolla, ja siksi niitä kulutetaan vähiten todennäköisesti, jos energiasisältö substraattitasolla määrittäisi asetogeenisen substraatin valinnan.
sellobioosille, glukoosille (kaikki T- ja P-arvot), laktaatille + H2:lle (vain = 1 μM:ssä, -1,9:ssä ja 25 °C:ssa; kaikki muuttumattomina taulukkoon 3 nähden), samoin kuin syringaattilääkkeelle (taulukko 4). Jos näitä substraatteja on saatavilla syvällä biosfäärissä ja jos asetogeenit tekevät valintoja substraattimolekyylikohtaisen energiamäärän perusteella, näitä substraatteja pitäisi käyttää mieluummin kuin muita tutkittuja substraatteja. Muita hyviä substraatteja voivat olla – energiantuoton laskevassa järjestyksessä – vanilaatti, metyylikloridi, laktaatti, pyruviitti, metanoli ja oksalaatti. Klassinen H2-CO2:sta lähtevä lito-autotrofinen reaktio sekä formiaatista ja glykolaatista lähtevät reaktiot ovat vähiten energiaa tuottavia substraattitasolla, ja siksi niitä kulutetaan vähiten todennäköisesti, jos energiasisältö substraattitasolla määrittäisi asetogeenisen substraatin valinnan.
Vertailtaessa sellaisten asetogeneesin substraattien energiantuottoa, joiden osalta tunnetaan useita reaktioreittejä, ts, CO, formiaatti, laktaatti, metanoli ja siiringaatti, samat yleiset suuntaukset, jotka on nähty reaktiokohtaisella tasolla, pätevät edelleen formiaatin ja siiringaatin osalta – riippumatta H2-pitoisuuksista (taulukot 3 ja 4). Hiilimonoksidin, laktaatin ja metanolin osalta samat suuntaukset ilmenevät = 1 nM:ssa, mutta eivät = 1 μM:ssa. Huolimatta siitä, että kokonaisreaktio hiilimonoksidista tuottaa enemmän energiaa kuin reaktio hiilimonoksidista + H2 korkeilla (taulukko 4), asetogeneesi hiilimonoksidista + H2 tuottaa enemmän energiaa substraattitasolla (taulukko 4). Laktaatin osalta reaktiot laktaatti + H2 korkeassa H2:ssa tuottavat enemmän energiaa laktaattia kohti kuin reaktiot pelkällä laktaatilla – ei ainoastaan, kuten aiemmin, -1,9 °C:ssa (taulukko 3) vaan myös +25 °C:ssa (taulukko 4). Ja metanolin osalta – toisin kuin aiemmin (taulukko 3) – H2:n kanssa tehdyt reaktiot tuottavat enemmän energiaa metanolia kohti korkeassa H2:ssa ja matalassa lämpötilassa (-1,9-25 °C) kuin reaktiot pelkän metanolin kanssa (taulukko 4). Nämä tulokset vahvistavat, että on tärkeää laskea energiatuotot substraattikohtaisesti. Lisäksi ne korostavat lämpötilan todennäköistä merkitystä sen säätelyssä, mitkä asetogeneesireaktiot tapahtuvat paikan päällä – jopa silloin, kun näihin reaktioihin liittyy sama hiilisubstraatti.
Missä määrin mikrobit pystyvät havaitsemaan ja reagoimaan (vähäisiin) eroihin samoja substraatteja sisältävien eri reaktioiden energiantuotoissa ja siten optimoimaan ravinnonhankintakäyttäytymisensä substraattikohtaisten energiantuottojen suhteen, sitä tunnetaan huonosti. Mahdolliset edut selviytymiselle energiavajeisissa ympäristöissä ovat ilmeiset. Ei kuitenkaan tiedetä, osoittavatko mikrobit minkäänlaista substraattiselektiivisyyttä energiavajeisessa syvän biosfäärissä vai kuluttavatko ne pikemminkin umpimähkään mitä tahansa niiden ulottuville tulevaa metaboloituvaa substraattia. Yksittäisen solun käyttämä strategia ei välttämättä riipu pelkästään energiantuotosta substraattia kohti. Todennäköisesti myös muut tekijät, kuten substraatin vaihtumisnopeus, substraatin/metaboliitin kuljetuksen energiakustannukset solukalvon läpi ja energian tuotto kullekin entsyymille, joka on syntetisoitava ylimääräisen energiasubstraatin katabolisoimiseksi, vaikuttavat siihen, mitä substraatteja kulutetaan.
Mitkä asetogeneesireaktiot todennäköisesti tapahtuvat paikan päällä?
Tähän mennessä esitetyt laskennalliset vapaan energian saannot perustuvat rajoitettuun julkaistuun informaatioon, joka on saatu asetogeneesisubstraattien pitoisuuksista. Ainoastaan H2-, formiaatti- ja asetaattipitoisuuksia koskevat tiedot on julkaistu syvän merenpohjan alapuolisen biosfäärin osalta (Shipboard Scientific Party, 2003; Lorenson et al., 2006; Heuer et al., 2009; Lever et al., 2010; Expedition 329 Scientists, 2011); muiden substraattien pitoisuuksia on jouduttu arvioimaan likimääräisesti pinnallisista merisedimenteistä saatujen tietojen perusteella (Meyer-Reil, 1978; Sørensen et al., 1981; King ym, 1983; Smith ja Oremland, 1983; Parkes et al., 1989; Martens, 1990; Hoehler et al., 2001; Dhillon et al., 2005; Finke et al., 2006; King, 2007), makean veden sedimenteistä (King et al., 1982; Lovley ja Goodwin, 1988; Chidhaisong et al., 1999; Keppler et al., 2000), merivesipatsaat (Edenborn ja Litchfield, 1987; Ballschmiter, 2003) ja maanpäällinen syvä biosfääri (Chapelle ja Bradley, 2007). Koska H2:n, formiaatin ja asetaatin pitoisuudet syvän biosfäärissä ovat päällekkäisiä näiden lajien pitoisuuksien kanssa muissa sedimenttiympäristöissä, vaikuttaa realistiselta approksimoida konservatiivisesti muiden substraattien, kuten glukoosin tai oksalaatin, merenpohjan alapuolisia pitoisuuksia muissa sedimenttiympäristöissä mitattujen alhaisimpien arvojen avulla. Tämä ei kuitenkaan voi peittää sitä tosiasiaa, että todellisia pitoisuuksia ei ole mitattu. Vaihtoehto energiantuoton laskemiselle oletetuilla substraattipitoisuuksilla on siis laskea kynnyspitoisuudet, joita asetogeenit tarvitsevat saavuttaakseen BEQ:n jostakin substraatista. Tämä voidaan tehdä konservatiivisesti, koska useimpien muiden reaktiotuotteiden ja -eduktien, eli H+, H2O, HCO3-, asetaatin, H2, Cl-, pitoisuudet ovat hyvin rajoitettuja syvän biosfäärin osalta ja/tai ne on asetettu konservatiivisiin arvoihin (ks. Materiaalit ja menetelmät). Termodynaamiset kynnyspitoisuudet laskettiin, kuten aiemmin, arvoille = 0,1 nM ja 1 μM (taulukko 5).
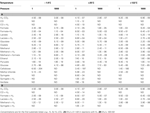
TAULUKKO 5. Laajalle levinneiden asetogeneesireaktioiden termodynaamiset kynnyskonsentraatiot laajalla lämpötila- ja painealueella olettaen, että biologinen energiakvantti on 
Ensimmäisellä silmäyksellä on selvää, että kynnyskonsentraatioiden käsite on merkityksellinen vain osalle asetogeenisistä substraateista. Glukoosin, sellobioosin, syringaatin sekä syringaatin + H2:n osalta 1 μM:n kynnyspitoisuudet ovat pienempiä kuin yksi molekyyli substraattia litrassa. Itse asiassa glukoosin ja sellobioosin termodynaamiset kynnyspitoisuudet ovat jopa suuruusluokkia pienempiä kuin yksi molekyyli maapallon koko valtameren tilavuudessa (taulukko 5)! Hiilimonoksidin, laktaatin, pyruvaatin, metyylikloridin, syringaatin + H2:n matalilla ja laktaatin + H2:n korkeilla lämpötiloilla BEQ:n saavuttaminen ei myöskään näytä olevan realistinen este. Näissä reaktioissa kynnyspitoisuudet ovat korkeintaan alhaisella pikomolaarisella alueella – ja sen myötä ~2-3 suuruusluokkaa alempana kuin mikrobien tiedetään vetävän rajoittavia aineenvaihduntatuotteiden pitoisuuksia alaspäin (esim. Fuhrman ja Ferguson, 1986; Hoehler et al., 2001; Stolper et al., 2010). Jos syvissä pohjasedimenteissä aiemmin mitatut orgaanisten substraattien pitoisuudet, jotka ovat suurimmaksi osaksi olleet (0,1 μM (esim. Shipboard Scientific Party, 2003; Mitterer, 2006; Heuer et al., 2009; Lever et al., 2010), ovat hyvä vertailukohta, jäämme samoihin johtopäätöksiin kuin aiemmin (taulukko 4), ts, että useimmat asetogeneesireaktiot tuottavat BEQ:n ylittäviä energiantuottoja jopa substraattipitoisuuksilla, jotka ovat matalia syvän biosfäärin kannalta.
Mutta ehkä vielä mielenkiintoisempaa on se, että tarkastelemalla niitä substraatteja, joiden aiemmin katsottiin olevan vähemmän todennäköisiä asetogeenien käyttämiä (taulukoiden 3 ja 4 perusteella), voidaan päätellä, että jopa formiaatti ja H2-CO2 ovat potentiaalisia asetogeenien substraatteja joissakin maanalaisissa ympäristöissä. Formiaattipitoisuuksia alhaisista mikromolaarisista arvoista kymmeniin mikromolaareihin (taulukko 5) on dokumentoitu kohteissa, jotka vaihtelevat orgaanisesti rikkaista (ODP-paikka 1230) erittäin oligotrofisiin (ODP-paikka 1231; Shipboard Scientific Party, 2003). Mitattuihin formiaattipitoisuuksiin perustuvat termodynaamiset laskelmat viittaavat siihen, että formiaatti voisi olla asetogeneesin substraatti tietyissä syvyyksissä Juan de Fuca -harjun sivustan maanalaisissa sedimenteissä (Lever et al., 2010). Syvän biosfäärin vetypitoisuuksien tarkkaan kvantifiointiin liittyy epävarmuutta, sillä kahden eri menetelmän tulokset eroavat toisistaan jopa kaksi suuruusluokkaa (Lin et al., 2011). Käytetystä menetelmästä riippumatta yli 10 nM:n mitatut pitoisuudet eivät kuitenkaan ole harvinaisia (Shipboard Scientific Party, 2003; Lorenson ym., 2006; Expedition 329 Scientists, 2011; Lin ym, 2011), ja ne viittaavat siihen, että jopa asetogeneesi H2-CO2:sta on mahdollista joissakin paikoissa, joskaan ei laajalle levinnyt.
Mitattuihin pitoisuuksiin perustuvat asetogeneesireaktioiden in situ -energiantuotot
Tietääkseni ainoat merenpohjan alapuoliset sedimenttinäytteet, joista on kvantifioitu kaikki asetogeneesireaktioiden edukti- ja tuotekonsentraatiot, ovat ODP-jalkaantumislohkareen 201 näytteistä (Shipboard Scientific Party, 2003). Seitsemän näytteenottopaikkaa, joista näytteet otettiin tämän tutkimusretken aikana, vaihtelevat orgaanisesti rikkaista oligotrofisiin, ja ne kattavat energiaolosuhteiden vaihteluvälin, joka todennäköisesti kattaa suurimman osan maapallon anoksisista merenpohjanalaisista sedimenteistä. Näistä näytteistä mitattiin formiaatin ja vedyn (eikä muiden asetogeenisten substraattien) pitoisuudet rinnakkain asetaatin, DIC:n (bikarbonaatin korvike) ja pH:n pitoisuuksien kanssa, mikä mahdollisti asetogeneesireaktioiden in situ -energiantuoton laskemisen H2-CO2:sta, formiaatista ja formiaatista + H2:sta (kuva 1).

Kuva 1. Asetogeneesireaktioiden energiantuottojen laskeminen. Asetogeneesireaktioihin liittyvien energiantuottojen syvyysprofiilit (A) H2-CO2:sta, (B) formiaatista ja (C) formiaatti-H2:sta ODP-paikoilla 1225-31. Kaikki laskelmat perustuvat mittauksiin sedimenttisydämistä, jotka kerättiin ODP Leg 201:n aikana (Shipboard Scientific Party, 2003).
Kolmen reaktion lasketut vapaan energian tuotot osoittavat selviä trendejä: H2-CO2:sta peräisin olevat reaktiot ovat enimmäkseen endergonisia, ja ne tuottavat vain muutamassa matalassa syvyydessä ODP:n havaintopaikalla 1231 BEQ-arvon ylittävää energiaa (kuva 1A). Formaatin reaktiot ovat eksergonisia, ja niiden energiantuotto on BEQ-arvon tuntumassa tai ylittää sen kaikilla näytteenottopaikoilla ja syvyyksillä (kuva 1B). Formaatti + H2 -reaktiot ovat suurimmaksi osaksi hieman eksergonisia, mutta ylittävät BEQ:n vain muutamassa syvyydessä ODP-paikoilla 1225, 1230 ja 1231 (Kuva 1C).
Tämän tuloksen perusteella voidaan olettaa, että asetogeneesi formaatista on mahdollista laajalla alueella merenpohjan alapuolisissa elinympäristöissä, kun taas H2-CO2:n tai formaatti + H2:n sisältämät asetogeneesireaktiot ovat epätodennäköisiä. Huokosveden H2-pitoisuuksien kvantifiointiin liittyvä suuri epävarmuus on kuitenkin otettava huomioon. ODP Leg 201:n aikana mitatut H2-pitoisuudet saatiin inkubaatiomenetelmällä, jossa oletetaan, että huokosveden vedyn ja huokosnesteeseen liuenneen vedyn välillä vallitsee tasapaino inkubaatioajan jälkeen (Lovley ja Goodwin, 1988; Hoehler et al., 1998). Kun inkubaatiomenetelmää verrataan uuteen, uuttoon perustuvaan menetelmään samoilla näytteillä, konsentraatiomittaukset ovat johdonmukaisesti yhdestä kahteen suuruusluokkaa pienempiä (Lin et al., 2011). Jos H2:n in situ -pitoisuudet Leg 201 -näytteenoton aikana otetuissa sedimenteissä ovat kertaluokkaa korkeammat kuin aiemmin mitatut pitoisuudet, tämä alentaisi H2-CO2:sta tapahtuvan asetogeneesin Gt′-arvoa ~22 kJ mol-1. Tällöin lähes puolella näytteistä olisi BEQ:n ylittävät energia-arvot (kuva 1A). Jos in situ -pitoisuudet ovat kaksi kertaluokkaa korkeammat, tämä alentaa H2-CO2:sta tapahtuvan asetogeneesin Δ Gt′:tä H2-CO2:sta tapahtuvan asetogeneesin osalta vielä ~22 kJ mol-1:llä – yhteensä ~44 kJ mol-1:llä reaktiota verrattuna mitattuihin H2-tietoihin. Tällöin H2-CO2:sta tapahtuvan asetogeneesin energiantuotto ylittäisi BEQ:n suurimmassa osassa näytteistä, jotka kerättiin osuudella 201.
H2:ta sisältävien asetogeneesireaktioiden energiantuotot verrattuna kilpaileviin sulfaattipelkistys- ja metanogeneesireaktioihin
Pääasiallinen empiirinen tuki redox-vyöhykejaon käsitteelle saadaan isotooppimerkkiainetutkimuksista ja mittauksista, joissa mitattiin vetypitoisuuksia sulfaattipelkistyvissä ja metanogeenisissä makeanveden ja rannikon pintasedimenteissä (esim, Cappenberg, 1974; Capone ja Kiene, 1988; Lovley ja Goodwin, 1988; Hoehler et al., 1998; Heimann et al., 2010). Asetogeneesiin on kiinnitetty vähemmän huomiota sedimenteissä, koska prosessia on vaikea havaita; lopputuotteena asetaatti on myös sulfaattipelkistäjien ja metaanigeenien keskeinen substraatti, ja nopean liikevaihdon vuoksi asetaattia ei tyypillisesti kerry suuriin pitoisuuksiin – toisin kuin sulfaattipelkistyksen ja metaanogeneesin lopputuotteita, sulfidia ja metaania. Lisäksi asetogeneesi rinnastetaan usein H2-CO2:sta muodostuvaan ”homoasetogeeniseen” reaktioon, joka on termodynaamisesti epäedullinen H2-pitoisuuksien termodynaamisen kontrollin alaisena sulfaattipelkistävissä tai metanogeenisissa sedimenteissä. Vain harvoin on otettu huomioon H2:n sisältävien organotrofisten asetogeneesireaktioiden energiantuotto (Liu ja Suflita, 1993; Lever et al., 2010). Tässä vertailen erilaisten H2:n sisältävien asetogeneesireaktioiden energiantuottoja laajalle levinneiden hydrogenotrofisten sulfaatin pelkistys- ja metanogeneesireaktioiden energiantuottoihin laajalla H2-pitoisuusalueella (kuva 2).
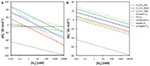
KUVA 2. Organotrofisten sulfaatin pelkistysreaktioiden energiantuotot. H2-pitoisuuksien ja energiantuottojen välinen suhde sulfaatin pelkistymisessä, metanogeneesissä ja asetogeneesissä H2-CO2:sta sekä asetogeneesissä formiaatti-H2:sta, CO-H2:sta, metanoli-H2:sta, laktaatti-H2:sta ja siiraatti-H2:sta. (A) energiantuotto reaktiota kohti  musta viiva osoittaa BEQ:n, (B) energiantuotto substraattia kohti
musta viiva osoittaa BEQ:n, (B) energiantuotto substraattia kohti  Kaikki laskelmat tehtiin olettaen vakiolämpötila ja -paine ja käyttäen educt- ja tuotekonsentraatioita materiaalien ja menetelmien mukaisesti, lukuun ottamatta .
Kaikki laskelmat tehtiin olettaen vakiolämpötila ja -paine ja käyttäen educt- ja tuotekonsentraatioita materiaalien ja menetelmien mukaisesti, lukuun ottamatta .
Ensi silmäyksellä on ilmeistä, että asetogeneesi H2-CO2:sta on termodynaamisesti epäedullisempi kuin sulfaatti- tai metanogeneesireaktiot H2-CO2:sta riippumatta H2:n konsentraatioista (kuva 2A). Laskelmissa käytetyissä olosuhteissa sulfaatin pelkistäjät voivat täyttää BEQ:n aina ~0,6 nM:n H2-pitoisuuksiin asti, metanogeenit 11 nM:iin asti, kun taas asetogeenit vaativat 410 nM:n H2-pitoisuuden. Asetogeneesi formiaatista + H2:sta on myös epätodennäköistä, koska sen energiantuotto on BEQ:n alapuolella, elleivät H2-pitoisuudet ole mikromolaarisella alueella. Sulfaatin pelkistymistä tai metanogeneesiä energeettisesti edullisempi on kuitenkin siiraatin ja H2:n muodostama asetogeeninen reaktio, joka jopa 0,01 nM:n H2-pitoisuuksilla tuottaa korkean energiantuoton (~-90 kJ mol-1) – pitoisuudet, joilla sekä sulfaatin pelkistyminen että metanogeneesi ovat endergonisia. Lisäksi, vaikka sulfaatin pelkistyminen H2-CO2:sta on kaiken kaikkiaan toiseksi eniten energiaa tuottava reaktio, asetogeneesireaktiot CO:sta, metanolista ja laktaatista tuottavat enemmän energiaa kuin vetytrofinen metanogeneesi H2-pitoisuuksissa, jotka ovat tyypillisellä alueella, joka on mitattu syvissä merenpohjanalaisissa sedimenteissä.
Kun energiantuottoa tarkastellaan vety-molekyylitasolla, tulokset ovat vieläkin vaikuttavampia. Asetogeneesireaktiot syringaatista + H2, metanolista + H2 ja CO + H2 tuottavat kaikki enemmän energiaa H2-molekyyliä kohti kuin sulfaatin pelkistyminen H2-CO2:sta (kuva 2B). Laktaatti + H2 -reaktio tuottaa vähemmän energiaa kuin hydrotrofinen sulfaatin pelkistyminen, mutta hieman enemmän kuin hydrotrofinen metanogeneesi, kun taas asetogeneesireaktiot formiaatti + H2:sta ja H2-CO2:sta tuottavat vähiten energiaa H2-molekyyliä kohti ja ovat endergonisia lukuun ottamatta mikromolaarisia H2-konsentraatioita (kuva 2B).
Voidaan väittää, että H2:n sisältämät hiilihydraatti- ja organotrofisen asetogeneesin H2-vaikutuksella toteutettavat asetogeneesin reaktiot ovat epätodennäköisiä merisedimentissä. Loppujen lopuksi reaktiot, joissa käytetään samaa hiilisubstraattia ilman H2:ta, tuottavat enemmän energiaa paitsi silloin, kun korkeat H2-pitoisuudet osuvat samaan aikaan matalan lämpötilan kanssa (taulukot 3 ja 4) – ehto, joka on perinteisesti havaittu vain vuodenaikojen aiheuttamien väliaikaisten epätasapainotilojen aikana matalissa sedimenteissä (Hoehler et al., 1999) ja joka on ehkä epätodennäköinen vuodenaikojen aikana stabiileissa maanalaisissa sedimenteissä. Jos uudella uuttoon perustuvalla menetelmällä (Lin et al., 2011) saadut korkeammat mittaustulokset osoittautuvat tarkoiksi, karboksydo- ja organotrofiset asetogeneesireaktiot H2:n kanssa voivat olla kilpailukykyisiä, ellei jopa energeettisesti edullisempia kuin karboksydo- ja organotrofiset reaktiot ilman H2:tä pääasiassa kylmässä syvän biosfäärissä. H2:n kanssa tapahtuvien organotrofisten reaktioiden merkitystä tukevat todisteet ovat peräisin Atlantin rannikkotasangon maanalaisista sedimenteistä (Liu ja Suflita, 1993). Näistä sedimenteistä peräisin oleva asetogeeninen isolaatti osoitti kasvua ainoastaan siiringaatin O-demetoksylaation avulla H2-CO2-ilmakehässä, kun taas siiringaatilla ei havaittu kasvua N2-CO2- tai N2-ilmakehässä. Metabolisoimalla siiringaattia H2:n avulla tämä organismi pystyi kilpailemaan H2:n suhteen vetytrofisten metanogeenien kanssa sedimentin alkuperäisessä rikastuksessa.
Kyky saada energiaa siiringaatin tai muiden ligniinimonomeerien demetoksylaatiosta on laajalti levinnyt asetogeenien keskuudessa, mutta ei sulfaatin pelkistäjien tai metanogeenien keskuudessa, mikä viittaa siihen, että aromaattisten renkaiden metoksyyliryhmät saattavat edustaa substraatteja, jotka eivät ole keskenään kilpailevia (Lever ym., 2010). Sama ei päde muihin substraatteihin, laktaattiin, CO:hon ja metanoliin (kuva 2). Laktaatti toimii kasvusubstraattina paitsi monille asetogeeneille (Lever et al., 2010) myös monille sulfaatin pelkistäjille (Rabus et al., 2006), joiden voidaan olettaa saavan suuremman energiantuoton kilpailevista sulfaatin pelkistysreaktioista. Vastaavasti, vaikka CO ja metanoli ovatkin vähemmän käytettyjä kasvusubstraatteina kuin asetogeenien keskuudessa (Lever et al., 2010), CO ja metanoli voivat myös toimia energiasubstraatteina tietyille sulfaattipelkistäjille (katsaus Mörsdorf et al., 1992) sekä useille metanogeeneille (katsaus Whitman et al., 2006, ja Ferry, 2010). Sekä sulfaattipelkistäjien että metanogeenien voidaan olettaa saavan enemmän energiaa reaktioista, joihin liittyy CO tai metanoli, kuin asetogeenien. Näin ollen todisteet, jotka viittaavat asetogeneesin tärkeään rooliin CO:n ja metanolin kiertokulussa meri- ja makean veden sedimenteissä, saattavat olla yllättäviä (King, 2007; Jiang et al., 2010). Seuraavassa jaksossa väitän, että asetogeenien kyky käyttää monenlaisia substraatteja on elinkelpoinen selviytymisstrategia energiarajoituksen olosuhteissa – huolimatta alhaisemmasta energiantuotosta substraattia kohti.
Asetogeenien aineenvaihduntastrategiat
Asetogeenien silmiinpistävä piirre aineenvaihduntakiltana on laajalle levinnyt kyky käyttää energiasubstraatteina suurta määrää ja laajaa moninaisuutta hiiliyhdisteitä. Yli puolet viljellyistä kannoista testaa positiivisesti kasvua H2/CO2:lla, hiilimonoksidilla, formiaatilla, metanolilla, etanolilla, muilla alifaattisilla yhdisteillä, kuten laktaatilla, ja metoksyloiduilla aromaattisilla yhdisteillä (Lever et al., 2010). Muita laajalti käytettyjä kasvualustoja ovat hiilihydraatit, muut lyhytketjuiset rasvahapot ja alkoholit, metoksyloidut alifaattiset yhdisteet, betaiinit, aminohapot ja aldehydit (Drake et al., 2006). Jotkut kannat käyttävät jopa monimutkaisia orgaanisia polymeerejä, kuten selluloosaa tai karboksimetyyliselluloosaa (Wolin ja Miller, 1994; Karita et al., 2003; Wolin et al., 2003). Koska energiasubstraattien määrä, joilla kasvua tyypillisesti testataan, on rajallinen, asetogeenien substraattivalikoima voi ylittää huomattavasti nykyisin tunnetun spektrin. Kaikki ympäristöstä löytyvien yhdisteiden metyyli- tai metoksyyliryhmät edustavat potentiaalisia energiasubstraatteja, jotka termodynaamisesti suotuisissa olosuhteissa voidaan yhdistää hiilidioksidin kanssa asetaatiksi.
Ottaen huomioon asetogeenien hämmästyttävän metabolisen monipuolisuuden vaikuttaa uskottavalta, että tästä johtuva muovautuvuus substraattien käytön suhteen on osa strategiaa, joka mahdollistaa asetogeenien rinnakkaiselon sulfaatin pelkistäjien ja metanogeenien kanssa. Seuraavissa jaksoissa tarkastelen kahta hypoteesia, joilla pyritään selittämään laajan metabolisen spektrin edut. Ensimmäinen hypoteesi on, että asetogeenit voivat elää rinnakkain sulfaattipelkistimien ja metanogeenien kanssa, koska ne ovat eriytyneet substraatin käytön suhteen. Toisin sanoen asetogeenit voivat välttää kilpailua kuluttamalla substraatteja, joita sulfaattipelkistäjät tai metanogeenit eivät käytä. Toisen hypoteesin mukaan kyky yhdistää monenlaisista aineenvaihduntareaktioista saatava energia mahdollistaa rinnakkaiselon huolimatta siitä, että jaetuista substraateista saatava energia on vähäisempää. Nämä kaksi hypoteesia eivät ole ristiriidassa keskenään, vaan niitä olisi pikemminkin pidettävä generalistisen aineenvaihduntastrategian kahtena toisiaan täydentävänä etuna.
Niche-erilaistuminen substraatin käytön perusteella
Kokonaisuutena tarkasteltuna sulfaattipelkistäjät, vaikkakaan eivät samassa laajuudessa kuin asetogeenit, pystyvät myös hyödyntämään suurta määrää erilaisia substraatteja. Tarkemmin tarkasteltuna näyttää kuitenkin siltä, että vain kyky käyttää H2:ta, lyhytketjuisia rasvahappoja ja etanolia on todella laajalle levinnyt eri sukujen välillä (Rabus ym., 2006). Yleiset asetogeeniset substraatit, kuten metanoli, glukoosi, fruktoosi, hiilimonoksidi ja metoksyloidut ligniinimonomeerit, eivät ole substraatteja suurimmalle osalle sulfaatin pelkistäjistä (Mörsdorf et al., 1992; Rabus et al., 2006). Termodynaaminen etu, joka johtuu sulfaatin pelkistymisen suuremmasta energiantuotosta verrattuna asetogeneesiin, toteutuu siis vain osalla asetogeenisistä substraateista, joita myös sulfaatin pelkistäjät hyödyntävät. Merkkiainekokeet, jotka osoittavat H2:n ja lyhytketjuisten rasvahappojen olevan tärkeimmät elektroninluovuttajat, joita sulfaatinpelkistäjät käyttävät suistoalueiden ja merisedimenttien sedimenteissä, tukevat tätä päätelmää (Sørensen ym., 1981; Parkes ym., 1989). Vastaavasti kokeellinen näyttö osoittaa asetogeenien olevan keskeisiä CO:n ja metoksyyliryhmien kuluttajia sulfaatteja pelkistävissä merisedimenteissä (Küsel et al., 1999; King, 2007) viittaa siihen, että huolimatta substraattien päällekkäisyyksistä asetogeenit ja sulfaattipelkistäjät harjoittavat eräänlaista kapeikkojen eriytymistä, jossa kumpikin ryhmä suosii eri energiasubstraatteja siellä, missä ne elävät rinnakkain.
Metanogeenien substraattivalikoima on metabolisesti huomattavasti vähemmän monipuolinen kuin asetogeenien tai sulfaatin pelkistäjien, ja se rajoittuu (1) hiilidioksidin pelkistämiseen (H2/CO2, formiaatti, muutamat käyttävät hiilimonoksidia tai alkoholeja), (2) asetaatin disproportionointiin ja (3) C1-yhdisteiden demetylointiin (metanoli, metyylisulfidit ja metyyliamiinit). Yhtä sukua (Methanosarcina) lukuun ottamatta useimmat metanogeenit ovat substraattispesialisteja ja pystyvät kasvamaan vain yhdellä näistä kolmesta substraattiryhmästä (Whitman et al., 2006). Näin ollen mahdollinen kilpailu asetogeenien ja metanogeenien välillä substraateista rajoittuu pieneen osajoukkoon asetogeenisiä substraatteja.
Niche-differentiaatio, joka johtaa erilaisten energiasubstraattien käyttöön siellä, missä ryhmät esiintyvät rinnakkain, voi näin ollen selittää sen, miksi sulfaatin pelkistäjät ja metanogeenit eivät sulje kilpailullisesti pois asetogeenejä anoksisissa sedimenteissä. Miksi sulfaattipelkistäjät eivät ole sopeutuneet käyttämään kaikkia asetogeenien käyttämiä substraatteja? Ja kun otetaan huomioon, että sekä asetogeenit että metanogeenit käyttävät reduktiivista asetyyli-CoA-reittiä energiantuotantoon ja/tai C:n sitomiseen ja että niiden substraattien käyttö on päällekkäistä (Drake ym., 2006; Whitman ym., 2006), miksi nämä kaksi ryhmää eroavat toisistaan niin paljon metabolisen monipuolisuutensa suhteen? Lopulliset evolutiiviset selitykset ovat edelleen spekulaatioiden varassa. Läheisemmällä tasolla erot energiasubstraattien energiantuotossa ja liikevaihtonopeuksissa ovat saattaneet vaikuttaa aineenvaihduntastrategioiden eroihin.
Yleisimmät sulfaattireduktioiden ja metanogeenien käyttämät substraatit, eli H2 ja asetaatti, niin sanotut orgaanisen hiilen hajoamisen keskeiset välituotteet (esim. Valentine, 2001; Dolfing ym., 2008), ovat oletettavasti elektroninluovuttajia, joilla on korkeimmat liikevaihtonopeudet anoksisissa sedimenteissä. Myös muilla lyhytketjuisilla rasvahapoilla, jotka ovat tärkeitä energiasubstraatteja sulfaatin pelkistäjille, tiedetään olevan suuri vaihtuvuus (Sørensen et al., 1981; Parkes et al., 1989); jopa metanogeenien käyttämillä metyloituneilla yhdisteillä, esim, metanolia, metyyliamiineja ja metyylisulfideja, tiedetään vaihtuvan nopeasti tietyissä ympäristöissä (esim. Zhilina ja Zavarzin, 1990; Mitterer et al., 2001; Jiang et al., 2010; Lin et al., 2010). Substraatit, joilla on korkea kiertonopeus, ovat tyypillisesti pieniä, koska ne ovat peräisin useista yksittäisistä harvinaisemmista, suuremmista lähdemolekyyleistä; niissä on myös usein vähemmän energiaa kuin suuremmissa orgaanisissa molekyyleissä, joilla on alhaisempi kiertonopeus (taulukot 3 ja 4). Miksi tietyt ryhmät saattavat käyttää substraatteja, joiden liikevaihtonopeus on suuri mutta energiantuotto pieni, kun taas toiset käyttävät substraatteja, joiden liikevaihtonopeus on pieni mutta energiantuotto suuri? Osa vastauksesta saattaa piillä solujen yleismaailmallisessa vaatimuksessa tyydyttää ylläpitoenergiavaatimukset.
Ylläpitoenergiavaatimusten tyydyttäminen on erityisen haastavaa syvissä maanalaisissa sedimenteissä, koska ne ovat tyypillisesti olleet tuhansista miljooniin vuosiin eristyksissä tuoreen orgaanisen aineksen saannista. Täällä suurin osa soluista on todennäköisesti jatkuvassa nälkäkuolleisuuden tilassa (D’Hondt et al., 2004; Jørgensen et al., 2006), ja nälkäkuolema voi olla jopa ensisijainen kuolleisuuden lähde. Kemostaattikokeiden perusteella on vahvistettu seuraava ylläpitoenergian ja lämpötilan välinen suhde (Tijhuis ym., 1993; Harder, 1997):

jossa ME on ylläpitoenergia (kJ (g kuivamassaa)-1 d-1), A vakio , Ea aktivaatioenergia (69,4 kJ mol-1 K-1), R yleiskaasuvakio (0,008314 kJ mol-1 K-1) ja T lämpötila (K). Vakion A arvo laskettiin energian syöttönopeudesta, jolla mikrobisolujen kasvu ja monistuminen pysähtyy kemostaattikokeissa (Tijhuis et al., 1993). Sittemmin on arvioitu, että solujen ylläpitoon tarvittava todellinen kynnysenergia on kolme kertaluokkaa alhaisempi kuin kasvun/replikaation kynnysarvo (Price ja Sowers, 2004; Biddle et al., 2006). Siksi käytän A:n arvoa 4,99 × 109 kJ (g kuivamassaa)-1 d-1 kaikissa ME:tä koskevissa laskelmissa. Tämän A:n arvon perusteella voidaan laskea ylläpitoenergiaksi 1,26 kJ (g kuivamassaa)-1 vuosi-1 vakiolämpötilassa. Tijhuis et al. (1993) ehdottavat, että 26 g solun kuivamassaa sisältää keskimäärin 12 g soluhiiltä. Yhdistettynä julkaistuun arvioon 10 fg C solua kohti sedimentissä elävien mikrobien osalta (Whitman et al., 1998), voidaan laskea solukohtaiseksi ylläpitoenergiaksi, MEcell, 2,74 × 10-14 kJ solu-1 vuosi-1 vakiolämpötilassa.
Suhde MEcell:n, substraattikohtaisen Gibbsin vapaan energian saannon,  (kJ mol-1), ja solukohtaisen substraatin vaihtumisnopeuden, kcell (mol solu-1 vuosi-1), jota solu tarvitsee täyttääkseen ylläpitoenergiantarpeen, välillä voidaan ilmaista seuraavasti:
(kJ mol-1), ja solukohtaisen substraatin vaihtumisnopeuden, kcell (mol solu-1 vuosi-1), jota solu tarvitsee täyttääkseen ylläpitoenergiantarpeen, välillä voidaan ilmaista seuraavasti:
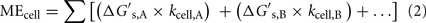
missä A:lla ja B:llä merkitään substraatteja A:n ja B:llä. Jos solut kuluttavat vain yhtä substraattia, tämä lauseke yksinkertaistuu, joten yhtälö voidaan ratkaista kcell:lle, jos MEcell ja  ovat tiedossa:
ovat tiedossa:

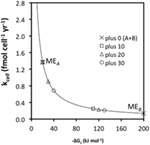
Kcell:n ja  välinen suhde on hyperbolinen (kuva 3A). Tällä on vaikutuksia mikrobien aineenvaihduntastrategioihin: mikrobit voivat esimerkiksi täyttää ylläpidon energiantarpeet kuluttamalla substraatteja, joiden energiantuotto on alhainen, kunhan liikevaihtonopeudet ovat korkeat ja BEQ täyttyy (MEA); vaihtoehtoisesti mikrobit voivat täyttää ME-tarpeet alhaisilla liikevaihtonopeuksilla, kunhan energiantuotto substraattia kohti on korkea (MEB).
välinen suhde on hyperbolinen (kuva 3A). Tällä on vaikutuksia mikrobien aineenvaihduntastrategioihin: mikrobit voivat esimerkiksi täyttää ylläpidon energiantarpeet kuluttamalla substraatteja, joiden energiantuotto on alhainen, kunhan liikevaihtonopeudet ovat korkeat ja BEQ täyttyy (MEA); vaihtoehtoisesti mikrobit voivat täyttää ME-tarpeet alhaisilla liikevaihtonopeuksilla, kunhan energiantuotto substraattia kohti on korkea (MEB).
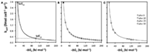
KUVIO3. Substraattikohtaisen energiantuoton  ja liikevaihtonopeuden (kcell) väliset suhteet. (A) Hyperbolinen suhde
ja liikevaihtonopeuden (kcell) väliset suhteet. (A) Hyperbolinen suhde  :n ja kcell:n välillä olettaen MEcell = 2,74 × 10- 14 kJ cell -1 vuosi -1. MEA ja MEB osoittavat kaksi erilaista strategiaa MEcellin saavuttamiseksi, MEA substraatille, jonka energiantuotto on alhainen
:n ja kcell:n välillä olettaen MEcell = 2,74 × 10- 14 kJ cell -1 vuosi -1. MEA ja MEB osoittavat kaksi erilaista strategiaa MEcellin saavuttamiseksi, MEA substraatille, jonka energiantuotto on alhainen  ja kcell korkea, ja MEB substraatille, jonka energiantuotto on korkea
ja kcell korkea, ja MEB substraatille, jonka energiantuotto on korkea  ja kcell alhainen. (B) Havainnollistus substraattikohtaisten energiantuottojen 10 kJ mol -1 lisäysten vaikutuksesta MEcellin saavuttamiseen vaadittavaan liikevaihtonopeuteen. (C) MEA:n ja MEB:n (”plus 0”) liikevaihtonopeudet verrattuna kilpaileviin reaktioihin ”plus 10”, ”plus 20” ja ”plus 30”, joissa on 10, 20 ja 30 kJ mol -1 korkeammat energiatuotot substraattia kohti.
ja kcell alhainen. (B) Havainnollistus substraattikohtaisten energiantuottojen 10 kJ mol -1 lisäysten vaikutuksesta MEcellin saavuttamiseen vaadittavaan liikevaihtonopeuteen. (C) MEA:n ja MEB:n (”plus 0”) liikevaihtonopeudet verrattuna kilpaileviin reaktioihin ”plus 10”, ”plus 20” ja ”plus 30”, joissa on 10, 20 ja 30 kJ mol -1 korkeammat energiatuotot substraattia kohti.
Toinen seuraus on, että pienet muutokset  vaikuttavat suuresti MEcellin täyttämiseen vaadittavaan liikevaihtonopeuteen, jos energiantuotto substraattia kohti on pieni (tässä <50 kJ mol-1), mutta ei, jos se on suuri (tässä ≥100 kJ mol-1; kuva 3B). Jos
vaikuttavat suuresti MEcellin täyttämiseen vaadittavaan liikevaihtonopeuteen, jos energiantuotto substraattia kohti on pieni (tässä <50 kJ mol-1), mutta ei, jos se on suuri (tässä ≥100 kJ mol-1; kuva 3B). Jos  muuttuu -10 kJ mol-1:stä -20 kJ mol-1:een, ylläpidon energiantarpeen täyttämiseksi tarvittava liikevaihtonopeus laskee 50 %. Vertailun vuoksi, jos
muuttuu -10 kJ mol-1:stä -20 kJ mol-1:een, ylläpidon energiantarpeen täyttämiseksi tarvittava liikevaihtonopeus laskee 50 %. Vertailun vuoksi, jos  muuttuu -100 kJ mol-1:stä -110 kJ mol-1:een, vaaditun liikevaihtonopeuden lasku on vain ~9 %.
muuttuu -100 kJ mol-1:stä -110 kJ mol-1:een, vaaditun liikevaihtonopeuden lasku on vain ~9 %.
Mitä tämä tarkoittaa sulfaattireduktorien ja metanogeenien käyttämien substraattien osalta verrattuna asetogeenien käyttämiin substraatteihin? Kuvassa 3C on esitetty ylläpidon liikevaihtonopeudet samoille aineenvaihduntareaktioille A ja B kuin kuvassa 3A (plus 0) sekä kolmelle hypoteettiselle reitille, jotka tuottavat suuremman energiantuoton substraattia kohti (plus 10, plus 20, plus 30); ”plus 0” on esimerkki asetogeneesireaktioista, jotka syntyvät korkean liikevaihdon omaavasta, matalaenergisestä substraatista (MEA) ja matalan liikevaihdon omaavasta, korkeaenergisestä substraatista (MEB); polut ”plus 10”, ”plus 20” ja ”plus 30” ovat energeettisesti suotuisampia metanogeneesi- ja sulfaattipelkistysreaktioita, joissa on mukana samat kaksi substraattia. Erot  -10, -20 ja -30 kJ mol-1 suhteessa asetogeenisiin reaktioihin perustuvat tyypillisiin eroihin
-10, -20 ja -30 kJ mol-1 suhteessa asetogeenisiin reaktioihin perustuvat tyypillisiin eroihin  , jotka on laskettu metanogeneesin/sulfaatin pelkistämisen vs. asetogeneesin reaktioille, joissa on mukana substraatteja formiaatti, metanoli ja laktaatti, laajalla lämpötila-alueella (275-337 K) ja sulfaattipitoisuuksilla (0-28 mM) maanalaisissa sedimenteissä (Lever et al., 2010). Vertailu havainnollistaa, että lähellä termodynaamista kynnysarvoa (MEA, ΔGs′ = -10 kj mol-1 Kuva 3C) toimivilla asetogeneesireaktioilla on valtava haitta MEcellin täyttämisessä verrattuna kilpaileviin metanogeenisiin tai sulfaattia pelkistäviin reaktioihin, jotka voivat toimia puolet, kolmasosa tai neljäsosa substraatin liikevaihdosta (taulukko 6). Etu, joka on siinä, että MEcellin saavuttaminen edellyttää huomattavasti alhaisempaa liikevaihtoa, pienenee, kun energiantuotto substraattia kohti kasvaa (MEB, kuva 3C). Tästä seuraa, että kolmen kilpailevan metanogeneesi- ja sulfaatin pelkistysreaktion vähimmäisliikemäärät ovat vain 9, 17 ja 23 % pienemmät, kun energiantuotto substraattia kohti on -100 kJ mol-1 asetogeneesireaktiolle (taulukko 6).
, jotka on laskettu metanogeneesin/sulfaatin pelkistämisen vs. asetogeneesin reaktioille, joissa on mukana substraatteja formiaatti, metanoli ja laktaatti, laajalla lämpötila-alueella (275-337 K) ja sulfaattipitoisuuksilla (0-28 mM) maanalaisissa sedimenteissä (Lever et al., 2010). Vertailu havainnollistaa, että lähellä termodynaamista kynnysarvoa (MEA, ΔGs′ = -10 kj mol-1 Kuva 3C) toimivilla asetogeneesireaktioilla on valtava haitta MEcellin täyttämisessä verrattuna kilpaileviin metanogeenisiin tai sulfaattia pelkistäviin reaktioihin, jotka voivat toimia puolet, kolmasosa tai neljäsosa substraatin liikevaihdosta (taulukko 6). Etu, joka on siinä, että MEcellin saavuttaminen edellyttää huomattavasti alhaisempaa liikevaihtoa, pienenee, kun energiantuotto substraattia kohti kasvaa (MEB, kuva 3C). Tästä seuraa, että kolmen kilpailevan metanogeneesi- ja sulfaatin pelkistysreaktion vähimmäisliikemäärät ovat vain 9, 17 ja 23 % pienemmät, kun energiantuotto substraattia kohti on -100 kJ mol-1 asetogeneesireaktiolle (taulukko 6).
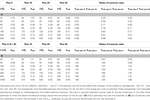
Taulukko 6. Metanogeneesin ja sulfaatin pelkistysreaktion vähimmäisliikemäärät. Yhteenveto solukohtaisista substraatin vaihtumisnopeuksista (kcell; fmol solu-1 vuosi-1), joita tarvitaan teoreettisen ylläpitoenergiantarpeen 2,74 × 10-1 4 kJ solu-1 vuosi-1 täyttämiseksi erilaisilla vapaan energian saannoilla substraattia kohti ( kJ mol-1).
kJ mol-1).
Palatakseni aiemmin tässä jaksossa esitettyyn kysymykseen, ts, voivatko metanogeenit/sulfaattipelkistäjät ja asetogeenit harjoittaa eräänlaista niche-erilaistumista, jossa kumpikin ryhmä käyttää eri substraatteja siellä, missä ne esiintyvät yhdessä, tässä esitetty malli antaa selkeän vastauksen. Suuren energiamäärän ja alhaisen liikevaihdon substraateilla ruokkiminen on mikrobeille elinkelpoinen selviytymisstrategia, samoin kuin pienen energiamäärän ja korkean liikevaihdon substraateilla ruokkiminen. Nämä kaksi strategiaa voivat ainakin osittain selittää asetogeenisten ja sulfaattia pelkistävien ja/tai metanogeenisten mikrobipopulaatioiden rinnakkaiselon. Syynä siihen, että sulfaatinpelkistäjät/metaanogeenit saattavat käyttää pääasiassa matalaenergisiä, suuren liikevaihdon omaavia substraatteja, on se, että niillä on suuri energeettinen etu asetogeeneihin verrattuna näiden substraattien metaboloinnissa. Korkeissa  lämpötiloissa sulfaatin pelkistäjien/metaanogeenien energeettinen etu asetogeeneihin nähden vähenee, ja muiden kiltakohtaisten ominaisuuksien merkitys voi kasvaa. Yhtä näistä käsitellään seuraavassa kappaleessa.
lämpötiloissa sulfaatin pelkistäjien/metaanogeenien energeettinen etu asetogeeneihin nähden vähenee, ja muiden kiltakohtaisten ominaisuuksien merkitys voi kasvaa. Yhtä näistä käsitellään seuraavassa kappaleessa.
Espesialisti vs. generalisti -argumentit
Espesialistisen vs. generalistisen elämäntavan mahdolliset edut ovat olleet ekologien keskustelunaiheena yli viiden vuosikymmenen ajan. Perinteinen näkemys on, että valikoivuus (erikoistuminen) kannattaa rajoituksettomissa energiaolosuhteissa, kun taas vähäisempi erottelu ravinnonlähteiden suhteen (generalismi) on tehokkaampi selviytymisstrategia energiarajoitusten vallitessa (esim. Emlen, 1966; Dykhuizen ja Davies, 1980; katsauksia ks. Pianka, 1994; Egli, 1995). Mikrobi-ekologian osalta tämä väite on kyseenalaistettu tietyissä mikrobien kasvukokeissa, joissa pitkät nälkäkuormitusjaksot näyttivät suosivan spesialisteja (esim. Kuenen, 1983).
Mikrobien ja makrobiotan perustavanlaatuinen ero energiarajoitusten vallitessa on se, että mikrobit kamppailevat paitsi ylläpidon energiantarpeen tyydyttämiseksi myös saadakseen aineenvaihdunnallisesta reaktiosta vapaan energian vähimmäismäärän BEQ:ta, jonka avulla ne pystyvät ylipäätään tuottamaan ATP:tä. Näin ollen substraattispesialisteilla on usein suuri substraattiaffiniteetti hyvin alhaisiin pitoisuuksiin asti, minkä ansiosta ne pystyvät kilpailemaan paitsi muiden aineenvaihduntakiltojen, myös oman aineenvaihduntakiltansa muiden jäsenten kanssa. Klassinen esimerkki metanogeenien joukossa on obligatisti etikkalastinen Methanosaeta-suku, joka pystyy kasvamaan alle 10 μM:n asetaattipitoisuuksilla (Jetten et al., 1992). Vertailun vuoksi (metanogeenien standardien mukaan) ”generalistinen” Methanosarcina-suku, jonka jäsenet voivat kasvaa hiilidioksidin pelkistämisen, asetaatin disproportionoinnin ja C1-yhdisteiden demetyloinnin avulla, vaatii kasvuun vähintään 200 μM:n asetaattikonsentraation (Jetten et al., 1992). Suuri substraattiaffiniteetti näyttää olevan strategia, jonka avulla spesialistit voivat tehokkaammin ottaa vastaan substraatteja ja ajaa substraattipitoisuudet alle generalistien vaatimien kynnyspitoisuuksien. Tämä energeettisen (eli termodynaamisen) poissulkemisen muoto, jota esiintyy vain mikrobeissa, tarjoaa substraattispesialisteille väylän edellyttäen, että ne pystyvät täyttämään ylläpidon energiavaatimukset. Substraattispesialisaation kustannukset ovat pienempi käytettävissä oleva energiavarasto, joka johtuu harvempien energiasubstraattien hyödyntämisestä, ja alhaisempi energiantuotto substraattia kohti.
Energiavajeisissa ympäristöissä, kuten syvissä maanalaisissa sedimenteissä, spesialistien aineenvaihduntastrategia voi toimia tehokkaasti substraateissa, joiden vaihtuvuus on suuri. Korkeat liikevaihtonopeudet ja suhteellisen suuret solutiheydet ovat välttämättömiä, jotta voidaan ylläpitää alhaisia substraattipitoisuuksia, joiden avulla spesialistit voivat termodynaamisesti sulkea pois saman substraatin vähemmän tehokkaat kuluttajat. Kuten aiemmin on osoitettu (taulukot 1-3), asetogeenien termodynaaminen syrjäytyminen on kuitenkin todennäköistä vain matalaenergisten substraattien H2 ja formiaatti osalta. Muut harvinaisemmat mutta energiarikkaammat substraatit esiintyvät pitoisuuksina, jotka ylittävät termodynaamisen kynnyksen, ja ne eivät juurikaan kannusta erikoistumiseen, koska muita ryhmiä, kuten asetogeenejä, ei voida termodynaamisesti sulkea pois niiden kulutuksesta. Näin ollen generalistisempi aineenvaihduntastrategia voi olla tehokkaampi näiden harvinaisempien ja energiarikkaampien substraattien kuluttajilla.
Kuten edellisessä jaksossa käsiteltiin, substraattigeneralismi on laajalle levinnyt piirre asetogeenien keskuudessa. Ylläpidon energiantarpeen täyttämisen kannalta useamman kuin yhden substraatin käyttämisellä on selviä etuja (kuva 4); esimerkiksi korkeilla liikevaihtonopeuksilla ja alhaisilla ΔG:illä (-10 kJ mol-1 substraatti) kahden substraatin, A ja B, energiantuoton yhdistäminen, joilla on sama  ja k-solu, voi mahdollistaa sen, että asetogeenit pystyvät alentamaan vaadittavaa substraatin liikevaihtoa 50 % ja kilpailemaan menestyksekkäästi metanogeenien/ sulfaatin pelkistäjien kanssa, jotka saavuttavat 10 kJ enemmän energiaa moolia substraattia A (MEA; kuva 4; taulukko 6) kohti. Vaikka tämä parantaakin kilpailukykyä, kahdesta substraatista saatavan energian yhdistäminen ei vielä riitä kilpailemaan metanogeenien/sulfaattipelkistimien kanssa, jotka saavat 20 tai 30 kJ enemmän energiaa substraattimoolia kohti ja jotka pystyvät silti saavuttamaan MEcellin 33 ja 50 prosenttia alhaisemmilla liikevaihdoilla (taulukko 6). Jälkimmäisten energiantuottojen saavuttamiseksi olisi yhdistettävä energiaa kolmesta tai neljästä substraatista, joilla on substraatin A ominaisuudet, mikä on huomattava haitta energiatehokkuuden kannalta, kuten voidaan väittää. Tämä muuttuu sellaisten substraattien osalta, joiden energiantuotto on korkea (esim. -100 kJ mol-1 substraatti) ja joiden vaadittu liikevaihtonopeus on näin ollen alhainen (MEB; kuva 4). Näiden osalta kahden substraatin energian yhdistäminen antaisi asetogeenille mahdollisuuden kasvaa huomattavasti alhaisemmalla liikevaihtonopeudella kuin yksikään kilpailevista metanogeeneistä/sulfaattipelkistäjistä, jotka käyttävät vain yhtä substraattia – tämä on merkittävä etu (kuva 4; taulukko 6). Tästä seuraa, että useista substraateista saatavan energian yhdistäminen lisäisi asetogeenien kilpailukykyä sulfaattipelkistimien ja metanogeenien kanssa yleisesti – ja erityisesti energiarikkaiden substraattien osalta.
ja k-solu, voi mahdollistaa sen, että asetogeenit pystyvät alentamaan vaadittavaa substraatin liikevaihtoa 50 % ja kilpailemaan menestyksekkäästi metanogeenien/ sulfaatin pelkistäjien kanssa, jotka saavuttavat 10 kJ enemmän energiaa moolia substraattia A (MEA; kuva 4; taulukko 6) kohti. Vaikka tämä parantaakin kilpailukykyä, kahdesta substraatista saatavan energian yhdistäminen ei vielä riitä kilpailemaan metanogeenien/sulfaattipelkistimien kanssa, jotka saavat 20 tai 30 kJ enemmän energiaa substraattimoolia kohti ja jotka pystyvät silti saavuttamaan MEcellin 33 ja 50 prosenttia alhaisemmilla liikevaihdoilla (taulukko 6). Jälkimmäisten energiantuottojen saavuttamiseksi olisi yhdistettävä energiaa kolmesta tai neljästä substraatista, joilla on substraatin A ominaisuudet, mikä on huomattava haitta energiatehokkuuden kannalta, kuten voidaan väittää. Tämä muuttuu sellaisten substraattien osalta, joiden energiantuotto on korkea (esim. -100 kJ mol-1 substraatti) ja joiden vaadittu liikevaihtonopeus on näin ollen alhainen (MEB; kuva 4). Näiden osalta kahden substraatin energian yhdistäminen antaisi asetogeenille mahdollisuuden kasvaa huomattavasti alhaisemmalla liikevaihtonopeudella kuin yksikään kilpailevista metanogeeneistä/sulfaattipelkistäjistä, jotka käyttävät vain yhtä substraattia – tämä on merkittävä etu (kuva 4; taulukko 6). Tästä seuraa, että useista substraateista saatavan energian yhdistäminen lisäisi asetogeenien kilpailukykyä sulfaattipelkistimien ja metanogeenien kanssa yleisesti – ja erityisesti energiarikkaiden substraattien osalta.
KUVIO 4. Asetogeenien kilpailukyky sulfaattipelkistimien ja metanogeenien kanssa. Sama suhde kuin kuvassa 3C, paitsi että MEA:n ja MEB:n (”plus 0”) vaatimat liikevaihtonopeudet lasketaan nyt kahden substraatin, A ja B, summalle . Kaikki muut arvot ovat samat kuin aiemmin.
Sama periaate kuin vertailtaessa kahden vs. yhden substraatin käytön hyötyjä pätee vertailtaessa useamman, esim. 3 vs. 2, 5 vs. 4, 10 vs. 5 jne., substraatin käytön hyötyjä. Tärkeintä on, että asetogeeneillä on tyypillisesti laajempi substraattispektri kuin sulfaattipelkistäjillä tai metanogeeneilla, ja että useammasta substraatista saatavan energian yhdistäminen voi mahdollistaa sen, että asetogeenit voivat joissakin tapauksissa selviytyä muita ryhmiä alhaisemmilla substraattien vaihtumisnopeuksilla huolimatta alhaisemmasta energiantuotosta substraattia kohti. Vielä puuttuu kokeellista näyttöä, joka vahvistaisi energialähteiden yhdistämisen selitykseksi asetogeenisten ja sulfaattipelkistävien ja/tai metanogeenisten populaatioiden rinnakkaiselolle syvän biosfäärin alueella. Sama periaate on kuitenkin osoitettu jatkuvatoimisissa viljelmissä, joissa on mukana muita mikro-organismiryhmiä, joita on kasvatettu hiiltä rajoittavissa olosuhteissa: tässä yhteydessä useat tutkimukset ovat osoittaneet, että substraattigeneralistit kasvavat alhaisemmilla substraattipitoisuuksilla kuin substraattispesialistit, kun inkubaatioissa on käytetty useita substraatteja (Gottschal et al., 1979; Dykhuizen ja Davies, 1980; tarkasteltu teoksessa Egli et al., 1993; Egli, 1995).
Esitettyjen laskelmien (kuva 4; taulukko 6) perusteella voidaan päätellä, että energian yhdistäminen on merenpohjan alapuolella eläville asetogeeneille tehokas strategia ME-solun saavuttamiseksi vain, jos siihen liittyy korkeaenergisiä substraatteja. Vähäenergisten substraattien osalta erikoistuneemmilla organismeilla, joilla on korkeampi energiantuotto substraattia kohti, eli sulfaatin pelkistäjillä ja metanogeeneilla, pitäisi olla suuri etu (kuva 4), edellyttäen, että asetogeneesireaktioiden energiantuotto jopa ylittää BEQ:n. Jopa tehokkain spesialisti saavuttaa kuitenkin rajan, kun substraatin kiertonopeus laskee alle MEcellin saavuttamisen edellyttämän kynnysarvon; tässä vaiheessa spesialistin on joko pakko kuluttaa lisää substraatteja tai sallia termodynaamisen kynnysarvon ylittävät substraattipitoisuudet. Jälkimmäistä mahdollisesti tukevat todisteet ovat peräisin Etelä-Tyynenmeren pyörremyrskyn ja Päiväntasaajan Tyynenmeren oligotrofisista sedimenteistä, joissa H2-pitoisuushuiput ovat olleet kymmenien nanomoolien luokkaa sellaisissa pinnanalaisissa kerroksissa, joissa mikrobien aktiivisuus on erittäin alhainen (Shipboard Scientific Party, 2003; Expedition 329 Scientists, 2011). Jos substraattispesialistien on pakko sallia termodynaamisen kynnysarvon ylittäviä substraattipitoisuuksia, niistä tulee haavoittuvaisia vähemmän tehokkaille, yleisemmille organismeille, jotka kilpailevat niiden suosimasta substraatista. Loppujen lopuksi suuremman saatavilla olevan substraatti- ja siten energiavaraston vuoksi voisi siis olettaa, että substraattigeneralistit hallitsevat kaikkein energiavajeisimmissa olosuhteissa.
Tähän mennessä esitetyt tulokset viittaavat siihen, että on hyvin vaikeaa ennustaa tulosta, joka syntyy monimutkaisesta kilpailusta, jota asetogeenit ja muut ryhmät käyvät substraateista syvän biosfäärin alueella. Fysikaalisten muuttujien, kuten lämpötilan ja paineen, lisäksi saattaa olla tarpeen mitata kaikkien merkityksellisten eduktien ja tuotteiden konsentraatioita – erittäin haastava tehtävä asetogeenien kohdalla niiden laajan substraattispektrin vuoksi – sekä mitata substraattikohtaisia liikevaihtonopeuksia – näennäisesti mahdoton tehtävä, kun otetaan huomioon hyvin alhaiset liikevaihtonopeudet syvän biosfäärin alueella. Vaikka konsentraatiot ja liikevaihtonopeudet olisivatkin täysin tiedossa, kilpailutulosten ennustaminen substraattitasolla olisi vaikeaa, koska tietämyksemme anoksisissa (merenpohjan alapuolisissa) sedimenteissä elävien mikrobien aineenvaihdunnallisista kyvyistä ja muista tärkeistä elämänhistoriallisista piirteistä ovat edelleen rajalliset. Yksi jälkimmäisistä on biosynteesin energiakustannukset – muuttuja, joka todennäköisesti vaihtelee suuresti mikrobien ja mikrobien aineenvaihduntakiltojen välillä.
Biosynteesin energeettiset kustannukset asetogeenien keskuudessa
Autotrofisen hiilen sidonnan tällä hetkellä tunnetuista kuudesta reitistä reduktiivinen asetyyli-CoA-reitti on yksinkertaisin ja energeettisesti edullisin monimutkaisten biokemiallisten välituotteiden puuttumisen vuoksi (Russell ja Martin, 2004; Berg ym, 2010). Tämä tiukasti anaerobinen reitti koostuu vain karbonyylihaarasta, jossa hiilidioksidi pelkistyy entsyymiin sitoutuneeksi karbonyyliryhmäksi, ja metyylihaarasta, jossa hiilidioksidi pelkistyy kofaktoriin sitoutuneeksi metyyliryhmäksi. Bifunktionaalinen entsyymi CO-dehydrogenaasi/asetyyli-CoA-syntaasi (CODH/ACS) suorittaa sekä hiilidioksidin pelkistämisen hiilidioksidiksi että lopputuotteen, asetyyli-CoA:n, synteesin yhdistämällä karbonyyli- ja metyyliryhmät (esim. Hügler ja Sievert, 2011). Reduktiivinen asetyyli-CoA:n reitti on ainutlaatuinen C:n sitoutumisreittien joukossa, koska se on lineaarinen; geokemiallisesti suotuisissa olosuhteissa, esimerkiksi emäksisissä hydrotermisissä venttiiliympäristöissä, jokainen vaihe on eksergoninen, mikä tarkoittaa, että CO2:n sitoutuminen voi tapahtua spontaanisti (Martin ja Russell, 2007). Siksi on esitetty, että tämä reitti alkoi geokemiallisena reittinä (Russell ja Martin, 2004). Koska se on ainoa tunnettu C:n sidontapolku, jota esiintyy sekä bakteereissa että arkeologeissa, on lisäksi arveltu, että reduktiivinen asetyyli-CoA:n polku on vanhin C:n sidontapolku (Fuchs ja Stupperich, 1985) tai jopa ensimmäinen biokemiallinen polku, joka on kehittynyt maapallolla (Peretó et al., 2004). Suuri yksinkertaisuus ja alhaiset energiakustannukset viittaavat siihen, että tätä reittiä käyttävillä anaerobisilla organismeilla on energeettinen etu verrattuna organismeihin, jotka käyttävät muita C:n sitoutumisreittejä, kuten käänteistä trikarboksyylihappokiertoa.
Reduktiivista asetyyli-CoA:n reittiä esiintyy kaikissa tunnetuissa asetogeeneissä ja metanogeeneissä sekä useissa autotrofisissa sulfaatin pelkistäjissä ja anammox-bakteereissa (Schauder et al., 1989; Drake et al., 2006; Strous et al., 2006; Whitman et al., 2006). Tietyt metanogeenit ja autotrofiset sulfaatinpelkistäjät käyttävät reittiä yksinomaan biosynteesiin, kun taas toiset, mukaan lukien asetaattia hapettavat sulfaatinpelkistäjät, etikkalastiset metanogeenit ja syntrofiset asetaattihapettimet, voivat tuottaa energiaa kääntämällä reitin toisin päin niin, että se muuttuu hapettavaksi (esim. Spormann ja Thauer, 1988; Hattori ym., 2005; Liu ja Whitman, 2008). Asetogeenit, ja näihin lukeudun fakultatiiviset asetogeenit, kuten tietyt sulfaatin pelkistäjät, metanogeenit ja anaerobiset asetaattihapettimet (esim., Jansen et al., 1984; Rother ja Metcalf, 2004; Hattori et al., 2005; Lessner et al., 2006; Henstra et al., 2007), ovat ainoa ryhmä, jonka tiedetään käyttävän tätä reittiä sekä biosynteesin että energiantuotannon osalta. Mahdollinen etu saman reitin käyttämisestä energiantuotantoon ja biomassan assimilaatioon on se, että on tuotettava ja ylläpidettävä pienempiä genomeja ja vähemmän entsyymejä. Koska nälkiintymistila on todennäköisesti pikemminkin sääntö kuin poikkeus mikrobien keskuudessa energiavajeisissa merenpohjan alapuolisissa sedimenteissä (Jørgensen et al., 2006), genomin ylläpidon ja entsyymisynteesin energiakustannusten pienentäminen voi antaa merkittävän edun mikrobeille, jotka pystyvät toteuttamaan energiantuotantoa ja biosynteesiä samaa reittiä pitkin.
Onkin esitetty, että depurinaatioreaktioista peräisin olevan DNA:n korjaamiseen tarvittavien entsyymien ja rasemisoitumisreaktioista peräisin olevien valkuaisaineiden synteesi ja ylläpito aiheuttavat suurimman osan eloonjäämismoodissa elävien mikro-organismien energiakuluista (Price ja Sowers, 2004). Vaikka solukohtaisista entsyymien pitoisuuksista ja liikevaihtonopeuksista syvällä merenpohjassa tiedetään liian vähän, jotta voitaisiin laskea näiden entsyymien synteesin ja ylläpidon energiakustannukset, proteiinien rakennusaineiden eli tiettyjen aminohappojen (aspartaatti, glutamaatti, seriini, glysiini) pitoisuuksia on mitattu Perun marginaalin ja Päiväntasaajan Tyynenmeren alueen merenalaisista sedimenteistä (Mitterer, 2006). Käytän näitä tässä laskettaessa niiden lithoautotrofisen synteesin energiakustannuksia. Paikasta riippumatta kaikkien neljän aminohapon synteesin energiakustannusten voidaan odottaa olevan korkeat (kuva 5). Jos oletetaan, että tämä on yleinen suuntaus kaikissa aminohapoissa, proteiinien ja siten myös entsyymien litoautotrofisen synteesin voidaan olettaa olevan energeettisesti kallis prosessi merenalaisissa sedimenteissä. Tärkeä välituote aminohappojen synteesissä anaerobisissa olosuhteissa on runsaasti energiaa sisältävä asetyyli-CoA-molekyyli, joka on myös tärkeä välituote asetogeneesissä. Jos oletetaan, että H2-CO2:sta tapahtuvaan asetogeneesiin liittyy energiakustannuksia (kuva 1A), obligat lithoautotrofit, mukaan lukien monet metanogeenit ja sulfaattipelkistäjät, jotka syntetisoivat aminohappoja H2:sta ja CO2:sta, käyttävät huomattavia määriä energiaa pelkkään asetyyli-CoA:n pelkistävään synteesiin. Sen sijaan suurin osa organotrofisten asetogeneesireaktioista on eksergonisia (taulukko 3). Useimmat asetogeenit saattavat siis pystyä vähentämään energiankulutusta entsyymisynteesin aikana obligatisti autotrofisiin eliöihin verrattuna käyttämällä orgaanisia substraatteja aminohappojen esiasteen asetyyli-CoA:n synteesiin.
KUVA 5. Aminohappojen esiasteen asetyyli-CoA:n synteesi. Aminohappojen (A) asparagiinihappo , (B) glutamiinihappo , (C) seriini ja (D) glysiini (2 HCO3- + NH4+ + 3 H2 + H+ → NH3+CH2COO- + 4 H2O) aminohappojen litoautotrofisen synteesin energiakustannusten syvyysprofiilit ODP-paikoissa 1225-31. Kaikki laskelmat perustuvat mittauksiin, jotka on saatu ODP Leg 201:n aikana kerätyistä sedimenttisydämistä (Shipboard Scientific Party, 2003; Mitterer, 2006).
Johtopäätös
Jos energiantuotto substraattia kohti on ainoa tärkeä muuttuja, joka ohjaa mikrobien aineenvaihduntaa energiavajeessa olevissa pinnanalaisissa sedimenteissä, asetogeenisten mikrobien pitäisi syrjäytyä muilta energeettisesti edullisempien menetelmien kuten sulfaatin pelkistymisen ja metanogeneesin kaltaisilta anaboliittisesti aktiivisemmin toimivilta mikrobeilta. Vaikka näin saattaa olla joissakin paikoissa, viimeaikaiset δ13C-isotooppianalyysit, jotka osoittavat, että asetogeenisten mikrobien osuus asetaatin kokonaisliikevaihdosta on merkittävä, ovat osoittaneet muuta (Heuer et al., 2009; Lever et al., 2010). Tässä tutkimuksessa käsittelen useita asetogeenisten mikrobien potentiaalisesti edullisia ominaisuuksia, jotka saattavat mahdollistaa niiden rinnakkaiselon sulfaattipelkistäjien ja metanogeenien kanssa huolimatta alhaisemmasta energiantuotosta substraattia kohti.
Konservatiivisten laskelmien avulla osoitan, että useimmat asetogeeniset substraatit esiintyvät todennäköisesti pitoisuuksina, jotka ylittävät huomattavasti asetogeneesin termodynaamisen kynnyskonsentraation, ja näin ollen ne ovat potentiaalisia energiasubstraatteja syvän biosfäärin asetogeeneille. Koska asetogeenit kykenevät metaboloimaan tiettyjä substraatteja useiden eri reaktioiden kautta, esim. pelkkä metanoli, metanoli + H2 tai metanoli + formiaatti, niillä on huomattava metabolinen joustavuus verrattuna sulfaatin pelkistijöihin ja metanogeeneihin, mikä joissakin tapauksissa voi antaa niille mahdollisuuden saada suurempia energiantuottoja substraattia kohden kuin nämä kaksi ryhmää. Asetogeenit ovat myös metabolisesti monipuolisempia käytettyjen substraattien määrän ja laajuuden suhteen kuin sulfaattipelkistäjät ja metanogeenit. Tämän vuoksi ne voivat välttää kilpailua erilaistamalla markkinarakojaan eli syömällä substraatteja, joita useimmat sulfaattipelkistäjät tai metanogeenit eivät käytä. Suurempi substraattivalikoima tarkoittaa lisäksi sitä, että asetogeenit voivat saada energiaa suuremmasta kokonaismäärästä substraatteja. Sen sijaan, että asetogeenit olisivat kehittyneet erittäin tehokkaiksi ja erikoistuneiksi yksittäisten runsaslukuisten substraattien kuluttajiksi, ne ovat todennäköisesti substraattigeneralisteja, jotka pystyvät hyödyntämään suurta määrää harvinaisempia (harvinaisia) substraatteja.
Asetogeenisen elämäntavan etuna voi olla myös se, että asetogeenit pystyvät hillitsemään biosynteesiin käytettyä energiaa. Asetogeenit käyttävät reduktiivista asetyyli-CoA-reittiä, joka on energeettisesti edullisin kaikista C:n sitoutumisreiteistä. Käyttämällä tätä reittiä sekä energiantuotantoon että biosynteesiin ne voivat vähentää energiaa, jota muut ryhmät käyttävät ylimääräisten geenien ja entsyymien ylläpitoon. Orgaanisten yhdisteiden käyttö H2/CO2:n sijasta biomassan synteesin lähtöaineina voi lisäksi mahdollistaa sen, että asetogeenit voivat kiertää energeettisesti kalliin litoautotrofisen C:n sidonnan. Kun otetaan huomioon aminohappojen synteesin korkeat energiakustannukset syvissä maanalaisissa sedimenteissä ja se, että DNA:n ja proteiinien korjaamiseen tarvittavien entsyymien synteesi ja ylläpito ovat todennäköisesti nälkäkuormituksessa olevien mikrobien pääasialliset energiankulutukset, asetogeenit saattavat pystyä säästämään eloonjäämisen kannalta elintärkeää energiaa biokemiallisen reittinsä yksinkertaisuuden ja monipuolisuuden ansiosta.
Kun otetaan huomioon, että suurin osa syvien maanalaisten sedimenttien soluista on luultavasti nälkäkasvatustilassa, ja niiden sukupolvisyntymäajat ovat satoja tai tuhansia vuosia (Biddle ym, 2006; Jørgensen et al., 2006), näiden organismien ekologiaa koskevat peruskysymykset ovat edelleen vailla vastausta. Ovatko löydetyt solut erittäin sitkeitä selviytyjiä pintaympäristöistä, vai ovatko ne sopeutuneet äärimmäiseen energiarajoitukseen? Ovatko mikrobit aktiivisesti kolonisoineet sedimenttejä kauan niiden kerääntymisen jälkeen, vai ovatko ne olleet läsnä sedimenttien alkuperäisestä laskeutumisesta lähtien? Riippumatta siitä, miten näihin kysymyksiin vastataan, on todennäköistä, että asetogeenien kyky käyttää laajaa substraattivalikoimaa ja suorittaa biosynteesiä alhaisin energiakustannuksin ovat arvokkaita selviytymisominaisuuksia syvän biosfäärin alueella – vaikka ne eivät alun perin olisikaan kehittyneet sopeutumina tähän ympäristöön.
Irintaristiriitoja koskeva lausunto
Tekijä vakuuttaa, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Haluan kiittää Bo Barker Jørgenseniä ja muita Geomikrobiologian keskuksen jäseniä rakentavista keskusteluista asetogeneesin mahdollisesta merkityksestä subseafloorissa sekä Bente Aa. Lomsteinia hyödyllisestä palautteesta koskien aminohappojen kemiaa. Tätä tutkimusta ovat tukeneet Tanskan kansallinen tutkimussäätiö ja Max Planck Society (apurahat Bo Barker Jørgensenille) sekä kirjoittajalle myönnetty Marie Curie Intra-European Fellowship (# 255135).
Amend, J. P., ja Helgeson, H. C. (1997). Vesipitoisten biomolekyylien vakiomolaalisten termodynaamisten ominaisuuksien laskeminen korotetuissa lämpötiloissa ja paineissa. Osa 1 L-α-aminohapot. J. Chem. Soc. Faraday Trans. 93, 1927-1941.
CrossRef Full Text
Amend, J. P., and Plyasunov, A. V. (2001). Hiilihydraatit termofiilien aineenvaihdunnassa: vesipitoisten pentoosien ja heksoosien vakiomolaaristen termodynaamisten ominaisuuksien laskeminen korotetuissa lämpötiloissa ja paineissa. Geochim. Cosmochim. Acta 65, 3901-3917.
CrossRef Full Text
Amend, J. P., and Shock, E. L. (2001). Termofiilisten ja hypertermofiilisten arkeoiden ja bakteerien yleisten aineenvaihduntareaktioiden energetiikka. FEMS Microbiol. Rev. 25, 175-243.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ansbaek, J., and Blackburn, T. H. (1979). Menetelmä asetaatin liikevaihdon analysoimiseksi rannikon merisedimentissä. Microb. Ecol. 5, 253-264.
CrossRef Full Text
Avery, G. B., Shannon, R. D., White, J. R., Martens, C. S., and Alperin, M. J. (2002). Metaanintuotannon kontrollit vuorovesi- ja makeanveden suistossa ja turvesuolla: metaanintuotanto asetaattikäymisen ja hiilidioksidin pelkistymisen kautta (Controls on methane production in a tidal freshwater estuary and a peatland). Biogeochemistry 62, 19-37.
CrossRef Full Text
Ballschmiter, K. (2003). Luontaisesti tuotettujen orgaanisten halogeenien malli ja lähteet meriympäristössä: orgaanisten halogeenien biogeeninen muodostuminen. Chemosphere 52, 313-324.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Berg, I., Kockelkorn, D., Ramos-Vera, H. G., Say, R. F., Zarzycki, J., Hügler, M., Alber, B. E., and Fuchs, G. (2010). Autotrofinen hiilen sidonta arkeoissa. Nat. Rev. Microbiol. 10, 1-14.
CrossRef Full Text
Biddle, J. F., Lipp, J. S., Lever, M. A., Lloyd, K. G., Sørensen, K. B.., Anderson, R., Fredricks, H. F., Elvert, M., Kelly, T. J., Schrag, D. P., Sogin, M. L., Brenchley, J. E., Teske, A., House, C. H. ja Hinrichs, K.-U. (2006). Heterotrofiset arkeat hallitsevat sedimenttien pinnanalaisia ekosysteemejä Perun edustalla. Proc. Natl. Acad. Sci. U.S.A. 103, 3846-3851.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Canfield, D. E., Jørgensen, B. B., Fossing, H., Glud, R., Gundersen, J., Ramsing, N. B., Thamdrup, B., Hansen, J. W., Nielsen, L. P. ja Hall, P. O. J. (1993). Orgaanisen hiilen hapettumisreitit kolmessa mannerjalustan reunasedimentissä. Mar. Geol. 113, 27-40.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Capone, D. G., and Kiene, R. P. (1988). Mikrobien dynamiikan vertailu meren ja makean veden sedimenteissä: anaerobisen hiilikatabolian vastakohtia. Limnol. Oceanogr. 33, 725-749.
CrossRef Full Text
Cappenberg, T. E. (1974). Sulfaattia pelkistävien ja metaania tuottavien bakteerien keskinäiset suhteet makeanveden järven pohjasedimentissä. 2. Inhibitiokokeet. Antonie Van Leeuwenhoek 56, 1247-1258.
Chapelle, F. H., and Bradley, P. M. (2007). Pohjaveden hiilimonoksidipitoisuuksien hydrologinen merkitys. Ground Water 45, 272-280.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chidhaisong, A., Rosenstock, B., and Conrad, R. (1999). Monosakkaridien mittaaminen ja glukoosin muuntuminen asetaatiksi anoksisessa riisipeltomaassa. Appl. Environ. Microbiol. 65, 2350-2355.
Pubmed Abstract | Pubmed Full Text
Cord-Ruwisch, R., Seitz, H.-J., and Conrad, R. (1988). Hydrogenotrofisten anaerobisten bakteerien kyky kilpailla vedyn jäljistä riippuu pääteelektronin akseptorin redox-potentiaalista. Arch. Microbiol. 149, 350-357.
CrossRef Full Text
Dalla-Betta, P., and Schulte, M. (2009). Sitruunahappokierron välituotteiden ja esiasteiden vesipitoisten termodynaamisten ominaisuuksien laskeminen ja korkean lämpötilan ja paineen tilayhtälön parametrien arviointi. Int. J. Mol. Sci. 10, 2809-2837.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dhillon, A., Lever, M., Lloyd, K. G., Albert, D. B., Sogin, M. L. ja Teske, A. (2005). Metanogeenien monimuotoisuus osoituksena metyylikoentsyymi M-reduktaasin (mcrA) geenien molekyylitason karakterisoinnista Guaymasin altaan hydrotermisissä sedimenteissä. Appl. Environ. Microbiol. 71, 4592-4601.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
D’Hondt, S., Jørgensen, B. B., Miller, D. J., Batzke, A., Blake, R., Cragg, B. A., Cypionka, H., Dickens, G. R., Ferdelman, T., Hinrichs, K.-U., Holm, N. G., Mitterer, R., Spivack, A., Wang, G.., Bekins, B., Engelen, B., Ford, K., Gettemy, G., Rutherford, S. D., Sass, H., Skilbeck, C. G., Aiello, I. W., Guèrin, G., House, C. H., Inagaki, F.., Meister, P., Naehr, T., Niitsuma, S., Parkes, R. J., Schippers, A., Smith, D. C., Teske, A., Wiegel, J., Padilla, C. N. ja Acosta, J. L. S. (2004). Mikrobitoiminnan jakautuminen syvissä merenpohjanalaisissa sedimenteissä. Science 306, 2216-2221.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
D’Hondt, S., Spivack, A. J., Pockalny, R., Ferdelman, T. G., Fischer, J. P., Kallmeyer, J., Abrams, L. J., Smith, D. C., Graham, D., Hasiuk, F., Schrum, H. ja Stancin, A. M. (2009). Subseafloor sedimentary life in the South Pacific Gyre. Proc. Nat. Acad. Sci. U.S.A. 106, 11651-11656.
Dolfing, J., Larter, S. R., and Head, I. M. (2008). Metanogeenisen raakaöljyn biohajoamisen termodynaamiset rajoitteet. ISME J. 2, 442-452.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Drake, H. L., Küsel, K., and Matthies, C. (2006). ”Acetogeeniset prokaryootit”, teoksessa The Prokaryotes: An Evolving Electronic Resource for the Microbiological Community, eds M. Dworkin, S. Falkow, E. Rosenberg, K.-H. Schleifer, and E. Stackebrandt (New York: Springer), 354-420.
Dykhuizen, D., and Davies, M. (1980). Kokeellinen malli: bakteerien spesialistit ja generalistit kilpailevat kemostaateissa. Ecology 61, 1213-1227.
CrossRef Full Text
Edenborn, H. M., and Litchfield, C. D. (1987). Glykolaatin vaihtuvuus New York Bightin apexin vesipatsaassa. Mar. Biol. 95, 459-467.
CrossRef Full Text
Egli, T. (1995). Heterotrofisten mikro-organismien kasvun ekologinen ja fysiologinen merkitys substraattiseoksilla. Adv. Microb. Ecol. 14, 305-386.
Egli, T., Lendenmann, U. ja Snozzi, M. (1993). Mikrobikasvun kinetiikka hiililähteiden seoksilla. Antonie Van Leeuwenhoek 63, 289-298.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Emlen, J. M. (1966). Ajan ja energian merkitys ruokapreferenssissä. Am. Nat. 100, 611-617.
CrossRef Full Text
Expedition 329 Scientists. (2011). ”South Pacific Gyre subseafloor life,” in Proceedings of Integrated Ocean Drilling Program, (College Station, TX: IODP), 1-108.
Ferry, J. G. (2010). CO metanogeneesissä. Ann. Microbiol. 60, 1-12.
CrossRef Full Text
Ferry, J. G., and Lessner, D. J. (2008). Metanogeneesi merisedimenteissä. Ann. N. Y. Acad. Sci. 1125, 147-157.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Finke, N., Vandieken, V., and Jørgensen, B. B. (2006). Asetaatti, laktaatti, propionaatti ja isobutyraatti raudan ja sulfaatin pelkistymisen elektroninluovuttajina arktisissa merisedimenteissä, Huippuvuoret. FEMS Microbiol. Ecol. 59, 10-22.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franklin, M. J., Wiebe, W. J., and Whitman, W. B. (1988). Metanogeenisten bakteerien populaatiot Georgian suolasuolla. Appl. Environ. Microbiol. 54, 1151-1157.
Pubmed Abstract | Pubmed Full Text
Froelich, P. N., Klinkhammer, G. P., Bender, M. L., Luedtke, N. A., Heath, G. R., Cullen, D., Dauphin, P., Hammond, D., Hartman, B. ja Maynard, V. (1979). Orgaanisen aineksen varhainen hapettuminen Itäisen päiväntasaajan Atlantin pelagisissa sedimenteissä: suboksinen diageneesi. Geochim. Cosmochim. Acta 43, 1075-1090.
CrossRef Full Text
Fuchs, G., and Stupperich, E. (1985). ”Evolution of autotrophic CO2 fixation,” in Evolution of Prokaryotes, eds K. H. Schleifer, and E. Stackebrandt (London: Academic Press), 235-251. .
Fuhrman, J. A., and Ferguson, R. L. (1986). Liuenneiden vapaiden aminohappojen nanomolaariset pitoisuudet ja nopea vaihtuvuus merivedessä: kemiallisten ja mikrobiologisten mittausten vastaavuus. Mar. Ecol. Prog. Ser. 33, 237-242.
CrossRef Full Text
Gottschal, J. S., de Vries, S., and Kuenen, J. G. (1979). Fakultatiivisesti kemolithotrofisen Thiobacillus A2:n ja obligatiivisesti kemolithotrofisen Thiobacilluksen ja heterotrofisen Spirillumin välinen kilpailu epäorgaanisista ja orgaanisista substraateista. Arch. Microbiol. 121, 241-249.
CrossRef Full Text
Griebler, C., and Lueders, T. (2008). Mikrobien monimuotoisuus pohjavesiekosysteemeissä. Freshw. Biol. 54, 649-677.
CrossRef Full Text
Harder, J. (1997). Lajista riippumaton ylläpitoenergia ja luonnolliset populaatiokoot. FEMS Microbiol. Ecol. 23, 39-44.
CrossRef Full Text
Hattori, S., Galushko, A. S., Kamagata, Y., and Schink, B. (2005). CO-dehydrogenaasi/asetyylikoentsyymi A -reitin toiminta sekä asetaatin hapetuksessa että asetaatin muodostuksessa syntrofisesti asetaattia hapettavassa Thermoacetogenium phaeum -bakteerissa. J. Bacteriol. 187, 3471-3476.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Heimann, A., Jakobsen, R., and Blodau, C. (2010). Energiarajoitukset H2-riippuvaisille terminaalielektronien vastaanottoprosesseille anoksisissa ympäristöissä: katsaus havaintoihin ja mallilähestymistapoihin. Environ. Sci. Technol. 44, 24-33.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Henstra, A. M., Dijkema, C., and Stams, A. J. M. (2007). Archaeoglobus fulgidus kytkee CO-hapetuksen sulfaattipelkistykseen ja asetogeneesiin ohimenevällä formiaatin kertymisellä. Environ. Microbiol. 9, 1836-1841.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Heuer, V., Elvert, M., Tille, S., Krummen, M., Prieto Mollar, X., Hmelo, L. R. ja Hinrichs, K.-U.,
. (2006). Haihtuvien rasvahappojen δ13C online-analyysi sedimentti-/vesijärjestelmissä nestekromatografia-isotooppisuhde-massaspektrometrillä. Limnol. Oceanogr. Methods 4, 346-357.
CrossRef Full Text
Heuer, V. B., Pohlman, J. W., Torres, M. E., Elvert, M., and Hinrichs, K.-U. (2009). Asetaatin ja muiden liuenneiden hiililajien stabiilien hiili-isotooppien biogeokemia syvissä merenpohjan alapuolisissa sedimenteissä pohjoisella Cascadian marginaalilla. Geochim. Cosmochim. Acta 73, 3323-3336.
CrossRef Full Text
Hoehler, T. M. (2004). Biologiset energiavaatimukset elämän kvantitatiivisina reunaehtoina maanalaisessa maaperässä. Geobiology 2, 205-215.
CrossRef Full Text
Hoehler, T. M., Albert, D. B., Alperin, M. J., and Martens, C. S. (1999). Asetogeneesi CO2:sta anoksisessa merisedimentissä. Limnol. Oceanogr. 44, 662-667.
CrossRef Full Text
Hoehler, T. M., Alperin, M. J., Albert, D. B., and Martens, C. S. (1998). Vetypitoisuuksien termodynaaminen kontrolli anoksisissa sedimenteissä. Geochim. Cosmochim. Acta 62, 1745-1756.
CrossRef Full Text
Hoehler, T. M., Alperin, M. J., Albert, D. B., and Martens, C. S. (2001). Metanogeenisten arkeoiden ja sulfaattia pelkistävien bakteerien näennäinen vapaan energian minimivaatimus anoksisessa merisedimentissä. FEMS Microbiol. Ecol. 38, 33-41.
CrossRef Full Text
Hügler, M., and Sievert, S. M. (2011). Beyond the Calvin Cycle: Autotrofinen hiilen sidonta meressä. Ann. Rev. Mar. Sci. 3, 261-289.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jansen, K., Thauer, R. K., Widdel, F., and Fuchs, G. (1984). Hiilen assimilaatioreitit sulfaattia pelkistävissä bakteereissa. Formaatin, hiilidioksidin, hiilimonoksidin ja asetaatin assimilaatio Desulfovibrio baarsii:ssa. Arch. Microbiol. 138, 257-262.
CrossRef Full Text
Jetten, M. S. M., Stams, A. J. M., and Zehnder, A. J. B. (1992). Methanogenesis from acetate: a comparison of the acetate metabolism in Methanothrix soehngenii and Methanosarcina spp. FEMS Microbiol. Rev. 88, 181-198.
CrossRef Full Text
Jiang, N., Wang, Y., and Dong, X. (2010). Metanoli ensisijaisena metanogeenisena ja asetogeenisena esiasteena kylmässä Zoige-kosteikossa Tiibetin ylängöllä. Microb. Ecol. 60, 206-213.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jørgensen, B. B., D’Hondt, S. L., and Miller, D. J. (2006). ”Leg 201 synthesis: controls on microbial communities in deeply burged sediments,” in Proceedings Ocean Drilling Program Science Results, eds B. B. Jørgensen, S. L. D’Hondt, and D. J. Miller (College Station, TX: ODP), 201, 1-45.
Kaiser, J.-P., and Hanselmann, K. W. (1982). Substituoitujen monoaromaattisten yhdisteiden fermentatiivinen metabolia anaerobisista sedimenteistä peräisin olevassa bakteeriyhteisössä. Arch. Microbiol. 133, 185-194.
CrossRef Full Text
Karita, S., Nakayama, K., Nakayama, K., Goto, M., Sakka, K., Kim, W.-J., and Ogawa, S. (2003). Uusi sellulolyyttinen, anaerobinen ja termofiilinen bakteeri, Moorella sp. kanta F21. Biosci. Biotechnol. Biochem. 67, 183-185.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Keppler, F., Eiden, R., Niedan, V., Pracht, J., and Schöler, H. F. (2000). Orgaanisen aineksen hajoamisen aikana luonnollisissa hapetusprosesseissa syntyvät halogeenihiilivedyt. Nature 203, 298-301.
CrossRef Full Text
King, G. M. (1988). Dehalogenoituminen merisedimenteissä, jotka sisältävät luonnollisia halofenolilähteitä. Appl. Environ. Microbiol. 54, 3079-3085.
Pubmed Abstract | Pubmed Full Text
King, G. M. (2007). Hiilimonoksidin kulutus suolaisen suon sedimenteissä. FEMS Microbiol. Ecol. 59, 2-9.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
King, G. M., Klug, M. J., and Lovley, D. R. (1982). Glukoosin aineenvaihdunta rehevöityneen järven sedimenteissä: imeytymisen ja tuotteiden muodostumisen merkkiaineanalyysi. Appl. Environ. Microbiol. 44, 1308-1317.
Pubmed Abstract | Pubmed Full Text
King, G. M., Klug, M. J., and Lovley, D. R. (1983). Asetaatin, metanolin ja metyloitujen amiinien metabolia Lowes Coven, Mainen vuorovesisedimentissä. Appl. Environ. Microbiol. 45, 1848-1853.
Pubmed Abstract | Pubmed Full Text
Kuenen, J. G. (1983). ”The role of specialists and generalists in microbial population interactions,” chapter 10 in Foundations of Biochemical Engineering, eds H. W. Blanch, E. T. Papoutsakis, and G. Stephanopoulos (Washington, DC: ACS Publications), 229-251.
Küsel, K., Pinkart, H. C., Drake, H., and Devereux, R. (1999). Acetogeeniset ja sulfaattia pelkistävät bakteerit, jotka asuttavat Halodule wrightii -meriruohon rizoplane- ja syväkuorisoluja. Appl. Environ. Microbiol. 65, 5117-5123.
Pubmed Abstract | Pubmed Full Text
Lessner, D. J., Li, L., Li, Q., Rejtar, T., Andreev, V. P., Reichlen, M., Hill, K., Moran, J. J., Karger, B. L. ja Ferry, J. G. (2006). Epätavanomainen reitti CO2:n pelkistämiseksi metaaniksi CO-kasvatetussa Methanosarcina acetivoransissa paljastui proteomiikan avulla. Proc. Natl. Acad. Sci. U.S.A. 103, 17921-17926.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lever, M. A., Heuer, V. B., Morono, Y., Masui, N., Schmidt, F., Alperin, M. J., Inagaki, F., Hinrichs, K.-U., and Teske, A. (2010). Acetogenesis in deep subseafloor sediments of the Juan de Fuca Ridge Flank: a synthesis of geochemical, thermodynamic, and gene-based evidence. Geomicrobiol. J. 27, 183-211.
CrossRef Full Text
Lin, Y. S., Heuer, V. B., Ferdelman, T. G., and Hinrichs, K.-U. (2010). Epäorgaanisen hiilen mikrobiologinen muuntuminen dimetyylisulfidiksi anoksisessa järvisedimentissä (Plußsee, Saksa). Biogeosciences 7, 2433-2444.
CrossRef Full Text
Lin, Y. S., Heuer, V. B., Goldhammer, T., Kellermann, M. Y., Zabel, M. ja Hinrichs, K.-U. (2011). Kohti H2-pitoisuuden määrittämistä merenpohjan alapuolisessa sedimentissä: ehdotus kahden eri lähestymistavan yhdistetystä analyysistä. Geochim. Cosmochim. Acta 77, 186-201.
CrossRef Full Text
Liu, F., and Conrad, R. (2011). Kemolithotrofinen asetogeeninen H2/CO2:n hyödyntäminen italialaisen riisipellon maaperässä. ISME J. 5, 1526-1539.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Liu, S., ja Suflita, J. M. (1993). H2-CO2-riippuvainen anaerobinen O-demetyloitumisaktiivisuus maanalaisissa sedimenteissä ja erään eristetyn bakteerin toimesta. Appl. Environ. Microbiol. 59, 1325-1331.
Pubmed Abstract | Pubmed Full Text
Liu, Y., and Whitman, W. B. (2008). Metanogeenisten arkeoiden metabolinen, fylogeneettinen ja ekologinen monimuotoisuus. Ann. N. Y. Acad. Sci. 1125, 171-189.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lorenson, T. D., Colwell, F. S., Delwiche, M., and Dougherty, J. A. (2006). ”17. Data report: Acetate and hydrogen concentrations in pore fluids associated with a large gas hydrate reservoir, southern hydrate ridge, offshore Oregon, USA,” in Proceedings of Ocean Drilling Program Scientific Results 204, eds A. M. Tréhu, G. Bohrmann, M. E. Torres, and F. S. Colwell (College Station, TX: IODP), 1-20.
Lovley, D. R., ja Goodwin, S. (1988). Vetypitoisuudet terminaalisten elektronia hyväksyvien reaktioiden indikaattorina vesisedimenteissä. Geochim. Cosmochim. Acta 52, 2993-3003.
CrossRef Full Text
Martens, C. S. (1990). Lyhytketjuisten orgaanisten happoanionien muodostuminen hydrotermisesti muuttuneissa sedimenteissä Guaymasin altaassa, Kalifornianlahdella. Appl. Geochem. 5, 71-76.
CrossRef Full Text
Martin, W., and Russell, M. J. (2007). Biokemian alkuperästä emäksisessä hydrotermisessä aukossa. Philos. Trans. R. Soc. Lond. B Biol. Sci. 362, 1887-1925.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Meyer-Reil, L.-A. (1978). Bakteerien glukoosin otto sedimentissä. Mar. Biol. 44, 293-298.
CrossRef Full Text
Millero, F. J., and Schreiber, D. R. (1982). Ioniparimallin käyttö luonnonvesien ionikomponenttien aktiivisuuskertoimien arvioimiseksi. Am. J. Sci. 282, 1508-1540.
CrossRef Full Text
Mitterer, R. M. (2006). ”12. Tietoraportti: D/L ratios and concentrations of selected amino acids in interstitial waters, Equatorial Pacific and Peru Margin, ODP Leg 201,” in Controls on Microbial Communities in Deeply Buried Sediments, Eastern Equatorial Pacific and Peru Margin Sites, eds B. B. Jørgensen, S. L. D’Hondt, and D. J. Miller (College Station, TX: ODP), 1-7.
Mitterer, R. M., Malone, M. J., Goodfriend, G. A., Swart, P. K., Wortmann, U. G., Logan, G. A., Feary, D. A. ja Hine, A. C. (2001). Rikkivedyn ja metaanin yhteistuotanto merikarbonaattisedimenteissä. Geophys. Res. Lett. 28, 3931-3934.
CrossRef Full Text
Mörsdorf, G., Frunzke, K., Gadkari, D., and Meyer, O. (1992). Mikrobien kasvu hiilimonoksidilla. Biodegradation 3, 61-82.
Oelkers, E. H., Helgeson, H. C., Shock, E. L., Sverjensky, D. A., Johnson, J. W., and Pokrovskii, V. A. (1995). Yhteenveto nestemäisten lajien, mineraalien ja kaasujen näennäisistä vakiomolaarisista Gibbsin vapaista muodostumisenergioista paineen ollessa 1-5000 baaria ja lämpötilan ollessa 5-1000 °C. J. Phys. Chem. Ref. Data 24, 1401-1560.
CrossRef Full Text
Parkes, R. J., Gibson, G. R., Mueller-Harvey, I., Buckingham, W. J., and Herbert, R. A. (1989). Sulfaattia pelkistävien bakteerien substraattien määrittäminen meren ja suiston sedimenteissä, joissa sulfaatin pelkistymisnopeus on erilainen. J. Gen. Microbiol. 135, 175-187.
Pedersen, K., Arlinger, J., Eriksson, S., Hallbeck, A., Hallbeck, L. ja Johansson, J. (2008). Mikrobipopulaatioiden lukumäärät, biomassa ja viljeltävä monimuotoisuus suhteessa syvyyteen ja porakaivokohtaisiin olosuhteisiin pohjavedessä 4-450 metrin syvyydessä Olkiluodossa, Suomessa. ISME J. 2, 760-775.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Peretó, J., Lopez-Garcia, P., and Moreira, D. (2004). Ancestral lipidibiosynteesi ja kalvojen varhainen evoluutio. Trends Biochem. Sci. 29, 469-477.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Phelps, T. J., and Zeikus, J. G. (1984). pH:n vaikutus terminaalisen hiilen aineenvaihduntaan lievästi happaman järven anoksisissa sedimenteissä. Appl. Environ. Microbiol. 48, 1088-1095.
Pubmed Abstract | Pubmed Full Text
Pianka, E. R. (1994). Evolutionary Ecology, 5th Edn. New York: HarperCollins College Publishers, 486.
Pilson, M. E. Q. (1998). Johdatus meren kemiaan. Upper Saddle River, NJ: Prentice-Hall, Inc.
Price, P. B., ja Sowers, T. (2004). Mikrobien kasvun, ylläpidon ja selviytymisen aineenvaihduntanopeuksien lämpötilariippuvuus. Proc. Natl. Acad. Sci. U.S.A. 101, 4631-4636.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Rabus, R., Hansen, T. A., and Widdel, F. (2006). ”Dissimilatory sulfate- and sulfur- reducing prokaryotes”, in The Prokaryotes: An Evolving Electronic Resource for the Microbiological Community, eds M. Dworkin, S. Falkow, E. Rosenberg, K.-H. M. Dworkin, S. Falkow, E. Rosenberg, K.-h. Schleifer, and E. Stackebrandt (New York: Springer), 659-768.
Rother, M., and Metcalf, W. W. (2004). Methanosarcina acetivorans C2A:n anaerobinen kasvu hiilimonoksidilla: epätavallinen elämäntapa metanogeeniselle arkeonille. Proc. Natl. Acad. Sci. U.S.A. 101, 16929-16934.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Russell, M. J., and Martin, W. (2004). Asetyyli-CoA-reitin kiviset juuret. Trends Biochem. Sci. 29, 358-363.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schauder, R., Preuß, A., Jetten, M., and Fuchs, G. (1989). Oksidatiivinen ja reduktiivinen asetyyli-CoA/hiilimonoksidi-dehydrogenaasireitti Desulfobacterium autotrophicumissa. Arch. Microbiol. 151, 84-89.
CrossRef Full Text
Shipboard Scientific Party. (2003). ”Controls on microbial communities in deep burged sediments, Eastern Equatorial Pacific and Peru Margin sites 1225-1231,” in Proceedings Of Ocean Drilling Program Initial Reports. 201, eds S. L. D’Hondt, B. B. Jørgensen, D. J. Miller, . (College Station, TX: ODP). Saatavilla osoitteessa: http://www-odp.tamu.edu/publications/201_IR/201ir.htm
Shock, E. L. (1995). Orgaaniset hapot hydrotermisissä liuoksissa: karboksyylihappojen vakiomolaaliset termodynaamiset ominaisuudet ja arviot dissosiaatiovakioista korkeissa lämpötiloissa ja paineissa. Am. J. Sci. 295, 496-580.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Shock, E. L., and Helgeson, H. C. (1988). Calculation of the thermodynamic and transport-properties of aqueous species at high pressure and temperatures-correlation algorithms for ionic species and equation of state predictions to 5-kb and 1000°C. Geochim. Cosmochim. Acta 52, 2009-2036.
CrossRef Full Text
Shock, E. L., and Helgeson, H. C. (1990). Vesiyhdisteiden termodynaamisten ja kuljetusominaisuuksien laskeminen korkeissa paineissa ja lämpötiloissa: Orgaanisten lajien vakio-osamolaariset ominaisuudet. Geochim. Cosmochim. Acta 54, 915-945.
CrossRef Full Text
Shock, E. L., Sassani, D. C., Willis, M., and Sverjensky, D. A. (1997). Epäorgaaniset lajit geologisissa nesteissä: korrelaatiot vesipitoisten ionien ja hydroksidikompleksien vakiomoolien termodynaamisten ominaisuuksien välillä. Geochim. Cosmochim. Acta 61, 907-950.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Smith, R. L., and Oremland, R. S. (1983). Anaerobinen oksalaatin hajoaminen: laajalle levinnyt luonnollinen esiintyminen vesisedimenteissä. Appl. Environ. Microbiol. 46, 106-113.
Pubmed Abstract | Pubmed Full Text
Smith, R. L., Strohmaier, F. E., and Oremland, R. S. (1985). Anaerobisten oksalaattia hajottavien bakteerien eristäminen makean veden järvisedimenteistä. Arch. Microbiol. 141, 8-13.
CrossRef Full Text
Sørensen, J., Christensen, D., and Jørgensen, B. B. (1981). Haihtuvat rasvahapot ja hydro-gen sulfaattia pelkistävien bakteerien substraatteina anaerobisessa merisedimentissä. Appl. Environ. Microbiol. 42, 5-90.
Pubmed Abstract | Pubmed Full Text
Spormann, A. M., and Thauer, R. K. (1988). Anaerobinen asetaatin hapettuminen CO2:ksi Desulfotomaculum acetoxidansin avulla. Arch. Microbiol. 150, 374-380.
CrossRef Full Text
Stolper, D. A., Revsbech, N. P., and Canfield, D. E. (2010). Aerobinen kasvu nanomolaarisissa happipitoisuuksissa. Proc. Nat. Acad. Sci. U.S.A. 107, 18755-18760.
CrossRef Full Text
Strous, M., Pelletier, E., Mangenot, S., Rattei, T., Lehner, A., Taylor, M. W., Horn, M., Daims, H., Bartol-Mavel, D., Wincker, P., Barbe, V., Fonknechten, N., Vallenet, D., Segurens, B., Schenowitz-Truong, C., Médigue, C., Collingro, A.., Snel, B., Dutilh, B. E., Op den Camp, H. J. M., van der Drift, C., Cirpus, I., van de Pas- Schoonen, K. T., Harhangi, H. R., van Niftrik, L., Schmid, M., Keltjens, J., van de Vossenberg, J., Kartal, B., Meier, H., Frishman, D., Huynen, M. A., Mewes, H.-W., Weissenbach, J., Jetten, M. S. M., Wagner, M. ja Le Paslier, D. (2006). Anammox-bakteerin evoluution ja metabolian tulkitseminen yhteisön genomista. Nature 440, 790-794.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stumm, W., and Morgan, J. J. (1981). Aquatic Chemistry. An Introduction Emphasizing Chemical Equilibria in Natural Waters, 3rd Edn. New York: John Wiley & Sons, 1022.
Takai, K., Nakamura, K., Toki, T., Tsunogai, U., Miyazaki, M., Miyazaki, J., Hirayama, H., Nakagawa, S., Nunoura, T., ja Horikoshi, K. (2008). Solujen lisääntyminen 122 °C:ssa ja isotooppisesti raskas CH4-tuotanto hypertermofiilisen metanogeenin korkeapaineviljelyssä. Proc. Natl. Acad. Sci. U.S.A. 105, 10949-10954.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tewari, Y. B., Lang, B. E., Decker, S. R., and Goldberg, R. N. (2008). 1,4-β-D-xylobioosin, 1,4-β-D-xylotrioosin, D-sellobioosin ja D-maltoosin hydrolyysireaktioiden termodynamiikka. J. Chem. Thermodyn. 40, 1517-1526.
CrossRef Full Text
Tijhuis, L., van Loosdrecht, M. C. M., and Heijnen, J. J. (1993). Termodynaamisesti perustuva korrelaatio ylläpidon Gibbsin energiantarpeelle aerobisessa ja anaerobisessa mikrobikasvussa. Biotechnol. Bioeng. 42, 509-519.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Valentine, D. L. (2001). ”Termodynaaminen ekologia vetyyn perustuvassa syntrofiassa”, teoksessa Cellular Origin, Life in Extreme Habitats and Astrobiology, Chap. 192. NewYork: Springer.
Wagman, D. D., Evans, W. H., Parker, V. B., Schumm, R. H., Halow, I., Bailey, S. M., Churney, K. L. ja Nuttall, R. L. (1982). Kemiallisten termodynaamisten ominaisuuksien NBS-taulukot: valikoituja arvoja epäorgaanisille ja orgaanisille C1- ja C2-aineille SI-yksiköissä. J. Phys. Chem. Ref. Data 11, 392.
Wang, G. Z., Spivack, A. J., Rutherford, S., Manor, U. ja D’Hondt, S. (2008). Samanaikaisten reaktionopeuksien kvantifiointi syvissä merenpohjanalaisissa sedimenteissä. Geochim. Cosmochim. Acta 72, 3479-3488.
CrossRef Full Text
Whitman, W. B., Bowen, T. L., and Boone, D. R. (2006). ”Metanogeeniset bakteerit”, teoksessa The Prokaryotes: An Evolving Electronic Resource for the Microbiological Community, eds M. Dworkin, S. Falkow, E. Rosenberg, K. H. Schleifer, and E. Stackebrandt (New York: Springer), 165-207.
Whitman, W. B., Coleman, D. C., and Wiebe, W. J. (1998). Prokaryootit: näkymätön enemmistö. Proc. Nat. Acad. Sci. U.S.A. 95, 6578-6583.
CrossRef Full Text
Wolin, M. J., and Miller, T. L. (1994). ”Acetogenesis from CO2 in the human colonic ecosystem,” in Acetogenesis, ed. H. L. Drake (New York: Chapman and Hall), 365-385.
Wolin, M. J., Miller, T. L., Collins, M. D., and Lawson, P. A. (2003). Formaattiriippuvainen kasvu ja homoacetogeeninen fermentaatio ihmisen ulosteesta peräisin olevalla bakteerilla: kuvaus Bryantella formatexigens gen. nov., sp. nov. Appl. Environ. Microbiol. 69, 6321-6326.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhilina, T. N., and Zavarzin, G. A. (1990). Erittäin halofiiliset, metyylitrofiset, anaerobiset bakteerit. FEMS Microbiol. Lett. 87, 315-321.
CrossRef Full Text