- Introduction
- Materiaalit ja menetelmät
- Materiaalit ja kemikaalit
- Solulinjojen valmistelu
- Seeprakalojen valmistus
- Solujen elinkelpoisuusmääritys ja morfologinen havainnointi
- Apoptoosin analysointi DAPI-värjäyksellä ja virtaussytometrialla
- Xenograft Animal Assay
- Real Time PCR (qPCR) -analyysi
- Western Blot (WB) -analyysi
- Statistinen analyysi
- Tulokset
- TF:n antiproliferatiivinen vaikutus
- TF:n pro-apoptoottinen vaikutus
- TF:n in vivo -vaikutus ksenografiineihin
- TF:n molekulaarinen vaikutus mRNA:n ilmentymiin A375-soluissa
- TB:n molekulaarinen vaikutus proteiinien ilmentymiin A375-soluissa
- Keskustelu
- Johtopäätös
- Data Availability Statement
- Eettinen lausunto
- Tekijän panos
- Rahoitus
- Conflict of Interest
- Lyhenteet
Introduction
Melanooma on kuolemaan johtava ihosyöpätyyppi, jolla on suuri metastaattisuuspotentiaali ja vaikeasti hoidettavissa oleva metastasoituva potentiaali (Yang et ai., 2018). Melanoomapotilaat ovat pitkälle edenneissä vaiheissa aina leikkauskelvottomia ja heillä on huonompi ennuste (Leonardi et al., 2018). Kemoterapia on melanooman kliinisen hoidon peruspilari, mutta kemoterapioiden teho on rajallinen niiden terveisiin kudoksiin kohdistuvien sivuvaikutusten vuoksi (Oliveira Pinho et al., 2019). Viime aikoina on kehitetty useita immunoterapioita, kuten CTLA-4- tai PD-1-reseptorin estäjiä, uusiksi vaihtoehdoiksi melanooman hoitoon, mutta niiden tehot ovat epäluotettavia ja sivuvaikutukset ovat edelleen vähäisiä (Rodríguez-Cerdeira ym., 2017). Siksi tarvitaan kiireellisesti uusia strategioita, joiden tehokkuus ja turvallisuus ovat tyydyttäviä. Perinteinen kiinalainen lääketiede (TCM) on täydentävä lähestymistapa, ja sitä on sovellettu kliinisesti tuhansien vuosien ajan, ja sillä on tietty tehokkuus ja vähemmän sivuvaikutuksia. TCM:n teorian mukaan syöpä liittyy liman, toksiinien tai tulehduksen kertymiseen elimistöön, ja limaa, myrkkyjä tai tulehdusta ehkäisevillä yrtteillä voi olla syövänvastaisia vaikutuksia (Wang ja Cheng, 2019). Teoriaa ovat tukeneet monet tapaukset. Esimerkiksi Rhizoma Curcumae longae -yrtin kurkumiini käytti sytotoksisia vaikutuksia indusoimalla apoptoosia ja estämällä melanoomasolujen angiogeneesiä (Mirzaei et al., 2016), ja Vitex negundon sisältämä vitexiini tukahdutti melanoomasolujen kasvua indusoimalla DNA-vaurioita ja lisäämällä ROS-tasoja (Liu et al., 2018). Siksi TCM:n kasviperäisillä komponenteilla on suuri potentiaali syöpien, kuten melanooman, hoidossa.
Tee on yksi maailman yleisimmistä juomista. Se on tunnettu paitsi erikoisesta mausta myös terveyshyödyistä. Prosessieroista johtuen teetä on kolmea päätyyppiä, joihin kuuluvat fermentoimaton vihreä tee, osittain fermentoitu oolong-tee ja täysin fermentoitu musta tee eli pu-erh-tee (Kuo et al., 2005). Teelehtiä on luonnehdittu TCM-yrtiksi, jolla on limaa ja myrkkyjä ehkäiseviä ominaisuuksia, mikä viittaa sen syöpää ehkäisevään potentiaaliin. Nykyaikaisissa tutkimuksissa on raportoitu, että teejuoma on tehokas syövän ehkäisyssä ja hoidossa (Jin et al., 2018). Äskettäin on havaittu, että teen polyfenoleilla on syövänvastaista toimintaa, jolla on parempi vaikutus kuin teejuomalla (Mao et al., 2019). Teaflaviini (TF) on tällainen polyfenolikomponentti, joka syntyy teelehtien katekiinien hapettumisesta fermentoinnin aikana ja joka toimii teen värin, maun ja bioaktiivisuuden pääpigmenttinä (Roberts et al., 1957). Se kykenee indusoimaan apoptoosia erilaisissa syöpäsolulinjoissa, kuten ihmisen rintasyövän solulinjoissa (MCF-7, MDA-MB-231, T47D ja ZR-75-1), paksusuolen karsinooman solulinjoissa (HCT-15 ja HT-29) ja maksasyövän solulinjoissa (HCCLM3 ja Huh-7), mikä viittaa syövänvastaiseen potentiaaliin (Adhikary ym. ym., 2009; Lahiry ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym. ym., 2010). Silti sen vaikutukseen melanoomaa kohtaan on toistaiseksi kiinnitetty vain vähän huomiota.
Ottaen huomioon TF:n raportoidut pro-apoptoottiset vaikutukset moniin syöpäsolulinjoihin (Lahiry et al., 2008), esitimme hypoteesin, että TF:llä on pro-apoptoottisia vaikutuksia melanoomasoluihin. Tämän todentamiseksi suoritettiin in vitro -kokeet TF:n sytotoksisen pro-apoptoottisen vaikutuksen arvioimiseksi ihmisen melanoomasoluihin ja suoritettiin in vivo -koe käyttämällä ksenograft-mallia toukkavaiheessa olevissa seeprakaloissa sen kasvainta estävän vaikutuksen määrittämiseksi. Lisäksi tutkittiin TF:n mekanismia.
Materiaalit ja menetelmät
Materiaalit ja kemikaalit
Teaflaviini (TF, >95 % puhtausaste) saatiin Theabio Co., Ltd:ltä (Hangzhou, Kiina) (Eränumero: 20181211061). Dulbecco′s modified Eagle′s medium (DMEM), joka sisälsi runsaasti glukoosia (4,5 g/l), saatiin HyClone Laboratoriesilta (UT, USA). Naudan sikiöseerumi (FBS) saatiin Cell Maxilta (Beijing, Kiina). Trypsiini (0,25 %) saatiin Gibcolta (NY, USA). 3-(4,5-dimetyylitatsoli-2-yyli)-2,5-difenyylitetratsoliumbromidi (MTT) ja dimetyylisulfoksidi (DMSO) saatiin Sigmasta (St. Louis, MO, USA). Annexin-V: FITC apoptoosin havaitsemispakkaus saatiin BD Biosciencesilta (CA, USA). 4′-6-diamidino-2-fenylindoli (DAPI) -värjäysliuos saatiin Thermo Fisher Scientificiltä (MA, USA). Ensisijaiset vasta-aineet saatiin Cell Signaling Technologylta (MA, USA). Trizol-reagenssi ja reaaliaikaisen polymeraasiketjureaktion (real time PCR) kitit saatiin TaKaRa:lta (Dalian, Kiina).
Solulinjojen valmistelu
Ihmisen HFF-1-ihon fibroblastit ja A375-melanoomasolulinja saatiin Shanghain tiedeakatemian Shanghain solupankista (Shanghain, Kiina) ja ihmisen A875-melanoomasolulinja saatiin Kunmingin tiedeakatemian Kunmingin solupankista (Kunming, Kiina). Näitä solulinjoja kasvatettiin DMEM-mediassa, joka sisälsi 10 % FBS:ää, 37 °C:ssa kostutetussa 5 %:n CO2-inkubaattorissa. Väliaine vaihdettiin päivittäin, ja soluja käsiteltiin TF:llä niiden logaritmisessa kasvuvaiheessa.
Seeprakalojen valmistus
Wild-tyyppinen AB-kanta seeprakaloja saatiin Kiinan tiedeakatemian hydrobiologian instituutin Kiinan seeprakalojen resurssikeskuksesta (Wuhan, Kiina), ja se akkreditoitiin kansainvälisen laboratorioeläinten hoidon arviointi- ja akkreditointiyhdistyksen (SYXK 2012-0171) toimesta. 2 dpf:n (days post fertilization) ikäiset seeprakalojen toukat tuotettiin luonnollisella parittelulla, ja ne pidettiin valo-ohjatussa vesiviljelylaitoksessa, jossa oli vakiovalokausi 14:10 h päivä/yö, ja niitä ruokittiin elävillä suolakatkaravuilla kahdesti päivässä ja kalanpoikashiutaleilla kerran päivässä.
Solujen elinkelpoisuusmääritys ja morfologinen havainnointi
MTT-määritykset suoritettiin TF:n estävien vaikutusten määrittämiseksi melanoomasolulinjoihin aiemmin kuvatulla tavalla (Zhou et al., 2017). Soluja kylvettiin 96-kuoppalevyihin 6 × 103 solua/kuoppa 200 μl:n väliaineeseen 24 tunnin adheesiota varten, minkä jälkeen niitä käsiteltiin TF:llä pitoisuuksina 0, 50, 100, 150, 200, 250, 300 ja 400 μg/ml 24, 48 ja 72 tunnin ajan. Tämän jälkeen 20 μl MTT-liuosta (5,0 mg/ml) lisättiin kuhunkin kuoppaan ja inkuboitiin 37 °C:n lämpötilassa 4 tuntia. DMSO (150 μl) lisättiin kuhunkin kuoppaan ja optinen tiheysarvo (OD-arvo) mitattiin 490 nm:ssä Biorad-mikrolevylukijalla (CA, USA). Inhibitioprosentti (%) = × 100 %. 50 %:n inhiboiva pitoisuus (IC50) 24, 48 ja 72 tunnin ajan laskettiin regressioanalyysillä. Näin ollen 120, 240 ja 360 μg/ml (232,3, 464,7 ja 697,0 μM) nimettiin mataliksi, keskisuuriksi ja suuriksi TF-annoksiksi. Sitten HFF-1-, A375- ja A875-solulinjat kylvettiin 96-kuoppalevyille edellä esitetyllä tavalla ja niitä käsiteltiin keskimmäisellä TF-annoksella 24 h. A375-solujen solumorfologiaa havainnoitiin Carl Zeissin fluoresenssimikroskoopilla (Göttingen, Saksa).
Apoptoosin analysointi DAPI-värjäyksellä ja virtaussytometrialla
Solujen apoptoosi määritettiin DAPI-värjäyksellä ja annexin-V/PI-värjäykseen perustuvalla virtaussytometrialla. DAPI-värjäystä varten A375-solut kylvettiin 96-kuoppalevyille ja niitä käsiteltiin TF:llä pienillä, keskisuurilla ja suurilla pitoisuuksilla 24 tunnin ajan, minkä jälkeen ne fiksoitiin 4-prosenttisella paraformaldehydillä PBS:ssä 30 minuutin ajan huoneenlämmössä ja värjättiin DAPI:llä 10 minuutin ajan pimeässä. Kolminkertaisen pesun jälkeen soluja havainnoitiin viidellä peitelevyllä Carl Zeissin fluoresenssimikroskoopilla (Göttingen, Saksa) ja apoptoottiset solut laskettiin. Virtaussytometria suoritettiin valmistajan ohjeiden mukaisesti. Lyhyesti sanottuna A375-soluja kylvettiin 6-kuoppalevyille 3 × 105 solua/kuoppa 24 tunnin ajan ja niitä käsiteltiin TF:llä matalilla, keskisuurilla ja korkeilla pitoisuuksilla vielä 48 tunnin ajan. Tämän jälkeen solut pestiin kahdesti ja leimattiin sitoutumispuskurissa olevilla annexin V-fluoresiini-isotiosyanaattiliuoksella ja PI:llä. Solujen fluoresenssin voimakkuus havaittiin BD C6 -virtaussytometrialla (CA, USA). Analyysi toistettiin ja varhaisen apoptoosin ja myöhäisen apoptoosin soluprosentit (%) laskettiin.
Xenograft Animal Assay
TF:n annosalueen määrittämiseksi käytettiin kaikkiaan 300 toukan zebrafissiä 3 dpf:n iässä, ja ne kasvatettiin satunnaisesti 6-kuoppalevyihin, joissa kussakin oli 30 kalaa. TF:ää liuotettiin kuhunkin kuoppaan 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1 000 ja 2 000 μg/ml:n annoksina 24 tunnin ajan. Tämän jälkeen kunkin ryhmän kaloja tarkkailtiin stereoskooppisella mikroskoopilla kuolleisuuden ja haittatapahtumien kirjaamiseksi. Kuten aiemmassa tutkimuksessamme kuvattiin, TF:n NOAEL-arvo (no observed adverse effect level) arvioitiin, ja 1/9 NOAEL-arvoa, 1/3 NOAEL-arvoa ja NOAEL-arvoa käytettiin pieninä, keskisuurina ja suurina annoksina seuraavassa kokeessa (Jin et al., 2018).
Ksenotransplanttimallin luomiseksi A375-solut värjättiin CM-Dilillä (punainen fluoresenssi) laimennoksella 1:1 000 ja mikroinjektoitiin toukkien seeprakalojen (2 dpf) keltarauhasiin annoksella 200 solua/kala. Kun kasvain oli kasvanut 24 tunnin ajan, kaikkia kaloja tarkkailtiin fluoresoivalla mikroskoopilla (AZ100, Nikon, Tokio, Japani) mallin todentamiseksi. A375-soluja kantavat kalat ryhmiteltiin viiteen ryhmään (30 kalaa kukin) ja niitä käsiteltiin vastaavasti 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL ja NOAEL TF:llä sekä 15 μg/ml (50 μM) sisplatiinia 24 h. Seeprakalojen A375-solumassan fluoresenssin voimakkuus (FI) havaittiin, ja inhibitioprosentti laskettiin seuraavasti: inhibitioprosentti (%) = × 100 %.
Real Time PCR (qPCR) -analyysi
TF:n molekulaaristen vaikutusten paljastamiseksi A375-soluihin käytettiin qPCR:ää ABI QuantStudio™ 7 Flex Real-Time PCR -järjestelmässä (Applied Biosystems, CA, USA). A375-solujen kokonais-RNA uutettiin Trizol-reagenssilla ja syntetisoitiin cDNA:ksi käänteisellä transkriptiolla. qPCR-reaktiojärjestelmän tilavuus oli 20,0 μl: 10 μl SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl PCR forward -aloitinta, 0,8 μl PCR reverse -aloitinta, 2,0 μl templaatti-cDNA:ta, 0,4 μl ROX-referenssiväriainetta ja 6,0 μl ddH2O. qPCR-reaktio-olosuhteet asetettiin 95 °C:seen 30 sekunnin aloitusdenaturaation ajaksi, 40 sykliin 95 °C:seen 5 sekunnin denaturaation ajaksi, 60 °C:seen 34 sekunnin annealingin ajaksi ja 72 °C:seen 40 sekunnin pidennyksen ajaksi. Kunkin reaktion lopussa tehtiin sulamiskäyräanalyysi. Vertailugeeninä käytettiin β-ACTIN:iä, ja kunkin geenin suhteellisen ilmentymisen analysointiin sovellettiin 2-ΔΔCT-menetelmää (taulukko 1).

Taulukko 1 qPCR-analyysissä käytetyt alukesekvenssit.
Western Blot (WB) -analyysi
A375-solujen proteiiniekspressio TF-käsittelyllä 0 μg/ml ja 120 μg/ml (232,3 μM) analysoitiin WB-analyysillä. Kokonaisproteiinit uutettiin lyysipuskurilla (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1 % Triton, 0,1 % SDS, 5 μg/ml leupeptiini ja 1 mM PMSF) 30 minuutin ajan jäällä toistuvasti jäädyttäen ja sulattaen. Kohdennetut proteiinit erotettiin denaturoivalla natriumdodekyylisulfaatti-polyakryyliamidigeelielektroforeesilla (SDS-PAGE) (8~12 %) ja siirrettiin sitten polyvinylideenifluoridikalvolle (PVDF) (Millipore, MA, USA). Kalvo estettiin 5-prosenttisella rasvattomalla maidolla 2 tunnin ajan, minkä jälkeen sitä inkuboitiin yön yli 4 °C:ssa vasta-aineilla: ACTIN, ASK1, ATM, fosforyloitu ATM (p-ATM), ATR, fosforyloitu ATR (p-ATR), pilkkoutunut kaspaasi 3 (c-CASP3), pilkkoutunut kaspaasi 8 (c-CASP8), CHK1, CHK2, fosforyloitu CHK1 ja CHK2 (p-CHK1 ja p-CHK2), JNK, fosforyloitu JNK (p-JNK), C-JUN, fosforyloitu C-JUN (p-C-JUN), pilkkoutunut PARP (poly ADP-riboosipolymeraasi), P53 ja fosforyloitu P53 (p-P53). Toissijaisen vasta-aineen kanssa inkuboinnin jälkeen nämä proteiinit visualisoitiin tehostetulla kemiluminesenssikitillä (Amersham Pharmacia Biotech, Little Chalfort, Iso-Britannia) ja havaittiin kemiluminesenssianalysaattorilla.
Statistinen analyysi
Tiedot ilmaistiin keskiarvoina ± SD, ja niille suoritettiin yksisuuntainen analyysi (one-way ANOVA), jota seurasi Fisherin pienimmän merkitsevän eron (least significant difference) vertailu. Kaikki analyysit tehtiin käyttäen DPS-ohjelmiston päivitettyä versiota (Tang ja Zhang, 2013).
Tulokset
TF:n antiproliferatiivinen vaikutus
Kuten kuvasta 1A käy ilmi, TF:llä 50 μg/ml (96.8 μM) esti merkittävästi A375-solujen elinkelpoisuutta, ja estoasteet kasvoivat TF:n pitoisuuksien kasvaessa 50-400 μg/ml (96,8-744,4 μM) (kukin P < 0,01 vs. normaali taso), mikä osoittaa pitoisuusriippuvaista tapaa. Estonopeudet kasvoivat myös TF-käsittelyn myötä 24-72 h, jolloin IC50 oli vastaavasti 218,9 – 84,9 μg/ml (423,8 – 164,4 μM). Sitten käytimme 120, 240 ja 360 μg/ml (232,3, 464,7 ja 697,0 μM) TF-L-, TF-M- ja TF-H-annoksina. Kuten kuvasta 1B näkyy, TF-M esti selvästi A375- ja A875-solujen elinkelpoisuutta, mutta sillä oli vain vähän vaikutusta HFF-1-soluihin. Kuten kuvasta 1C käy ilmi, A375-solujen morfologia muuttui selvästi ja elävien solujen määrä väheni TF-käsittelyn myötä kasvavilla pitoisuuksilla.

KUVIO 1 A375-solujen solujen elinkelpoisuus TF-käsittelyllä 24, 48 ja 72 tunnin kohdalla (A), HFF-1-, A375- ja A875-solujen solujen elinkelpoisuus TF-käsittelyllä 24 tunnin kohdalla (B) ja A375-solujen morfologia teaflaviini- (TF-) käsittelyllä 24 tunnin kohdalla (C). Tiedot olivat keskiarvo ± SD (n = 5). Fisherin pienimmän merkitsevän eron (LSD) moninkertaisten vertailujen avulla tiedot (keskiarvo ± SD), joissa on sama pieni kirjain (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d), eivät merkitse merkitsevää eroa keskenään, kun taas tiedot, joissa on eri kirjaimet (a vs. b vs. c vs. b vs. b vs. e vs. f vs. g), merkitsevät merkittävää eroa keskenään. Mittakaavapalkki = 200 μm.
TF:n pro-apoptoottinen vaikutus
DAPI-värjäys ja virtaussytometria suoritettiin TF:n pro-apoptoottisen vaikutuksen arvioimiseksi A375-soluihin. DAPI-värjäyksen tulos osoitti apoptoottista morfologiaa, mukaan lukien kutistunut muoto, karyopyknoosi ja ydinfragmentaatio, A375-soluissa TF-käsittelyllä 120-360 μg/ml (232,3-697,0 μM) (kuva 2A). Apoptoottisten solujen lukumäärät lisääntyivät merkittävästi TF-käsittelyllä 240 ja 360 μg/ml (464,7 ja 697,0 μM) (kukin P < 0,01 vs. NC) (Kuva 2C). Virtaussytometrian tulos osoitti TB:n aiheuttaman A375-solujen varhaisen apoptoosin ja myöhäisen apoptoosin (kuva 2B). Varhaisten ja myöhäisten apoptoottisten solujen lukumäärät kasvoivat TF-hoidon yhteydessä 120-360 μg/ml (232,3-697,0 μM) (kuva 2B), ja niiden osuudet olivat merkittävästi suuremmat TF-hoidon yhteydessä, kun TF-hoito oli 360 μg/ml (697,0 μM) (P < 0,01 ja P < 0,05 vs. normaali taso) (kuvat 2D, E). Tulokset osoittivat, että TF indusoi A375-solujen apoptoosia pitoisuusriippuvaisella tavalla.
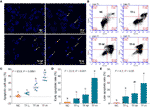
KUVIO 2 DAPI-värjäyshavainnot (A) ja virtaussytometria-analyysi (B) A375-soluista, joille on annettu teaflaviinihoito (TF). Apoptoottisten solujen määrän tilastollinen analyysi (C), varhaisen apoptoosin määrän tilastollinen analyysi (D) ja myöhäisen apoptoosin määrän tilastollinen analyysi (E). Fisherin pienimmän merkitsevän eron (LSD) moninkertaisten vertailujen avulla tiedot (keskiarvo ± SD), joissa on sama pieni kirjain (a vs. ab; ab vs. b; b vs. b; c vs. c), osoittavat, että niiden välillä ei ole merkitsevää eroa, kun taas tiedot, joissa on eri kirjaimet (a vs. b vs. c), osoittavat merkitsevän eron toisiinsa. Mittakaavapalkki = 100 μm.
TF:n in vivo -vaikutus ksenografiineihin
Kuvassa 3A on esitetty TF-hoitoa saaneiden zebrafiisien kuolleisuuden ja haittavaikutusten käyrät. Kalojen kuoleman aiheutti TF 31,25 μg/ml (60,5 μM), eikä yksikään kala selvinnyt hengissä TF 125 μg/ml (242,0 μM) -annoksella, mikä osoittaa, että TF:n suurin ei-tappava annos on pienempi kuin 31,25 μg/ml (60,5 μM). Haittatapahtumia, mukaan lukien ruumiin epänormaali pyöriminen ja turvotus, havaittiin TF-käsittelyn yhteydessä 3,47 μg/ml (6,7 μM) ja sen suurempien annosten välillä, mikä osoittaa, että TF:n NOAEL-arvo on alle 3,47 μg/ml (6,7 μM). Toistettujen testien jälkeen NOAEL-arvoksi arvioitiin lopulta 2,0 μg/ml (3,9 μM). Näin ollen 0,22, 0,67 ja 2,0 μg/ml (0,4, 1,3 ja 3,9 μM) käytettiin TF:n alhaisina, keskisuurina ja suurina annoksina myöhemmissä kokeissa.
Kuten kuvassa 3B on esitetty, A375-solujen ksenotransplantaattimalli luotiin toukkavaiheessa oleviin seeprakaloihin, ja kaloissa olevien solujen solumassan fluoresoivia intensiteettejä testattiin. 24 tunnin käsittelyn jälkeen TF 0,22-2,0 μg/ml (0,4, 1,3 ja 3,9 μM) esti selvästi A375-kasvaimen kasvua, ja estoasteet olivat 1,0-46,4 %. TF:n estovaikutukset 0,67 ja 2,0 μg/ml (1,3 ja 3,9 μM) olivat merkitseviä, jos niitä verrattiin malliryhmään (P < 0,01), ja TF:n vaikutus 2,0 μg/ml (3,9 μM) oli jopa suurempi kuin sisplatiinin vaikutus sen NOAEL-arvolla (50 μM).
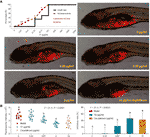
KUVIO 3 Teaflaviinin (TF) aiheuttama kuolleisuus ja haittatapahtumat toukkien seeprakalojen kohdalla ja havainnot toukkien seeprakaloista, joihin oli istutettu A375-soluja ksenotransplantaatiolla TF- tai sisplatiinikäsittelyllä (A), sekä TF:n fluoresenssin voimakkuus ja estonopeudet (B). Punaisella fluoresoiva alue edustaa A375-solujen massaa. LSD-moninkertaisten vertailujen avulla tiedot (keskiarvo ± SD), joissa on sama pieni kirjain (a vs. a; c vs. c), eivät merkitse merkitsevää eroa keskenään, kun taas tiedot, joissa on eri kirjaimet (a vs. b vs. c), merkitsevät merkitsevää eroa keskenään.
TF:n molekulaarinen vaikutus mRNA:n ilmentymiin A375-soluissa
F:n kohdegeenien suhteelliset mRNA:n ilmentymiset testattiin qPCR-määrityksellä. Kuten kuvasta 4 käy ilmi, TF:n vaikutuksesta BAX:n, BIM:n, C-MYC:n, P21:n, P53:n ja PUMA:n ilmentymät nousivat merkittävästi (kukin P < 0,01 vs. NC-taso), lukuun ottamatta BAX:n ilmentymää TF-käsittelyllä sen alhaisella pitoisuudella. Vaikka BCL-2:n ilmentymistä TF sääteli ylöspäin, BAX/BCL-2:n suhdeluvut olivat merkittävästi korkeammat TF-käsittelyllä sen keski- ja korkeilla pitoisuuksilla kuin NC-tasolla (P < 0,01), mikä osoittaa BAX:n tärkeimmän roolin TF:n vaikutuksessa.
TB:n molekulaarinen vaikutus proteiinien ilmentymiin A375-soluissa
WB:tä käytettiin TF:n kohteena olevien proteiinien ilmentymisen ja fosforylaation määrittämiseksi. Kuten kuvasta 5 näkyy, ATM:n, p-ATM:n, CHK1:n, p-CHK1:n, p-CHK2:n, p-P53:n, c-PARP:n, ASK1:n, JNK:n, p-JNK:n, C-JUN:n (48 kd), p-C-JUN:n (Ser 63), c-CASP8:n ja c-CASP3:n ilmentymiä säädeltiin merkitsevästi TF:n vaikutuksesta annostelussa, kun annostelussa käytettiin 120 μg/ml:aa (232,3 μm:aa) (kumpikin P < 0,01 vs. NC-taso). Lisäksi TF:n vaikutukset ATR:ään, p-ATR:ään, CHK2:een, P53:een, C-JUN:iin (43 kd) ja p-C-JUN:iin (Ser 73) olivat merkityksettömiä (kukin P > 0.05 vs. NC-taso).
Keskustelu
Vaikka TF:n syövänvastaiset vaikutukset on dokumentoitu hyvin (Sur ja Panda, 2017; Takemoto ja Takemoto, 2018; Sajadimajd ym, 2020), tieto sen tehosta melanoomaan on edelleen vähäistä. Tämän aukon täyttämiseksi tässä tutkimuksessa tehtiin in vitro- ja in vivo -kokeita TF:n vaikutusten ja mekanismin tutkimiseksi melanoomasoluja vastaan. Osoitimme ensimmäistä kertaa TF:n sytotoksiset pro-apoptoottiset ja kasvainta estävät vaikutukset melanooma A375-soluihin. Sen mekanismin ehdotettiin liittyvän P53- ja JNK-reitteihin. Tämän tutkimuksen uutuus on TF′:n melanoomavastaisen tehon havaitseminen, kun aiemmat raportit keskittyivät vain TF′:n vaikutuksiin muihin kasvaimiin (Lin, 2002; Sur ja Panda, 2017). Lisäksi tämä on myös ensimmäinen raportti TF:n molekulaarisesta vaikutuksesta JNK-reittiin, kun taas TF′:n pro-apoptoottisen vaikutuksen P53-reittiin liittyvästä mekanismista syöpäsoluihin on raportoitu aiemmin (Lahiry et al., 2008).
Viime aikoina ksenotransplantaattikasvainmallit, joissa on käytetty toukkavaiheen seeprakaloja, ovat herättäneet yhä suurempaa huomiota syövänvastaisissa tutkimuksissa toukkavaiheen seeprakalojen etujen vuoksi verrattuna muihin eläinmalleihin: (2) kehon läpinäkyvyys mahdollistaa kasvaimen kasvun ja lääkkeiden myrkyllisyyden in vivo näkyvän tarkkailun; ja (3) laajamittainen sukupolvi ja nopea organogeneesi mahdollistavat lyhyemmät koeajat (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). Tässä tutkimuksessa TF:llä oli annosriippuvainen estovaikutus A375-kasvaimen massaan toukkien seeprakaloissa (kuva 3B), ja estoaste oli 46,4 % NOAEL-arvolla (3,9 μM). Estoaste oli korkeampi kuin sisplatiinin estoaste, mikä osoittaa, että TF oli tehokkaampi kuin sisplatiini niiden turvallisella annosalueella. Lisäksi inhibitioaste oli korkeampi kuin toisen teepigmentin (teabrowniini) inhibitioaste (Jin et al., 2018), mikä viittaa siihen, että TF on teen tehokkain komponentti. TF:n tehokas in vivo -annosalue (1,3-3,9 μM) on kuitenkin paljon pienempi kuin sen tehokas in vitro -annosalue (96,8-774,4 μM). Syynä tällaiseen eroon voi olla se, että suun kautta annostelun jälkeen metaboloituneilla TF-johdannaisilla on suurempi vaikutus kuin TF:llä. Se osoittaa, että suun kautta annostelu voi olla TF:n osalta tehokkaampaa kuin muut antoreitit.
Annosmuunnossäännön mukaan TF:n tehokkaat annokset (1,3 ja 3,9 μM) toukkien seeprakalojen toukkien kohdalla voidaan arvioida olevan 0,03-0,09 mg/kg ihmisellä (Zhang ym., 2003). Tämä viittaa siihen, että TF:n oraalinen anto näin pienellä annosalueella voi olla tehokasta melanoomapotilaiden hoidossa, mikä viittaa tämän yhdisteen hyvään kustannustehokkuuteen. Tietojemme mukaan TF:n kliinisestä käytöstä on vain muutamia raportteja. Kaksoissokkoutetussa, satunnaistetussa, plasebokontrolloidussa rinnakkaisryhmätutkimuksessa TF:llä rikastettua vihreän teen uutetta on käytetty lievää tai keskivaikeaa hyperkolesterolemiaa sairastavien potilaiden hoitoon 12 viikon ajan (Maron ym., 2003). Kyseisessä tutkimuksessa TF:n päivittäinen saanti oli 75 mg vihreän teen uutteessa, mikä vähensi merkittävästi kokonaiskolesterolia, LDL-C:tä ja triglyseridejä hyperkolesterolemiaa sairastavilla aikuisilla ilman, että merkittäviä haittavaikutuksia havaittiin (Maron ym., 2003). Tässä tutkimuksessa TF:n tehokas annosalue oli paljon pienempi kuin raportoitu, mikä viittaa TF:n suurempaan potentiaaliin melanooman hoidossa klinikassa. Vaikka TF:n tehokas annosalue oli pieni, sen tappavan annoksen kynnysarvo seeprakalan toukille oli kuitenkin myös matala (<60,5 μM) ja alhaisempi kuin muilla teepigmenteillä (Kuva 3A) (Jin et al., 2018), mikä jättää huolen TF:n mahdollisesta myrkyllisyydestä ihmisille. Mielenkiintoista oli, että havaitsimme, että TF:llä oli vain vähän vaikutusta normaaliin solulinjaan (HFF-1-ihon fibroblastiin) (kuva 1B), mikä viittaa sen ulkoisen käytön kliiniseen toteutettavuuteen, jolla voidaan välttää sen sisäisen käytön mahdollinen myrkyllisyys.
Mekanistinen kokeilumme osoitti, että TF aktivoi P53-reitillä ATM:n, CHK1/2:n, P53:n, CASP8/3:n ja aktivoi JNK-reitillä ASK1:n, JNK: n ja C-JUN:n, mikä liittyy A375-solujen apoptoosiin. Apoptoosi määritettiin DAPI-värjäyksellä ja virtaussytometrisellä analyysillä solutasolla (kuva 2), ja se välittyi pro-apoptoottisten geenien (P53, BAX, BIM ja PUMA) yliekspressiosta ja apoptoosiin liittyvien proteiinien (kaspaasien ja PARP:n) aktivoitumisesta molekyylitasolla (kuvat 4 ja 5). P53 (TP53) koodaa DNA:ta sitovaa ydinfosfoproteiinia, jolla on kasvainsuppressoriaktiivisuus ja joka toimii transkriptiotekijänä keskellä verkostoa, jolla kontrolloidaan apoptoosia vasteena solustressiin (Martin ym., 2002). Se aktivoi apoptoosia stimuloimalla Bcl-2-perheen geenien, kuten BAX:n, BIM:n ja PUMA:n, transkriptiota (Levine ja Oren, 2009). BAX ja BIM koodaavat pro-apoptoottisia jäseniä, jotka aiheuttavat apoptoosia ja solukuolemaa aktivoimalla kaspaasikaskadin vastauksena apoptoottisiin ärsykkeisiin (Rossé ym., 1998; Youle ja Strasser, 2008). PUMA, joka on P53:n ylössäätämä apoptoosin modulaattori, koodaa BH3-domeenin sisältävää proteiinia, joka lokalisoituu mitokondrioihin, on vuorovaikutuksessa Baxin ja Bakin kanssa ja aktivoi kaspaasikaskadin pilkkomalla CASP3:n (Nakano ja Vousden, 2001; Letai, 2009). Tässä tutkimuksessa CASP8 ja CASP3 pilkottiin vastauksena P53-aktivoitumiseen. CASP8 on apoptoottisen kaskadin aloittava kaspaasi, joka aktivoi CASP3:n apoptoottista DNA:n pirstoutumista varten, mikä johtaa PARP:n (c-PARP) myöhempään pilkkomiseen apoptoottisen prosessin toteuttamiseksi (Jänicke ym., 1998; Stennicke ym., 1998; Boulares ym., 1999). PARP vastaa DNA:n korjauksesta ja solujen elinkelpoisuudesta vastauksena eksogeeniseen stressiin (Satoh ja Lindahl, 1992). CASP3 voi pilkkoa sen ja helpottaa siten solun hajoamista apoptoosissa (Oliver et al., 1998). Siten pilkotun PARP:n (c-PARP) määrää voidaan käyttää solujen apoptoosin merkkiaineena.
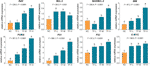
KUVA 4 Teaflaviiniin (TF) kohdistuvien geenien suhteellinen mRNA-ekspressio A375-soluissa 24 tunnin käsittelyn jälkeen. Fisherin pienimmän merkitsevän eron (LSD) moninkertaisten vertailujen avulla samalla pienellä kirjaimella merkityt tiedot (keskiarvo ± SD) (a vs. a; b vs. b; c vs. c) osoittavat, että niillä ei ole merkittävää eroa toistensa välillä, kun taas eri kirjaimilla merkityt tiedot (a vs. b vs. c vs. d) merkitsevät merkitsevää eroa keskenään.
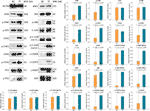
KUVIO 5 Teaflaviiniin (TF) kohdistuvien proteiinien ilmentyminen ja fosforylaatio A375-soluissa 24 tunnin käsittelyn jälkeen. Eri pienillä kirjaimilla merkityt tiedot (keskiarvo ± SD) eroavat merkitsevästi toisistaan Fisherin pienimmän merkitsevän eron (LSD) moninkertaisissa vertailuissa.
Edellisissä tutkimuksissamme olemme raportoineet, että DNA-vaurion induktio liittyi teabrowniinin P53-reitin välittämään pro-apoptoottiseen mekanismiin (Wu ym., 2016; Jin ym., 2018). Vaikka sekä TF että teabrowniini aktivoivat P53-reittiä ja indusoivat kasvainsolujen apoptoosia, emme kuitenkaan havainneet DNA-vaurioinduktiota TF-hoidon yhteydessä tässä tutkimuksessa. Vaihtoehtoisesti havaitsimme ASK1-JNK-C-JUN-kaskadin aktivoitumisen, joka toimii myös apoptoottisena reittinä. Tässä signalointimoduulissa ASK1 (apoptoosisignaalia säätelevä kinaasi 1) on mitogeeniaktivoitu proteiinikinaasi, jolla on keskeinen rooli sytokiinien ja stressin aiheuttamassa apoptoosissa käynnistämällä mitokondrioista riippuvainen reitti (Matsuzawa ja Ichijo, 2001; Zhang ym., 2003). Se aktivoi jatkoketjun JNK-signalointia vasteena erityyppisiin stressitekijöihin, mikä johtaa solujen apoptoosiin C-JUN-aktivaation ja sitä seuraavan pro-apoptoottisten geenien yliekspression kautta (Tobiume et al., 2001). Kemoterapeuttisten aineiden, kuten sisplatiinin, doketakselin ja paklitakselin, on raportoitu indusoivan melanoomasolujen apoptoosia P53-reitistä riippumattoman JNK-reitin kautta (Mandic ym., 2001; Mhaidat ym., 2008; Selimovic ym., 2008). Tämä viittaa siihen, että TF:llä saattaa olla etulyöntiasema näihin lääkkeisiin verrattuna sen kaksitie-välitteisen vaikutusmekanismin ansiosta, mikä on alustavasti osoitettu TF:n suuremmilla kasvainta estävillä vaikutuksilla kuin sisplatiinin vaikutuksilla tässä tutkimuksessa. Tässä tutkimuksessa on kuitenkin joitakin rajoituksia, jotka ovat seuraavat: (1) P53- ja JNK-reittien toimintaa TF:n ehdotetussa kaksitie-välitteisessä mekanismissa ei ole varmistettu; (2) P53- ja JNK-reittien välistä vuorovaikutusta ei ole tutkittu, ja ei tiedetä, kumpi reitti on tärkeimmässä roolissa; ja (3) in vitro -annosalue ja in vivo -annosalue ovat varsin erilaiset, minkä syy on selitetty, mutta se vaatii kokeellista näyttöä. Näiden kysymysten käsittelemiseksi tarvitaan tulevaisuudessa lisätutkimuksia. Esimerkiksi P53:n ja JNK:n siRNA:ta tai inhibiittoreita olisi käytettävä näiden reittien vaikutusten todentamiseksi ja toistensa välisen vuorovaikutuksen tutkimiseksi, ja TF:n seerumin metaboliitit olisi analysoitava kemiallisesti ja tutkittava farmakologisesti hypoteesimme testaamiseksi, jonka mukaan metaboloituneilla TF-johdannaisilla on suurempi vaikutus kuin TF:llä. Lisäksi, koska TF:stä ei ole kliinisiä raportteja syövän hoidossa, TF:n terapeuttista tehoa ja hyötyjä syöpäpotilailla olisi tutkittava tarkemmin.
Johtopäätös
Koska TF:n syövänvastainen potentiaali on hyvin dokumentoitu, on edelleen epäselvää, onko TF tehokas melanooman hoidossa. Tässä tutkimuksessa havaitsimme melanoomasolulinjaa ja ksenograft-seeprakalamallia käyttämällä TF:n sytotoksisia pro-apoptoottisia ja kasvainta estäviä vaikutuksia melanoomasoluihin ja paljastimme sen mekanismin yhdessä P53- ja JNK-reittien aktivointien kanssa. Tämä on ensimmäinen tutkimus, jossa kuvataan TF:n vaikutuksia ja mekanismia melanoomasoluja vastaan. Koska TF:n mekanismi ei ollut riippuvainen ainoastaan P53-reitistä, voidaan olettaa, että TF voi olla tehokas P53-mutaation saaneiden solulinjojen hoidossa. Lisätutkimukset ovat perusteltuja tämän päätelmän todentamiseksi. Kaiken kaikkiaan tämä tutkimus tarjoaa näyttöä TF:n tehosta melanoomaa vastaan, mikä edistää TF:stä johdettujen aineiden kehittämistä melanooman hoitoon.
Data Availability Statement
Tämän artikkelin johtopäätöksiä tukevat raakadatat ovat saatavissa vastaavalta kirjoittajalta perustellusta pyynnöstä.
Eettinen lausunto
Eläintutkimus tarkastettiin ja hyväksyttiin Zhejiangin kiinalaisen lääketieteellisen yliopiston eettisessä komiteassa.
Tekijän panos
LeZ suoritti tämän artikkelin päätyön. BY suoritti solu- ja molekyylikokeet. LiZ ja SM osallistuivat tämän käsikirjoituksen kirjoittamiseen. WD antoi ideoita ja rahoitustukea tähän työhön. YX suoritti seeprakalakokeen. LS suunnitteli tämän työn ja laati käsikirjoituksen. TE paransi tämän työn suunnittelua ja luonnosta. Kaikki kirjoittajat osallistuivat artikkelin kirjoittamiseen ja hyväksyivät toimitetun version.
Rahoitus
Tätä työtä ovat tukeneet Kiinan kansallinen luonnontieteellinen säätiö (apurahat nro 81774331, 81873049 ja 81973873), Zhejiangin maakunnan luonnontieteellinen säätiö (apuraha nro LY18H270004), Zhejiangin maakunnan perinteisen kiinalaisen lääketieteen tiede- ja teknologiaprojekti (apuraha nro. 2016ZZ011), Zhejiang Provincial Key Construction University Superiority Characteristic Discipline (Traditional Chinese Pharmacology) ja Opening Foundation of China (Grant No. ZYX2018006).
Conflict of Interest
YX oli Hunter Biotechnology, Inc:n palveluksessa.
Muut kirjoittajat ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
Lyhenteet
DAPI, 4′-6-diamidino-2-fenylindoli; DMEM, Dulbecco′s modified Eagle′s medium; DMSO, dimetyylisulfoksidi; dpf, days post fertilization (hedelmöityksen jälkeiset päivät); FBS, naudan sikiön seerumi; FI, fluoresenssin voimakkuus; LSD, Fisherin pienin merkitsevä ero; NOAEL, no observed adverse effect level; MTT, 3-(4,5-dimetyylitatsoli-2-yyli)-2,5-difenyylitetratsolibromidi; PARP, poly ADP-riboosipolymeraasi; SDS-PAGE, denaturoiva natriumdodekyylisulfaatti-polyakryyliamidigeelielektroforeesi; TCM, teaflaviini; TF, perinteinen kiinalainen lääketiede.
Adhikary, A.., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Teaflaviinit hidastavat ihmisen rintasyöpäsolujen migraatiota estämällä NF-kappaB:tä p53-ROS-ristikytkennän kautta. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. (1999). Poly(ADP-riboosi)polymeraasin (PARP) pilkkoutumisen rooli apoptoosissa. Kaspaasi-3-resistentti PARP-mutantti lisää apoptoosin määrää transfektoiduissa soluissa. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., M. R., Porter, A. G. (1998). Kaspaasi-3:a tarvitaan apoptoosiin liittyvään DNA:n pirstoutumiseen ja morfologisiin muutoksiin. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Teabrowniini laukaisee DNA-vaurion tukahduttamaan ihmisen osteosarkooma U2OS-soluja aktivoimalla p53-signalointireitin. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Seeprakalan ksenotransplantaatiot välineenä ihmisen syöpää koskevissa in vivo -tutkimuksissa. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Vertailevat tutkimukset oolong-, musta-, pu-erh- ja vihreän teen lehtien hypolipideemisistä ja kasvua hillitsevistä vaikutuksista rotilla. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). P53-välitteisen Bax-transaktivaation osuus teaflaviinin aiheuttamassa maitorauhasen epiteelikarsinoomasolujen apoptoosissa. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Teaflaviinit kohdistuvat Fas/caspase-8- ja Akt/pBad-reitteihin apoptoosin indusoimiseksi p53-mutoituneissa ihmisen rintasyöpäsoluissa. Carcinogenesis 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Seeprakala: uusi malli lääkealan catwalkilla. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Ihomelanooma: From pathogenesis to therapy (Review). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma iskee Baxiin. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.200903134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). P53:n ensimmäiset 30 vuotta: kasvava yhä monimutkaisemmaksi. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Teaflaviinit estävät ATP-syntaasia ja hengitysketjua lisäämättä superoksidin tuotantoa. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Syövän kemopreventio teepolyfenoleilla moduloimalla signaalinsiirtoratoja. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Vitexin-yhdiste 1, uusi uutos kiinalaisesta yrtistä, tukahduttaa melanoomasolujen kasvua DNA-vaurion kautta lisäämällä ROS-tasoja. J. Exp. Clin. Sisplatiini indusoi Bakin proapoptoottisen konformaation deltaMEKK1-riippuvaisella tavalla. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Tee ja sen komponentit ehkäisevät syöpää: Katsaus redoxiin liittyvään mekanismiin. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Teaflaviinilla rikastetun vihreän teen uutteen kolesterolia alentava vaikutus: satunnaistettu kontrolloitu tutkimus. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). TP53-kasvainsuppressoriproteiinin mutaatiotietojen ja rakenneanalyysin integrointi. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Elämän ja kuoleman välisen päätöksen molekyylimekanismit: apoptoosin säätely apoptoosisignaalia säätelevällä kinaasi 1:llä. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Endoplasmisen retikulumiin liittyvän stressin osallistuminen ihmisen melanooman doketakselin aiheuttamaan JNK-riippuvaiseen apoptoosiin. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., ym. et al. (2016). Curcumin: Uusi ehdokas melanooman hoitoon? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, uusi proapoptoottinen geeni, on p53:n indusoima. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Kehittyvät nanoteknologiset strategiat systeemiseen kemoterapiaan melanoomaa vastaan. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Poly(ADP-riboosi)polymeraasin ja sen pilkkomisen merkitys apoptoosissa. Oppia pilkkomattomasta mutantista. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Koo, C. K., C. L., Gilleland, C. L., Wasserman, C. S. C., M. C., M. F., M. F., Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. K., Wasserman, S. C., Pardo-Martin, C., Chang, T.-Y. Korkean läpimenon in vivo selkärankaisten seulonta. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). Valmistetun teen fenoliset aineet. I. Vesiliukoisten aineiden fraktiointi ja paperikromatografia. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Melanooman immunoterapian edistysaskeleet: kattava katsaus. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Luonnollisten polyfenolien edistysaskeleet ihosyövän syöpälääkkeinä. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Poly(ADP-riboosin) muodostumisen rooli DNA:n korjauksessa. Nature 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Taksolin aiheuttama mitokondriaalinen stressi melanoomasoluissa välittyy c-Jun N-terminaalisen kinaasin (JNK) ja p38-reittien aktivoitumisen kautta uncoupling protein 2:n kautta. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Teaflaviinit tukahduttavat kasvaimen kasvua ja etäpesäkkeitä STAT3-reitin estämisen kautta hepatosellulaarisessa karsinoomassa. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). Pro-kaspaasi-3 on kaspaasi-8:n tärkeä fysiologinen kohde. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Molekulaariset näkökohdat teen ja teen polyfenolien syövän kemopreventiivisestä ja terapeuttisesta tehokkuudesta. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Teaflaviinien synteesi ja niiden toiminnot. Mol. (Basel Switzerland) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Data Processing System (DPS) -ohjelmisto, jossa on kokeellinen suunnittelu, tilastollinen analyysi ja tiedonlouhinta ja joka on kehitetty käytettäväksi entomologisessa tutkimuksessa. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1:tä tarvitaan JNK/p38 MAP-kinaasien jatkuvaan aktivoitumiseen ja apoptoosiin. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analyysit syöpätoksiinin patogeneesiteoriasta ja ”kehon vastustuskyvyn vahvistamisen ja lähteen puhdistamisen” teoriasta. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Teabrowniinin antiproliferatiivinen ja apoptoosia indusoiva vaikutus ei-pienisoluisen keuhkojen adenokarsinooman A549-soluja vastaan. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). Epidemiologinen katsaus ruokavaliosta ja ihon pahanlaatuisesta melanoomasta. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). BCL-2-proteiiniperhe: vastakkaiset toiminnot, jotka välittävät solukuolemaa. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Seeprakala: eläinmalli toksikologisiin tutkimuksiin. Curr. Protoc. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Teabrowniini estää keuhkokarsinooman solusyklin etenemistä ja kasvaimen kasvua c-myc:hen liittyvän mekanismin kautta. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar