- Introduction
- Materiaalit ja menetelmät
- Tutkimusjoukko
- Tutkimusmuuttujat
- Tulokset
- Ab0/Rh-veriryhmän jakauma PCa-potilailla
- No Significant Differences in Clinicopathologic Characteristics among PCa Patients Among AB0/Rh Blood Groups According to AB0/Rh Blood Groups
- Veriryhmällä ei ollut merkittävää ennustearvoa BCR-vapaan eloonjäämisen kannalta RP:n jälkeen
- Keskustelu
- Tietoinen suostumus
- Eettinen lausunto
- Tekijöiden panos
- Conflict of Interest Statement
Introduction
Eturauhassyöpä (PCa) on yleisin pahanlaatuinen kasvain läntisissä maissa ja toiseksi yleisin syöpään liittyvien kuolemantapausten syy miehillä (1). Tunnetuimpia riskitekijöitä PCa:n kehittymiselle ovat ikääntyminen, etninen alkuperä ja sukuhistoria (2). Perinnöllinen alttius viittaa siihen, että tautiin liittyy perinnöllinen geneettinen komponentti (3), mutta se muodostaa vain vähemmistön (5-10 %) PCa-tapauksista. Tämän vuoksi useimmille potilaille altistavia ympäristö- ja geneettisiä tekijöitä ei vielä tunneta (4, 5). AB0-veriryhmä on perinnöllinen ominaisuus, joka on yhdistetty useiden pahanlaatuisten kasvainten esiintyvyyteen ja ennusteeseen (6-8). AB0-veriryhmän ja syöpäriskin välillä havaitun yhteyden selittämiseksi on ehdotettu useita uskottavia mekanismeja, kuten tulehdusta, pahanlaatuisten solujen immuunivalvontaa, solujen välistä adheesiota ja kalvosignaalien välittämistä.
AB0-veriryhmän antigeenit (ABH) ovat punasolujen pinnalla ilmentyviä glykoproteiineja. Fenotyyppiset A- ja B-antigeenit ovat terminaalisia hiilihydraatteja, jotka syntetisoidaan lisäämällä yksittäisiä sokereita, joita katalysoi joukko spesifisiä glykosyylitransferaaseja. Fenotyypille 0 on ominaista A- ja B-glykosyylitransferaasien puuttuminen, jolloin esiintyy vain proteiinin selkäranka, H-antigeeni. Punasolujen antigeeneillä on erilaisia tehtäviä, kuten kalvon rakenteellinen eheys, molekyylien kuljetus kalvojen läpi ja adheesio (9). Sen lisäksi, että ABH-antigeenejä ilmentyy punasoluissa, niitä ilmentyy myös monissa epiteelisoluissa, kuten uroteelissä, ruoansulatuskanavan limakalvoilla ja keuhkoissa. Useissa tutkimuksissa on osoitettu, että ABH:n ilmentymismalli syöpäsoluissa muuttuu kasvaimen asteen ja taudin etenemisen mukaan, mikä viittaa mahdolliseen yhteyteen AB0-veriryhmän ja joidenkin epiteeliperäisten pahanlaatuisten sairauksien riskin välillä (8, 10). Viimeaikaiset tutkimukset osoittivat, että henkilöillä, joilla oli veriryhmä A, AB tai B, haimasyövän ilmaantuvuus oli lisääntynyt verrattuna henkilöihin, joilla oli veriryhmä 0, kun taas korkeimman riskin todettiin liittyvän veriryhmään B (8). Vastaavasti veren serotyypin A raportoitiin olevan yhteydessä suurempaan maha-, rinta- ja munasarjasyövän riskiin (11). Toisaalta veriryhmä 0 korreloi korkeimpaan uusiutumis- ja etenemisprosenttiin transuretraalisen virtsarakon resektion jälkeen ja oli siten yhteydessä huonompaan ennusteeseen potilailla, joilla oli ei-lihasinvasiivinen virtsarakon uroteelikarsinooma (6).
Perustuen nykyiseen näyttöön veriryhmän ennustavasta merkityksestä useissa pahanlaatuisissa kasvaimissa, oletimme, että veriryhmää voidaan käyttää lisäparametrina, joka helpottaa riskien arviointia ja auttaa arvioimaan ennustetta leikkauksen jälkeen PCa-potilailla. Nykyisessä kirjallisuudessa on saatavilla vain vähän kliinistä näyttöä veriryhmästä ja PCa:sta yleensä, mikä on osoittanut ristiriitaisia tuloksia (12-14) Lisäksi tällä hetkellä on olemassa vain yksi tutkimus, jossa keskitytään erityisesti veriryhmien vaikutukseen radikaalin eturauhasen poistoleikkauksen (RP) jälkeisten potilaiden lopputulokseen (13). Kirjoittajat käyttivät 555 potilasta, joilla oli PCa ja joille oli tehty RP, ja osoittivat AB0-veriryhmän olevan riippumaton biokemiallisen uusiutumisen (BCR) ennustaja monimuuttuja-analyysissä mutta ei yksimuuttuja-analyysissä.
Tämän tutkimuksen tavoitteena oli siis lisätä lisätietoa meneillään olevaan keskusteluun analysoimalla AB0/Rh-veriryhmän ja sen jakautumisen korrelaatiota PCa-potilailla, kasvaimen patologiaa, uusiutumista ja kuolleisuutta potilailla, joilla on paikallinen PCa ja joille on tehty RP, käyttämällä suurta yhden keskuksen aineistoa, johon kuului 3574 potilasta.
Materiaalit ja menetelmät
Tutkimusjoukko
Tutkimus hyväksyttiin laitoksen tarkastuslautakunnassa. Yhteensä 3582 potilasta, joilla oli kliinisesti paikallistettu PCa ja joille tehtiin RP laitoksessamme vuosina 2009-2010, seulottiin tutkimukseen sisällyttämistä varten. Ne potilaat, joiden tiedot olivat puutteelliset ja joiden seuranta puuttui (n = 8), jätettiin pois (n = 8), joten analyysia varten oli käytettävissä 3574 potilasta.
Radikaalinen eturauhasen poisto tehtiin avoimella retropubisella lähestymistavalla (n = 3220) tai robottiavusteisella laparoskooppisella lähestymistavalla (n = 354), kuten aiemmin on kuvattu (15). Imusolmukkeiden poisto suoritettiin D’Amicon keskiriski- ja korkean riskin potilaille Euroopan urologiyhdistyksen (EAU) PCa:ta koskevien ohjeiden mukaisesti (16). Leikkausnäytteet käsiteltiin tavanomaisten histopatologisten menettelyjen mukaisesti, ja kokeneet uropatologit arvioivat ne suuren volyymin keskuksessa (>2 000 eturauhasen poistonäytettä vuodessa). Kasvaimet porrastettiin American Joint Committee on Cancerin vuoden 2007 TNM-porrastusjärjestelmän mukaisesti, ja histopatologinen luokitus annettiin Gleason-järjestelmän mukaisesti (17).
Kaikki osallistujat testattiin serologisesti ennen RP:tä. AB0- ja Rh-veriryhmän laboratoriovahvistus saatiin Hamburg-Eppendorfin yliopistollisen sairaalan verensiirtolääketieteen osastolta. Kontrollina käytettiin Saksan väestön AB0-vertailujakaumaa (18).
Tutkimusmuuttujat
Tutkimusmuuttujiin kuuluivat AB0/Rh-veriryhmä, ikä, preoperatiivinen eturauhaspesifinen antigeeni (PSA), eturauhasen tilavuus (transrektaalinen ultraäänitutkimus), Gleasonin pistemäärä (näyte), pT-aste, pN-aste, leikkausmarginaali, BCR ja kuolleisuus RP:n jälkeen. Potilaiden seuranta koostui PSA-testauksesta 3-6 kuukauden välein kahden ensimmäisen vuoden aikana RP:n jälkeen, BCR määriteltiin PSA-tasoksi ≥0,2 ng/ml.
Ab0-veriryhmän ja kliinispatologisten muuttujien välistä suhdetta arvioitiin khiin neliö -testeillä ja t-testeillä. Coxin regression monimuuttuja-analyysissä (log-rank-testit) arvioitiin veriryhmän, preoperatiivisen PSA:n, Gleasonin pistemäärän, pT-vaiheen, pN-statuksen ja leikkausmarginaalin vaikutusta BCR-vapaaseen eloonjäämiseen eloonjäämisen ennustearvojen arvioimiseksi. BCR-vapaan eloonjäämisen todennäköisyyttä verrattiin 0-, A-, B- ja AB-ryhmissä Kaplan-Meierin analyysin ja log-rank-testin avulla.
Kaikki testit olivat kaksimielisiä, ja p-arvoja <0,05 pidettiin tilastollisesti merkitsevinä. Tilastolliset analyysit tehtiin JMP-ohjelmistolla v9.0.2 (SAS Institute, Inc., Cary, NC, USA) ja R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Tulokset
Loppuanalyyseihin kelpuutettiin yhteensä 3574 potilasta, joilla oli kliinisesti paikallistettu PCa, iän mediaani leikkaushetkellä oli 65 vuotta (vaihteluväli: 38-80) ja seurannan mediaani 36,9 kuukautta (taulukko 1).

TAULUKKO 1. AB0-veriryhmän ja Rhesus-tekijän yhteys 3 574 radikaalilla eturauhasen poistolla hoidetun potilaan kliinispatologisiin ominaisuuksiin.
Ab0/Rh-veriryhmän jakauma PCa-potilailla
Ab0-veriryhmän jakauma PCa:ta sairastavilla potilailla ennen RP:n suorittamista oli seuraava: 0 1350 potilaalla (38 %), A 1605 potilaalla (45 %), B 445 potilaalla (12 %) ja AB 174 potilaalla (5 %). 83 % potilaista oli Rh-positiivisia (taulukko 1). Saksan väestön viitejakauma on seuraava (18): 0 41 %:lla, A 43 %:lla, B 11 %:lla, AB 5 %:lla, Rhesuspositiivinen 85 %. AB0- sekä Rh-veriryhmien kokonaisjakaumat tutkimuskohortissa vastasivat saksalaisessa miesväestössä havaittua jakaumaa.
No Significant Differences in Clinicopathologic Characteristics among PCa Patients Among AB0/Rh Blood Groups According to AB0/Rh Blood Groups
Potilaiden enemmistöllä oli kliinisesti paikallistettu PCa, jolla oli keskitason riskiprofiili. Eniten raportoitu Gleason-pistemäärä oli 3 + 4 (66,9 %), ja 63,3 %:lla potilaista preoperatiiviset PSA-tasot olivat välillä 4-10 ng/ml. 68,7 %:lla todettiin pT2-kasvaimia, ja 81,3 %:lla potilaista saavutettiin negatiivinen marginaali. Eturauhasen tilavuuden mediaani oli 40 ml, ja imusolmukkeiden osallistuminen diagnosoitiin 224 (6,3 %) potilaalla (taulukko 1). Eri AB0-veriryhmiin kuuluvien potilaiden kliinispatologisissa ominaisuuksissa ei ollut merkittäviä eroja. AB-veriryhmään kuuluvilla potilailla todettiin hieman enemmän pitkälle edennyttä kasvainta (≥pT3b) kuin veriryhmiin 0, A ja B kuuluvilla potilailla (16,1, 12,6, 9,9 ja 13,7 %, p = 0,033). AB-veriryhmään kuuluvassa potilaspopulaatiossa esiintyi myös kohtalaisen paljon negatiivista Rh-tekijää (21,8 %) verrattuna muihin veriryhmiin (16,9 %, p = 0,01) (taulukko 1).
Veriryhmällä ei ollut merkittävää ennustearvoa BCR-vapaan eloonjäämisen kannalta RP:n jälkeen
Monimuuttujaisen cox-regressioanalyysin mukaan preoperatiivinen PSA, Gleasonin pistemäärä, pT-aste, pN-status ja leikkausmarginaali korreloivat merkitsevästi ja itsenäisesti BCR-vapaan eloonjäämisen kanssa (kaikki p < 0,05) (taulukko 2). AB0-veriryhmällä ei kuitenkaan voitu havaita olevan vaikutusta BCR-määriin (kuva 1). Arvioimme edelleen veriryhmän 0 ennustearvoa verrattuna muihin kuin 0-veriryhmiin sekä vaihtoehtoisten veriryhmien A/B/AB sisällä, mutta tulokset olivat merkityksettömiä (taulukko 2). Vaikka tehtiin osa-analyysi, jossa oli vain potilaita, joilla oli positiivinen tai negatiivinen marginaalistatus, AB0/Rh:n vaikutus BCR:ään oli merkityksetön (kuvat 2A,B). Myöskään potilaiden Rhesus-tekijän statuksella ei ollut vaikutusta BCR-vapaaseen eloonjäämiseen (p = 0,74).
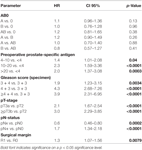
TAULUKKO 2. AB0:n ja tavanomaisten ennustetekijöiden monimuuttujaiset cox-regressiomallit biokemiallisesta uusiutumattomasta eloonjäämisestä.
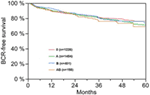
Kuva 1. Biokemiallisesta uusiutumisesta (BCR) vapaa eloonjääminen radikaalin eturauhasen poiston jälkeen AB0-veriryhmien mukaan ositettuna (p = 0,572).
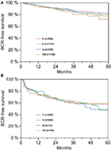
KUVIO 2. Biokemiallisesta uusiutumisesta vapaa eloonjääminen radikaalin eturauhasen poiston jälkeen. (A,B) Biokemiallisesta uusiutumisesta (BCR) vapaa eloonjääminen radikaalin eturauhasen poistoleikkauksen jälkeen AB0-veriryhmien mukaan jaoteltuna potilailla, joilla leikkausmarginaalin status oli negatiivinen ja positiivinen.
Keskustelu
Mahdollisia yhteyksiä AB0-veriryhmän ja joidenkin epiteelialueen pahanlaatuisten kasvainten riskin välillä, mukaan lukien haima-, paksusuoli- ja mahasyövän riski, on raportoitu usein (19, 20). Lisäksi AB0/Rh-veriryhmät ovat saatavilla useimmilta potilailta ennen kirurgista toimenpidettä, joten niitä ehdotetaan ihanteelliseksi lisämarkkeriksi ilman ylimääräisiä laboratoriokäsittelyvaiheita.
Joitakin vuosikymmeniä sitten tehdyissä immunohistokemiallisissa tutkimuksissa osoitettiin, että potilailta peräisin olevilla PCa-soluilla on erilainen ABH:n ilmentymismalli kuin normaaleilla/benigneillä eturauhassoluilla (21). Koska sekä AB0-veriryhmän että sen antigeenin ilmentymisen kudoksessa on raportoitu olevan yhteydessä ilmaantuvuuteen, taudin etenemiseen ja lopputulokseen useissa pahanlaatuisissa kasvaimissa (8, 22, 23), tällainen ABH-antigeenin muuttunut ilmentyminen eturauhaskudoksessa viittasi veriryhmän mahdolliseen vaikutukseen eturauhassolujen pahanlaatuiseen transformaatioon.
Marktin ja työtovereiden hiljattain julkaisemassa tutkimuksessa (14) analysoitiin AB0-veriryhmän suhdetta riskiin, joka liittyy aggressiivisen PCa:n esiintymiseen. Kirjoittajat analysoivat aineiston, johon kuului 2 774 potilasta, joilla oli aggressiivinen PCa, ja 4 443 potilasta, joilla ei ollut PCaa kontrollina. Näiden tietojen perusteella AB0-veriryhmän tai A- tai B-alleelien ”annoksen” ja aggressiivisen PCa:n riskin välillä ei voitu osoittaa merkittävää korrelaatiota. Kirjoittajat raportoivat myös syöpäspesifisen ja kokonaiskuolleisuuden veriryhmittäin, mutta tutkimukseen ei sisältynyt tietoja PCa-taudin hoidosta. Lisäksi mukaan otettiin vain potilaita, joilla oli aggressiivinen kasvain, mikä saattaa peittää alleen eri veriryhmien mahdollisen vaikutuksen.
Nämä tulokset ovat samansuuntaisia kuin Kvistin ja kollegoiden johtamassa tutkimuksessa, joka osoitti, ettei AB0-veriryhmän ja tarkkaavaisella odottamisella hoidettujen PCa-potilaiden eloonjäämisajan välillä ole yhteyttä. Tätä tutkimusta rajoitti lähinnä pieni tapausmäärä (n = 279) (12). Mielenkiintoista on, että ainoassa RP:n jälkeisiin potilaisiin keskittyvässä tutkimuksessa, johon osallistui 555 japanilaista potilasta, raportoitiin hiljattain, että veriryhmä 0 liittyi merkitsevästi pienempään BCR-riskiin RP:n jälkeen monimuuttuja- mutta ei yksimuuttuja-analyysissä (13). Niiden potilaiden osa-analyysissä, joilla oli negatiivinen leikkausmarginaali, 5 vuoden BCR-vapaa osuus veriryhmässä 0 oli merkittävästi korkeampi kuin ryhmässä A (91,2 vs. 71,0 %; p = 0,026). Tässä tutkimuskohortissa 46,3 prosentilla potilaista oli positiivinen leikkausmarginaali, vaikka 74,2 prosentilla potilaista kliininen vaihe oli T1c. Patologista vaihetta (pT) ei mainittu.
Retrospektiivinen kohorttimme, johon kuului 3574 potilasta, joilla oli kliinisesti lokalisoitunut PCa, on suurin tähän mennessä analysoitu kohortti, jonka avulla on pyritty selvittämään sekä AB0- että Rh-veriryhmien mahdollinen vaikutus kasvaimen ominaisuuksiin ja lopputulokseen RP:n jälkeen. Tässä tutkimuksessa suurimmalla osalla potilaista oli pT2-kasvain (68,7 %) ja 18,6 %:lla oli positiivinen marginaalistatus. Näiden tietojen avulla emme pystyneet osoittamaan AB0/Rh-veriryhmien merkittävää vaikutusta kliinispatologisiin ominaisuuksiin (preoperatiivinen PSA, Gleasonin pisteet, eturauhasen tilavuus, pT-vaihe, pN-status ja leikkausmarginaali) ja BCR-vapaaseen eloonjäämiseen kuratiivisen RP:n jälkeen. Lisäksi AB0/Rh:n vaikutus BCR:ään oli merkityksetön, kun tehtiin osa-analyysi, jossa tarkasteltiin vain potilaita, joilla oli positiivinen tai negatiivinen marginaalistatus. Näin ollen emme voineet toistaa japanilaisen tutkimuksen tuloksia (13). Toisin kuin muissa pahanlaatuisissa kasvaimissa, kuten haima- tai virtsarakon syövässä, AB0/Rh-veriryhmällä ei ollut ennustearvoa PCa-taudissa.
Tutkimukseemme liittyy useita tärkeitä rajoituksia. Ensimmäisenä ja tärkeimpänä ovat retrospektiivisille analyyseille ominaiset rajoitukset ja kontrolliryhmän puuttuminen. Lisäksi tutkimuskohorttimme sisältää pääasiassa lokalisoitunutta PCa:ta, jonka riskiprofiili on matala tai keskisuuri (Gleasonin pisteet 3 + 4 66,9 %:lla, preoperatiivinen PSA 4-10 ng/ml 63,3 %:lla, pT2 68,7 %:lla ja negatiiviset marginaalit 81,3 %:lla potilaista), mikä mahdollistaa suotuisan ennusteen omaavien potilaiden esivalinnan. Lisäksi AB:n kokonaisjakauma on – toisin kuin muissa veriryhmissä – yleisesti ottaen vähäinen (4,9 %). Jotkin havainnot, kuten negatiivisen Rh-tekijän kohtalaisen suurentunut osuus (21,8 %) AB-potilailla verrattuna muihin veriryhmiin (16,9 %, p = 0,01), voivat mahdollisesti johtua Rh-negatiivisen AB-tyypin harvinaisuudesta, mikä estää korrelaation havaitsemisen tilastollisesti merkitsevästi tässä alaryhmässä. Lopuksi tieto kyseisen veriryhmän genotyypistä puuttui.
Yllä mainittujen piirteiden lisäksi ympäristöön, maantieteeseen ja rotuun liittyviä seikkoja ei voida koskaan jättää huomiotta keskusteltaessa AB0-veriryhmän ja syövän välisistä korrelaatioista. Rodulliset ja etniset erot veriryhmissä sekä PCa-taudissa tunnetaan hyvin (24, 25). Euroopassa, jossa PCa on yleisin pahanlaatuinen sairaus ja toiseksi yleisin syöpään liittyvä kuolinsyy miehillä (1), yleisimmät veriryhmät ovat A ja 0, ja ne lisääntyvät B-alleeliin lännestä itään. Sitä vastoin Aasian maille, joissa PCa-taudin ilmaantuvuus on alhaisin ja asteeltaan matala, on ominaista B-tyypin suuri esiintyvyys ja 0-tyypin suhteellisen pieni esiintyvyys sekä pienempi väestö, jolla on negatiivinen Rh-tekijä (26). Tältä osin tuloksemme eroavat tämänhetkisestä tutkimuksesta japanilaisilla potilailla, joilla oli suhteellisen korkea positiivinen marginaalistatus ja BCR kuratiivisen RP:n jälkeen (13).
Moneita mekanismeja on ehdotettu selittämään, miten veriryhmä vaikuttaa syövän ilmaantuvuuteen ja etenemiseen; ne ovat kuitenkin edelleen epäselviä. Virtsarakon syövän tapauksessa on ehdotettu kromosomipoikkeamaa, koska AB0-geeni sijaitsee kromosomissa 9q34, joka on usein muuttunut virtsarakon syövässä (27). Koska AB0-geeni itse asiassa koodaa glykosyylitransferaaseja, jotka katalysoivat sokerien siirtymistä H-antigeeniin (0), virtsarakon syövän esiintyminen korreloi mahdollisesti veriryhmän 0 kanssa. Sitä vastoin on raportoitu, että henkilöillä, joilla on muu kuin 0-veriryhmä (A, AB ja B), on kohonnut riski sairastua mahasyöpään, mikä viittaa veriryhmän syöpäspesifiseen rooliin.
PCa-taudin osalta on käynnissä useita pyrkimyksiä selvittää veriryhmän merkitystä hoidon jälkeiseen selviytymiseen. On jo raportoitu, että potilailla, joiden veriryhmä ei ole 0, pitäisi olla lisääntynyt laskimotromboemboliariski RP:n jälkeen, millä voi olla vaikutusta lopputulokseen (28). Hiljattain julkaistussa tutkimuksessa osoitettiin, että seerumin veriryhmän A vasta-aineet ennustavat eloonjäämistä PROSTVAC-VF:n (vaiheen III kliinisissä tutkimuksissa oleva poxviruspohjainen terapeuttinen syöpärokote pitkälle edenneen PCa:n hoitoon) jälkeen, ja sitä olisi pidettävä uutena potentiaalisesti ennustavana biomarkkerina PROSTVAC-VF:lle (29). Vaikka tutkimuksessamme ei havaittu selvää yhteyttä AB0/Rh-veriryhmän ja kasvaimen patologian ja lopputuloksen välillä, nämä todisteet viittaavat silti veriryhmän ennustavaan rooliin PCa:n epidemiologiassa ja kliinisessä lopputuloksessa, erityisesti hoitovasteen kannalta.
Tämä 3574 potilasta käsittävä tutkimus on toistaiseksi laajin tutkimus, jossa on analysoitu AB0- tai Rh-veriryhmän vaikutusta patologiaan ja lopputulokseen RP:n jälkeen, ja se lisää tärkeää tietoa kirjallisuuteen.
Johtopäätöksenä voidaan todeta, että tietomme viittaavat siihen, että AB0/Rh-veriryhmällä ei ole relevanttia yhteyttä epäsuotuisiin klinikkapatologisiin kasvainominaisuuksiin tai leikkauksen jälkeiseen syöpäsairauden lopputulokseen, päinvastoin kuin lukuisissa toisissa maligniteeteissa. Jatkotutkimukset ovat kuitenkin aiheellisia, jotta voitaisiin arvioida mahdollista yhteyttä veriryhmän genotyypin tai sen antigeenin ilmentymisen välillä PCa-kudoksessa ja ennusteen välillä eri hoitoryhmissä, mukaan lukien korkea-asteinen tai pitkälle edennyt PCa, joka ei näkynyt riittävästi tutkimusryhmässämme.
Tietoinen suostumus
Tietoinen suostumus saatiin kaikilta yksittäisiltä osallistujilta, jotka otettiin mukaan tutkimukseen.
Eettinen lausunto
Kaikki menettelyt, jotka suoritettiin tutkimuksissa, joihin osallistui ihmisiä, olivat laitoksen ja/tai kansallisen tutkimuskomitean eettisten standardien sekä Helsingin julistuksen 1964 ja sen myöhempien muutosten tai vertailukelpoisten eettisten standardien mukaisia.
Tekijöiden panos
SO, DT ja TS: olennainen panos työn konseptoinnissa tai suunnittelussa, työn luonnostelussa, lopullisen julkaistavan version hyväksynnässä. PM: olennainen osallistuminen työn ideointiin tai suunnitteluun, työn laatiminen, julkaistavan version lopullinen hyväksyminen. FC: tietojen hankinta, analysointi tai tulkinta työtä varten, työn kriittinen tarkistaminen tärkeän henkisen sisällön osalta, julkaistavan version lopullinen hyväksyminen. PT: aineiston hankinta, analyysi tai tulkinta työtä varten, sen kriittinen tarkistaminen tärkeän henkisen sisällön osalta, julkaistavan version lopullinen hyväksyminen. SP: aineiston hankinta, analyysi tai tulkinta työtä varten, sen kriittinen tarkistaminen tärkeän henkisen sisällön osalta, julkaistavan version lopullinen hyväksyminen. JLH, JH ja MG: tietojen hankinta, analyysi tai tulkinta työtä varten, kriittinen tarkistaminen tärkeän henkisen sisällön osalta, julkaistavan version lopullinen hyväksyminen. Kaikki kirjoittajat suostuivat vastaamaan työn kaikista näkökohdista varmistaakseen, että työn minkä tahansa osan tarkkuuteen tai eheyteen liittyvät kysymykset tutkitaan ja ratkaistaan asianmukaisesti.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Käsittelijätoimittaja ilmoitti, että hänellä on yhteisiä sidonnaisuuksia, vaikkakaan ei muuta yhteistyötä, useiden kirjoittajien kanssa (FC, SP, JH ja DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Eturauhassyövän riskitekijät. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Perinnöllisen eturauhassyövän geneettinen etiologia. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Raportoitu syöpä suvussa eturauhas-, keuhko-, paksusuoli- ja munasarjasyöpien syövän seulontatutkimuksessa. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, ym. ABO-verityypin vaikutus primaarista ei-muskelainvaasioivaa rakkosyöpää sairastavien potilaiden hoitotuloksiin. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013..11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034.
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreatic cancer risk and ABO blood group alleles: results from the pancreatic cancer cohort consortium. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. I-veriryhmän antigeenia koodaava geeni: katsaus I:n silmään. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. Veriryhmäantigeenien A, B ja H ilmentyminen karsinoomakudoksessa korreloi kolorektaalisyöpäpotilaiden huonon ennusteen kanssa. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO-veriryhmä ja epiteliaalisen munasarjasyövän esiintyvyys. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Eturauhassyöpäpotilaiden ennustemuuttujat: ABO (H) -veriryhmän, Rhesusjärjestelmän, iän, erilaistumisen, kasvaimen vaiheen ja etäpesäkkeiden vaikutus. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. ABO-veriryhmien ja biokemiallisen uusiutumisen väliset yhteydet radikaalin eturauhasen poiston jälkeen. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO-veriryhmäalleelit ja eturauhassyövän riski: tuloksia rinta- ja eturauhassyövän kohorttikonsortiosta (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovaskulaarisen rakenteen viereinen pakastepoikkileikkaustutkimus (NeuroSAFE) lisää hermoja säästävää taajuutta ja vähentää positiivisia leikkausmarginaaleja avoimessa ja robottiavusteisessa laparoskooppisessa radikaalisessa eturauhasen poistoleikkauksessa: kokemuksia 11 069 peräkkäisen potilaan jälkeen. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Guidelines on Prostate Cancer 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Eturauhasen adenokarsinooman ennusteen ennustaminen yhdistetyllä histologisella luokittelulla ja kliinisellä vaiheistuksella. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blood group determinates incidence for pancreatic cancer in Germany. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO-veriryhmät ja syöpä. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. ABO- ja Lewisin veriryhmäjärjestelmä. Immunokemia, genetiikka ja suhde ihmisen sairauksiin. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Veriryhmäantigeenien osoittaminen eturauhasen epiteelin pakastepoikkileikkeistä. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. ABH/Lewisiin liittyvien antigeenien ilmentyminen ennustetekijöinä rintasyöpäpotilailla. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. Veriryhmän ABO-geenin transkripti on alasreguloitunut ihmisen virtsarakon kasvaimissa ja kasvua stimuloivissa uroteelisolulinjoissa. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Eturauhassyöpää koskevat vertailevat tutkimukset Japanissa ja Yhdysvalloissa. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Model-based patterns in prostate cancer mortality worldwide. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. ABO- ja Rh(D)-fenotyyppien taajuudet eri rotu/etnisten ryhmien keskuudessa Yhdysvalloissa. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, ym. histoblood-ryhmän ABO(H) genotyyppinen ja fenotyyppinen karakterisointi primaarisissa virtsarakon kasvaimissa. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Eturauhassyöpä: ei-O-veriryhmä on VTE-riskitekijä radikaalin eturauhasen poiston jälkeen. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Seerumin vasta-aineet veriryhmä A:ta vastaan ennustavat selviytymistä PROSTVAC-VF-hoidossa. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar
.