punaisten verisolujen tärkein toiminnallinen ainesosa, joka toimii happea kuljettavana proteiinina; se on hemoproteiinityyppi, jossa kukin molekyyli on tetrameeri, joka muodostuu neljästä monomeeristä, joita heikot sidokset pitävät yhdessä. Se koostuu kahdesta polypeptidiketjuparista, globiineista, joihin kumpaankin on kiinnittynyt heemimolekyyli, joka koostuu raudasta ja protoporfyriinimolekyylistä. Symboli Hb.
Rauta-atomilla on vapaa valenssi ja se voi sitoa yhden happimolekyylin. Jokainen hemoglobiinimolekyyli voi siis sitoa yhden happimolekyylin. Yhden monomeerin hapen sitoutuminen lisää tetrameerin muiden monomeerien affiniteettia happea kohtaan. Tämä tekee hemoglobiinista tehokkaamman kuljetusproteiinin kuin monomeerinen proteiini, kuten myoglobiini.
Happea sitova hemoglobiini (oksihemoglobiini) on väriltään kirkkaanpunaista; happea sitomaton hemoglobiini (deoksihemoglobiini) on tummempaa. Tämä selittää valtimoveren kirkkaan punaisen värin, jossa hemoglobiini on noin 97-prosenttisesti hapella kyllästynyt. Laskimoveri on tummempaa, koska se on vain noin 20-70-prosenttisesti tyydyttynyt, riippuen siitä, kuinka paljon kudokset käyttävät happea. Hemoglobiinin affiniteetti hiilimonoksidia kohtaan on 210 kertaa voimakkaampi kuin sen affiniteetti happea kohtaan. Muodostunut kompleksi (karboksihemoglobiini) ei pysty kuljettamaan happea. Näin ollen hiilimonoksidimyrkytys johtaa hypoksiaan ja tukehtumiseen.
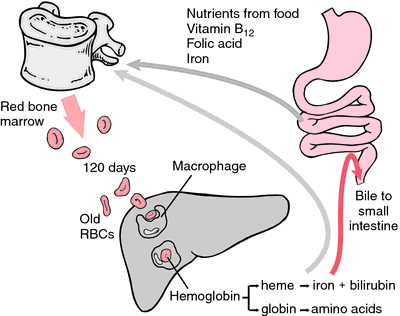
Toinen hemoglobiinin muoto, joka ei kykene kuljettamaan happea, on methemoglobiini, jossa rauta-atomi on hapettunut hapetusasteeseen +3. Punasolun 120 päivän elinkaaren aikana hemoglobiini hapettuu hitaasti methemoglobiiniksi. Ainakin neljä eri entsyymijärjestelmää voi muuntaa methemoglobiinin takaisin hemoglobiiniksi. Kun nämä entsyymit ovat viallisia tai ylikuormittuneita, seurauksena voi olla methemoglobinemia, jolloin korkeat methemoglobiinipitoisuudet aiheuttavat hengenahdistusta ja syanoosia.
Hemoglobiinin toissijainen tehtävä on toimia osana veren puskurijärjestelmää. Globiiniketjujen histidiinijäämät toimivat heikkoina emäksinä, jotka minimoivat veren pH:n muutosta, joka tapahtuu hapen imeytyessä ja hiilidioksidin vapautuessa keuhkoissa sekä hapen kulkeutuessa ja hiilidioksidin imeytyessä kudoksista.
Kun erytrosyytit kuluvat tai vaurioituvat, retikuloendoteelisysteemin makrofagit syövät niitä. Hemin porfyriinirengas muuttuu sappipigmentiksi bilirubiiniksi, joka erittyy maksasta. Rauta kulkeutuu luuytimeen liittyäkseen vasta muodostuneiden erytrosyyttien hemoglobiiniin.
Veren hemoglobiinipitoisuus vaihtelee hematokriitin mukaan. Veren hemoglobiinipitoisuuden normaaliarvot ovat miehillä 13,5-18,0 g/100 ml ja naisilla 12,0-16,0 g/100 ml. Normaali keskimääräinen korpuskulaarinen hemoglobiinipitoisuus, joka on pitoisuus punasolujen sisällä, on 32-36 g/100 ml.
Mutaatioista johtuvia epänormaaleja hemoglobiineja on löydetty useita. Joillakin on muuttunut happiaffiniteetti, jotkut ovat epästabiileja, ja joissakin rauta-atomi on hapettunut, mikä johtaa synnynnäiseen methemoglobinemiaan. Jotkin mutaatiot johtavat hemoglobiinisynteesin hidastumiseen. Kaikki tällaiset tilat tunnetaan nimellä hemoglobinopatiat.
Yleisin hemoglobinopatia on sirppisolusairaus, joka johtuu mutaatiosta, jossa β-ketjun kuudes aminohappo, normaalisti glutamiinihappo, on korvattu valiinilla. Variantti hemoglobiini α2βS2 tunnetaan nimellä Hb S. Mutaatioita, jotka johtavat toisen ketjun vähentyneeseen synteesiin, kutsutaan talassemioiksi. Ne voivat johtua ketjun geenin deletoitumisesta tai mutaatiosta ketjun synteesiä kontrolloivassa säätelygeenissä.