A: A savállandó meghatározása
Kétségtelenül tisztában vagy azzal, hogy egyes savak erősebbek, mint mások. A különböző vegyületek vagy funkciós csoportok relatív savasságát – más szóval, hogy azonos körülmények között milyen arányban képesek protont adni egy közös bázisnak – a savassági állandónak nevezett számmal, rövidítve Ka-val számszerűsítik. Az összehasonlításhoz választott közös bázis a víz.
Elsőként az ecetsavat tekintjük. Ha vízben hígított ecetsavoldatot készítünk, a sav (protondonor) és a víz (protonakceptor) között sav-bázis reakció játszódik le.
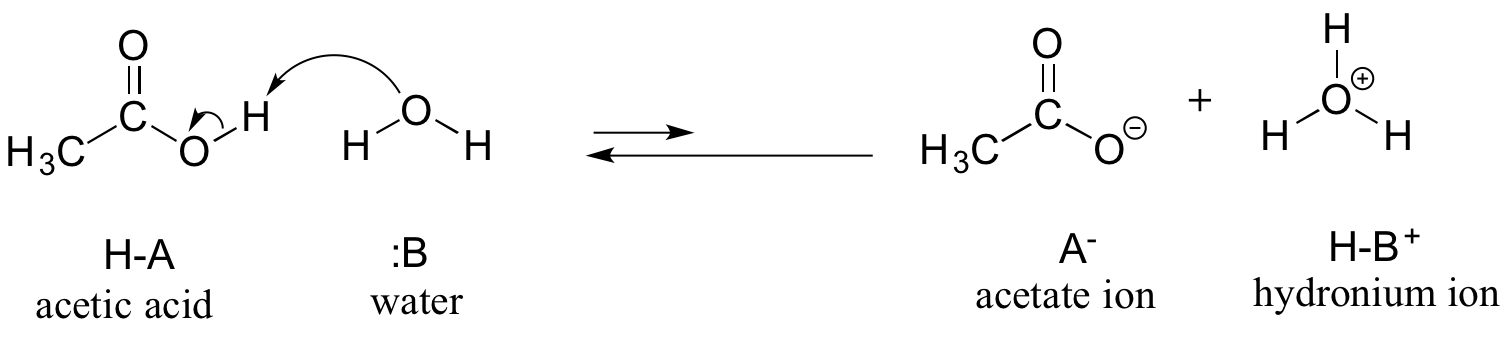
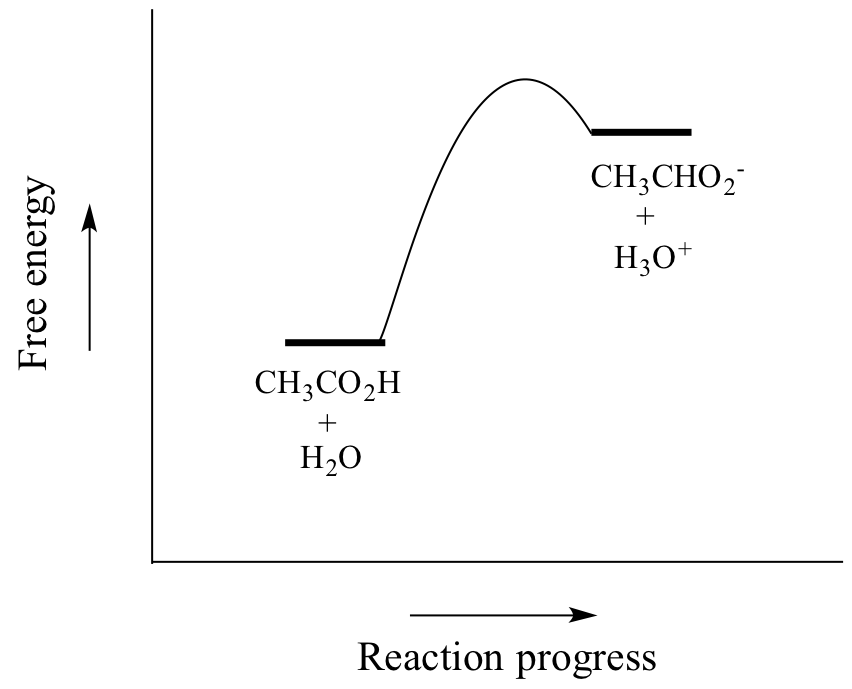
Az ecetsav gyenge sav, ezért az egyensúly a reaktánsoknak kedvez a termékekkel szemben – termodinamikailag “felfelé” halad, amint azt a fenti ábrán az előre és a hátrafelé mutató reakciónyilak relatív hossza, valamint az alábbi reakciókoordináta-diagram is jelzi, amelyen a termékek nagyobb energiájúak, mint a reaktánsok.
Mint tudjuk, az egyensúlyi állandó Keq meghatározása:
![]()
Az egyensúlyi állandó minden kifejezése valójában a reakcióban részt vevő összes faj aktivitásának aránya. Az aktivitások használatának elkerülése és a kísérleti mérések egyszerűsítése érdekében a koncentrációk egyensúlyi állandója híg oldatokban az oldott anyagok és gázok aktivitását a megfelelő molaritásaikkal közelíti. A szilárd anyagok, tiszta folyadékok és oldószerek aktivitását azonban nem a molaritásaikkal közelíti. Ehelyett ezeket az aktivitásokat 1 (egy) értékűnek határozzuk meg.
Így, ha tudomásul vesszük, hogy a víz aktivitását híg oldatban egységnyi (1) értékkel közelítjük, akkor 1-gyel osztva megkapjuk a Ka, az ecetsav savállandójára vonatkozó kifejezés általános formáját:
\}{(1)} = \dfrac{}{}{}{} \]
Tény, hogy híg vizes oldat esetén a víz aktivitását 1 értékkel közelítjük, így egy adott sav HA vagy HB+ általános disszociációs állandója a következőképpen fejezhető ki:
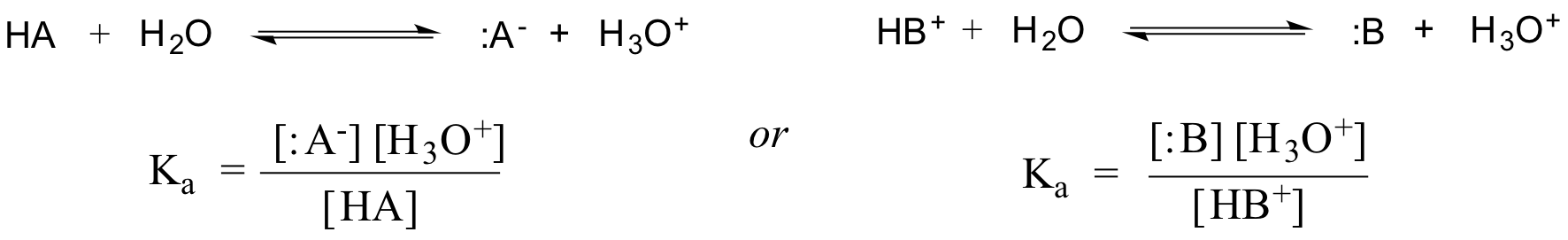
A Ka értéke az ecetsav esetében 1.75 x 10-5 – sokkal kisebb, mint 1, ami azt jelzi, hogy az egyensúlyi állapotban sokkal több ecetsav van az oldatban, mint acetát- és hidróniumion.
Ezzel szemben a kénsav, amelynek Ka értéke körülbelül 109, vagy a sósav, amelynek Ka értéke körülbelül 107, mindkettő lényegében teljes disszociáción megy keresztül vízben: ezek nagyon erős savak.
Egy olyan számot, mint az 1,75 x 10- 5, nem túl könnyű sem kimondani, sem megjegyezni, sem szemléltetni, ezért a vegyészek általában egy kényelmesebb kifejezést használnak a relatív savasság kifejezésére. Egy sav pKa értéke egyszerűen a Ka értékének logaritmusa (bázis 10).
pKa = -log Ka Ka Ka = 10-pKa
A matematikát elvégezve azt találjuk, hogy az ecetsav pKa értéke 4,8. A kénsav pKa értéke -10, a sósavé pedig -7. A pKa értékek használata lehetővé teszi, hogy a gyakori vegyületek és funkciós csoportok relatív savasságát egy körülbelül -10-től (nagyon erős sav) 50-ig (egyáltalán nem savas vegyület) terjedő számskálán fejezzük ki. Minél alacsonyabb a pKa érték, annál erősebb a sav.
A biológiai szerves kémia szempontjából fontos ionizálható (protonadományozó vagy -elfogadó) funkciós csoportok pKa értékei általában 5 és 20 között mozognak. Ezek közül a legfontosabbakat az alábbiakban foglaljuk össze, a konjugált savas formák nagyon durva pKa értékeivel. A referenciaként további savas csoportok is szerepelnek, amelyek pKa értéke a nulla közelében van.
Közelítő pKa értékeket kell tudni
hidróniaion (H3O+) : 0
protonált alkohol: 0
protonált karbonil: 0
karbonsavak: 5
protonált iminek: 7
protonált aminok: 10
fenolok: 10
tiolok: 10
víz: 14
alkoholok: 15-18
alfa-szénsavak*: 20
*az alfa-szénsavakról később lesz szó ebben a fejezetben
Ezeket a durva értékeket most erősen ajánlott megjegyezni – aztán ha pontosabb értékre van szükséged, bármikor utánanézhetsz egy pKa táblázatban.
Vigyázat! A pKa nem azonos a pH-val!
Fontos tisztában lenni azzal, hogy a pKa nem ugyanaz, mint a pH: az előbbi egy vegyület vagy funkciós csoport inherens tulajdonsága, míg az utóbbi egy adott vizes oldatban lévő hidróniumion koncentrációjának mérőszáma:
pH = -log
A pKa értékek ismeretében nemcsak a savak erősségét tudjuk összehasonlítani, hanem a bázisokét is. A legfontosabb gondolat, amit nem szabad elfelejteni, a következő: minél erősebb a konjugált sav, annál gyengébb a konjugált bázis. Megállapíthatjuk, hogy a hidroxidion erősebb bázis, mint az ammónia (NH3), mert az ammóniumion (NH4+, pKa = 9,2) erősebb sav, mint a víz (pKa = 14,0).
GYakorlat 7.2.1
Melyik az erősebb bázis, a CH3O- vagy a CH3S-? Az acetátion vagy az ammónia? Hidroxidion vagy acetátion?
Solution
A pKa fogalmának megértését alkalmazzuk egy összetettebb molekula összefüggésében. Mekkora például az alábbi vegyület pKa értéke?
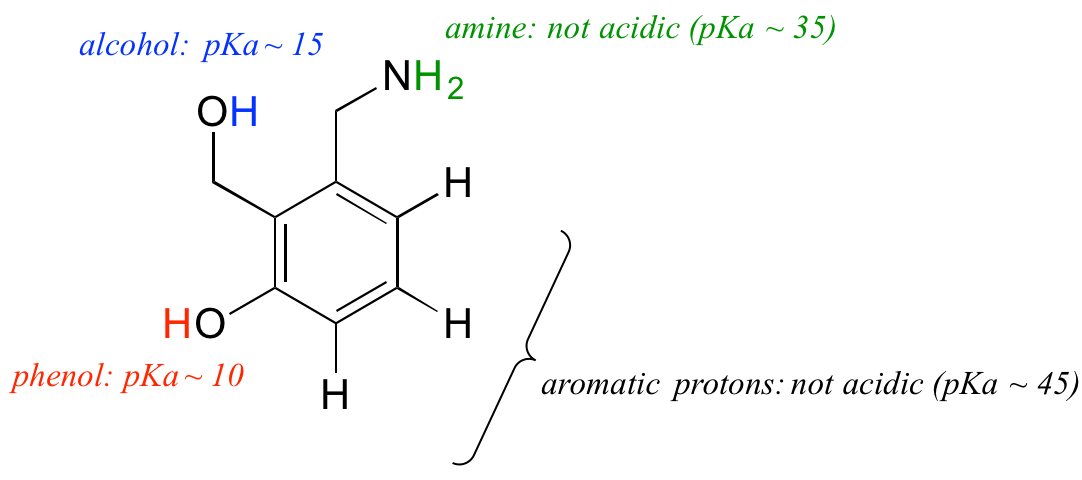
A molekulán található négy különböző típusú proton potenciális savasságát kell értékelnünk, és meg kell találnunk a legsavanyúbbat. Az aromás protonok nem mind savasak – a pKa értékük 45 körül van. Az amincsoport szintén nem savas, a pKa értéke körülbelül 35. (Ne feledjük, hogy a töltés nélküli aminok bázikusak: a pozitív töltésű protonált aminok, 10 körüli pKa értékekkel, gyengén savasak). Az alkohol protonjának pKa értéke kb. 15, a fenol protonjának pKa értéke pedig kb. 10: a fenti molekulán tehát a fenol a legsavanyúbb csoport. (Ügyeljen arra, hogy felismerje a fenol és az alkohol közötti különbséget – ne feledje, a fenolban az OH-csoport közvetlenül az aromás gyűrűhöz kapcsolódik). Ha ez a molekula egy mólegyenértéknyi erős bázissal, például nátrium-hidroxiddal reagálna, akkor a fenol protonját adná le, hogy fenolát-aniont képezzen.
7. feladat.2.2
Az alábbi molekulák mindegyikénél azonosítsa a legsavanyúbb funkciós csoportot, és adja meg annak hozzávetőleges pKa értékét.

Az oldat
.