A savasság és bázisosság Brønsted-Lowry-féle definíciója
A sav-bázis kémia tárgyalását néhány alapvető definícióval kezdjük. Az elsőt Johannes Brønsted dán kémikus és Thomas Lowry angol kémikus javasolta 1923-ban, és a savasság és bázicitás Brønsted-Lowry-féle definíciójaként vált ismertté. A Brønsted-Lowry-féle meghatározás szerint a sav olyan faj, amely protondonorként, míg a bázis protonakceptorként működik. Az előző fejezetben már tárgyaltuk a Brønsted-Lowry-féle sav-bázis reakció egyik legismertebb példáját, a sósav és a hidroxidion közötti reakciót:
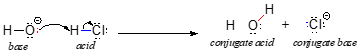
A reakcióban a HCl-ről (a savról, vagyis a protondonorról) egy proton kerül át a hidroxidionra (a bázisra, vagyis a protonakceptorra). Ahogy az előző fejezetben tanultuk, a görbe nyilak az elektronok mozgását ábrázolják ebben a kötésbontó és kötésképző folyamatban.
Miután egy Brønsted-Lowry-sav lead egy protont, azt, ami megmarad, konjugált bázisnak nevezzük. A kloridion tehát a sósav konjugált bázisa. Fordítva, amikor egy Brønsted-Lowry-bázis egy protont vesz fel, konjugált savas formájába alakul át: a víz tehát a hidroxidion konjugált sava.
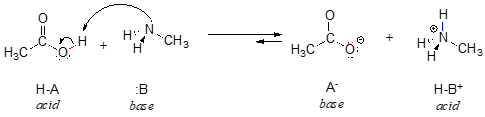
Itt egy szerves sav-bázis reakció, az ecetsav és a metilamin között:
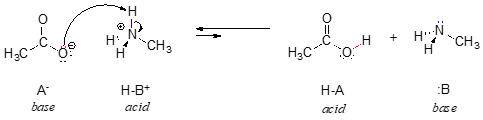
A reakció fordítottjában az acetátion a bázis, a metilammóniumion (protonált metilamin) pedig a sav.
Mitől lesz egy vegyület savas (valószínűleg protonokat adományoz) vagy bázikus (valószínűleg protonokat vesz fel)? Ennek a kérdésnek a megválaszolása az egyik fő feladatunk ebben a fejezetben, és ehhez az első két fejezetben a szerves szerkezetről tanultak nagy részét, valamint a 6. fejezetben áttekintett termodinamikai elképzeléseket kell felhasználnunk.
Egyelőre csak a bázisok egy közös tulajdonságát vizsgáljuk meg: ahhoz, hogy egy molekula bázisként viselkedjen, egy reaktív elektronpárral kell rendelkeznie. Az összes sav-bázis reakcióban, amit ebben a fejezetben látni fogunk, a bázikus fajnak van egy olyan atomja, amely magányos elektronpárral rendelkezik. Amikor például a metil-amin bázisként viselkedik, a nitrogénatom magányos elektronpárját arra használja fel, hogy új kötést alakítson ki egy protonhoz.
A metil-ammóniumion nyilvánvalóan nem viselkedhet bázisként – nincs reaktív elektronpárja, amellyel egy protont felvehetne.
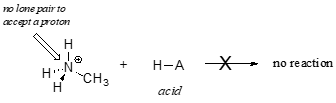
Később, a 14. fejezetben olyan reakciókat fogunk tanulmányozni, amelyekben egy alkén vagy aromás gyűrű kötésében lévő elektronpár bázikusan viselkedik – most azonban a nem kötő (magányos pár) elektronok bázicitására koncentrálunk.
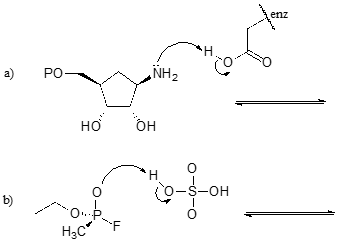
GYakorlat \(\PageIndex{1}\)
Töltse ki az alábbi reakciókat – más szóval rajzolja meg a hiányzó konjugált savak és konjugált bázisok szerkezetét, amelyek a megadott íves nyilakból adódnak.